Perguntas Métodos Instrumentais de Análise by Carolina Bica
1/237
Earn XP
Description and Tags
Perguntas de Exames por Capitulos - Métodos Instrumentais de Análise By Carolina Bica
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
238 Terms
Recolha da amostra
Processo de garantir que existe amostra suficiente para a análise do analito.
Amostragem
Processo de seleção de material para análise (amostra), recolha e preparação do material a analisar, que deve representar fielmente o lote.
Escolha do método
Considerar as propriedades físicas e químicas do analito e da matriz, a concentração para o analito, a quantidade de amostra disponível e o número de amostra a analisar.
Validação do método
Processo pelo qual se confirma se o equipamento está em boas condições de utilização para o fim em vista, produzindo resultados de confiança.
Especificidade do método:
Capacidade de um método analítico para descriminar o analito de outras substâncias presentes da amostra (matriz).
Linearidade do método:
Capacidade do método de gerar resultados linearmente proporcionais à concentração do analito enquadrados em faixa analítica específica.
Limite de deteção do método
Menor quantidade de analito na amostra que pode ser detetada, mas não necessariamente quantificada como valor exato.
Branco deve ter, sempre que possível, uma matriz semelhante à amostra.
corresponde à concentração mínima que é possível distinguir do branco (ausência de analito).
razão sinal ruído 3:1
Limite de quantificação do método
Menor quantidade de analito numa amostra que pode ser determinada com uma precisão e exatidão aceitáveis.
Razão sinal ruído 10:1
Exatidão
Concordância entre o resultado obtido e o verdadeiro valor. Pode ser determinada:
com MRC (materiais de referência certificados)
percentagem de recuperação do analito, juntamente com os intervalos de confiança e a precisão.
Repetibilidade
Expressa a precisão usando as mesmas condições de análise, o mesmo analista e o mesmo equipamento, num curto intervalo de tempo.
Precisão intermédia
É determinada fazendo a mesma análise em dias diferentes, mas no mesmo laboratório e nas mesmas condições de análise; devem ser utilizados analistas diferentes, equipamentos diferentes, diferentes lotes de reagentes e colunas…
Os resultados obtidos permitem identificar mais os fatores que contribuem para uma maior variabilidade dos resultados
Seletividade do método
Capacidade de um certo método analítico responder preferencialmente a um certo analito, identificando-o numa mistura complexa sem interferência de outros componentes
Gama de trabalho
Quando se utiliza uma metodologia que envolve o traçado de uma curva de calibração pode ser avaliada pelo teste de homogeneidade das variâncias
Precisão
Representa a dispersão dos resultados obtidos e correspondentes a várias análises sobre uma mesma amostra ou amostras semelhantes, em condições definidas. Será preferível a precisão sobre amostras, para minimizar efeitos de matriz. (Geralmente varia com a gama de concentrações). Divide-se em:
Repetibilidade (acima)
Precisão intermédia (acima)
Reprodutibilidade: refere-se à precisão do mesmo método analítico, mas em diferentes laboratórios, obtida através de ensaios interlaboratoriais.
Tem diferentes métodos de análise validados que pode escolher para dosear um analito. O analito está presente na amostra em concentração muito baixa.
De entre os parâmetros anteriores referidos, qual o que considerava mais importante para a escolha do método de análise?
Limite de quantificação do método – é necessário saber qual a menor quantidade de analito numa amostra que pode ser determinada com uma precisão e exatidão aceitáveis para que os resultados sejam fiáveis.
Qual o primeiro método que deve avaliar se quiser validar um método analítico?
Especificidade – é necessário certificarmo-nos logo à partida que o método analítico escolhido irá descriminar o analito da matriz.
Se não for um método específico, todos os outros parâmetros já estarão comprometidos.
Tem um método de análise validado para o composto X numa determinada amostra. Se analisar o mesmo composto noutro tipo de amostra acha que o teste de exatidão que fez ainda é válido? Justificar.
Não, pois a exatidão é a concordância entre o valor obtido e o verdadeiro valor logo, ao mudar o tipo de amostra tanto o valor real como o valor obtido irão mudar, sendo possível que deixe de existir esta concordância. (?)
Na aula laboratorial de HPLC procedeu-se ao doseamento de X. Como poderia proceder no laboratório para verificar os seguintes parâmetros:
Repetibilidade
Precisão intermédia
Repetibilidade:
Confirmar se as condições de análise eram iguais;
confirmar se o analista era igual;
confirmar se o equipamento se encontra igual;
confirmar se o intervalo de tempo é curto.
Precisão intermédia:
confirmar se foi analisada em dias diferentes, mas no mesmo laboratório e nas mesmas condições de análise;
os analistas devem ser diferentes, equipamentos diferentes, diferentes lotes de reagentes e colunas;
forma de ver quais os fatores que contribuem para uma maior variabilidade dos resultados.
De entre os vários desvios da lei de Lambert-Beer, refira-se aos desvios químicos e instrumentais [e interferências do equipamento]
Desvios Químicos:
Deslocamento do equilíbrio: quando uma amostra se dissocia, associa ou reage com um solvente para formar um produto que tem um espetro de absorção diferente da amostra
Dissociação de complexos: excesso ou insuficiência de agente complexante
Precauções:
Fixação do pH/tampões
Trabalhando no ponto isobástico (corresponde ao valor de comprimento de onda para qual a absorvância se mantem apesar das variações do pH do meio).
Desvios instrumentais:
limitações pela policromaticidade das radiações
Impossibilidade do aparelho isolar uma faixa muito estreita de radiação (próximo da monocromaticidade)
Precauções:
Selecionar uma faixa de comprimento de onda numa zona de espetro em plataforma.
Interferências do equipamento:
Radiações interferentes
Mau isolamento do interior do equipamento: luz parasita
Mau alinhamento do percurso ótico: luz difratada
Emissão de fluorescência, proveniente da amostra ou proveniente de interferentes
Precauções:
Validação do método e do equipamento
Informação que deve acompanhar um espectro de absorção, referindo-se à substância analisada.
Natureza da amostra
Data de análise
Concentração da amostra
Natureza do solvente e condições químicas do ensaio (tampões utilizados, pH, etc)
Condições instrumentais utilizadas (largura da fenda, espessura da célula utilizada)
Marca e modelo do aparelho utilizado.
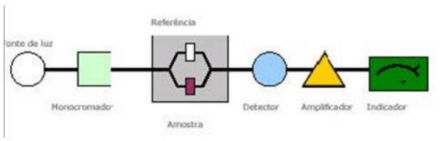
Representar um esquema básico de um espetrofotómetro de feixe duplo. Indicar de um modo sucinto a função de cada um dos componentes.
Fonte de radiação - é originado um sinal a partir de um componente do instrumento ou amostra.
Monocromador - seleciona o comprimento de onda pretendido. Se a fonte de radiação for o laser, dispensa monocromador.
Célula - recipiente tubular ou prismático que vai conter a amostra.
Detetor - deteta a intensidade da radiação refratada.
Processador de sinal - trabalha o sinal e pode estar integrado no detetor.
Periférico de saída - transforma o sinal elétrico em sinal digital ou análogo, que o operador consiga reconhecer.
Qual o interesse de optar por células de diferentes espessuras para medir as absorvências?
Tendo em conta a fórmula: A=a x l x c
A espessura é proporcional à absorvência logo a utilização de diferentes espessuras para aumentar a absorvência.
Normalmente utilizam-se células de 1cm. Quando a solução é muito concentrada e não se pode diluir, utilizam-se células de 0,1cm. Quando a solução é muito diluída e não pode ser concentrada, utilizam-se células de 10cm. Deste modo, evitam-se desvios à Lei de Lambert-Beer para que a absorvência não fique nos extremos.
Qual a importância da escolha do comprimento de onda na medida de absorvência?
O comprimento de onda selecionado deve aquele para o qual a absorvência é máxima, de modo a evitar interferências de outras substâncias presentes na matriz.
O c.d.o. onde a sensibilidade é máxima corresponde aquele onde o coeficiente de absortividade é maior. Assim, é claro que a gama espectral mais adequada é o máximo de absorção da espécie em estudo.
Fazer um esquema do detetor de vetor de díodos.
Vantagens do detetor de diodos.
Um detetor de díodo de sílica é mais sensível que um fototubo, mas em geral menos sensível que um tubo fotomultiplicador.
A radiação que atravessa a amostra é integral e instantaneamente analisada
A absorvância em todos os c.d.o. é determinada de um modo simultâneo.
Desvantagens do detetor de diodos:
Os detetores comercialmente disponíveis não são sensíveis para comprimentos de onda maiores do que IV próximo, o que limita o espetro de imagens por eles obtidas.
Um dos componentes de um espetrofotómetro de UV-Vis é o tubo fotomultiplicador cujo funcionamento se baseia na célula fotoelétrica ou fototubo.
Explique o seu funcionamento e indique a vantagem em relação à célula fotoelétrica.
A radiação atinge o cátodo, provocando a emissão de eletrões que migram para o ânodo. No entanto, ao longo do percurso, os eletrões atravessam díodos que geram uma cascata de eletrões, amplificando o sinal, o que torna o detetor mais sensível.
Dispositivo eletrónico que faz parte dos tubos a vácuo e que converte a luz em corrente elétrica, sendo assim um multiplicador de sinal elétrico.
Fundamenta-se no princípio do fototubo, na qual é gerada uma alteração da voltagem proporcional à intensidade de radiação. No entanto, consegue uma amplificação de sinal (em cascata) muito superior, o que lhe confere uma maior sensibilidade.
Vantagens:
maior sensibilidade
multiplicação do sinal
responde rapidamente numa banda alongada de c.d.o
amplifica facilmente um sinal sem grande ruído de fundo (função do processador de sinal)
Preencha o seguintequadro:
Ensaio | Gama de c.d.o de trabalho | Fontes de Radiação | Funcionamento do órgão selecionador do c.d.o. |
|---|---|---|---|
Análise colorimétrica com filtro de absorção | Visível | Lâmpada de Tungsténio (400-800 nm) | Seleciona o c.d.o através da passagem de radiação numa placa |
Análise num espetrofotómetro com prisma | Visível ou UV | Visível: L. Tungsténio UV: L. de Hidrogénio ou Deutério (200 a 400 nm) | Osdiferentes c.d.otem diferentes ângulos de refração, sendo fácil separa-los |
Análise num espetrofotómetro com rede | Visível, UV e IV (300 a 2000 nm) | Visível: L. Tungsténio UV: L. de Hidrogénio ou Deutério (200 a 400 nm) IV próximo: L. Tungsténio | Composta por grande no de estrias paralelas, equidistantes, traçadas sobre uma superfície altamente polida. Quando se faz incidir radiação na rede cada estria ou sulco da rede origina um pequeno espetro. Formam-se assim frentes de onda que reforçam os c.d.o em fase e eliminam os que não estão em fase |
Coloque por ordem crescente de energia as seguintes radiações do espetro eletromagnético:
Ondas de rádio, raios gama, ultravioleta, IV, Visível, Microondas, Raios X
Ondas de rádio < Microondas < IV < Vis < UV < Raios X < Raios Gama
Descreva as principais diferenças entre os seguintes itens:
Filtros de absorção
Filtros de interferência
Filtro de absorção:
Seleciona o c.d.o através da passagem de radiação numa placa
Constituído por uma ou mais substâncias
Usado na região do visível
Baixo custo
Filtro de interferência:
Dielétrico transparente entre 2 filmes metálicos semitransparentes. Utiliza a interferência ótica para fornecer bandas estreitas de radiação. A espessura do dielétrico que determina o c.d.o da radiação transmitida
Passa apenas 1 c.d.o e os seus múltiplos
Isola bandas até 10nm de largura
Pode ser usado no UV e no Visível
Descreva as principais diferenças entre os seguintes itens:
Célula fotoelétrica
tubo fotomultiplicador como detetores de radiação eletromagnética.
Ambos têm o mesmo princípio, mas no fotomultiplicador consegue-se uma amplificação de sinal (em cascata) muito superior, o que lhe confere muito maior sensibilidade.
Descreva as principais diferenças entre os seguintes itens:
Espetrofotómetro de feixe duplo no espaço
espetrofotómetro de feixe duplo no tempo.
O espetrofotómetro de feixe duplo separado no espaço dispõe de 2 detetores que detetam o sinal do branco e da amostra simultaneamente e o sinal do branco é subtraído ao sinal da amostra.
No espetrofotómetro de feixe duplo separado no tempo os feixes são separados no tempo por um espelho giratório com setores que dirigem o feixe que vem do monocromador através da célula do branco e depois da célula da amostra.
Descreva as principais diferenças entre os seguintes itens:
Lâmpada de tungsténio
lâmpada de hidrogénio.
L. de tungsténio - fonte de radiação utilizada no espetrofotómetro na zona do visível, na gama de 380 a 780 nm.
L. de Hidrogénio - fonte de radiação utilizada no espetrofotómetro na zona do UV, na gama de 200-380nm
Filtro de absorção
Componente que seleciona o comprimento de onda desejado através da passagem de radiação em uma placa.
Constituído por uma ou mais substâncias
Usado na região do visível
Baixo custo
Filtro de interferência
Dielétrico transparente entre 2 filmes metálicos semitransparentes.
Utiliza a interferência ótica para fornecer bandas estreitas de radiação.
A espessura do dielétrico que determina o c.d.o da radiação transmitida
Passa apenas 1 c.d.o e os seus múltiplos
Isola bandas até 10nm de largura
Pode ser usado no UV e no Visível
Célula fotoelétrica vs tubo fotomultiplicador
Ambos têm o mesmo princípio, mas no fotomultiplicador consegue-se uma amplificação de sinal (em cascata) muito superior, o que lhe confere muito maior sensibilidade.
Espetrofotômetro de feixe duplo separado no espaço
2 detetores que detetam o sinal do branco e da amostra simultaneamente e o sinal do branco é subtraído ao sinal da amostra
Espetrofotômetro de feixe duplo separado no tempo
Os feixes são separados no tempo por um espelho giratório com setores que dirigem o feixe que vem do monocromador através da célula do branco e depois da célula da amostra.
Lei de Lambert-Beer
A absorvência é diretamente proporcional à concentração da amostra.
Rede de difração
Elemento dispersivo de um monocromador
Lâmpada de Tungstênio e Lâmpada de Hidrogênio
A lâmpada de tungstênio é utilizada no espectrofotômetro na zona do visível, enquanto a lâmpada de hidrogênio é utilizada na zona do UV.
Fibra Ótica
Um filamento de vidro com capacidade de transmitir luz a alta velocidade, sem ruído elétrico e manipulando mais sinais que os meios convencionais. É constituída por um núcleo interior, "core", revestido por material com índice de refração menor, "cladding".
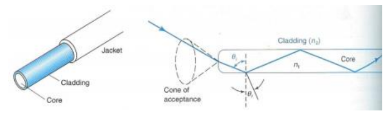
Lei de Snell
Se o ângulo de incidência ultrapassar o ângulo limite, a luz é refletida quase totalmente nas paredes do núcleo da fibra ótica.
Assim, toda a luz que entra no extremo da fibra emerge no outro extremo com uma perda na sua intensidade mínima.
Aplicações de fibra otica em Espectrofotometria
Fotômetros tipo sonda e sensores destinados a análises específicas
Nas várias moléculas orgânicas que contêm o grupo C=O a respetiva banda pode variar entre cerca de 1800cm-1e1600 cm-1. Como explica esta variabilidade?
A frequência do grupo carbonilo depende dos átomos que o rodeiam, ou seja, do grupo funcional.
O tamanho da ligação C=O reduz quando estamos perante um efeito indutivo, aumentando a frequência de absorção e a constante de força.
Quando estamos perante um efeito de ressonância, o tamanho da ligação C=O aumenta, diminuindo a frequência de absorção.
A banda do C=N é mais fraca que a banda do grupo C=O. Justifique.
A banda do C=N é mais fraca que a banda do grupo C=O devido ao oxigênio ser um átomo mais eletronegativo que o nitrogênio, resultando em uma ligação ao carbono mais curta e mais forte, aumentando a frequência de absorção.
Menor c.d.o = maior frequência
No que consiste e quais as vantagens da técnica de reflectância total atenuada como método de obtenção de espetros no IV?
Na refletância total atenuada (ATR), a reflecção ocorre quando um feixe de radiação passa de um meio mais denso (cristal de ATR) para um meio menos denso (amostra), ocorre reflexão da radiação na amostra, sendo alguma radiação absorvida e a restante refletida e detetada.
Os cristais de ATR podem ser ZnSe, Ge e KRS-5 – recentemente diamante.
O feixe de radiação penetra apenas a uma curta distância (˜1um) na amostra (onda evanescente) antes de ocorrer a reflexão completa; a intensidade do feixe de radiação é reduzida (atenuada) pela amostra nas regiões do espetro onde esta absorve.
Vantagens:
Os espetros de absorção são obtidos rapidamente numa grande variedade de amostras com um mínimo de preparação
A radiação não atravessa a amostra, pelo que esta pode ser utilizada em amostras sólidas opacas
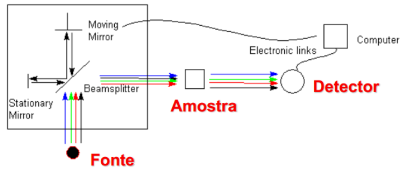
Interferômetro de Michelson
Dispositivo utilizado em espectrofotômetros baseados na transformada de Fourier.
Vantagens do Interferômetro de Michelson em relação aos espectrofotômetros dispersivos
Melhoria da razão sinal-ruído
Maior rapidez
Melhor resolução e sensibilidade (o espetro final resulta da média de vários espetros)
Maior rigor nos valores de frequência
Melhor capacidade no tratamento de dados
Zona dos grupos funcionais
(4000-1300 cm-1 – vibrações de alongamento)
Unidades vibracionais constituídas apenas por 2 átomos de 1 molécula, unidades que dependem mais ou menos do grupo funcional que provocou a absorção e não da estrutura molecular completa
Zona de impressão digital
(1300 a 650 cm-1 – vibrações de deformação)
Padrão de absorção complexo
Corresponde às frequências de alongamento da ligação simples dos sistemas poliatómicos em que há movimento das ligações que unem um grupo substituinte ao resto da molécula.
Tipos de fontes emissão radiante:
Emissor de Nerst
Emissor Globar
Filamento incandescente
Fonte de emissão radiante
Consiste num sólido inerte que é aquecido eletricamente a uma T entre 1500 e 2000k resultando uma radiação continua semelhante à do corpo negro.
Emissor de Nerst
bastonete oco ˜2 x 20 nm
óxidos de metais raros (zircónico e ítrio)
1500 –2000ºk
necessita de pré-aquecimento até a corrente elétrica ser suficiente para manter a temperatura
Emissor Globar
cilindro ˜5 x 50 nm
carboneto de silício
1300 –1700ºK
necessita de refrigeração por água
Filamento incandescente (o que mais se utiliza)
hélice metálica (níquel e crómio)
1100ºK
maior duração
intensidade de energia superior
2 vantagens dos aparelhos FT-IR
Melhoria da razão sinal-ruído
Maior rapidez
Melhor resolução e sensibilidade (o espetro final resulta da média de vários espetros)
Maior rigor nos valores de frequência
Melhor capacidade no tratamento de dados
Quais as aplicações analíticas da espetroscopia no IV?
Análise qualitativa de substâncias e identificação em análises de rotina
Elucidação estrutural de moléculas através da pesquisa de grupos funcionais
Identificação de isómeros geométricos em compostos orgânicos e inorgânicos
Determinação quantitativa de substâncias através da utilização da lei de Lambert-Beer
Aparelhos FT-IR
Aparelhos de espectroscopia de IV baseados na transformada de Fourier, que apresentam vantagens como maior rapidez, melhoria na razão sinal-ruído, melhor resolução e sensibilidade.
Absorção de radiação na zona do IV
Resultando em variação do momento dipolar da molécula absorvente originando transições vibracionais.
Compostos transparentes no IV
KBr sólido (discos)
NaCl sólido (pastilhas)
Constituição da ótica dos espectrofotômetros de IV
Materiais transparentes no IV como halogenetos alcalinos:
KBr
NaCl
Células de amostra (feitas de material que não absorve no IV)
Para amostras líquidas
Fechadas (espessura variável ou fixa)
Abertas (discos)
Para gases: Fechadas
Explique resumidamente o funcionamento do interferometro de michleson
A radiação passa por um divisor de feixe (beamsplitter) que a divide em duas direções em ângulos retos.
Um dos feixes de radiação é enviado para o espelho fixo e volta para trás; o outro feixe é enviado para o espelho móvel. O movimento do espelho móvel torna variável a distância total percorrida pela radiação em relação à do espelho fixo.
Quando os dois feixes de radiação (procedentes dos espelhos) se encontram de novo no divisor do feixe, recombinam-se, mas as diferenças entre as distâncias percorridas originam interferências construtivas e destrutivas, ou seja, um interferograma.
Quando se traça um espetro em aparelho FT-IR, que tem feixe simples, inicialmente traça-se o espetro sem amostra colocada – branco (“background”) que regista absorção de traços de H2O e CO2
Como é que a temperatura e a viscosidade do solvente alteram a fluorescência?
A temperatura baixa favorece a fluorescência. O aumento da temperatura aumenta a frequência das colisões entre moléculas o que leva a uma maior probabilidade de desativação por conversão externa.
A viscosidade elevada do solvente favorece a fluorescência. Porque uma menor vibração das moléculas levará a uma menor colisão entre elas.
Para dosear uma vitamina tem duas possibilidades.
Doseamento no UV-Vis, sabendo que a solução apresenta uma banda forte de absorção a 270 nm que se encontra numa solução de dois solventes.
Doseamento em água/etanol/ácido acático, a pH=3,5, onde se verifica que o composto apresentava fluorescência.
Atendendo a que a solução que tem disponível tem a vitamina em concentração muito baixa e que está numa matriz complexa, diga qual dos dois ensaios escolheria, justificando.
Escolheria a 2a possibilidade, pois a técnica de fluorescência é mais sensível e seletiva que a espetrofotometria de adsorção. Isto acontece porque a intensidade da radiação fluorescente permite determinar quantitativamente vestígios de muitas espécies orgânicas e inorgânicas, tendo o método limites de deteção muito baixos (ppb).
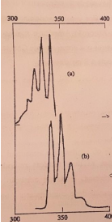
Considere os espetros do composto apresentado na figura. Diga qual corresponde o espetro de absorção e qual o de emissão, justificando.
Durante o processo de excitação eletrónica, a molécula pode ser promovida a qualquer um dos estados vibracionais. O excesso de energia vibracional é imediatamente perdida como consequência das colisões entre as moléculas do solvente (relaxamento vibracional).
A fluorescência de uma substância só envolve o estado vibracional de mais baixa energia do estado excitado (menor E, maior c.d.o). Logo, a banda de fluorescência desloca-se para c.d.o. maiores em relação à banda de absorção (Desvio de Strokes). Assim:
A) Espetro de excitação (absorção)
A fluorescência é medida a um c.d.o fixo, enquanto se faz variar o c.d.o de excitação; ajustando a intensidade da fonte de radiação e a resposta do detetor este espetro é semelhante a um espetro de absorção.
B) Espetro de emissão (fluorescência)
O c.d.o de excitação mantém-se constante e faz-se variar o c.d.o de emissão.
NOTA: O espetro de excitação (ou absorção) e o espetro de fluorescência são a imagem no espelho um do outro.
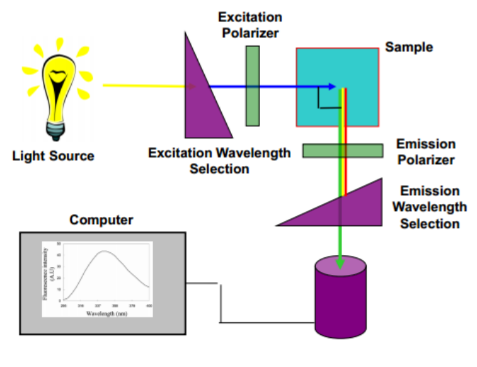
Quais os componentes principais de um equipamento utilizado em fluorescência? Faça um esquema.
Explique quais as razões que o fariam optar por utilizar a fluorescência para a quantificação relativamente à espetrofotometria de absorção no UV-Vis?
Maior seletividade e sensibilidade
Limites de deteção muito baixos (ppb) – permite determinar quantitativamente vestígios de muitas espécies orgânicas e inorgânicas
Porque é que os 2 monocromadores na espetrofotometria de fluorescência têm que estar a um ângulo de 90ºC?
Os monocromadores têm um ângulo de 90oC para não haver deteção da radiação da fonte e sim apenas da amostra.
Tipos de células usadas na fluorescência
Forma:
tubulares e quadrangulares (4 faces transparentes)
Tipo de material:
vidro
quartzo
Quais as vantagens e desvantagens da fluorimetria em relação ao UV?
Vantagens:
Maior sensibilidade (x1000) e seletividade
A intensidade da radiação permite determinar quantitativamente vestígios de muitas espécies orgânicas e inorgânicas
Limite de deteção na ordem dos ppb; enquanto que a espetrofotometria é na ordem dos ppm
Desvantagens:
Campo de aplicação reduzido, pois apenas um númeno mínimo de sistemas emite radiação fluorescente.
Existem vários fatores que podem levar ao aumento ou diminuição da fluorescência.
Fatores que podem influenciar a fluorescência | Aumentar a fluorescência | Diminui a Fluorescência | Influi, aumentando ou diminuindo |
|---|---|---|---|
Viscosidade | X | ||
Calor | X | ||
Concentração Elevada | X | ||
Grupos -NH2, -OH | X | ||
Oxigénio dissolvido | X | ||
Grupos -COOH, -Cl | X | ||
Estrutura química planar | X | ||
Presença de átomos pesados | X |
Por vezes é possível analisar uma molécula por fluorimetria, apesar de a mesma não ser diretamente fluorescente. Indique uma destas situações e como procederia para a resolver.
Através da reação destas moléculas com reagentes fluorométricos que envolvem a formação de quelatos fluorescentes.
Este processo ocorre na determinação fluorométrica de espécies inorgânicas. Um exemplo é a deteção de produtos farmacêuticos.
Defina luminescência.
Emissão de luz por uma molécula. Ocorre quando o eletrão volta ao estado fundamental a partir de um estado excitado e perde o excesso de energia sob a forma de fotão.
Esta engloba 3 técnicas de espectrometria:
fluorescência
fosforescência
quimioluminescência
Porque razão não são coincidentes os espetros 1 e 2?
Este fenómeno ocorre devido à relaxação vibracional, ou seja, durante o processo de excitação eletrónica, a molécula pode ser promovida a qualquer um dos estados vibracionais.
Em solução, o excesso de energia vibracional é imediatamente perdido como consequência das colisões entre as moléculas no estado excitado e as moléculas do solvente.
Assim, a fluorescência de uma substância em solução, só envolve o estado vibracional da mais baixa energia do estado excitado.
Como consequência, a banda de fluorescência desloca-se para maior c.d.o, em relação à banda de absorção (desvio de stokes).
Indique os vários tipos de interferências que podem ocorrer nos métodos de absorção atómica e de fotometria de chama.
Espetrais (espécies interferentes)
Físicas (partículas na chama)
Associações e dissociações moleculares (reações de oxidação dos metais na chama)
Ionização dos elementos (principalmente com metais alcalinos)
Formação de compostos de ponto de ebulição elevado (reação com certos aniões – Sulfato, Nitrato, Fosfato)
Auto absorção (absorção da radiação emitida pelos próprios átomos não excitados [métodos de emissão])
Interferências Espectrais:
Quando as espécies interferentes absorvem ou emitem em c.d.o. muito próximos dos da espécie em análise.
Corrige-se:
usando bom sistema monocromador
selecionando outro c.d.o de trabalho (outra risca)
Interferências Físicas
Quando existem partículas na chama (gotículas ou partículas sólidas) que difratam ou absorvem radiação
Corrige-se:
evitando viscosidades elevadas
presença de matéria em suspensão nas soluções a analisar
Associações e Dissociações moleculares:
Reações de oxidação dos metais na chama, sendo alguns destes compostos muito estáveis e dificultando atomização
Corrige-se:
usando chamas quentes, solventes orgânicos
operando com chamas redutoras
Ionização dos elementos:
Principalmente em metais alcalinos
Corrige-se:
usando “tampões de ionização” (elementos mais facilmente ionizáveis que os analitos e que, sendo adicionados à amostra em quantidades muito superiores, vão originar um meio muito concentrado em iões e eletrões evitando a ionização desses analitos)
Formação de compostos de ponto de ebulição elevado:
Reação com certos aniões (ex.: sulfato, nitrato, fosfato)
Corrige-se:
adição do ião interferente (até estabilização do sinal) ou competidores (preferencialmente se liguem ao anião [lantânio] ou ao elemento a analisar [EDTA])
Auto Absorção:
Absorção da radiação emitida pelos próprios átomos não excitados do elemento em análise
Corrige-se:
trabalhando com soluções de baixas concentrações (menor concentração -> menor colisão entre átomos-> menor auto absorção)
Em relação à fluorescência atómica, esta representa muitas vantagens em relação às outras técnicas atómicas. Indique-as.
Interferências espetrais raras
Limites de deteção menores para intensidades maiores da radiação emitida pela fonte
Não são necessárias riscas tão estreitas
As retas de calibração são lineares desde o limite de deteção até 103 a 105 vezes superiores (absorção atómica até 102)
Menos dependente da Temperatura da Chama
Grande sensibilidade para elementos que emitem as suas riscas de ressonância no UV, como é o caso do mercúrio (253,7 nm)
Aparelhagem menos complexa
Ainda que apresente muitas vantagens, a fluorescência atómica não está muito implementada como técnica corrente. Explique porquê.
Devido ao sucesso de outros métodos de emissão e absorção atómica, estando muito mais divulgados comercialmente e pelo facto de existirem poucos compostos que emitam fluorescência.
Quais os métodos que permitem a atomização da amostra?
Emissão com chama
Absorção Atómica
Emissão com Plasma
Fluorescência Atómica
Métodos de atomização da amostra que ocorrem a frio
- Vapor frio (VAAS)
- Geração de vapor de Hidretos (HGAAS)
Explicar a técnica dos hidretos.
Por ação do borohidreto de sódio alguns elementos são reduzidos a hidretos que sendo muito voláteis vão ser arrastados na corrente de gás inerte (hélio). Chegando a um queimador de quartzo (em vez de chama), a temperatura aqui é maior e o elemento é facilmente libertado do hidreto à sua forma atómica estando em condições de absorver radiação.
Aplica-se a elementos que sendo relativamente voláteis tornam o tratamento da amostra difícil como: Arsénio, Antimónio, Estanho, Selénio, Bismuto, Chumbo
A atomização de uma amostra para posterior análise por absorção atómica, pode ser obtida por diferentes modos. Enumere 4 modos.
Atomização por chama
Câmara de grafite
Vapor a Frio
Vapor de hidretos
Um dos modos referidos anteriormente não utiliza atomizador. Descreva sucintamente como se obtém atomização neste caso especial.
Vapor a frio: análise de mercúrio
O mercúrio é o mais volátil dos metais. É retirado a frio das moléculas em que se insere por um redutor (ex: cloreto de estenho). É arrastado por uma corrente gasosa e levado para uma célula de absorção de fluxo contínuo instalada no percurso de um espetrómetro de absorção atómica (apenas para a análise de mercúrio)
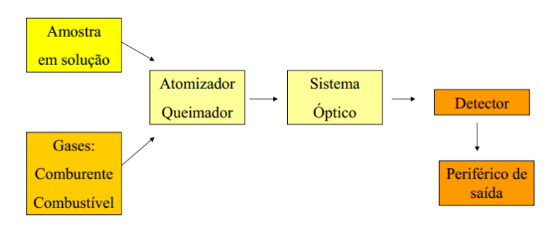
Desenhar e legendar um esquema com os componentes de um espetrofotómetro de emissão com chama.
Em que situações podem ocorrer, neste método, interferências espectrais e físicas e como se podem corrigir?
Espetrais:
Quando espécies interferentes absorvem ou emitem em c.d.o. muito próximos dos da espécie em análise
Corrige-se:
usando um bom sistema monocromador
selecionando outro c.d.o de trabalho (outra risca)
Físicas:
Quando existem partículas na chama (gotículas ou partículas sólidas) que difratam ou absorvem radiação
Corrige-se:
evitando viscosidades elevadas e a presença de matéria em suspensão das soluções a analisar.
Na maior parte dos casos, quando um laboratório adquire um equipamento para fazer análises por absorção atómica, o mesmo aparelho também pode ser utilizado para analisar amostras por fotometria de chama. Comente a frase.
Ambos os métodos são métodos atómicos e necessitam de atomização. Neste caso é necessário que o aparelho seja o mesmo para que ocorra atomização.
A diferença reside no facto de o aparelho de absorção atómica necessitar de fonte de radiação e modulador, que facilmente são incorporados no aparelho, mas não são utilizados para fotometria de chama.
Na maior parte dos casos, quando um laboratório adquire um equipamento para fazer análises por absorção atómica, o mesmo aparelho também pode ser utilizado para analisar amostras por fotometria de chama.
Compare as duas técnicas referidas em termos de: campo de aplicação, interferências, limite de deteção e rapidez de execução da análise. Esta comparação deve contemplar a absorção atómica com chama e com câmara de grafite.
Fotometria de chama:
tem maior sensibilidade para metais alcalinos (facilmente excitáveis)
Absorção Atómica:
grande sensibilidade para os restantes metais
A AA com chama é menos dependente da temperatura desta (já que não é a chama que excita os átomos)
Ambos os processos de AA têm alta seletividade, riscas de absorção muito estreitas e menos interferências espetrais (só os átomos dos elementos em análise e da lâmpada é que absorvem)
AA com chama:
é rápida e precisa
determina concentrações na ordem dos ppm,
consome muita amostra
pode formar óxidos
AA com câmara de grafite:
é muito demorada e dispendiosa,
mas muito sensível, detetando concentrações na ordem dos ppb.
Consome menos amostra
não forma óxidos
Campo de aplicação | Interferencias | Limite de deteção | Rapidez | |
|---|---|---|---|---|
Fotometria de Chama | ++ | +++ | +++ | ++ |
Absorção atómica com chama | +++ | +++ | +++ | ++ |
Absorção atómica com camara de grafite | +++ | ++ | + | ++ |
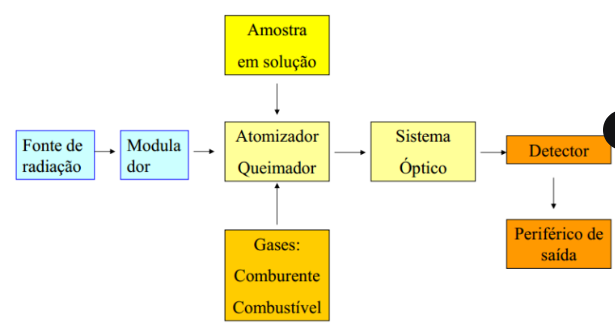
Faça uma representação esquemática dos diferentes elementos constituintes de um espetrofotómetro de absorção atómica. Não esqueça da respetiva legenda.
Em algumas situações é vantajoso o método da adição padrão em espetrometria de absorção atómica. Explique a razão.
Para eliminar as interferências de matriz/chama que alteram os valores de leituras de absorvências e transmitância (quando a amostra possui outras espécies químicas absorventes).
Em que consiste o método da adição padrão?
Introduz-se igual quantidade de solução problema em todos os balões.
Adicionam-se concentrações crescentes de solução padrão aos balões exceto a 1.
Completa-se o volume com o solvente.
De seguida, com os sinais obtidos traça-se uma curva de calibração.
A vs [ ] e para y=0 obtém-se a [ ] da amostra problema.
As lâmpadas mais utilizadas em espetroscopia de absorção atómica são as lâmpadas de cátodo oco. Explique o funcionamento destas lâmpadas. Qual a principal diferença das lâmpadas de alta intensidade?
Lâmpadas de cátodo oco:
Elemento a analisar é constituinte do cátodo.
Lâmpada preenchida por um gás raro inerte, que quando sujeito a uma corrente elétrica que provoque a sua ionização, irá bombear o cátodo.
Os átomos do metal do cátodo são excitados regressando depois ao seu estado fundamental com a libertação de radiação.
Lâmpadas de alta intensidade:
Ocorre uma descarga elétrica que excita o árgon e só depois é que este vai interagir com os elementos do cátodo.
Na análise de cálcio por absorção atómica com chama observaram-se os seguintes resultados:
a. A leitura de absorvência de uma solução de cálcio (0,1mg%)em água:metanol (60:40) foi de0,280
b. A leitura de absorvência de uma solução de cálcio (o,1mg%) em água foi de 0,225.
Explicar a situação.
O metanol é um solvente orgânico. Estes aumentam os sinais de emissão e de absorção, sendo que no 1º caso houve um aumento da absorção devido à sua presença.
Efeito Físico (Redução da viscosidade – maior aspiração da amostra para a chama e nebulização)
Efeito Térmico (Menor arrefecimento da Chama)
Efeito Redutor (Dificultando a formação dos óxidos)
Efeito Quelante
Explicar a formação de associações e dissociações moleculares na espetrometria de absorção atómica e como se corrige.
Ocorrem por reações de oxidação dos metais na chama, sendo alguns destes compostos muito estáveis e dificultando a atomização.
Corrige-se usando chamas quentes (ex: oxido nitroso-acetileno), usando solventes orgânicos e operando com chamas redutoras.
Explique como funciona a tocha “torch” em ICP
Plasma: mistura gasosa condutora de eletricidade com uma significativa concentração de catiões e eletrões (as concentrações dos 2 são tais que a carga total se aproxima do zero).
A atomização do analito faz-se num dispositivo onde se produz o plasma, designado por TOCHA (“torch”) e não uma chama. É constituída por 3 tubos de quartzo concêntricos através dos quais flui uma corrente de árgon. No topo há uma bobine que produz um campo magnético efetuando movimentos circulares com grande atrito, o que provoca a elevação da temperatura (3 x superior à chama). É esta elevação da T que provoca a:
Vaporização do solvente
Volatização da amostra
Atomização da amostra
Excitação da amostra