A.1.1 Agua
1/17
Earn XP
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
18 Terms
Agua
Muchas moléculas de H2O unidas mediante fuerzas intermoleculares conocidas como puentes/enlaces de hidrógeno. Esta es imprescindible para la vida.
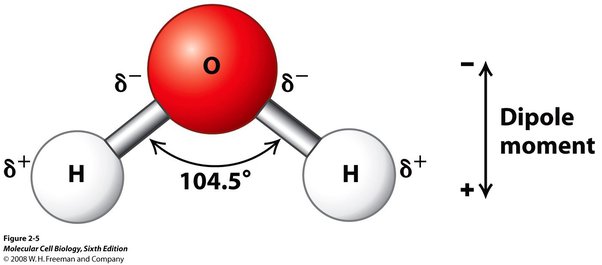
H2O
Molécula constituida por un átomo de oxígeno unido a dos átomos de hidrógeno mediante los enlaces covalentes (compartiendo electrones). El oxígeno tiene una carga parcial negativa (dado que es más electronegativa) mientras que los hidrógenos una carga parcial positiva (menos electronegativos). Al tener cargas parciales positivas y negativas, se dice que el H2O es una molécula polar. Forma un ángulo de 104.5º.
Puentes de Hidrógeno
Son un tipo de fuerza intermolecular que se forma entre un oxígeno de una molécula de H2O y un hidrógeno de otra molécula de H2O.
En estado sólido: Por el frío se congelan los puentes de hidrógeno formando el hielo.
En estado líquido: se van rompiendo y recreando.
En estado gaseoso: Se rompen los puentes de hidrógeno.
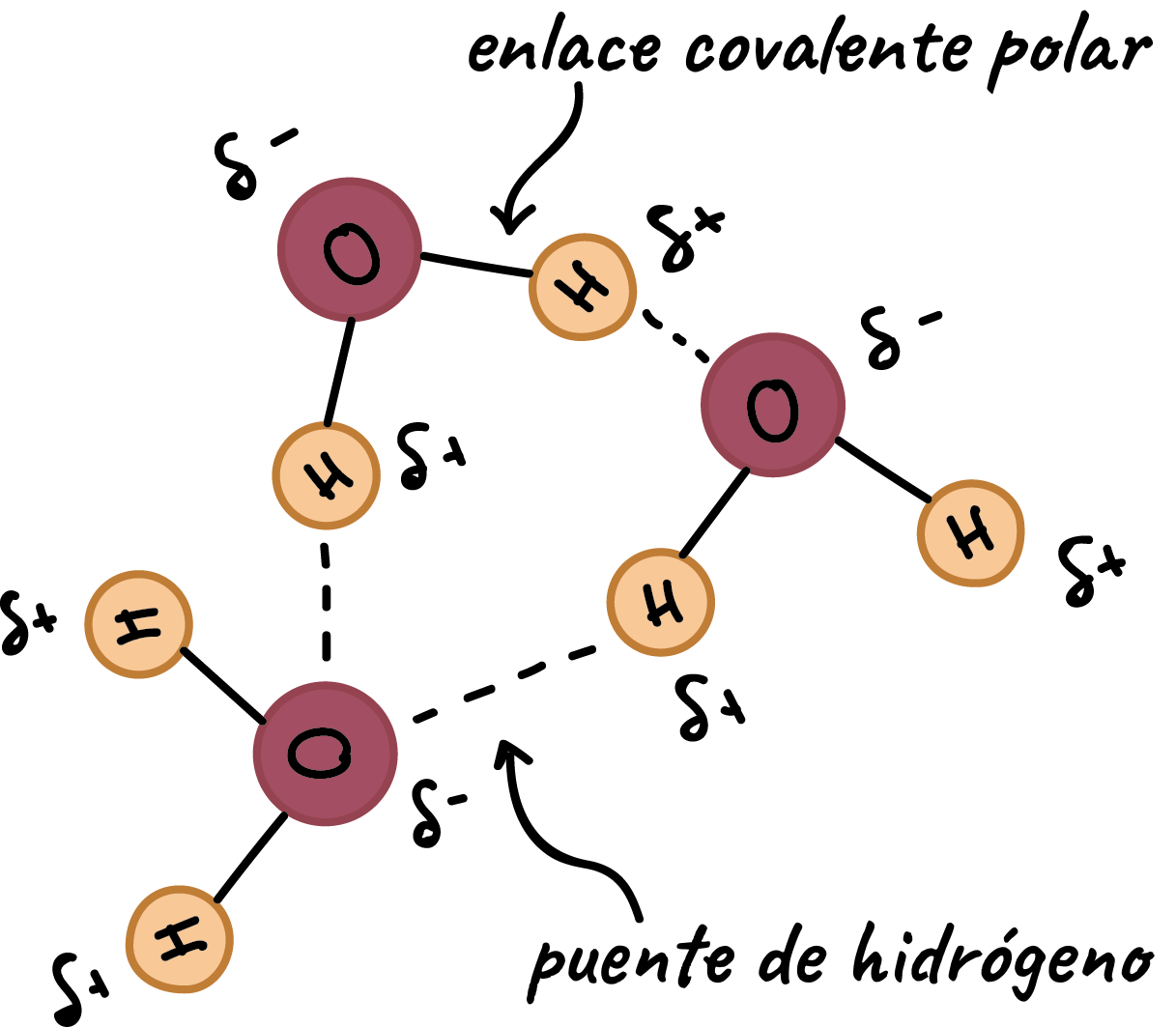
Cohesión
Unión de moléculas polares iguales, que se unen mediante puentes de hidrógeno. En el caso del agua: Unión de moléculas de agua mediante puentes de hidrógeno. Por la alta cohesión entre las moléculas de H2O, generan la tensión superficial.
Tensión Superficial
Por la alta cohesión entre las moléculas de agua, cuando esta entra en contacto con el aire, por los puentes de hidrógeno haciendo que estén muy atraídas, hacen que se forme una pequeña capa o membrana en la superficie.

Adhesión
Unión de moléculas polares diferentes, que se unen mediante puentes de hidrógeno. En el caso del agua: Unión de una molécula de agua y una molécula polar diferente mediante puentes de hidrógeno.
Capilaridad
La adhesión entre la molécula de agua y otra molécula polar distinta (como las moléculas del xilema que son polares) crean la capilaridad, en la que el agua va subiendo apoyándose de las moléculas del xilema, yendo en contra de la gravedad. Es importante mencionar que las moléculas de agua se cohesionan entre sí y adhieren a las paredes, creando una cadena que sube.
Propiedades Químicas
Por la química del agua, esta tiene ciertas propiedades químicas que hay que tener en cuenta.
Disolvente Universal
Como el agua es polar, este disuelve lo polar. El agua es conocida como un disolvente universal, ya que por sus puentes de hidrógeno tiene la capacidad de diluir los sólidos. Estas propiedades proporcionan a los seres vivos lo siguiente:
Transporte: El agua puede disolver aminoácidos, azucares o sales. De esta forma puede dar un medio para transportar todo los nutrientes necesarios. Un ejemplo es la sangre (85% agua) transportando así los nutrientes disueltos por el cuerpo.
Metabolismo: Son las reacciones químicas que ocurren dentro de las células, las cuales son aceleradas por enzimas. En el citoplasma, que es en gran parte agua se encuentras de forma disuelta ciertas enzimas y sustancias responsables del metabolismo.
Propiedades Físicas
El agua en sí tiene ciertas propiedades físicas que hay que tener en cuenta:
Flotabilidad
Es la fuerza que contrarresta la gravedad. Esta fuerza empuja al objeto sumergido hacía arriba. Si la densidad del objeto es mayor que la densidad del fluido, este se hundirá. Si la densidad del objeto es menor que la densidad del fluido, este flota.
Como el hielo es menos denso que el agua dado que se congelan los puentes de hidrógeno, los seres vivos pueden vivir en épocas muy frías, dado que se congela de arriba a abajo y no de abajo a arriba.
Viscosidad
La cantidad de fuerza necesaria para poder cambiar la forma de un líquido. El agua es muy viscosa por la fricción de sus puentes de hidrógeno. El hecho de que el aire es 50 veces menos viscoso que el agua hace que los animales terrestres necesiten menos energía para moverse que los animales marinos, los cuales necesitan más energía.
Calor Específico
La cantidad de energía necesaria para poder calentar una sustancia. El agua tiene un calor específico muy alto por sus puentes de hidrógeno no permiten que las moléculas se separen tan fácilmente. Por su alto punto de fusión y ebullición, la temperatura del agua permanece más estable que la del aire. Es por ello que los hábitats marinos son más estables en temperatura que los terrestres.
Conductividad Térmica
La capacidad de transferir calor. El agua tiene una alta conductividad térmica, mayor que la del aire. Esta es la razón por la que los animales marinos pierden calor corporal más que los animales terrestres.
Foca Anillada
Propiedad del agua | Foca anillada – Adaptación 🦭 | Colimbo ártico – Adaptación 🐦 |
|---|---|---|
Alta densidad (el agua sostiene peso) | Cuerpo denso y redondeado, con grasa, que permite flotar y descansar parcialmente en el agua. | Huesos más densos que otras aves voladoras → ayuda a sumergirse sin flotar demasiado. |
Gran capacidad térmica (retiene calor) | Grasa subcutánea actúa como aislante: mantiene calor corporal incluso si el agua cambia de temperatura lentamente. | Plumaje denso y aceitoso que evita pérdida de calor, aprovechando que el agua cambia de temperatura lentamente. |
Viscosidad (resistencia al movimiento) | Cuerpo hidrodinámico y extremidades modificadas en aletas → reduce la fricción al nadar en un fluido viscoso. | Patas palmeadas traseras → impulsan con fuerza en agua viscosa, pero mala movilidad en tierra. |
Tensión superficial | No es tan relevante para la foca por su tamaño, pero sus vibrisas pueden detectar perturbaciones en la superficie. | Aprovecha la tensión superficial al posarse brevemente sobre el agua y al detectar movimientos de presas. |
Alta conductividad térmica (pierde calor rápido) | Capa de grasa gruesa → evita la rápida pérdida de calor corporal al estar sumergida por mucho tiempo. | Plumas impermeables y aire atrapado entre ellas → actúan como aislante térmico frente a la pérdida de calor. |
Solubilidad del oxígeno limitada y variable | Adaptaciones fisiológicas para el buceo: almacenamiento de oxígeno en músculos y sangre (mioglobina y hemoglobina). | Buceos breves, pero buena eficiencia respiratoria para aprovechar el oxígeno disponible antes de sumergirse. |
Colimbo Ártico
Origen Extraplanetareo del Agua en la Tierra
Antes la Tierra era muy caliente por lo que no había agua en estado líquido, hasta que, según evidencia científica, cayeron asteroides ricos en agua a la tierra. Esta se quedó porque el sol estaba a la distancia perfecta y por la gravedad se retuvo.
Relación entre la búsqueda de vida extraterrestre y el agua
Los astro biólogos son aquellos que intentan buscar la vida en cualquier parte del universo. Es por ello que dicen que DONDE HAY AGUA HAY VIDA. A estas zonas donde hay agua y son habitables se les llaman goldilocks.