Kemi prov 3
1/12
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
13 Terms
u
atommassenheten unit, 1,6605 × 10-27 kg = 1u
atommassa
medelvärdet av isotopernas atommassor räknat på grundämnets naturliga isotopbildningar.
Formelmassa
summan av massorna för de atomer som ingår i ämnets formel.
molekylmassa
summan av massorna för de atomer som ingår i en molekyl av ämnet.
kristallvatten
vattenmolekyler som är bundna till jonerna i ett fast salt. Punkten visar att vattenmolekylen ingår i formelmassan, inte att man ska multiplicera.
Substansmängd
Storheten n, enheten mol. Det är ett specifikt antal partiklar 6,022 × 1023 formelenheter. 1 mol innehåller lika många oavsett vilket ämne det är fråga om, däremot väger de olika mycket. Avogadros konstant = NA.
molmassa
Storheten M, enhet g/mol, beräknas m/n = M. Massan per mol av ett ämne. Värdet kan avläsas i periodiska systemet.
masshalt
=grundämnets massa/föreningens massa. Beskriver föreningens sammansättning genom att ange de olika grundämnenas masshalter i procent. Spelar ingen roll om uträkningen baseras på en molekyl eller en mol av ämnet, eftersom man räknar med samma mätetal.
Empiriska formeln
beskriver minsta heltalsförhållandet mellan atomslagen i en kemisk förening.
mättad lösning
innehåller maximal mängd av det upplösta ämnet.
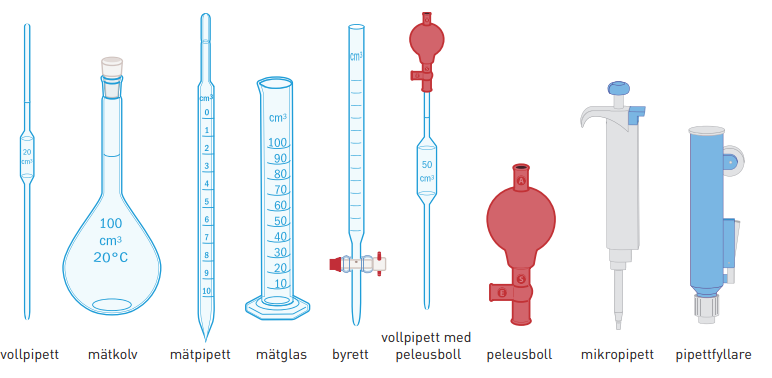
vollpipett, mätkolv, mätpipett, mätglas, byrett, vollpipett med peleusboll, peleusboll, mikropipett, pipettfyllare
substansmängdförhållande
en balanserad reaktionsformel ger substansmängdförhållandet mellan de olika ämnen som deltar i reaktionen.
gravimetri
innebär att vågen används som analysinstrument