pH, pKA och kemisk bindning
1/61
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
62 Terms
Vad är en atom?
Partikel av materia, subatomära partiklar = protoner, neutroner och elektroner arrangerade i en specifik rumslig struktur
Vart finner vi protoner och neutroner? Vad gäller?
Kärnan, mesta av massan
Vart finner vi elektroner?
Utspridda i elektronmoln beroende på energinivå
Vad definierar ett kemisk grundämne?
Antalet protoner i kärnan
Atomens massa och laddning
protoner + neutroner, 0
Elektronens massa och laddning
9.11×10-31 kg, -
Protonens massa och laddning
1.6726×10-27 kg, +
Neutronens massa
1.6749×10-27 kg
Varför uppstår kemiska bindningar, dvs. attraktiva interaktioner mellan atomer?
Uppnå stabilt antal elektroner i hösta elektronskalet = Valensskalet
Hur kan kemiska bindningar uppstå?
Atomer kan donera, ta emot och dela elektroner
Vad blir atomer när de tar emot eller avger elektroner?
Joner
Katjon = Positivt laddad
Anjon = Negativt laddad
Jonbindning beskrivning
Den elektrostatiska attraktionen mellan motsatt laddade joner
Elektronegativitet X beskriver vadå? Hänger ihop med vadå?
Atomens tendens att vid reaktioner attrahera elektroner. Vilka bindingstyper ett element kan bilda
Stor skillnad i elektronegativitet ger en…
Jonbindning
Liten eller ingen skillnad i elektronegativitet ger….
Kovalent bindning
3 exempel på jonföreningar med jonbindning
NaCl, KCl och MgO
Exmepel på natriumkloridbildning
Natrium, 1 valenselektron, X “=” 1,31
Klor, 7 valenselektroner, X “=” 3,16
Elektronen överförs från Natrium till Syret
Resultat: Na+ och Cl- hålls ihop av jonbindning
Jonföreningar, beskrivning
Starkaste bindningarna (energi)
Solida kristaller, hög smältpunkt
Ofta: Metaller (katjoner) och icke-metaller (Anjoner)
Ibland: Enkla monoatomära joner och polyatomära joner
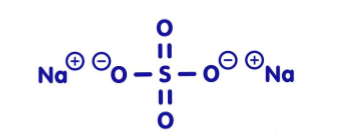
Vad är detta?
Natriumsulfat
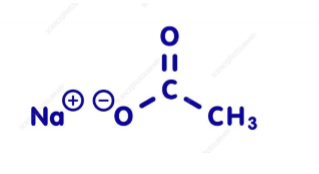
Vad är detta?
Natriumacetat
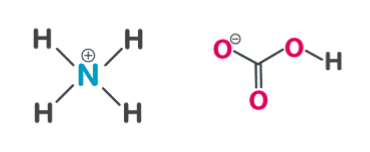
Vad är detta?
Ammoniumacetat
Hur uppstår kovalenta bindningar?
Atomer kan dela elektroner för att uppnår stabilt antal valenselektroner
Kovalenta föreningar beskrivning
Tydliga enheter = Molekyler
Lösliga i lösningsmedel med liknande polaritet
Vanligen mellan icke-metaller
Hur uppstår dipoler och polaritet?
Beroende på elektronegativitet och symmetri kan molekyler vara polära eller ha en partiell laddning = Dipol
Elektronegativitetsskillnad och vad de troligen då är för bindning
>1,8 = Jonbindning
0,4 - 1,8 = Polär kovalent bindning
< 0,4 = Opolär kovalent bindning
Vad gäller polär och dipol
Bindningar är polära, molekyler är antingen dipolära eller så tar laddningarna ut varandra så den är opolär
Hela molekylens porlatitet beror på…
Bindningarnas polaritet (skillnad i elektronegativitet)
Molekylens geometri (symmetri eller asymmetri)
Hur uppstår en dipol?
Osymmetriska polära bindningar => Ojämn laddningsfördelning
Vad gäller om man skulle blanda polära molekyler med opolära?
De blandas dåligt eller inte alls
Icke-bindande attraktiva interaktioner mellan molekyler och joner beskrivning
Svagare är jon- och kovalenta bindningar, starka i stora antal
3 typer av icke-bindande attraktiva interaktioner
Hydrofoba interaktioner = Van der Waals bindningar
Elektrostatiska interaktioner = Attraktion mellan motsatta laddningar
Vätebindningar = Attraktion mellan motsatta laddningar
Hydrofoba interaktioner
Attraktionen mellan opolära (hydrofoba) molekyler i polära lösningsmedel (vatten)
Två typer av hydrofoba interaktioner
Hydrofob effekt = Hydrofoba molekyler klustrar ihop för att minimera/undvika kontakt med vatten
Van der Waals-krafter = Molekyler interagerar genom dispensionskrafter
Elektrostatiska interaktioner
Elektrostatiska attraktionen mellan motsatt laddade partiklar bildar dipolsinteraktioner, ex. jon-dipol, dipol-dipol och jon-jon
Vätebindningar
Interaktion mellan en väteatom bunden till F, O eller N och en annan elektronegativ atom (F, O eller N) med fria elektronpar.
3 exemepel på vätebindningar
Vatten-vatten, vatten-ammoniak och etanol-etanol
Exempel på ämnen som ingår i vätebindningar
Vatten, ammoniak, alkoholer, aminer och karboxylsyror
Vad gäller för löslighet/Blandbarhet?
Ämnen kan bara blandas och lösas i varann om de kan skapa svaga interaktioner mellan delar av sina molekyler/joner
Löslighetens principer
Polär + Polär = Blandbar/Löslig
Polär + Opolär = Ej blandbar/Löslig
Opolär + Opolär = Blandbar/Löslig
Hydrofila ämnen är…
Gör vadå?
Lösliga i vatten, klumpar ihop sig för att minska kontakten med vatten
Hydrofoba ämnen är…
Bildar vadå?
Inte lösliga i vatten, bildar vätebindningar med vatten
Amfipatiska ämnen har…
Både hydrofila och hydrofoba delar, kan interagera med både polära och opolära lösningsmedel
Vatten kan i lite utsträckning göra vad? (Jonbildning)
Dissociera från molekylära formen H2O =>
Hydronium, H3O+ (=proton, H+)
Hydroxid, OH-
Vad är direkt kopplat till begreppen syror och baser?
Förekomst och bildning av hydronium och hydroxid
Definitionen av en syra respektive bas (syra/bas)
Ämne som ökar koncentrationen av H+ eller OH- i lösning
Syror och baser gör vad med varandra? Leder till vad?
Neutraliserar varandra => Vatten och salter
Exempel på syror
HCl, H2SO4, HNO3
Exempel på baser
NaOH, KOH, CaOH
Vid en Protonöverföringsreaktion är syror vad och baser vad?
Syror = Ämnen som donerar protoner
Baser = Ämnen som tar emot protoner
Protonöverföringsreaktioner är reversibla, vad kallas ämnet som tog emot en proton respektive gav bort en
Tog emot en proton = Konjugerad syra
Gav bort en proton = Konjugerad bad
Vid syra-bas reaktioner bildas vad genom vad?
Joner genom jonisering
Vad avgör om det är en stark syra/bas?
Benägenheten att joniseras
Reaktionen för saltsyra
Reaktionsutbyte?
Partiell eller fullständig jonisering?
Stark eller svag syra?
HCL + H2O → H3O+ + Cl-
Nästan 100%
Fullständig
Stark syra
Stark syra
Stark bas
Svag syra
Svag bas
Saltsyra, HCL
Natriumhydroxid, NaOH
Ättiksyra, CH3COOH
Ammoniak, NH3
Reversibel reaktion beskrivning
Kemisk reaktion där omvandlingen från reaktanter till produkter och tillbaka sker samtidigt
Kemisk jämvikt
Framåtgående och bakåtgående reaktionen sker med samma hastighet. Reaktionerna fortsätter, koncentrationerna av produkter och reaktanter förändras inte
reversibla reaktioner - Jämviktskonstant Keq
Keq uttrycker förhållandet mellan produkter och reaktanter i molär koncentration M, i en reaktion i jämvikt
Allmänna jämviktsreaktionen
A + B ←→ AB
Keq = [AB] / ([A] x [B])
[A] x [B] = [AB]
Keq = 1, lika mycket produkter som reaktanter
[A] x [B] < [AB]
Keq > 1, framåtreaktionen gynnas => Fler produkter
[A] x [B] > [AB]
Keq < 1, bakåtreaktionen gynnas => fler reaktanter