Chemia organiczna
1/66
Earn XP
Description and Tags
Mcmurry, reakcje
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
67 Terms
Co daje alken w reakcji z NBS i CCl3?
Reakcja o mechanizmie rodnikowym (możliwe wiele produktów reakcji). Powstaję bromoalkeny.
Co należy dodać by przekształcić alkohole 1* i 2* rzędowe w bromoalkan?
PBr3 (produkt uboczny P(OH)3)
Co należy dodać by przekształcić alkohole 3* rzędowe w bromoalkan
HBr
Co należy dodać by przekształcić alkohole 3* rzędowe w chlorooalkan
HCl
Co należy dodać by przekształcić alkohole 1* i 2* rzędowe w chloroalkan?
SOCl2 (produkt uboczny SO2 i HCl)
Jaki jest najbardziej trwały karbokation?
Trzeciorzędowy (a ich trwałość maleje wraz ze spadkiem rzędowości)
Co się stanie jak do halogenka alkilowego dodamy zasadę (w środowisku alkoholowym)?
Powstanie alken
Co się stanie jak do alkoholu dodamy kwas i go ogrzejemy?
Alken
Jak zachodzi addycja HX do alkenu?
W wyniku addycji elektrofilowej powstaje halogenoalkan, zgodny z regułą Markownikowa
Jak zachodzi addycja X2 (w środowisku z CH2Cl2)?
Według addycji elektrofilowej. Reakcja biegnie przez pośredni jon cyklobromoniowy, co powoduje addycje anti.
Co to halogenohydryny i jak powstają?
Halogenohydryna to związek gdzie wicynalnie występuję halogen i grupa -OH. Powstają w wyniku addycji elektrofilowej alkenów z X2 i H2O. Obserwuje się stereochemię anti i zgodność z regułą Markownikowa
Jak z alkenu otrzymać alkohol, który będzie zgodny z regułą Markowinkowa?
W pierwszym etapie dodać Hg(OAc)2 i H2O (ew. THF). Następnie zredukować NaBH4.
Jak otrzymać z alkenu alkohol NIEzgodny z regułą Markownikowa
W pierwszym etapie dodać BH3 oraz THF. W drugim etapie zredukować w środowisku zasadowym H2O2. Obserwuje się addycję sin.
Z jaką stereochemią przebiega uwodernienie alkenów?
Ze stereochemią sin.
Jak z alkenu otrzymać alkohol wicynalny?
W pierwszym etapie użyć OsO4, a następnie NaHSO4 wraz z H2O. Obserwuje się addycje sin.
Co się dzieje gdy do alkenu w środowisku zasadowym dodamy CHCl3?
Powstanie 1,1-dichlorocyklopropan. Mechanizm przebiega przez karben.
Co to reakcja Simmsona-Smitha?
Reakcja alkenu z CH2I2 zachodząco na blaszce Zn(Cu) z dodatkiem eteru. Powstaje cyklopropan.
Co to ozonoliza?
To dodanie ozonu, a następnie cynku w środowisku kwasowym. Alken się rozszczepia i powstają ketony - w miejsce wiązania podwójnego wchodzi atom tlenu.
Co powoduje dodanie KMnO4 w środowisku kwasowym do związku nienasyconego?
W przypadku alkenów gdzie przy wiązaniu nie występują żadne wodory - ketony. W przypadku jednego wodoru przy at. węgla - kwas karboksylowy. W przypadku dwóch wodorów przy jednym at. węgla - tlenek węgla(IV). W przypadku alkinów - kwasy
Jak rozszczepić diole wicynalne?
Dodać HIO4 w środowisku wodnym. Powstają dwa ketony
Jak wydłużyć łańcuch węglowodorowy w alkinach?
Dodać NaNH2, co daje jon acetylenkowy. W kolejnym etapie dodać porządany przez nas łańcuch (z bromem przyłączonym do pierwszorzędowego at. węgla).
Addycja HX do alkinów (w środowisku eteru)
W zależności od ilości użytego reagenta może powstać halogenoalken albo dihalogenoalkan. Wszystko zgodnie z regułą Markownikowa
W jakim środowisku zachodzi addycja X2 do alkinu?
CH2Cl2, mogą powstawać dihalogenoalkeny albo tetrahalogenoalkany
Czy po dodaniu wody do alkinu (w obecności siarczanu(VI) rtęci(II)) powstanie enol?
Nie, enol tautomeryzuje do formy ketonowej (ew. aldehydowej). Tautomeryzacja jest zawsze przesunięta w stronę tego związku, który ma at. H przyłączony bezpośrednio do at. C
Co powoduje dodanie do alkinu BH3, a następnie H2O2?
Powstaje keton (albo aldehyd), produkt niezgodny z regułą Markownikowa.
Co daje lit w środowisku NH3 z alkinem
trans-alken
Jak otrzymać cis-alken z alkinu?
Dodać wodoru w obecności kat. Lindlara
Co to są związki Gringarda i jak je otrzymać?
To związki, gdzie do at. C przyłączony jest at. Mg. Związki te powstają przed dodanie do halogenoalkanu magnezu w obecności eteru.
Co to są odczynniki Gilmana i jak je otrzymać?
Do halogenoalkanu należy dodać nadmiar litu (w obecności pentanu). Następnie dodać jodek miedzi(I)
Na czym polega sprzęganie związków metaloorganicznych?
Na dodaniu odczynnika Gilmana do halogenoalkanu. Część węglowodorowa z odczynnika Gilmana łączy się z częścią węglowodorową halogenoalkanu.
Jak ze związku Gringarda otrzymać alkan?
Zakwasić środowisko
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów nasyconych?
Od 0,7 do 1,8 ppm, im wyżej rzędowy atom wodory tym mniejsze przesunięcie chemiczne
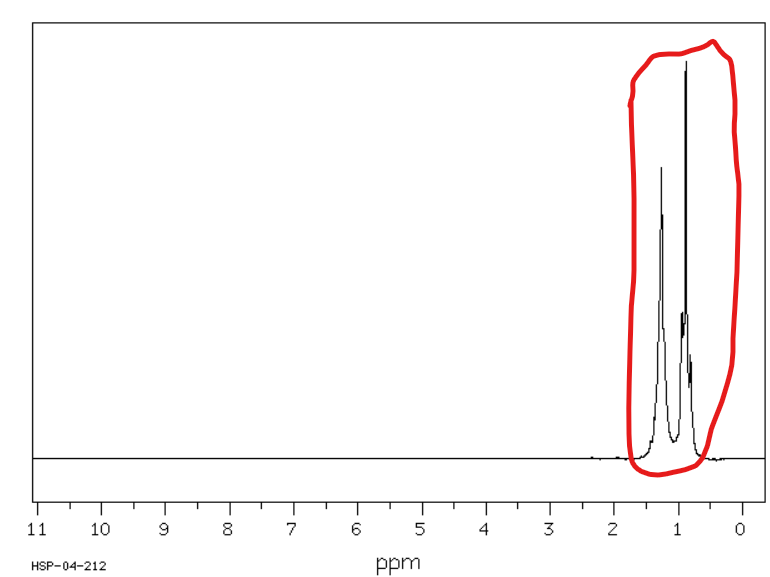
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów allilowych (w odległości dwóch węgli od wiązania podwójnego)?
Od 1,6 do 2,2 ppm
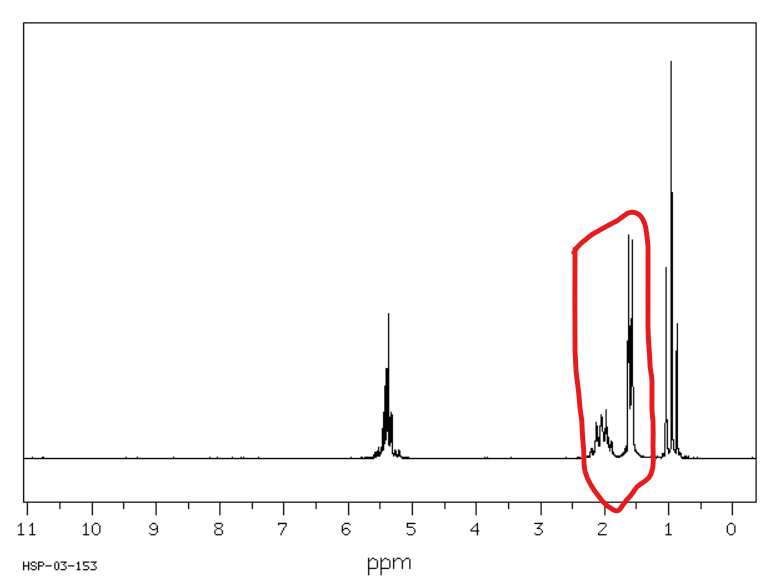
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów benzylowych (w odległości jednego węgla od pierścienia aromatycznego)?
Od 2,3 do 3 ppm
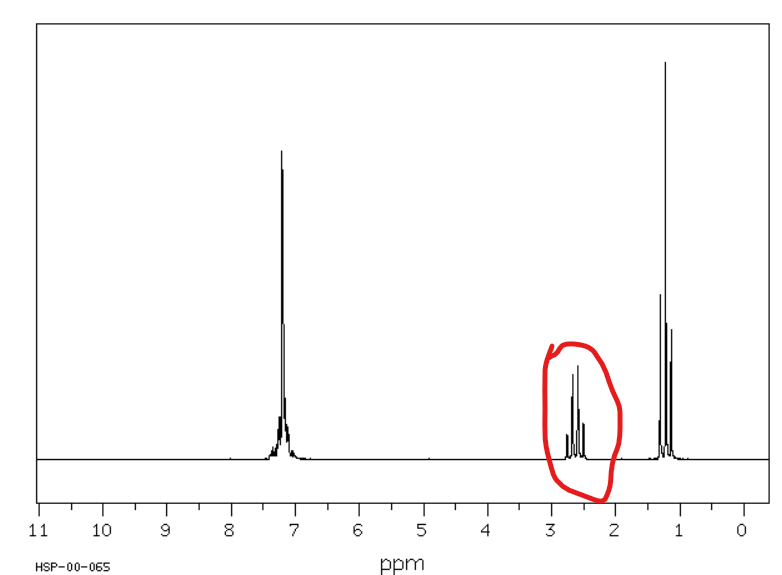
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów alkinylowych?
Od 1,8 do 3 ppm
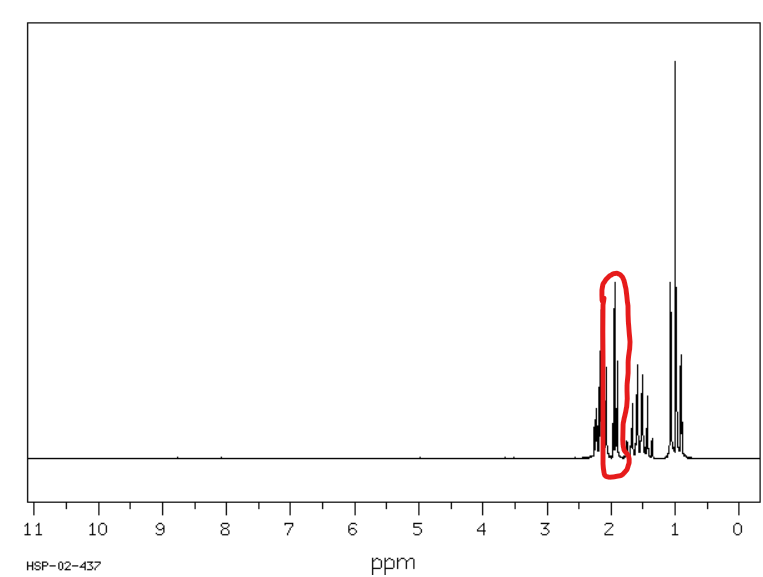
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów alfa w ketonach?
Od 2 do 2,4 ppm
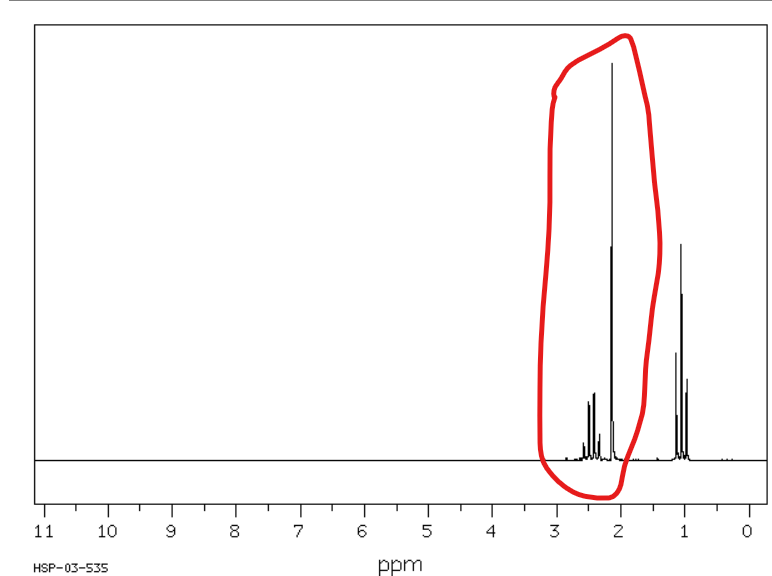
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów alfa-alkoholowych/alfa-eterowych?
Od 3,3 do 4,5 ppm
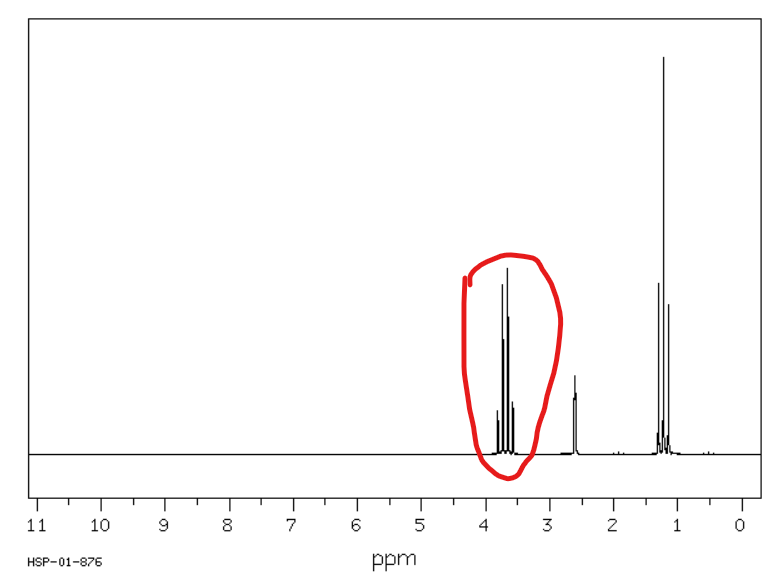
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów winylowych (przy wiązaniu podwójnym)?
Od 4,5 do 6,5 ppm
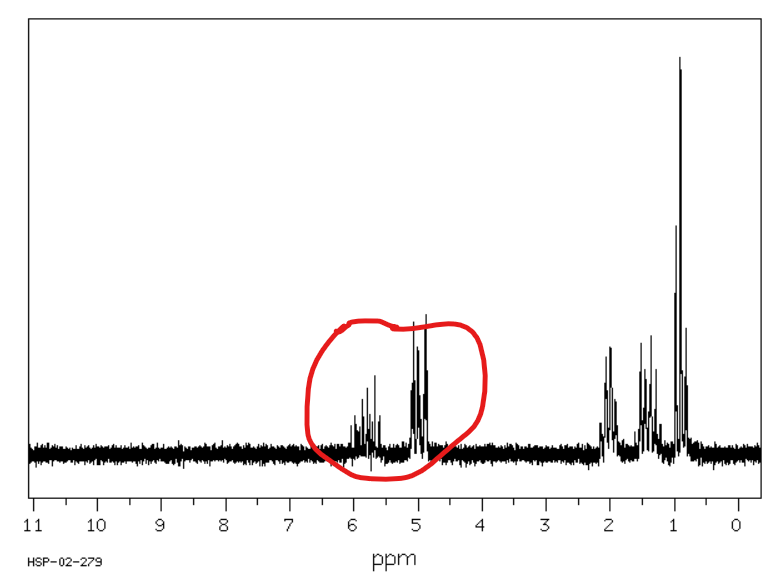
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów aromatycznych?
Od 6,5 do 8 ppm
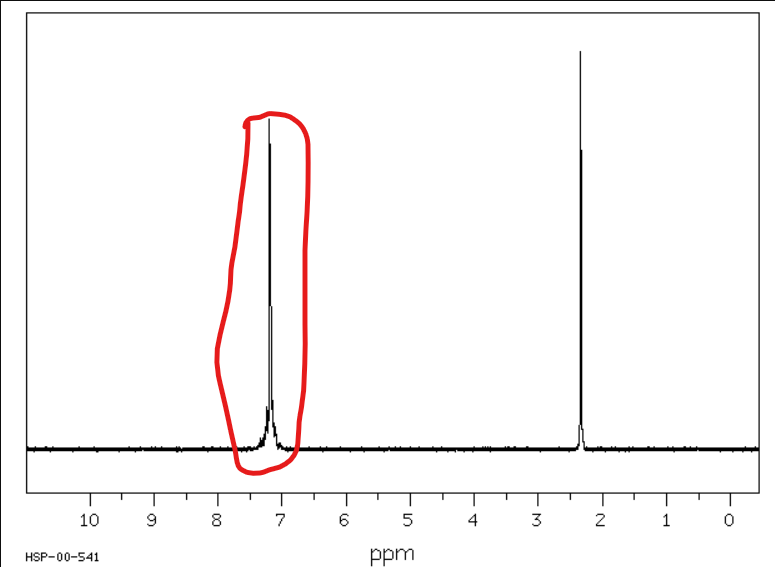
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów alfa-aldehydowych?
Od 9 do 10 ppm
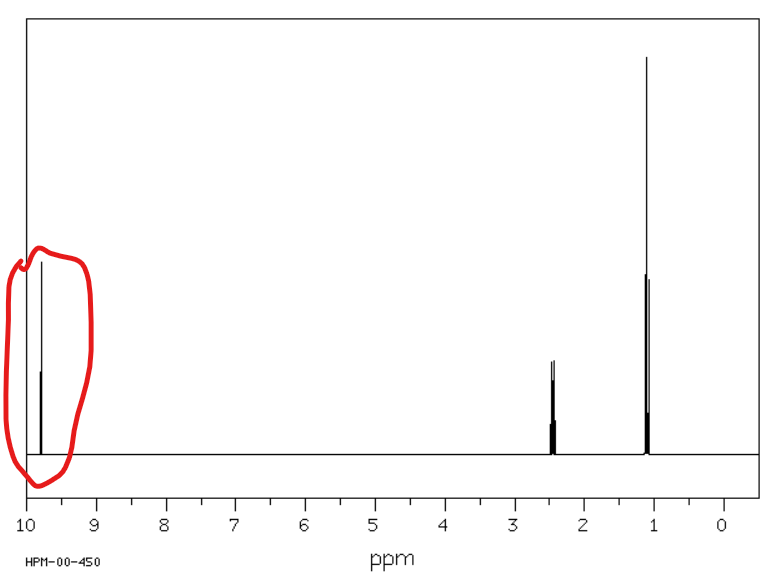
Jakie jest przesunięcie chemiczne w NMR 1H dla wodorów karboskylowych?
Od 10 do 13 ppm
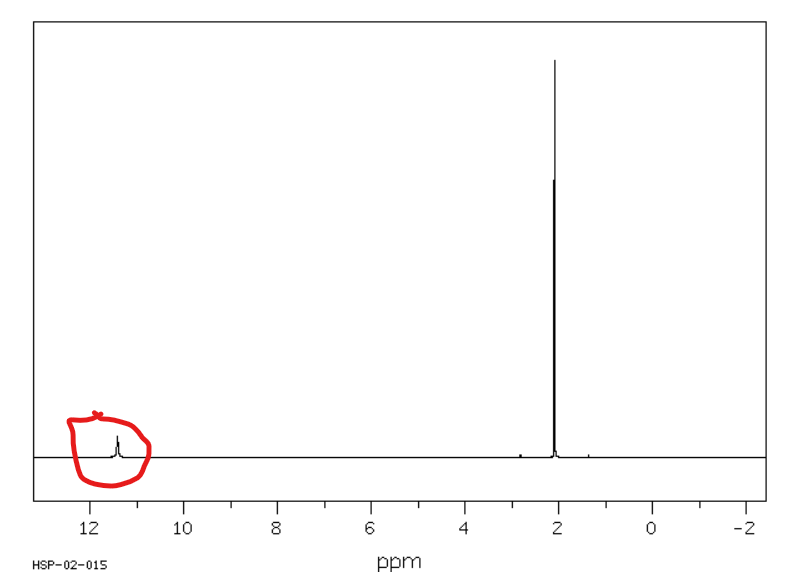
Jakie jest przesunięcie chemiczne w NMR 13C dla węglów alkilowych?
Od 10 do 60 ppm (im wyżej rzędowy węgiel tym mniejsza wartość przesunięcia chemicznego)
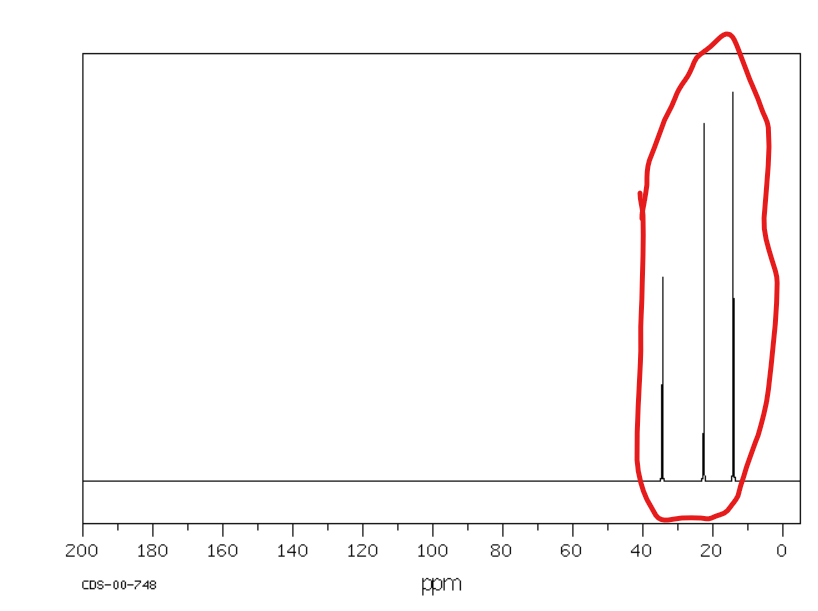
Jakie jest przesunięcie chemiczne w NMR 13C dla węglów alkenowych i aromatycznych?
Od 110 do 170 ppm
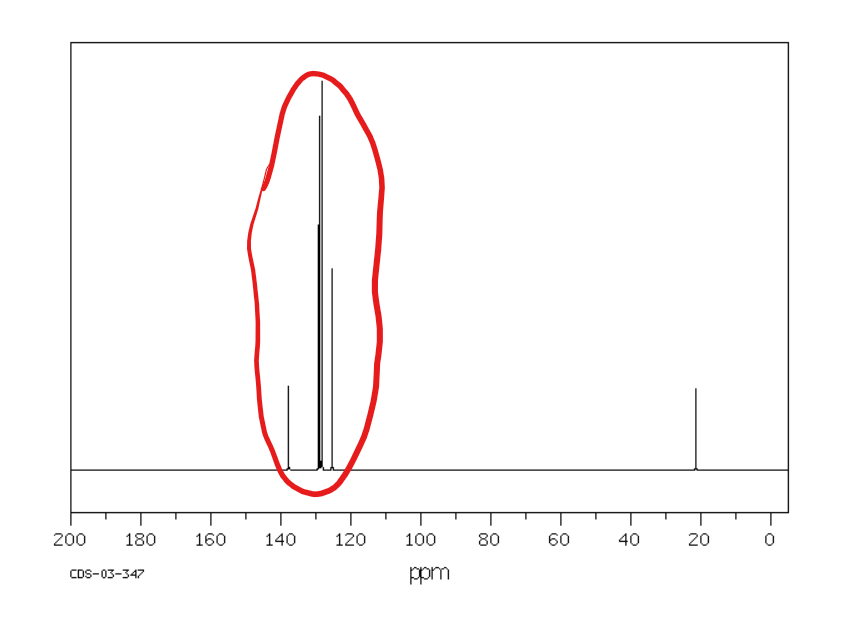
Jakie jest przesunięcie chemiczne w NMR 13C dla węglów karboksylowych?
Od 160 do 190 ppm
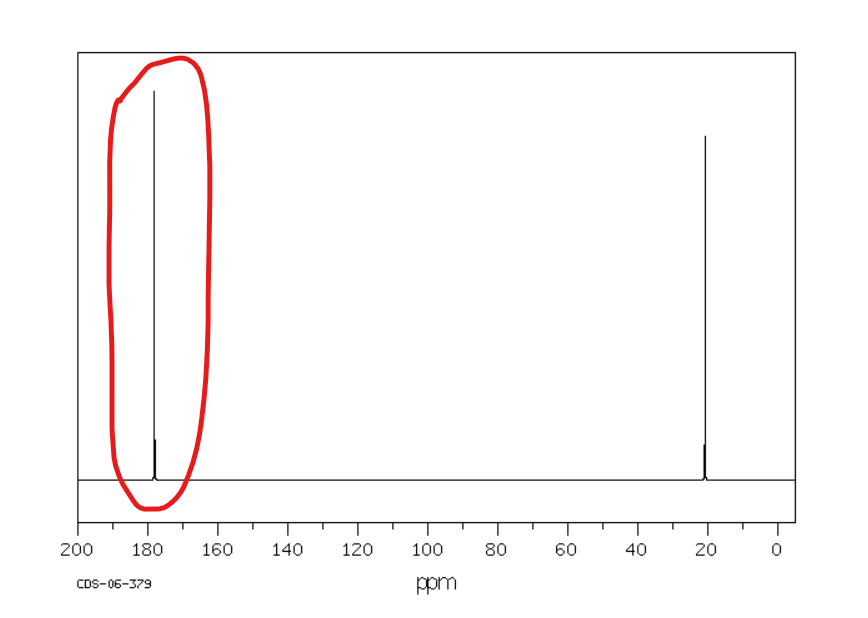
Jakie jest przesunięcie chemiczne w NMR 13C dla węglów ketonowych/aldehydowych?
Od 200 ppm w dół pola
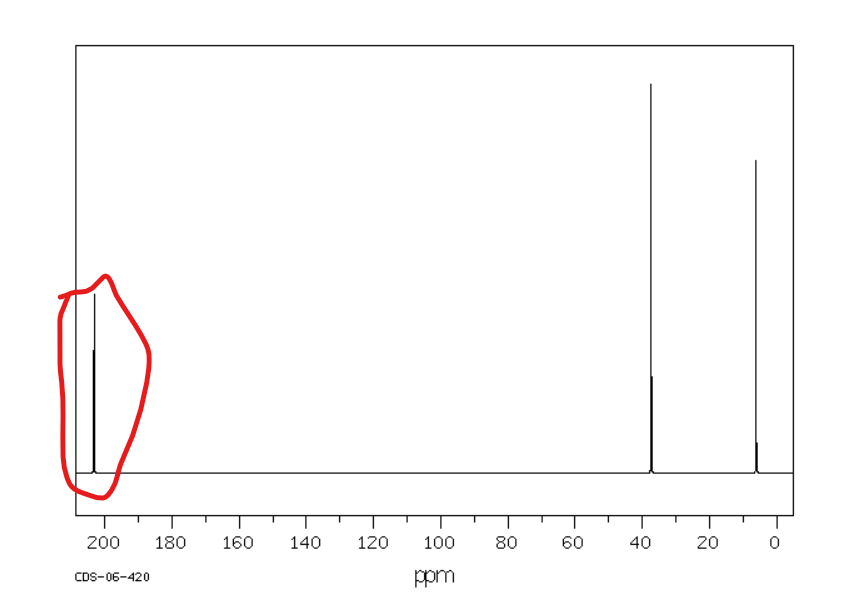
Jakie jest przesunięcie chemiczne w NMR 13C dla węglów nitrylowych?
Od 110 do 130 ppm
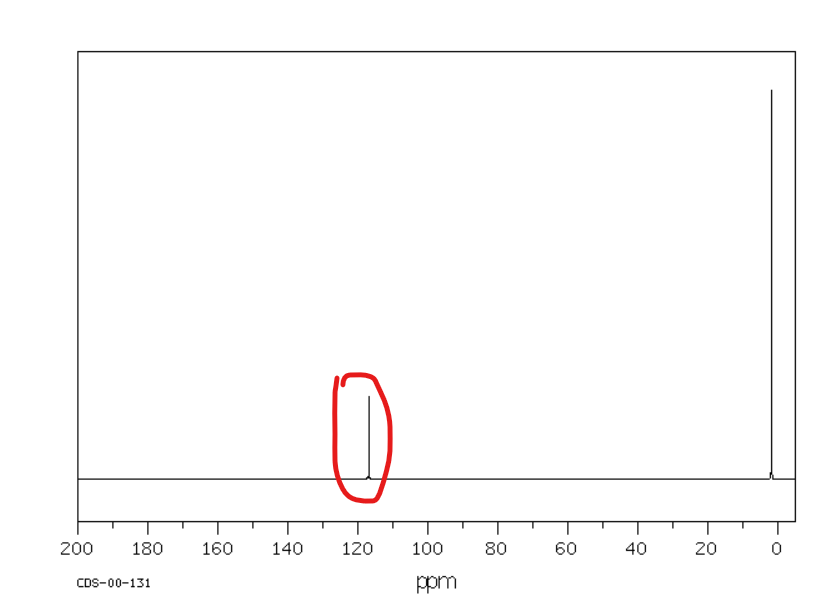
Jakie jest przesunięcie chemiczne w NMR 13C dla węglów alkoholowych/eterowych?
Od 60 do 100 ppm
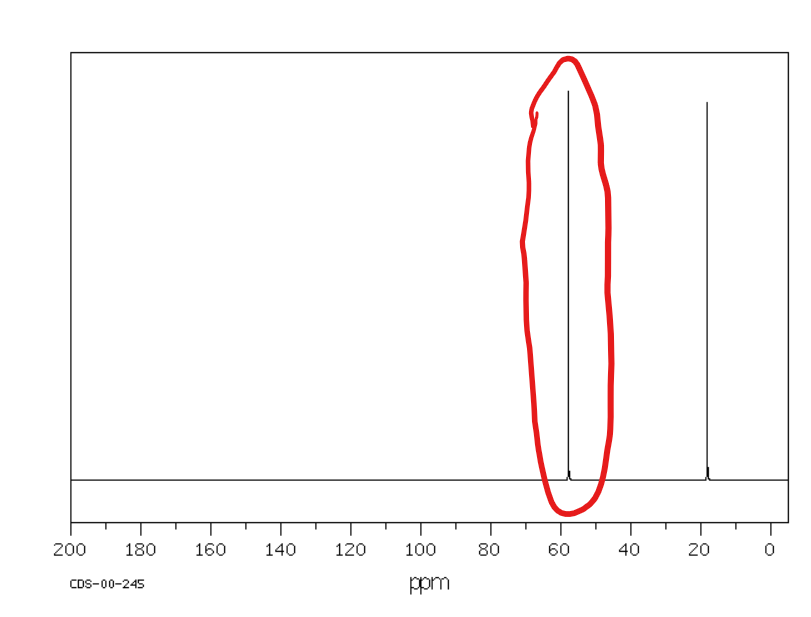
Jakie jest przesunięcie chemiczne w NMR 13C dla węglów alkinowych?
Od 70 do 110 ppm
Co możemy odczytać ze spektroskopii DEPR-90 i DEPR-135?
Rzędowość at. węgla. W DEPR-135 piki dodatnie są dla CH i CH3 a ujemne dla CH2, brak natomiast pików dla węgla czwartorzędowego. W DEPR-90 widać tylko piki CH
Co to protony niezależne?
To protony, które są nierównocenne i nie ma między nimi żadnej korelacji. Mają inne wartości absorpcji w widmie NMR.
Czym są protony homotropowe?
To protony równocenne chemicznie (czyli po podstawieniu jednego z nich halogenem będzie taki sam produkt niezależnie od wybranego wodoru) o takiej samej absorpcji w widmie NMR.
Czym są protony enancjotropowe?
To protony, które po podmienieniu jednego z nich halogenem dają enancjomer. Charakteryzują się taką samą absorpcją w widmach NMR.
Czym są protony diastereotopowe?
To protony, które po podmienieniu halogenem nie utworzą enancjomerów a diastereoizomery. Są to protony nierównocenne, a więc wykazują różną absorpcje w widmie NMR.
Jaki jest najlepszy substrat w reakcji SN1?
Halogenoalkan 2* lub 3* rzędowy
Jaki jest najlepszy substrat w reakcji SN2?
Halogenoalkan 1* lub 2* rzędowy
W którym typie substytucji nukleofil ma większy wpływ na kinetykę reakcji?
W SN2 ze względu na to, że jest to reakcja, pod względem kinetycznym, drugiego rzędu. W SN1 nie ma to aż takiego znaczenia, ponieważ etap limitujący reakcję zachodzi bez udziału nukleofila
Jaki powinien być rozpuszczalnik w reakcji SN2?
Powinien być polarny ale aprotyczny
W którym typie substytucji nukleofilowej następuje racemizacja konfiguracji, a w którym inwersja?
W SN1 dochodzi do racemizacji (atak może odbywać się z obydwu stron ze względu na płaski karbokation).
W SN2 dochodzi do inwersji (atak następuje z drugiej strony).
Jakie są warunki reakcji E2 i kiedy najłatwiej zachodzi?
Wymagana jest geometria antyperiplanarna (zazwyczaj chodzi o trans). Najłatwiej zachodzi dla halogenków 2* i 3* rzędowych.
Kiedy zachodzi reakcja E1?
W rozpuszczalnikach niezasadowych dla halogenków 3*
Czym jest reakcja Dielsa-Aldera?
Reakcją addycji 1,4 dienofilu (alkenu/alkinu) do sprzężonego dienu. W wyniku reakcji powstaje pierścień cykloheksenowy.
Czy istnieją warunki na reakcję Dielsa-Aldera?
Tak, wiązania dienowe muszą być w konfiguracji s-cis. Nie każdy związek może go spełnić przez zatłoczenie steryczne jakie wynikałoby z konfiguracji cisoidalnej.
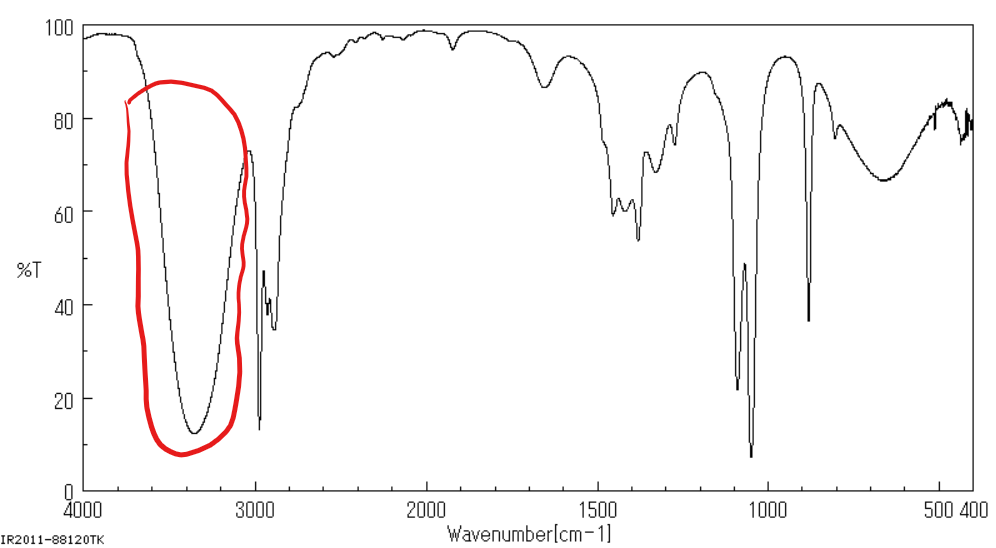
Jakie jest położenie pasma w spektroskopii IR jest dla alkoholi?
3400-3650 cm-1 i jest to długie, szerokie pasmo
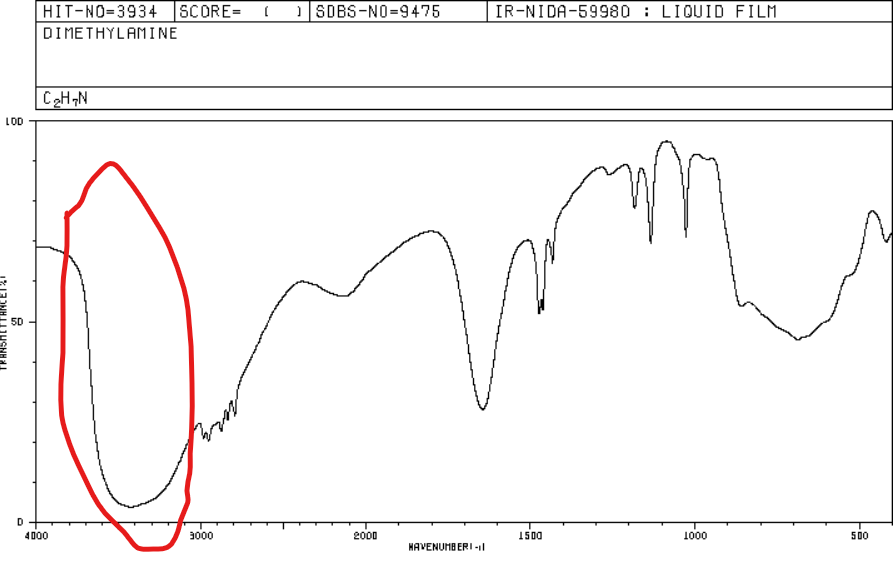
Jakie jest położenie pasma w spektroskopii IR dla amin 1* i 2*?
3300-3500 cm-1 i jest to długie, szerokie pasmo
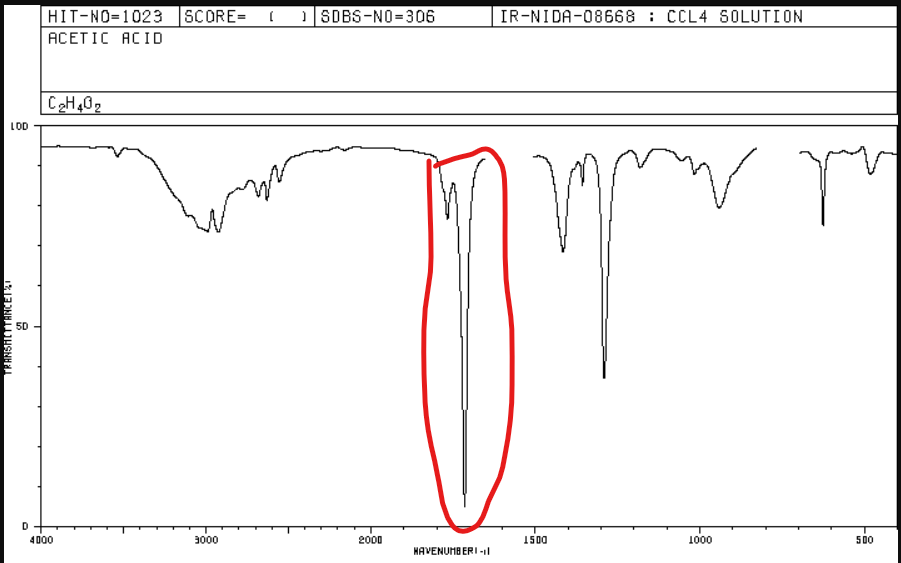
Jakie jest położenie pasma w spektroskopii IR dla związków karbonylowych?
Od 1670 do 1780 cm-1
Jakie jest położenie pasma w spektroskopii IR dla nitryli i alkinów (terminalnych)?
2210-2260 cm-1
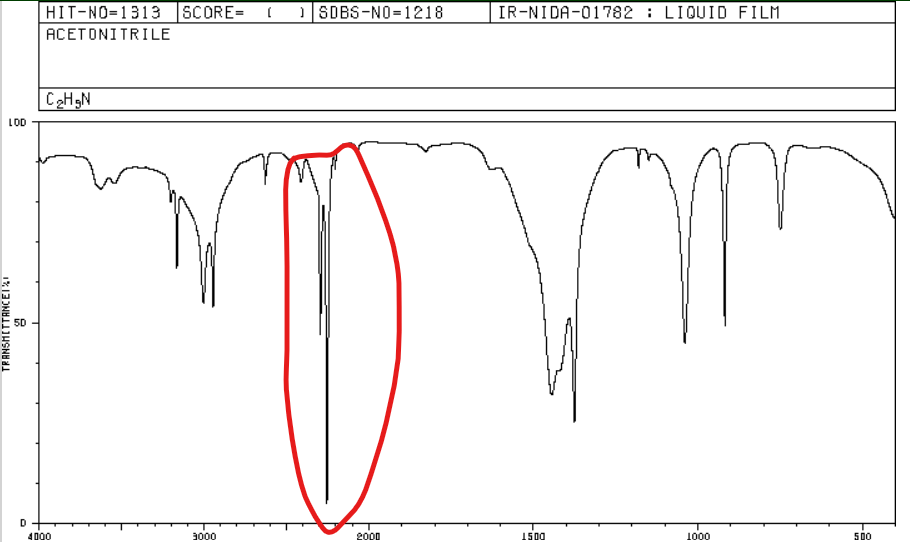
Jakie jest położenie pasma w spektroskopii IR dla arenów?
1450-1600 cm-1