zuren
1/28
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
29 Terms
Geef de vaak voorkomende binaire zuurresten
F- (fluoride)
Cl- (chloride)
Br- (bromide)
I- (iodide)
S²- (sulfide)
Geef de meest voorkomende binaire zuren
Hf (waterstoffluoride) , HCl (waterstofchloride), HBr (waterstofbromide), HI (waterstofjodide), H2S ((di)waterstofsulfide)
geef de populaire ternaire zuren

Geef sterke zuren

Geef de sterke bases
OH-, H-, Nh2-, O²,
Geef de zwakke basen

Een sterk zuur gaat … geïoniseerd voorkomen
Volledig
Een zwakke base gaat … geïoniseerd voorkomen
Niet volledig
Een sterke base gaat … geïoniseerd voorkomen
Volledig
Een zwak zuur gaat … geïoniseerd voorkomen
Niet volledig
Een sterk zuur dissocieert … in …
Volledig in een geconjugeerde base en h3O+
Een sterke base dissocieert … in …
Volledig in een geconjugeerde zuur en OH-
Kw (dissociatieconstante van water) =
[H3O+] × [OH-]= 1,00 × 10^-14
[H3O+] =
[OH-] = 1,00^-7
pH=
-log[H3O+] of 14-pOH
pOH =
-log [OH-]
kZ (dissociatieconstante ve zuur in water) =
([H3O+] × [A-]) / [HA]
kB (dissociatieconstante ve base in water) =
([OH-] × [BH+])/ [B]
pkz=
-log kz
pkb=
-log kb
verband tussen kz en kb van een zuur base koppel
[H3O+] × [OH-]= 1,00 × 10^-14 —> pkz + pkb = 14 (bij 25 graden celsius)
Als de Kz/Kb stijgt dan…
daalt het pkz/pkb en stijgt de sterkte van een zuur/base
de kz of kb ligt tussen … bij een zwak zuur/base
1,00 × 10^-14 en 1
de kz of kb is … bij een sterk zuur/base
groter dan 1 en is dus een aflopende reactie
als de kz of kb 1 is dan…
is er een chemisch evenwicht
Een buffer is
mengsel om binnen een bepaalde range ph constant te houden —> buffer is altijd een zwak zuur en een zout van zijn geconjugeerde base of een zwakke base een zout van zijn geconjugeerde zuur
waarvoor dient titratie
in een zuur base titratie ga je ph gebruiken om de concentratie van je betrokken stof te zoeken
Is de onbekende stof een zuur dan moet je titreren met een base en omgekeerd
welk formule gebruik je om een formule te vinden bij titratie
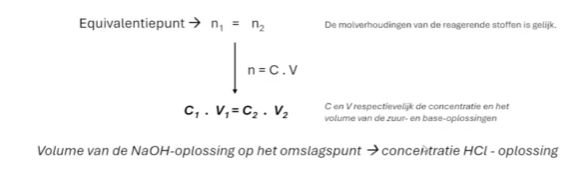
Als de evenwicht constante onder de… is, dan ligt evenwicht naar … en als die boven de … dan ligt de evenwicht naar …
onder 10^-3, links en boven 10³ naar rechts