Chemia wykład 4 20 listopada
1/21
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
22 Terms
o czym mówi teoria dysocjacji elektrolitycznej archeniusa? /co to są elektrolity i nieelektrolity według Arrehniusa?
elektrolity to związki chemiczne które po rozpuszczeniu w wodzie lub w stanie stopionym przewodzą prąd elektryczny, np sole kwasy i zasady, nieelektorlity to związki chemiczne które prądu nie przewodzą

co to dysocjacja elektrolityczna?
rozpad cząstek elektrolitów na jony pod wpływem wody

co to jony? jakie są? podaj nazwy
atomy lub grupy atomów obdarzone ładunkiem, dodatnie-kationy, ujemnym- aniony

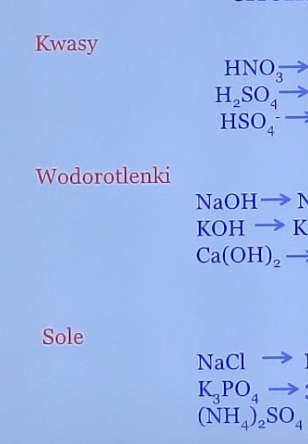
przeprowadz dysocjację elektrolitytczną tych związków:

co jest według Arrheniusa miarą mocy kwasów i zasad?
ich stopień dysocjacji α

co to stopień dysocjacji? podaj wzór
wielkość określająca jaka część cząsteczek substancji rozpuszczonej uległa dysocjacji na jony (jak silny jest elektrolit)
α=(nz*100%)/ nw gdzie nz to liczba moli cząsteczek zdysocjowanych na jony, a nw liczba moli cząsteczek rozpuszczonej PO PROSTU ICH STOSUNEK TO STOPIEŃ DYSOCJACJI

podaj zakresy procentowe mocnych i słabych kwasów i zasad odnoiśnie ich stopnia dysocjacji podaj przykłady bardzo mocnych i słabych kwasów i zasad
70%-100% to bardzo mocne np. kwas azotowy V, wodorotlenek potasu, 20%-70% to mocne np. wodorotlenek wapnia, kwas siarkowy VI, 1%-20% średnio mocne np. kwas fosforowy V i wodorotlenek srebra, 0,1%-1% to słabe amoniak i kwas octowy, mniejsze niż 0,1% to bardzo słabe np. wodorotlenek glinu i kwas węglowy
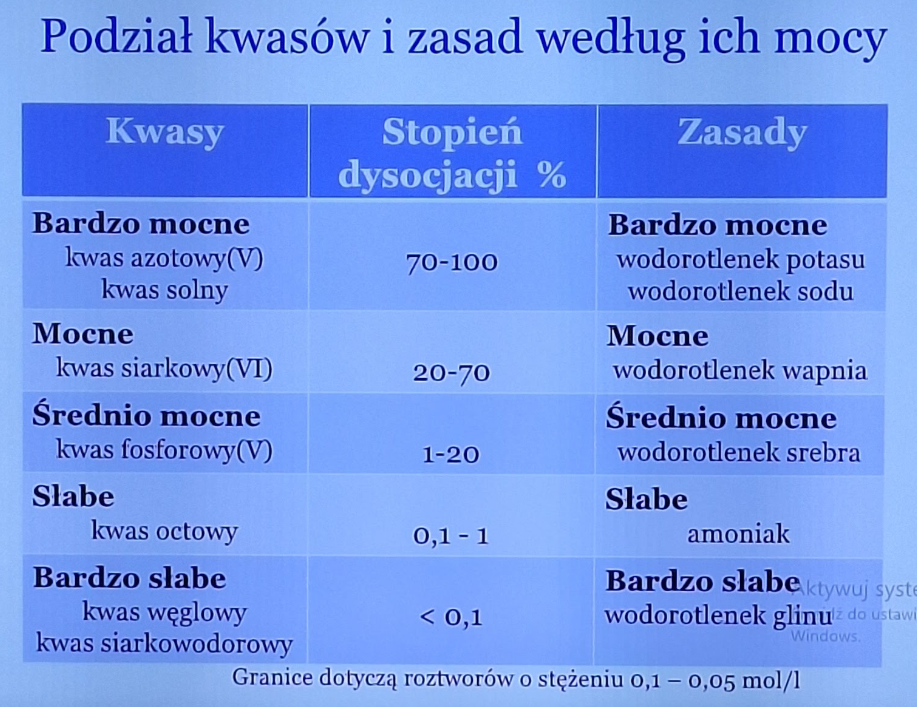
od czego zależy stopień dysocjacji? (4)
rodzaj elektrolitu, rodzaju rozpuszczalnika, stężenia roztworu, temperatury (nieznacznie)

co to elektrolity mocne i słabe?
mocne to takie związki które w niezbyt stężonym roztworze wodnym dysocjują całkowicie α=1 (100%), słabe to takie związki co w roztworze wodnym tylko częściowo dysocjują na jony α<1

o czym mówi stała dysocjacji?
miara ta mówi jak łatwo dany związek ulega dysocjacji na jony, im większe K tym łatwiejsza dysocjacja
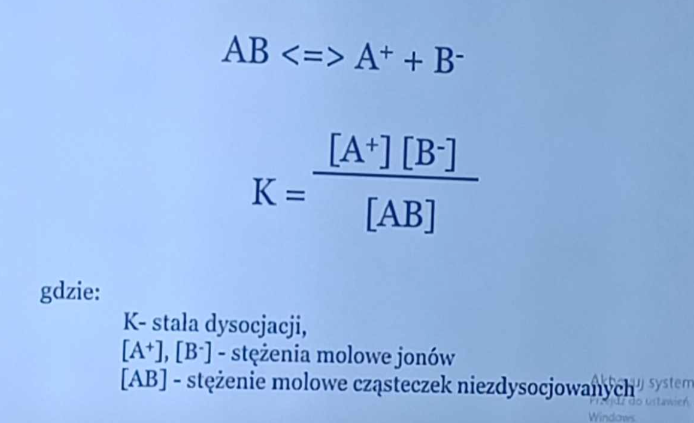
podaj wzór na stałą dysocjacji
K=(A++B-)/AB gdzie A+ i B- to stężenia molowe jonów a AB to stężenie molowe cząsteczek niezdysocjowanych

podaj teorię kwasów i zasad według Bronsteda-Lowrego
kwasy to związki chemiczne lub jony zdolne do oddawania protonów a zasady do ich przyłączania

czym charakteryzują się kwasy anionowe? podaj przykład
proton pochodzi od anionu np. HSO4-

czym charakteryzują się kwasy kationowe? podaj przykład
proton pochodzi od jonu dodatniego (kationu) np NH4+

czym charakteryzują się kwasy cząsteczkowe? podaj przykład
proton pochodzi z cząsteczki neutralnej np HCl

czym charakteryzują się zasady cząsteczkowe? podaj przykład
proton przyjmowany jest przez neutralną cząsteczke np. NH3

czym charakteryzują się zasady anionowe? podaj przykład
proton przyjmowany jest przez ujemny jon- anion np. CO3^2-

czym charakteryzują się zasady kationowe? podaj przykład
proton przyjmowany jest przez dodatni jon-kation np. N2H5+

czym jest woda według Lewisa?
zarówno zasadą i kwasem
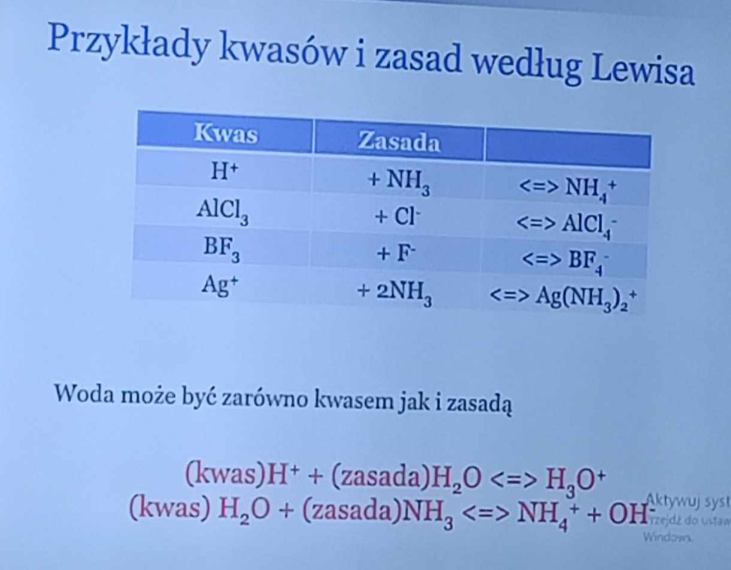
teoria kwasów i zasad - Arrhenius podaj
kwasy odszczepiają H+ a zasady OH-

teoria kwasów i zasad- Bronsted-Lowery podaj
kwasy to donory H+ (protonów), zasady akceptują H+ (przujmują protony)

teoria kwasów i zasad według Lewisa
kwasy są akceptorami pary elektronowej a zasady donorami tej pary
