Algemene chemie: termen
1/120
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
121 Terms
atoomnummer (Z)
het aantal protonen in de kern van een atoom
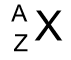
massagetal (A)
som van de protonen en neutronen in een atoom
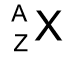
Isotopen
atomen met hetzelfde aantal protonen en elektronen, maar verschillend aantal neutronen en dus ook verschillende massa
relatieve atoommassa
een getal dat uitdrukt hoeveel keer de massa van dat getal groter is dan de atomaire massaeenheid
atomaire massaeenheid
1/12 van de absolute massa van een koolstof-12isotoop (1,66×10-24g)
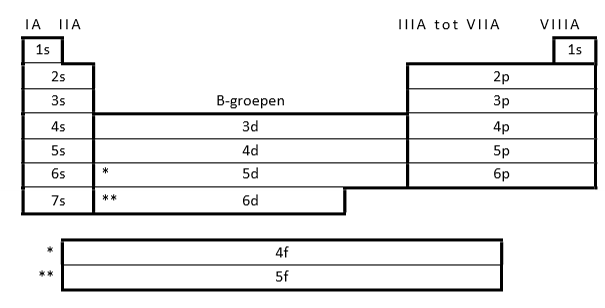
hoofdgroepen
A-groepen
nevengroepen
B-groepen
transitie-elementen
elementen in de nevengroepen
inner-transitie-elementen
lathaniden en actiniden
orbitaal
ruimte rond een atoomkern waar de elektronen het meest waarschijnlijk voorkomen
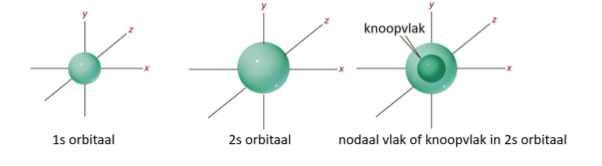
s-orbitaal (vorm)
sfeer

verschil 1s en 2s-orbitaal
2s is groter dan 1s-orbitaal
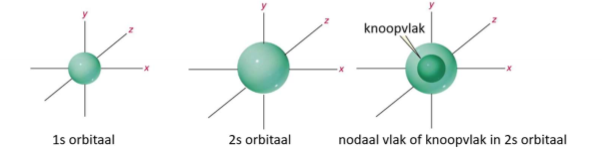
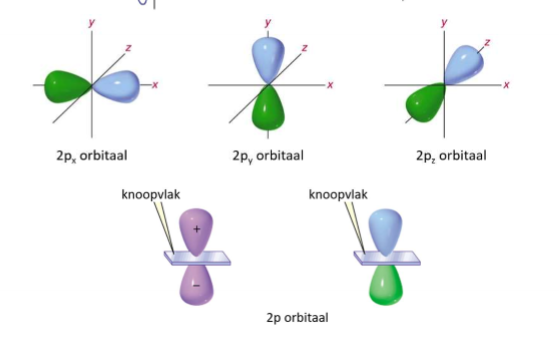
knoopvlak
denkbeeldig vlak in een orbitaal waar de kans om een elektron te vinden onbestaand is
p-orbitalen (vorm)
2 lobben
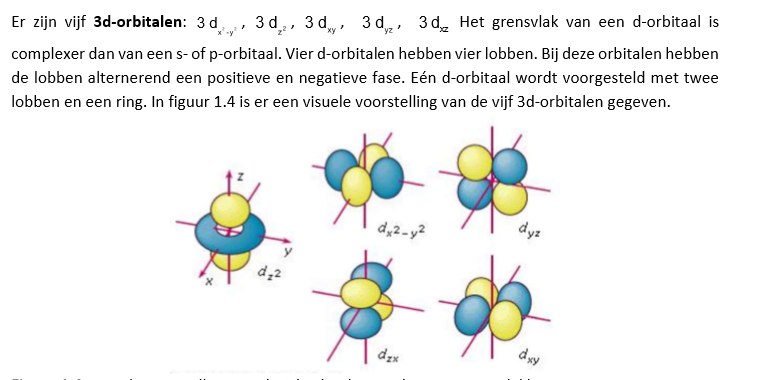
d-orbitalen
atoomorbitaal
hoogstens 2 elektronen met verschillende spin
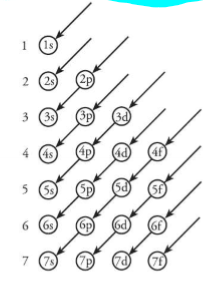
opbouwprincipe (definitie)
volgorde waarin de atoomorbitalen worden opgevuld om de grondtoestand (=meest stabiele toestand) te verkrijgen.
opbouwprincipe (volgorde)
diagonaalregel: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f
valentie-elektronen
elektronen op de buitenste schil
elektronenconfiguratie in grondtoestand van 1e 10 elementen (met orbitaaldiagram, best schrijven)
Orbitaaldiagram:
Bv. H: 1 1S1 1S: ↑
He: 2 1S2 1S: ↑↓ (gepaarde spin)
Li: 3 1S2 2S1 1S: ↑↓ 2S: ↑
= [He] 2S1
B: 5 [He] 2S2 2P1 2S: ↑↓ 2Px: ↑
C: 6 [He] 2S2 2P2 2S: ↑↓ 2Px: ↑ 2Py: ↑
N: 7 [He] 2S2 2P3 2S: ↑↓ 2Px:↑ 2Py: ↑ 2Pz: ↑
O: 8 [He] 2S2 2P4 2S: ↑↓ 2Px: ↑↓: 2Py: 2Pz: ↑
P: 9
Ne: 10 [He] 2S2 2P6 2S: ↑↓ 2Px:↑↓ 2Py: ↑↓ 2Pz: ↑↓ (Edelgasconfiguratie)
uitzonderingen elektronenconfiguratie

energiediagram

periodieke eigenschappen
ionische binding
elektronen worden overgedragen, het ene atoom wordt kation, het ander anion. (Voorbeelden: NaCl, LiAlH4)
kation
positief geladen ion
anion
negatief geladen ion
gewone covalente binding
Ø twee dezelfde atomen vormen 1 tot 3 bindingen door voor elke binding elk één elektron ter beschikking te stellen. Ze delen dus hun elektronen. (Voorbeelden: H2, N2)
coördinatieve/datieve covalente binding
tussen twee verschillende atomen. Beide elektronen in de binding zijn van één van de atomen afkomstig. (Voorbeeld: H3O+)
polaire covalente binding
tussen twee verschillende atomen. Beide atomen geven één elektron per binding, maar t.g.v. de verschillende elektronegativiteiten worden de twee elektronen meer naar één van de atomen toegetrokken (deelladingen δ, dipoolmoment µ)
formele lading
de lading die aan een atoom in een molecule of samengesteld ion wordt
#valentie-elektronen - #toegekende elektronen

elektronegativiteit
mate waarin een atoom elektronen naar zich toe trekt
partiële lading
gedeeltelijke lading van een atoom binnnen een molecuul
elektrische dipool
wordt gevormd door de twee partiële ladingen voorgesteld door een vector
dipoolmoment
de grootte van de vector van een elektrische dipool.
is het product van de lading en de afstand
Uitzondering edelgasconfiguratie (minder)
BF3: 6VE, alternatief is ongunstig door lading van dubbele binding tussen B en Fl (elektronegativiteit)
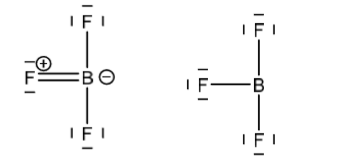
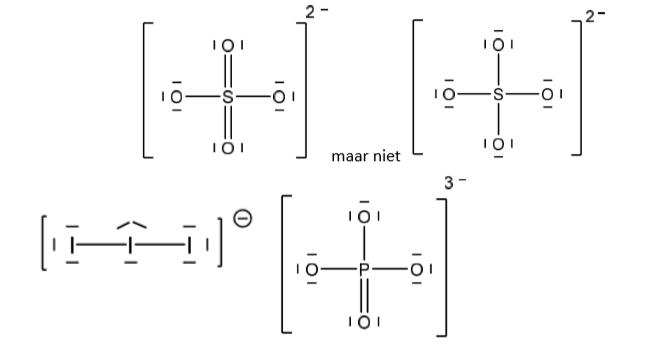
Uitzondering edelgasconfiguratie (meer)
Bij moleculen waarin het centrale atoom, een element van de derde periode is (s-, p- en d-orbitalen). Als d-orbitalen gebruikt worden voor bindingen kunnen meer dan 8VE zijn.
alifatische verbindingen
zijn alle verbindingen gemaakt door koolwaterstoffen die niet aromatisch (ook niet anit-aromatisch) zijn
cyclische verbindingen
de koolstoffen zijn in een ringvorm verbonden met elkaar
aromatische verbindingen
verbindingen die een aromatische ring zoals vb. benzeen bevatten
Verzadigd-Onverzadigd koolwaterstoffen
Verzadigd: enkele bindingen aan H vanuit C-atomen
Onverzadigd: als er dubbele bindingen zitten tussen de koolstofatomen
cis/trans isomerie
cis: alkeen waarbij de 2 gelijke substituenten op zitten aan dezelfde kant en tegenover zitten de waterstoffen
trans: alkeen waarbij de 2 gelijke substituenten op schuin tegenover elkaar bevinden en de waterstoffen vult de rest op
E/Z-configuratie
Volgens CIP prioriteitsregel.
E=entgegen, de zware ketens zitten schuin tegenover elkaar
Z=zusammen, de zware ketens zitten aan dezelfde kant
CIP prioriteitsregel
CIP=Cahn-Ingold-Prelog: substituenten op dezelfde koolstof-atoom worden vergeleken op basis van het atoomnummer van het atoom dat rechtstreeks op de dubbele binding staat.

benzeen (definitie)
eenvoudigste aromaat: zeshoek met 3 dubbele bindingen
arylgroep (definitie)
substituent/functionele groep afgeleid van aromaat door het verwijderen van 1 H-atoom
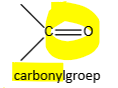
carbonylgroep (definitie)
groep bestaande uit een koolstofatoom dubbel gebonden met een zuurstofatoom
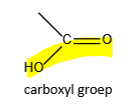
carboxylgroep (definitie)
combinatie van carbonyl- en hydroxylgroep
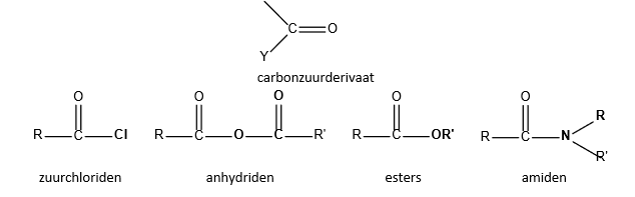
carbonzuurderivaten (definitie)
carbonzuren waarbij hydroxylgroepen vervangen is door een ander elektronegatieve substituent Y.
identificeren van hoofdketen

nummering hoofdketen

Getal van Avogrado
NA = 6,02×10²³
gasconstante
R = 8,314 J*mol-1*K-1
molariteit
=concentratie
aantal mol/liter
normaliteit
~molariteit (aantal reagerende functionele groepen per molecule)
bv. 1 wijnsteenzuur + 2 NaOH —> zuurrest + 2 Na+ + 2 H2O
normaliteit van NaOH = 2N
normaliteit van wijnsteenzuur = 1N
partieeldruk (definitie)
de druk van gas A (in een mengsel) wanneer alleen A in hetzelfde volume V (totale volume mengsel) aanwezig is.
omzettingsgraad (definitie)
Xt = (aantal mol A weggereageerd op tijd t)/(aantal mol op tijd 0)
opbrengst (definitie)
Yt = (aantal mol C reëel gevormd)/(aantal mol C dat maximaal kan gevormd worden)
invloed potentiaal op redox (redoxpotentiaal = E0)
hoe negatiever, hoe beter de reductans
hoe positiever, hoe beter de oxidans
reactiesnelheid (definitie)
v = (∆concentratie)/(∆tijd)
is evenredig met de concentraties van de reagentia
→ v = k*[reagens1]*[reagens2]
k is de snelheidsconstante
evenwichtsconstante (definitie + vergelijking)
constante K drukt de verhouding uit van de concentraties bij chemisch evenwicht. (waterconcentratie niet constante opgenomen bij zuren of basen)
a*A + b*B ⇌ c*C + d*D
vloeistof: K = ([C]c*[D]d)/([A]a*[B]b) (concentraties bij evenwicht)
vaste stof: K= verhouding van molfractie
gas: K = verhouding van partieeldrukken
![<p>constante K drukt de verhouding uit van de concentraties bij chemisch evenwicht. (waterconcentratie niet constante opgenomen bij zuren of basen)</p><p>a*A + b*B ⇌ c*C + d*D</p><p></p><p>vloeistof: K = ([C]<sup>c</sup>*[D]<sup>d</sup>)/([A]<sup>a</sup>*[B]<sup>b</sup>) (concentraties bij evenwicht)</p><p>vaste stof: K= verhouding van molfractie</p><p>gas: K = verhouding van partieeldrukken</p>](https://knowt-user-attachments.s3.amazonaws.com/b102b112-7046-4454-a5d5-703cd28487c3.png)
inwendige energie (definitie)
Bij inwendige energie (U) wordt meestal het verschil in inwendige energie (∆U) gebruikt, om zo te weten te komen of het energie opneemt of afgeeft.
∆U = ∆H + p*∆V
enthalpie (defintie)
Enthalpie (H) is de wartme-energie die stof heeft. Het verschil in enthalpie is wel voor reacties. Indien het energie wordt afgegeven is ∆H negatief en bij opname positief.
∆H, negatief = exotherm → spontane reacties
∆H, positief = endotherm
De verandering hangt af van de sterkte en het aantal bindingen die gebroken/gevormd worden. (zie p.6.10 voor meer informatie)
arbeid bij chemische reacties (definitie)
De arbeid (w) is de energie gebruikt bij het expanderen van de volume om de druk in de opstelling gelijk te houden aan de buitendruk.
w = p*∆V
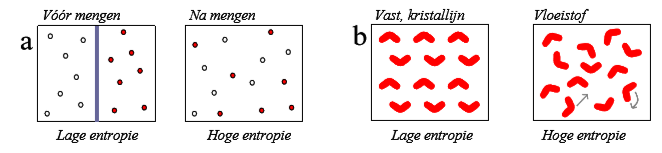
entropie (definitie)
Entropie (S) is een maat voor de wanorde in een systeem. Hoe meer mogelijke manier om de atomen, de molecules in het systeem geschikt kan worden hoe wanordelijker.
Mengen zorgt voor entropieverhoging en wanneer een vaste stof smelt een vloeistof wordt ook.
vije energie (definitie)
Vrije energie (G) is de grootheid die de trends van enthalpie en entropie combineerd. Een reactie verloopt spontaan bij een negatieve ∆G.
∆G = ∆H - T∆S
negatieve ∆G = exergonische reactie = reactie loopt verder
∆G = 0 = chemisch evenwicht
positieve ∆G = endergonische reactie = reactie loopt terug
reactiequotiënt (definitie)
Analoog aan evenwichtsconstante K, maar een momentopname. d.w.z. ipv bij evenwicht, worden de concentraties op een gegeven moment gebruikt om het quotient Q te berekenen.
vrije energie verandering (∆rG0) (formule)
∆rG0 = -R*T*ln(K)
bij chemisch evenwicht: ∆rG = 0 = ∆rG0 + R*T*ln(K) → ∆rG0 = -R*T*ln(K)
effect van externe factoren op chemisch evenwicht (invloeden + formules)
Temperatuur: hangt af van exotherme of endotherme karakter van reactie.
endotherme reactie: evenwicht meer rechts bij hogere temperatuur
exotherme reactie: evenwicht meer rechts bij lagere temperatuur
ln(KT) = ln(K298) - (∆rH0/R)*(1/T - 1/298) ↔ ∆rG0T = -R*T*ln(KT)
Reactievolume/Druk (voor gassen):
als gasmoleculen toeneemt in heenreactie en drukverhoging → chemisch evenwicht naar links
als gasmoleculen afneemt en drukverhoging → chemisch evenwicht naar rechts
Concentratie:
toevoegen van extra reagentia of verwijderen van producten → reactie-evenwicht naar rechts
toevoegen van producten → evenwicht naar links
exergonisch/endergonisch (betekenis)
exergonisch: spontaan
endergonisch: niet spontaan
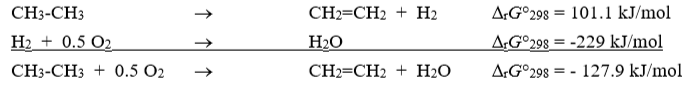
gekoppelde reactie (definitie)
Een gekoppelde reactie is een proces waarbij een thermodynamisch ongunstige reactie toch verloopt doordat ze direct gekoppeld is aan een gunstige reactie, zodat de totale ΔG negatief is.
Voorbeeld: dehydrogenatie van alkaan naar alkeen adhv reactie van H2 met O2
Anders gezegd: een endergonische reactie wordt gekoppeld aan een reactie die nog sterker exergonisch is.
sterke zuren (definitie)
dissociëren volledig in protonen (of H3O+) en het bijhorende anion A-

Leveling effect:
In water is H3O+ de sterkste zuur dat kan bestaan, bij toevoeging van sterkere zuren → reactie met water en meteen H3O+ gemaakt.
→ zuursterkte van toegevoegde zuren worden verwaarloosd en geëvenaard
Bij sterke base analoog aan sterke zuren:
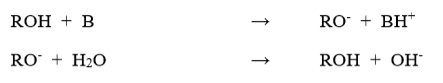
sterke basen (definitie)
hierbij treedt zoals bij sterke zuren volledige dissociatie. (vaak eenwaardige of tweewaardige metaalionen: Na+, Mg2+)

zwakke zuren en basen (soort reactie)
Bij deze soort stoffen treedt er een onvolledige reactie op (gedeeltelijke dissociatie) Evenwicht ligt naar links = Ka << 1 → grotere pKa-waarde
zuurdissociatieconstante (definitie)
=Ka: Analoog aan gewone evenwichtsconstante, maar dan bij zuren waardoor water uit de vergelijking gelaten wordt.
Evenwicht ligt naar links: Ka << 1 (= grotere pKa-waarde) = zwakke zuur
Evenwicht naar rechts: lagere pKa-waarde = sterke zuur
→ evenwichtsconstante van zuren pKa waarbij,
pKa = - log(Ka)
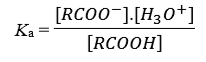
basiciteitsconstante (definitie)
=Kb:
sterke base: Kb-waarde groter (maar typisch nog steeds << 1) → kleinere pKb
geconjugeerde zuur (definitie)
Geprotoneerde vorm van een base.
Hoe zwakker de base, hoe meer neiging de geconjugeerde base heeft om weer een proton af te geven.
Reacties tussen zuren en basen (reacties opnoemen)
sterke zuur + sterke base: aflopend
zwake zuur + sterke base of sterke zuur + zwakke base: aflopend
zwakke zuur + zwakke base: pKa en pKb controleren voor evenwicht te zien
(zie p. 7.8 voor examenvraag)
pH berekenen van zouten/zuur-base(de verschillende situaties)
Oplossingen van zouten van zwakke zuren: (K: metaalkation, A: anion, GB: geconjugeerde base)
ZZ → K+ + A- (oplossing, H2O) ↔ A- + H2O → GB + OH-
pOH = -log([OH-]) → pH = 14 - pOHOplossingen van zouten van zwakke basen: analoog met geconjugeerde zuur
pH = -log([H3O+)Oplossingen van sterk zuur + zwak zuur: dissociatie van sterk zuur is volledig waardoor evenwicht van dissociatie van zwak zuur naar links gaat. → De pH wordt dan volledig bepaald door het sterke zuur.
Oplossingen van sterke + zwakke base: analoog aan sterk zuur met zwak zuur, maar dan met OH- → Enkel sterke base beïnvloedt pH.
Oplossingen van zwakke base + sterke zuur: pH wordt bepaald door de relatieve hoeveelheden die gemengd worden. (zie p.7.10)
Oplossingen van zwak zuur + sterke base: bepalen de concentraties naar welk stof er gekeken moet worden. (zie p. 7.10-11 en afbeelding)
Oplossingen van zwak zuur + zwak base: wordt bepaald door overmaat zuur of base. (zie p.7.11-12)
![<ul><li><p><strong>Oplossingen van zouten van zwakke zuren:</strong> (K: metaalkation, A: anion, GB: geconjugeerde base)<br>ZZ → K<sup>+</sup> + A<sup>- </sup>(oplossing, H<sub>2</sub>O) <span>↔</span><sup> </sup>A<sup>-</sup> + H<sub>2</sub>O → GB + OH<sup>-</sup><br>pOH = -log([OH<sup>-</sup>]) → pH = 14 - pOH</p></li><li><p><strong>Oplossingen van zouten van zwakke basen:</strong> analoog met geconjugeerde zuur<br>pH = -log([H<sub>3</sub>O<sup>+</sup>)</p></li><li><p><strong>Oplossingen van sterk zuur + zwak zuur:</strong> dissociatie van sterk zuur is volledig waardoor evenwicht van dissociatie van zwak zuur naar links gaat. → <u>De pH wordt dan volledig bepaald door het sterke zuur.</u></p></li><li><p><strong>Oplossingen van sterke + zwakke base:</strong> analoog aan sterk zuur met zwak zuur, maar dan met OH<sup>-</sup> → <u>Enkel sterke base beïnvloedt pH.</u></p></li><li><p><strong>Oplossingen van zwakke base + sterke zuur: </strong><u>pH wordt bepaald door de relatieve hoeveelheden die gemengd worden. (zie p.7.10)</u></p></li><li><p><strong>Oplossingen van zwak zuur + sterke base:</strong> bepalen de concentraties naar welk stof er gekeken moet worden. (zie p. 7.10-11 en afbeelding)</p></li><li><p><strong>Oplossingen van zwak zuur + zwak base: </strong>wordt bepaald door overmaat zuur of base. (zie p.7.11-12)</p></li></ul><p></p>](https://knowt-user-attachments.s3.amazonaws.com/cf8318cb-511f-4aa6-b410-b5c89b1622b1.png)
intermediairen/IM (definitie)
Vrij stabiele tussenstapen in een reactieverloop. Op de G-curve vormen ze lokale minima.
Voorbeelden: carbokationen, carbonanionen, radicalen (met ongepaard e- op C, of op O, etc.)
Elementaire stap (definitie)
Elke stap van reagentia tot product met daar tussen IM’n.
Transitietoestand/TS (definitie)
Het maximum van G na een elementaire stap, waarbij een binding is gebroken en de nieuwe bindingen nog moeten gevormd worden. Aangeduid door ++ bij een ∆G.
activatie-vrije-energie/∆G++ (definitie)
Het verschil in vrije energie tussen de reagerende moleculen aan het begin van elke elementaire reactie en de volgende transitietoestand
geactiveerd complex (definitie)
Reagerende moleculen in transitietoestand.

snelheidsvergelijking (definitie)
drukt uit hoe de snelheid afhangt van de concentraties van de reagentia. De snelheid hangt ook af van de katalysatorconcentratie.

orde van de reactie (definitie)
De exponenten van de concentraties, kunnen 0, 1, 2 of een niet-geheel getal.
Hierbij is k de snelheidsconstante die beschrijft hoe v afhangt van de concentraties.
De totale orde is gelijk aan de som van de orde van de reagentia.
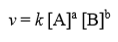
berekenen orde?
Op basis van gemeten vinit.
Zo kan zelfs niet-gehele ordes bepaald worden.Toepassing van geïntegreerde snelheidsvergelikingen
Hierbij wordt de concentratie in functie van de tijd op een grafiek gezet en gekeken bij welke orde het best past.

Snelheidsbepaling reacties (algemeen)
De snelheid wordt vooral bepaald door de reactiesnelheid van de traagste elementaire stap, deze stap noemen we dan snelheidsbepalend.

Arrhenius relatie (formule + gebruik)
Hiermee kan snelheidsconstante berekend worden. Uit de k kan dan weer de activeringsenergie berekend worden.

Katalysator (rol+voorbeelden)
Een katalysator versnelt een reactie, maar reageert zelf niet weg. De katalysator verlaagt de activeringsenergie waardoor er sneller reactie kan gebeuren.
Voorbeelden:
Zuren en basen: door protonering, van bv. alkanen
Metaalionen: verschillende reagentia rond zich schikken, van oxidatietrap veranderen → redox vlotter.
Thermodynamische + kinetische controle (def)
Wanneer er een systeem tussen twee reacties kan kiezen, waarin ze beiden van vrije energie daalt, maar niet noodzakelijk in dezelfde mate.
Wordt de reactieweg met de laagste vrije energie verkozen, dit wordt thermodynmische controle genoemd.
Dit is wel niet altijd het geval, soms is de reactiesnelheid van de andere reactieweg sneller door een katalysator en zo wordt deze reactieweg verkozen. Kinetische controle
VSEPR-model (definitie + gebruik)
=valentieschil-elektronenpaar-repulsiemodel
Visuele representatie om de geometrie van een Lewisstructuur de weergeven.
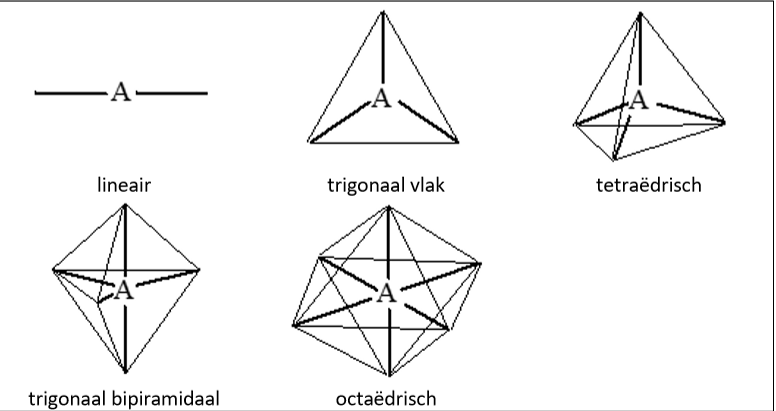
valentiebindingstheorie (definitie)
Beschrijft het vormen van bindingen via het overlappen van atomaire orbitalen en het delen van elektronen. De valentiue-elektronen behoren tot specifieke atomen.
molecuulorbitaaltheorie (definitie)
De atomaire orbitalen worden gecombineerd om nieuwe moleculaire orbitalen te vormen die zich over het hele molecuul uitstrekken. De elektronen behoren niet langer tot specifieke atomen, maar bevinden zich in deze moleculaire orbitalen.
Valentiebindingstheorie, niet verkeerd gewoon in verkeerde context. In dit geval gaat het over orbitalen van de atomen in een hele molecule en niet tussen 2 atomen → hybridisatie.
hybridisatie (definitie)
Dat is het mixen van verschillende atoomorbitalen op hetzelfde atoom tot een neieuwe equivalente orbitaal.
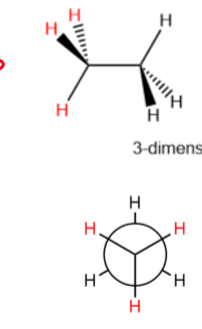
staggered Newman-projectieformule
De waterstoffen zijn geschrankt.
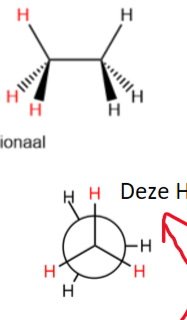
eclipsed Newman-projectieformule
De waterstoffen zijn parallel.
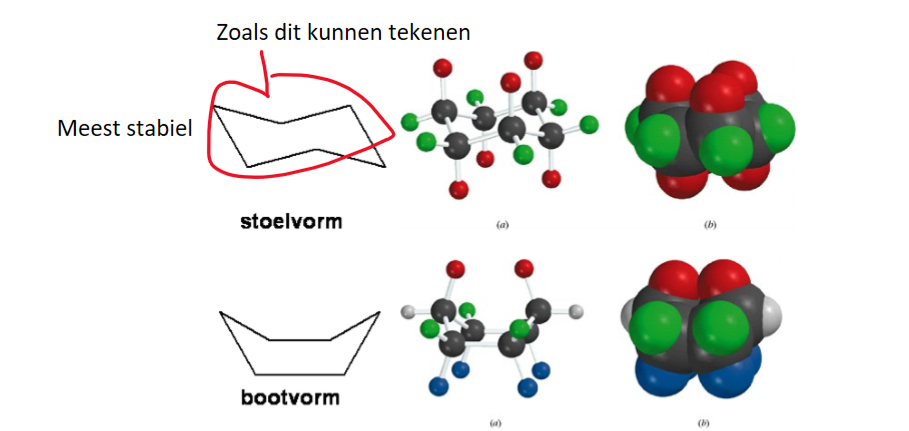
conformaties (definitie+speciaal geval)
De verschillende standen die de waterstofatomen kunnen aannemen in een molecuul.
Bij cyclohexaan zijn er maar 2 conformaties: stoel- en bootconformaties
stoelvorm: meest stabiel, geen sterische hindering, alle koolstof-waterstof-bindingen zitten in een gunstige staggered situatie → eigenlijk zijn er hiervan 2, waarbij de axiale veranderen in equatoriale bindingen, de vormen worden voortdurend omgezet in elkaar
bootvorm: minder stabiel, hogere energie door eclipsed waterstoffen C5-C6, en C1 en C4 te dicht op elkaar
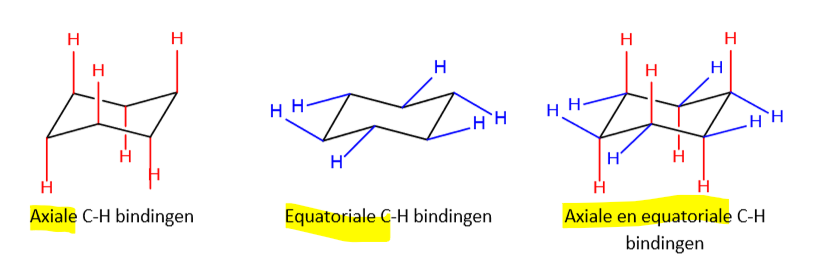
orientatie C-H bindingen (cyclohexaan stoelconfiguratie)
axiale bindingen: loodrecht op de ring
equatoriale bindingen: de rest ligt min of meer in het vlak van de ring
bindingsdissociatie energie (definitie)
Energie die nodig is om binding te breken.