Biologie 12e exam
1/17
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
18 Terms
Définis la matière
Tout ce qui occupe un volume et qui possède une masse
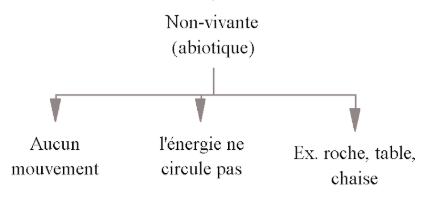
Nomme les facteurs non-vivante (abiotique)
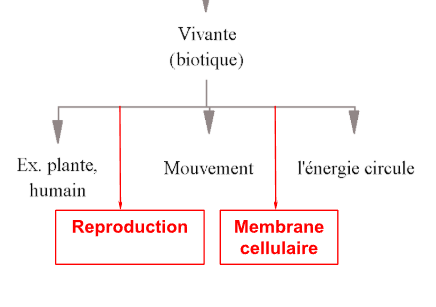
Nomme les facteurs vivante (biotique)
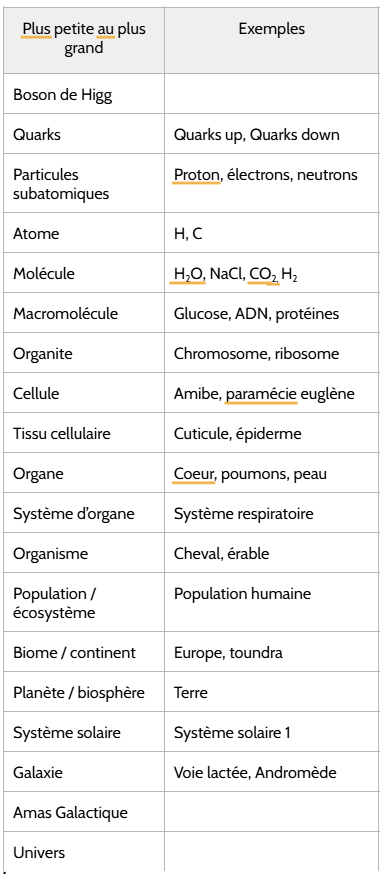
Niveaux de complexification
Nomme les 6 élements importants a la base des molécules du vivant
CHONPS – carbone, hydrogène, oxygène, azote, phosphore, soufre
Molécules organiques vs. molécules inorganiques
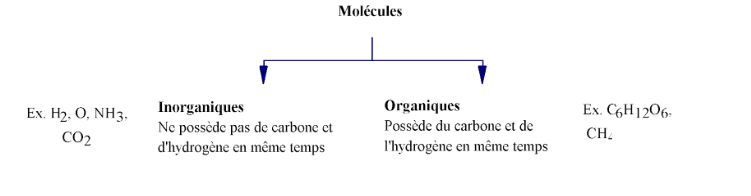
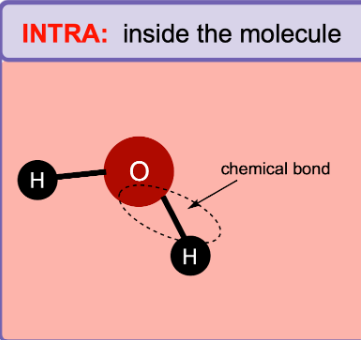
Les liaisons intramoléculaires
On parle des forces établies entre les atomes d’une même molécule
Exemples :
Liaisons covalentes dans un lipide (glycérol + acides gras)
Liaisons covalentes dans le glucose
Squelette sucre-phosphate de l’ADN
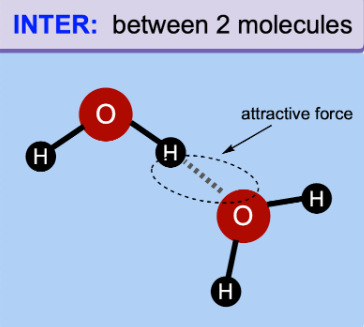
Les liaisons intermoléculaire
On parles des attractions entre les molécules, ou certaines parties d’une plus grosse molécule
Pourquoi les liaisons intramoléculaires sont important en biologie ?
Les liaisons intramoléculaires sont importantes en biologie parce qu’elles empêchent les macromolécules (ex : lipides) de se briser dans l’eau, elle garde le sucre + groupement phophate dans l’ADN.
Elles sont PLUS FORTES que les liaisons intermoléculaires.
Pourquoi les liaisons intermoléculaires sont important en biologie ?
Les liaisons intramoléculaires sont importantes en biologie parce qu’elles permettent l’interation/rencontre avec les molécules
ex : enzyme + substrat, ba. + ba.
Polarité
Distribution inégale des charges de l’eau
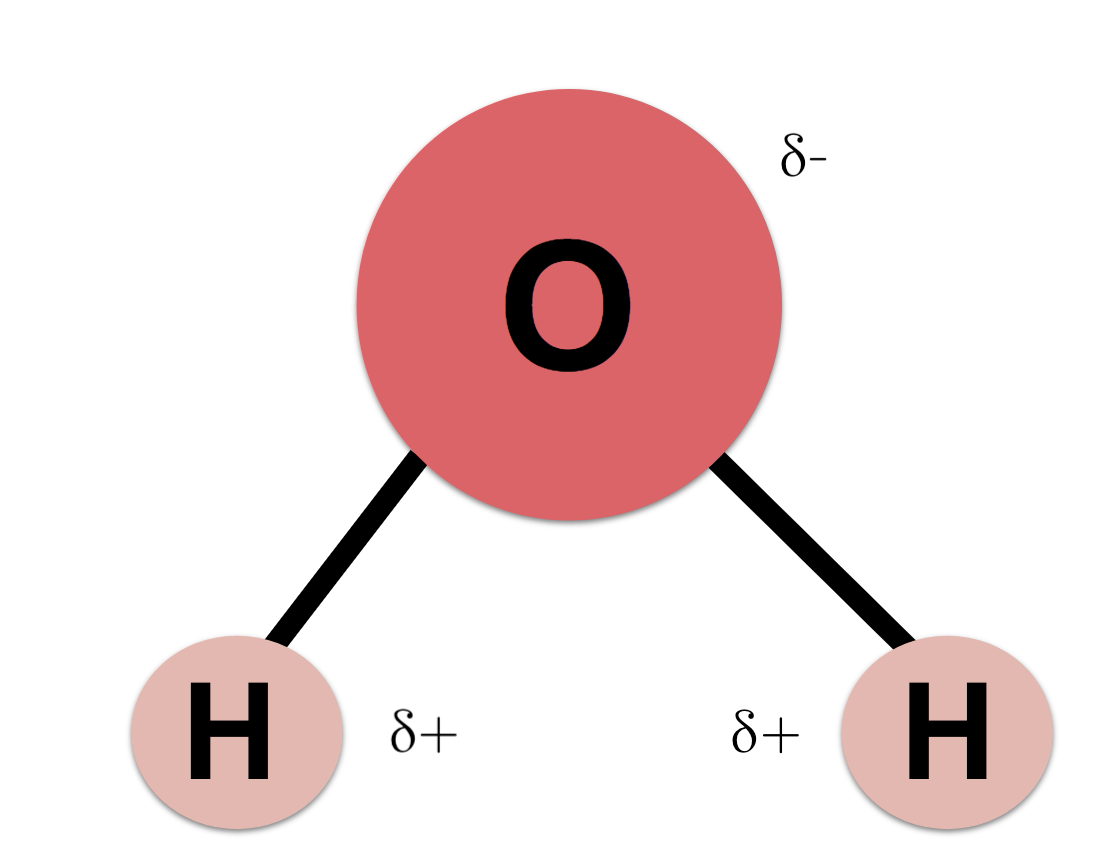
Polarité d’UNE molécule d’eau (liaison intramoléculaire)
👉 Intramoléculaire
À l’intérieur d’une seule molécule de H₂O :
L’oxygène attire les électrons plus fortement que l’hydrogène
Les électrons passent plus de temps près de l’oxygène
Donc :
L’oxygène devient légèrement négatif (δ–)
Les hydrogènes deviennent légèrement positifs (δ+)
💡 Ce partage inégal des électrons correspond à des liaisons covalentes polaires.
📌 Ce sont des liaisons intramoléculaires
➡ Liaisons O–H à l’intérieur d’une même molécule d’eau
➡ Elles créent la polarité
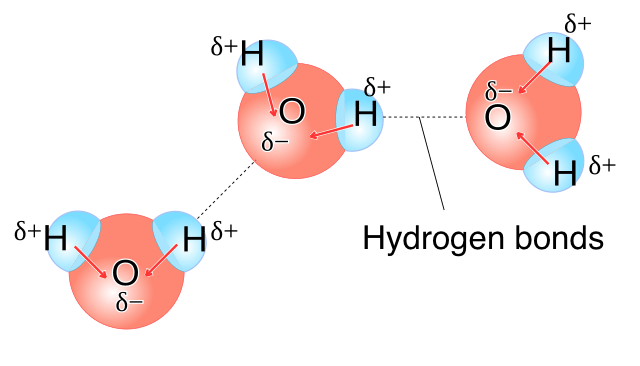
Attraction entre DIFFÉRENTES molécules d’eau (liaison intermoléculaire)
Puisque chaque molécule d’eau est polaire :
L’hydrogène δ+ d’une molécule
est attiré par l’oxygène δ– d’une autre molécule
Cette attraction s’appelle une liaison hydrogène.
📌 Ce sont des interactions intermoléculaires
➡ Entre différentes molécules d’eau
➡ Plus faibles que les liaisons covalentes
Que sont les liaisons hydrogènes
Association faible entre un atome portant une charge partielle negative et un atome d’hydrogène portant une charge partielle positive. Ces attractions sont aussi dites “ponts hydrogène”
Interactions hydrophiles (polaires)
« Hydro » = eau, « phile » = qui aime
Ce sont les molécules attirées par l’eau
Elles sont polaires ou chargées
Elles se dissolvent facilement dans l’eau
Exemples :
Glucose (sucre)
Ions (Na⁺, Cl⁻)
Têtes polaires des phospholipides dans les membranes
Interactions hydrophobes (non polaires)
« Hydro » = eau, « phobe » = qui n’aime pas
Ce sont les molécules repoussées par l’eau
Elles sont non polaires
Elles ne se dissolvent pas dans l’eau
Exemples :
Acides gras
Huiles et graisses
Queues non polaires des phospholipides
Groupement fonctionels
Atome ou groupes d’atomes attachés a une molécule qt qui lui onne des propriétés physiques et chimiques specifiques
Propriétés des groupement fonctionnels
Affectent les propriétés physiques des molécules
Etat de la matière, points de fusion, point d'ébullition
Plus réactif, donc aident avec l’interaction avec d’autre atomes ou molécules
Les rends polaires…alors hydrophiles
Peuvent aider pour avoir un forme spécifique…par exemple la forme des protéines