Biología Tema 3 CCAA
1/34
Earn XP
Description and Tags
PROTEÍNAS
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
35 Terms
¿Cuál es la principal funte de nitrógeno de nustro organismo?
Las proteínas
¿Por qué es necesario eliminar el nitrógeno del organismo y que supone?
Porque el nitrógeno es tóxico para el cuerpo y su eliminación requiere altos niveles de enregía
¿Qué tipo de macromolécula son las proteínas?
Son polímeros de aminoácidos
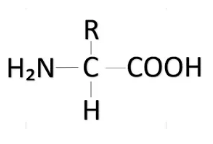
¿Qué grupos funcionales contienen los aminoácidos?
Un grupo carboxilo (-COOH) y uno amino (-NH2)
¿Cuántos aminoácidos forman las proteínas?
Las forman 20 aminoácidos diferentes
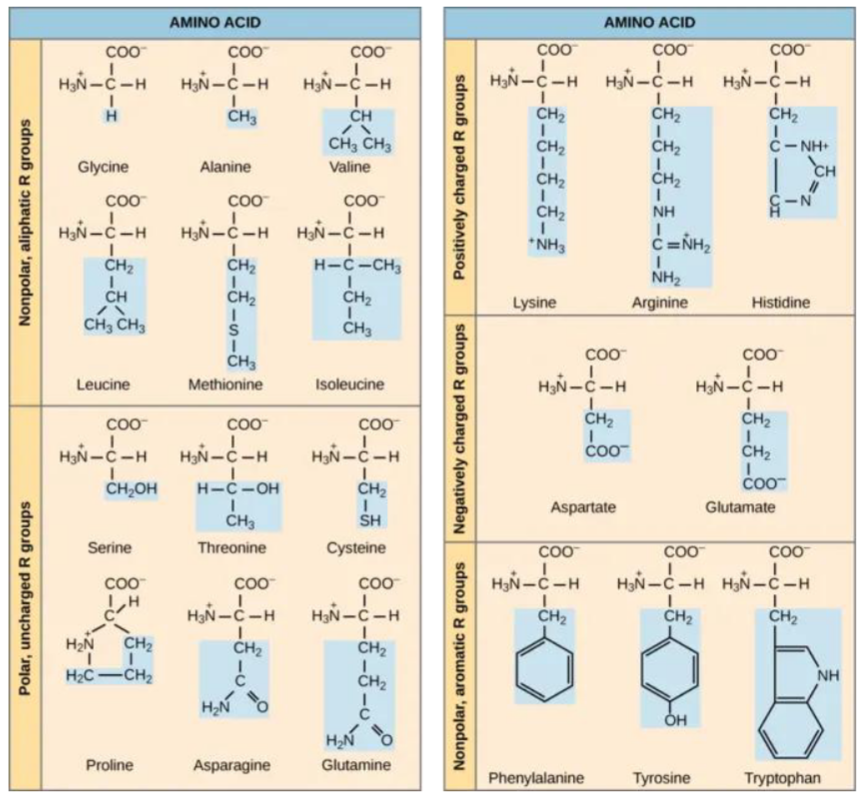
¿Qué determina las características de un aminoácido?
La cadena lateral R, que varía en naturaleza y afecta en la solubilidad, reactividad e interacciones
¿Qué es la isometría de los aminoácidaos?
La existencia de moléculas con la misma composición pero diferente distribución espacial, especialmente la esteroisometría D y L basada en el carbono asimétrico.
¿Qué es una enlace peptídico?
Un enlace covalente que une el grupo amino de un aminoácido con el grupo carboxilo de otro
¿Qué direccionalidad tiene una cadena peptídica?
Tiene un extremo amino libre (N-terminal) y un extremo carboxilo libre (C-terminal).
¿Qué características tiene el enlace peptídico?.
Es plano y rígido, con los seis átomos implicados en un mismo plano; el enlace N-C no rota, pero sí pueden rotar los enlaces adyacentes.

¿Qué es la estructura primaria de una proteína?
La secuencia lineal de aminoácidos desde el extremo N-terminal al C-terminal.
¿Qué determina la estructura primaria?
El código genético y es esencial para la estructura tridimensional y función de la proteína.
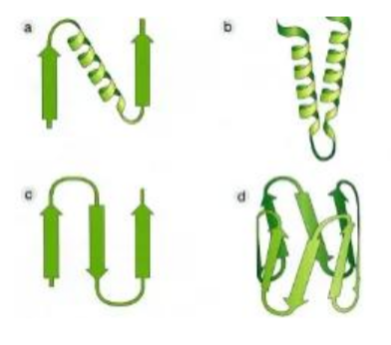
¿Qué es la estructura secundaria?
El plegamiento local de la cadena polipeptídica en α-hélices y hojas plegadas β, estabilizado por puentes de hidrógeno.
Describe la hélice α.
Una hélice dextrógira donde los grupos N-H y C=O forman puentes de hidrógeno cada 4 aminoácidos, con cadenas laterales hacia afuera.
Describe la hoja plegada β.
Estructura extendida en zigzag, estabilizada por puentes de hidrógeno entre grupos N-H y C=O, con cadenas laterales hacia ambos lados.
¿Qué es la estructura terciaria?
La conformación tridimensional completa de una cadena polipeptídica, resultado de interacciones entre cadenas laterales.
¿Qué tipos de interacciones estabilizan la estructura terciaria?
No covalentes: hidrofóbicas, Van der Waals, electrostáticas, puentes de hidrógeno
Covalentes: puentes disulfuro, unión a metales, fosforilación, glucosilación
¿Qué es la estructura cuaternaria?
La asociación de dos o más cadenas polipeptídicas con estructura terciaria para formar una proteína funcional.
Da un ejemplo de proteína con estructura cuaternaria.
La hemoglobina.
¿Qué es la desnaturalización de una proteína?
Es la pérdida de la conformación nativa de la proteína, es decir, la estructura en la que es funcional.
¿Cuáles son los principales factores que causan la desnaturalización?
Temperatura, alteraciones del pH, concentración de sales y otros factores ambientales.
¿Qué es la renaturalización?
Es el proceso por el cual una proteína vuelve a su conformación nativa si se restablecen las condiciones adecuadas.
¿Qué demuestra la capacidad de renaturalización de una proteína?
Que la información necesaria para el plegamiento está en la secuencia de aminoácidos.
¿Por qué la desnaturalización puede ser beneficiosa?
Porque es esencial en procesos biológicos como la digestión.
¿Qué hacen las chaperonas moleculares?
Ayudan a otras proteínas a plegarse correctamente proporcionando un espacio y tiempo estables.
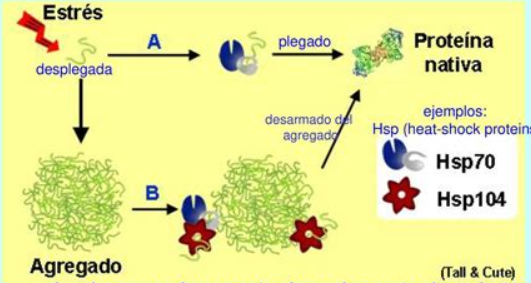
¿Qué son las chaperonas constitutivas?
Son chaperonas siempre presentes en la célula pero inactivas debido a un factor de inactivación.
¿Qué ocurre con las chaperonas cuando la célula está bajo estrés?
Se elimina el factor de inactivación, activando las chaperonas para evitar la desnaturalización proteica.
¿Qué función tiene el factor de inactivación separado de la chaperona?
Se traslada al núcleo para inducir la producción de más chaperonas (genes Hsp70).
¿Qué indica un aumento de las proteínas Hsp en un organismo?
Que el organismo está bajo un estado de estrés.
¿De qué dependen las funciones de las proteínas?
De su estructura terciaria o cuaternaria.
Menciona algunas modificaciones que pueden alterar la función de una proteína.
Glucosilación, fosforilación y proteólisis.
¿Qué efecto tiene la glucosilación en las proteínas?
Ayuda en el direccionamiento y reconocimiento celular.
¿Cómo afecta la fosforilación a las proteínas?
Cambia su forma y función al añadir grupos fosfato.
¿Qué es la proteólisis?
La segmentación o corte de la proteína para modificar su función.
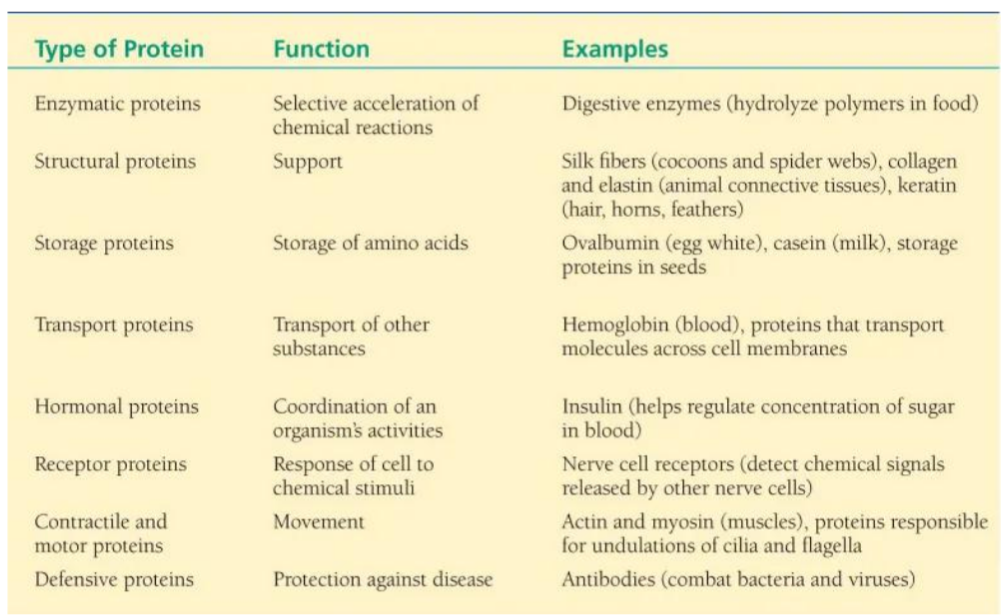
Nombra alguna función de las proteínas.
Estructural (colágeno y queratina), reguladora (insulina y hormona del crecimiento), transportadora (hemoglobina), inmunológica ( anticuerpos), enzimática (pepsina)