4.19 - CARBO- OF KOOLHYDRATEN
1/31
Earn XP
Description and Tags
McMurry - hoofdstuk 25 (832 - 869)
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
32 Terms
koolhydraten
= carbohydraten
= suikers
klasse v. poly-gehydroxyleerde aldehyden en ketonen
classificatie
monosacchariden
6-ring = pyranose; glucose, mannose, galactose
5-ring = furanose; fructose, ribose
disacchariden
cellobiose = glucose + glucose (equatoriaal gebonden)
maltose = glucose + glucose (axiaal gebonden)
lactose = glucose + galactose
sucrose = glucose + fructose
polysacchariden
cellulose = ketting cellobiose
zetmeel
20% amylose = ketting maltoses
80% amylopectine = vertakte amylose
naamgeving monosacchariden
aldehyde of keton?
aantal koolstoffen?
- ose
vb. aldohexose, ketohexose, aldopentose
monosacchariden
komen zowel voor als;
lineaire molecule (open vorm)
ring (gesloten vorm)
gesloten > open vorm; stabiliteit
opm; bij weergeven beide structuren;
open; carbonyl-groep (C=O) bovenaan
gesloten; O rechts achteraan
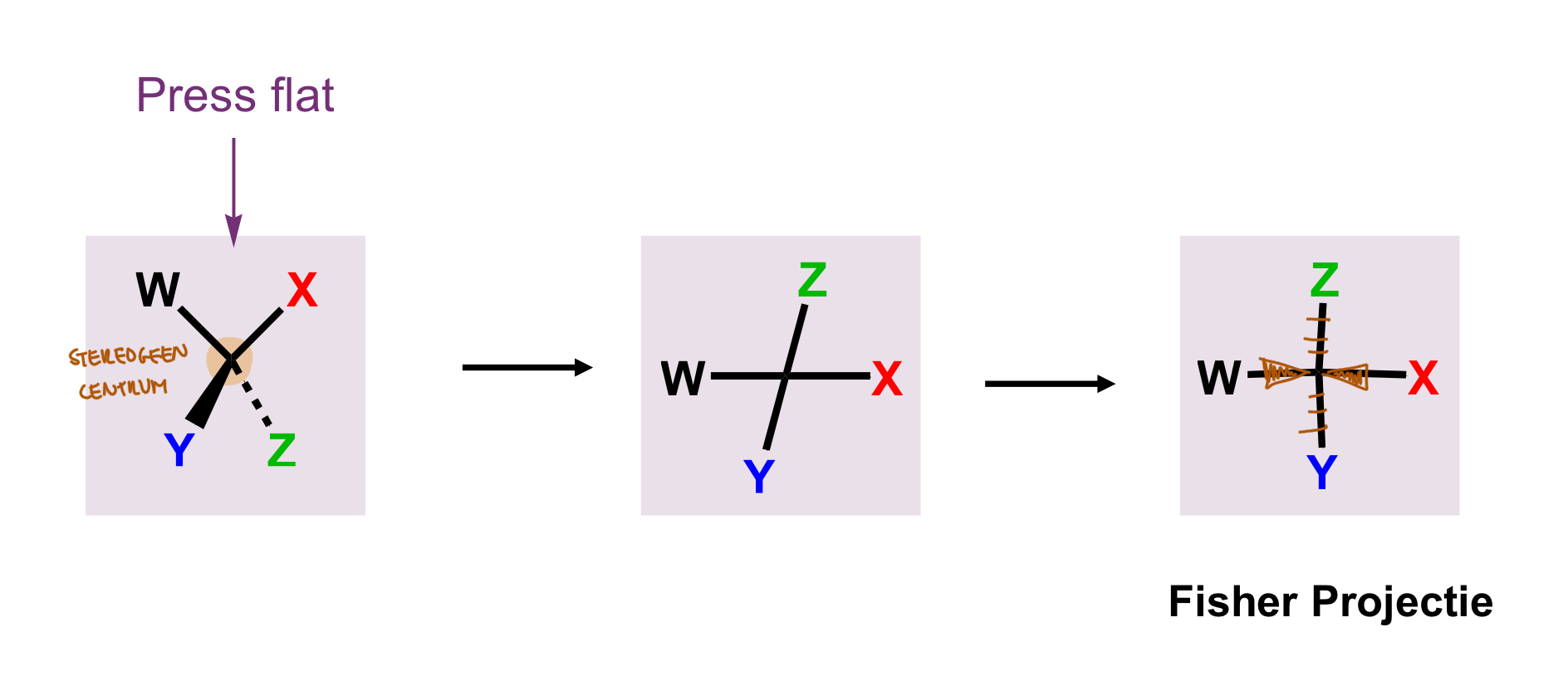
3D → Fischer projectie
D- en L-suikers — opbouw
D-suiker
verst stereogeen centrum carbonyl; R
daaraan gebonden OH-groep; rechts
L-suiker
verst stereogeen centrum carbonyl; S
daaraan gebonden OH-groep; links
D- en L-suikers — eigenschappen
D-suiker
draaiing gepolariseerd licht; rechts
komt natuurlijk voor
L-suiker
draaiing gepolariseerd licht; links
niet natuurlijk
opm; L-suiker is volledige spiegelbeeld D-suiker
opm; R/S zegt iets over individuele stereogene centra, D/L zegt iets over eig. gehele molecule (draaiing gepol. licht)
D- en L-suikers — weergave ring
algemeen;
O-atoom rechts achter
OH-groep(en) die rechts staat bij Fischer projectie; staat onder ring
D-suiker; CH2OH-groep boven ring
L-suiker; CH2OH-groep onder ring
α-suiker; CH2OH en OH op 1’ staan cis
β-suiker; CH2OH en OH op 1’ staan trans
D- en L-suikers — voorbeeld
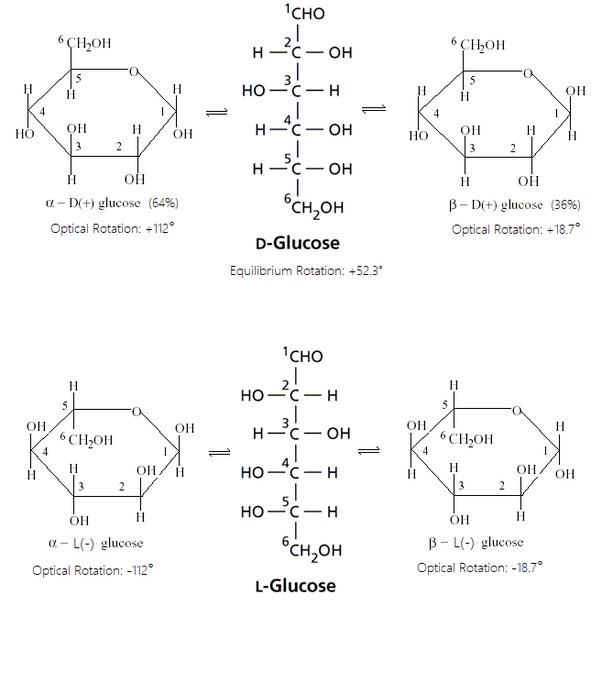
herhaling — tekenen stoelstructuur
configuratie aldoses
aldotetroses
4C → 2 stereogene centra
22 = 4 stereoisomeren = 2 D,L-paren enantiomeren
aldopentoses
5C → 3 stereogene centra
23 = 8 stereoisomeren = 4 D,L-paren enantiomeren
aldohexoses
6C → 4 stereogene centra
24 = 16 stereoisomeren = 8 D,L-paren enantiomeren
hemi-acetal vorming
aldehyde + R-OH → hemi-acetal
in aanwezigheid zuur; katalysator
hemi-acetal, aanwezig in dezelfde molecule;
carbonyl (C=O)
hydroxyl (OH)
kan nog verder reageren tot cyclisch hemi-acetal;
intramoleculaire nucleofiele additie
→ voorkomen open en gesloten structuur
te kennen reactiemechanismen
PAD - PEAD - mechanisme
P = protonatie
E = eliminatie
A = additie
D = deprotonatie
opm; reacties kunnen ook omgekeerd worden uitgevoerd; we spreken dan over hydrolyse
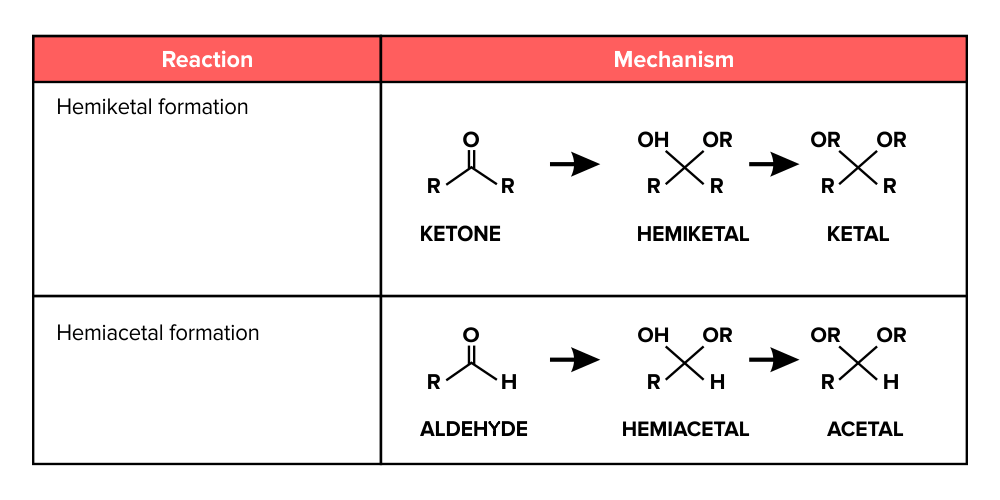
aldehyde → hemi-acetal — stappen
zuur-base; protonering carbonylgroep
nucleofiele additie; aanval alcohol (SBS)
zuur-base; vorming hemi-acetal
aldehyde → hemi-acetal — uitwerking
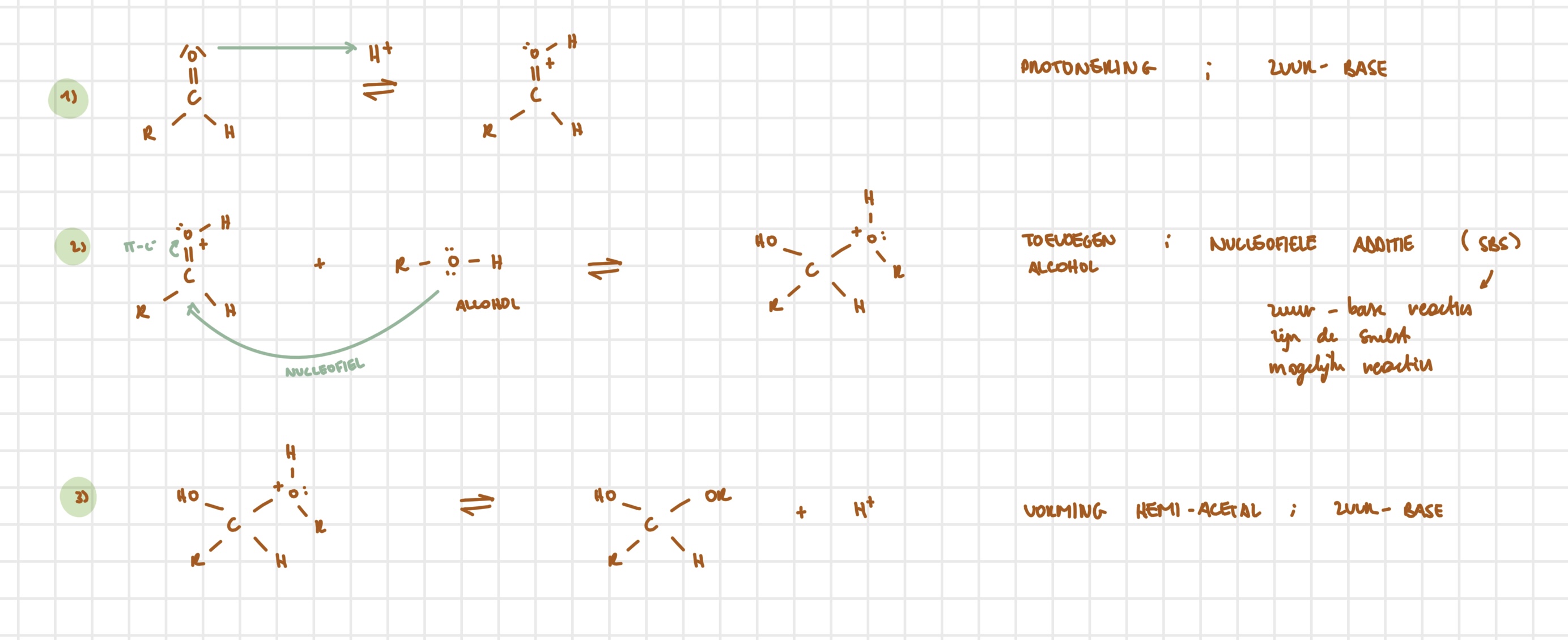
hemi-acetal → acetal — stappen
zuur-base; protonering hydroxylgroep
eliminatie; vorming oxonium-ion
nucleofiele additie; aanval alcohol
zuur-base; deprotonering
hemi-acetal → acetal — uitwerking
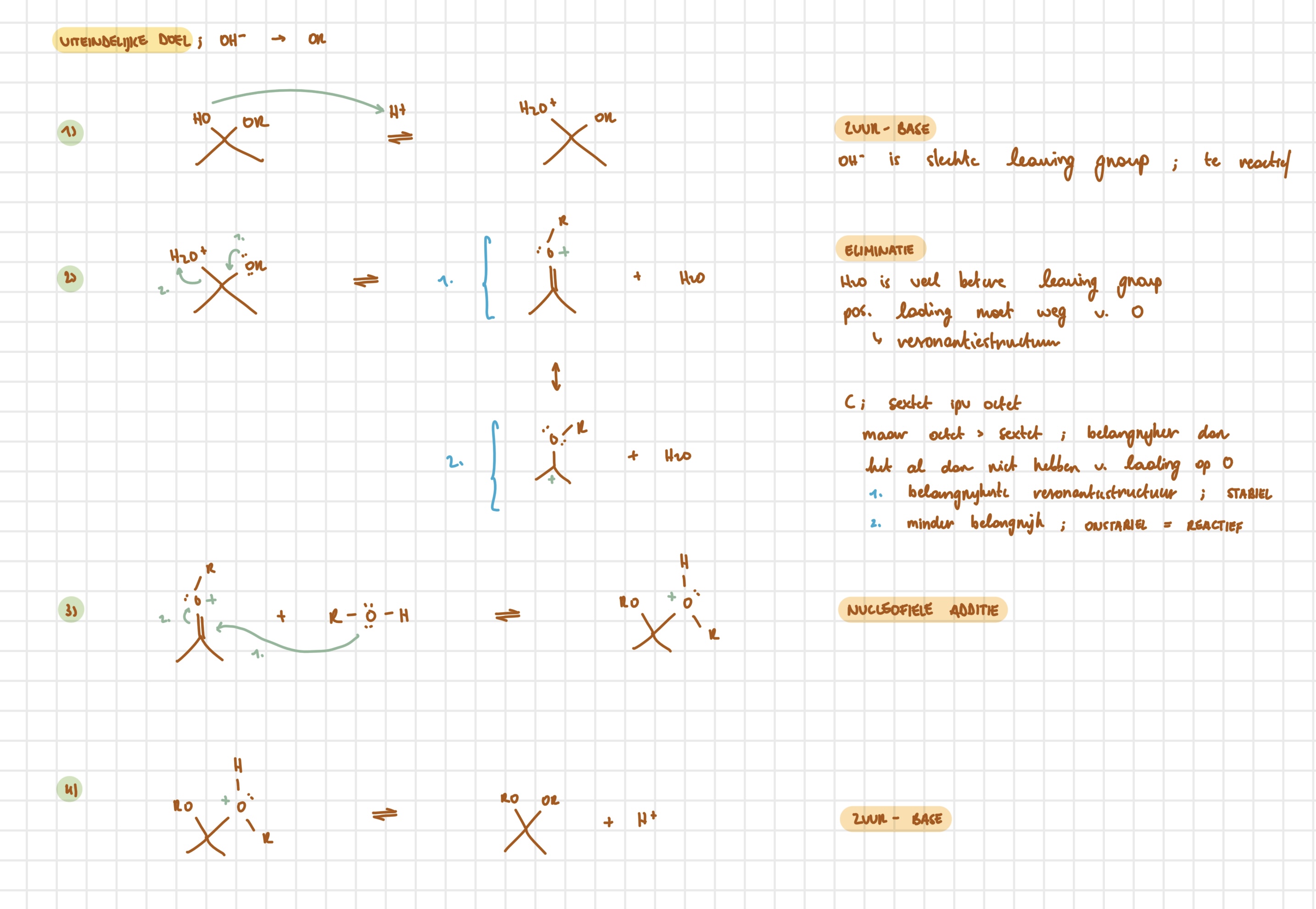
lineair → cyclisch
zuur-base
additie
zuur-base
leidt tot het ontstaan van
anomeer centrum/koolstofatoom
lineair → cyclisch — uitwerking
base neemt H op van OH op 5’
O- (van oorspr. OH) valt aan op carbonyl
O- (van oorspr. =O) neemt H op
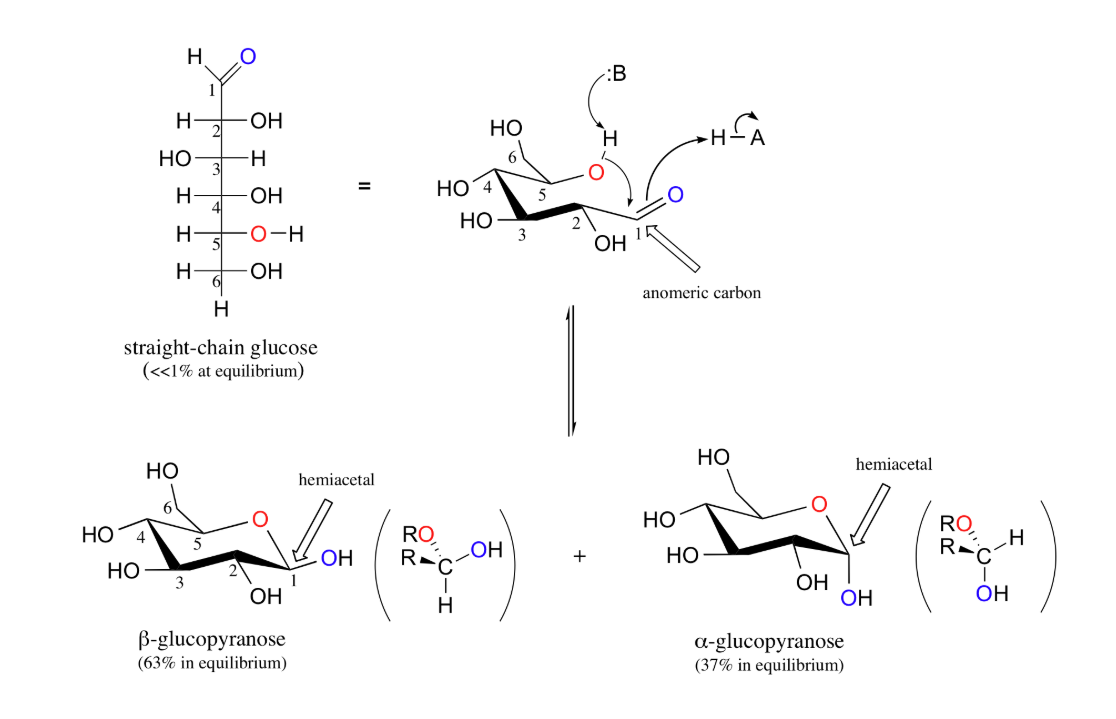
anomeer centrum
= nieuw ontstaan stereogeen centrum door overgang van open naar gesloten vorm
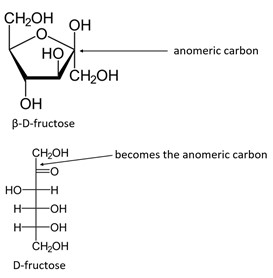
cyclisch → lineair
zuur-base
eliminatie
zuur-base
cyclisch → lineair — uitwerking
base neemt H op van OH op 1’
elektronen springen terug;
O- → =O
binding → O-
O- (rechtsachter) neemt H op
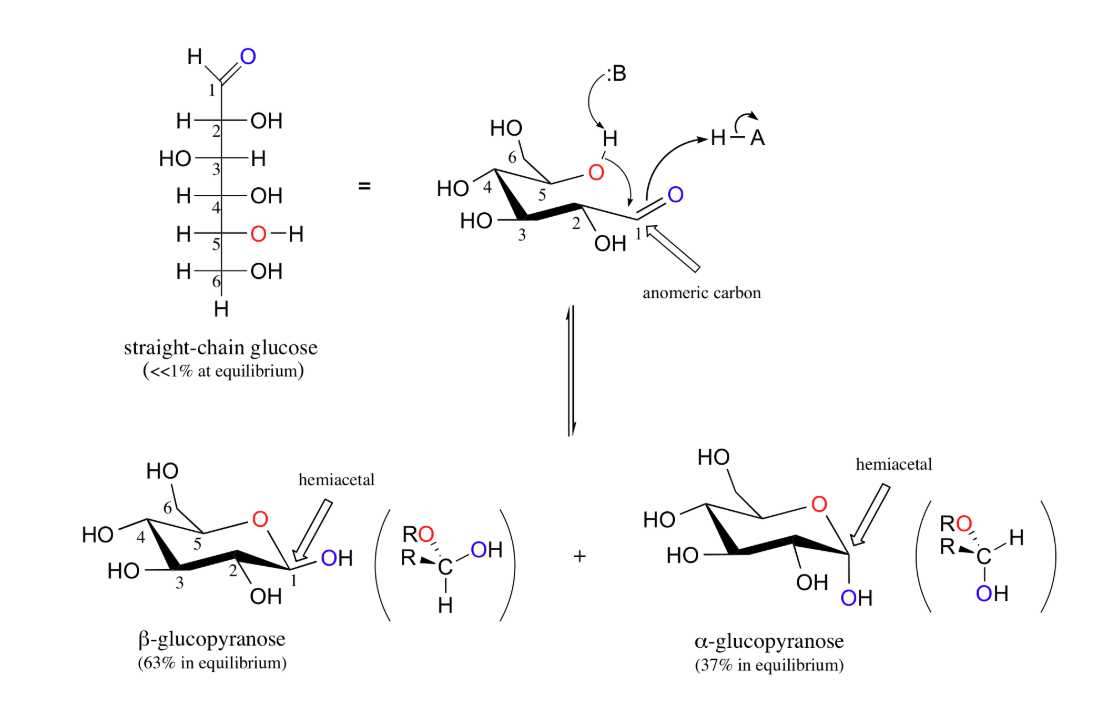
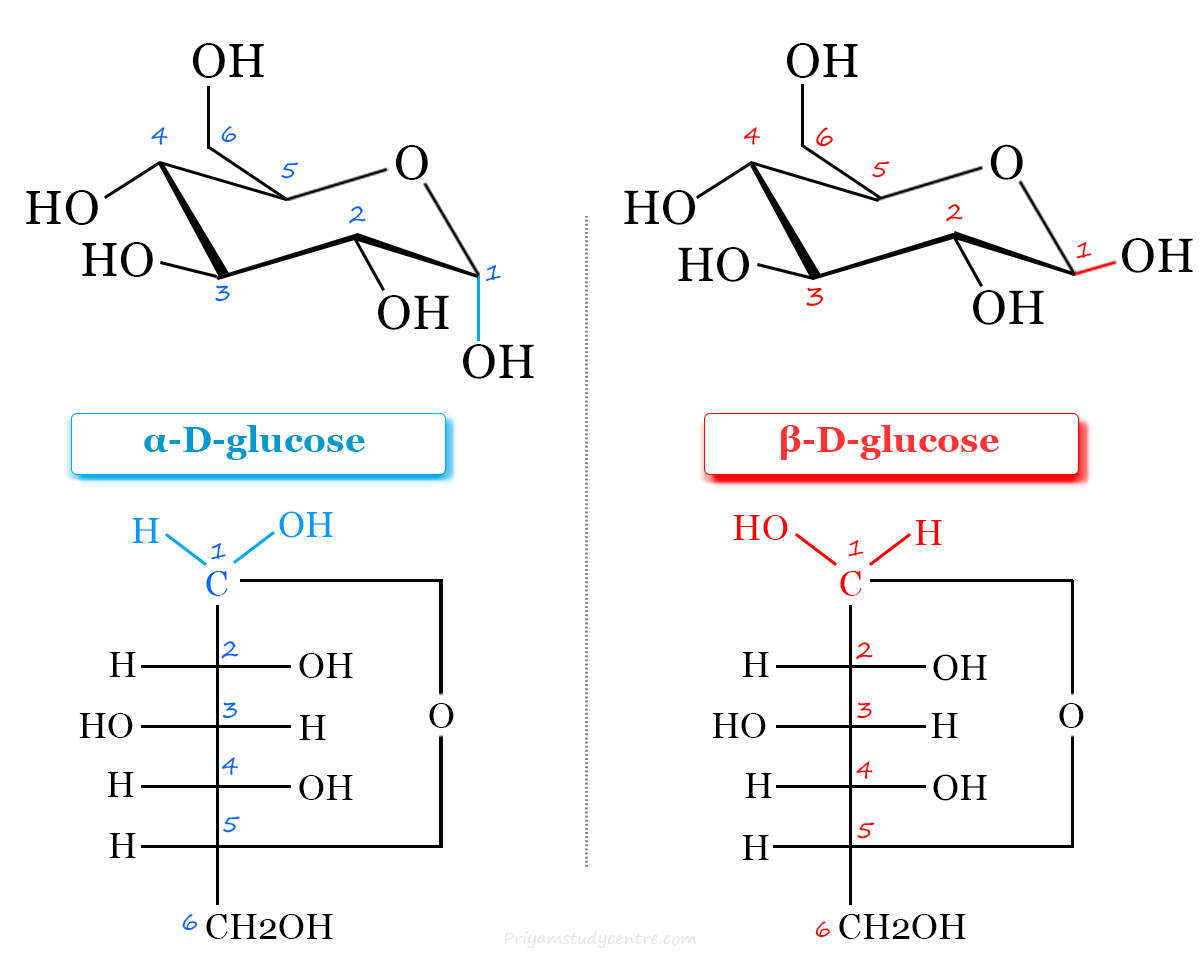
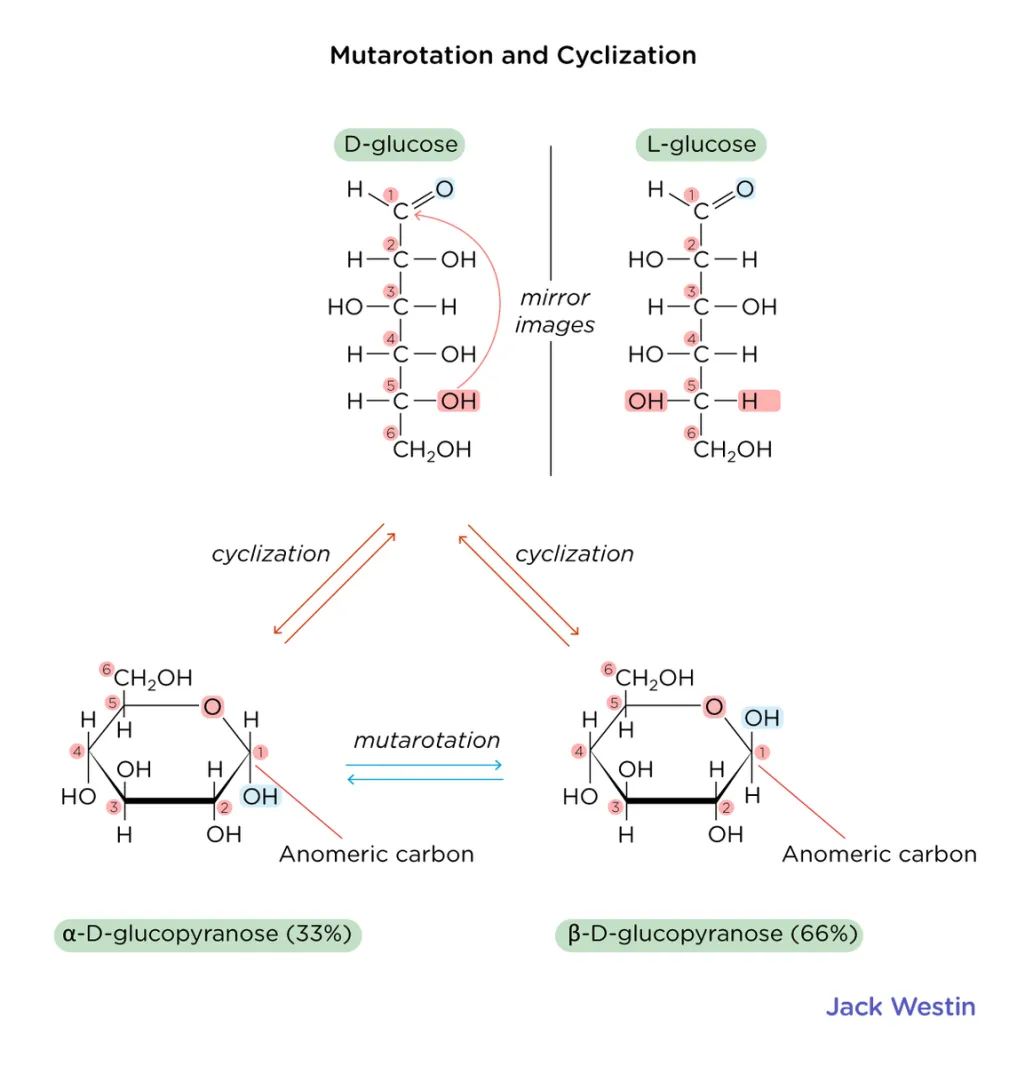
anomeren
anomeren = 2 mogelijke configuraties
(bij cyclische suikers);
α ; OH (anomeer centrum) trans tov CH2OH
β ; OH (anomeer centrum) cis tov CH2OH
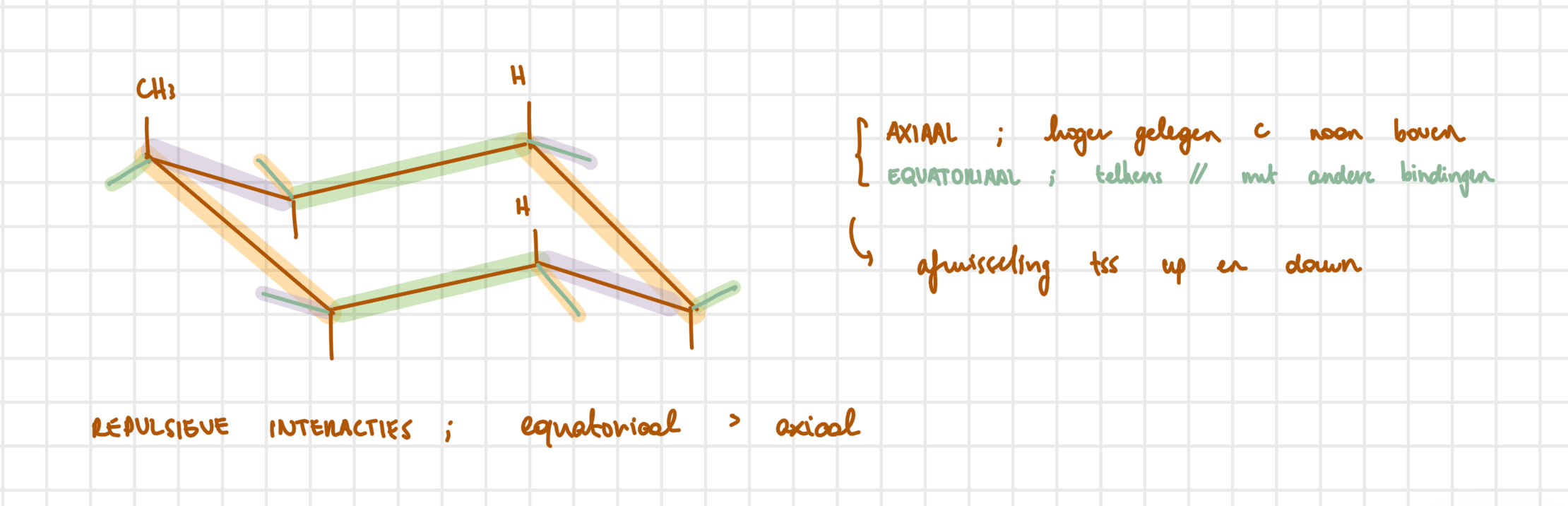
merk op; β-vorm is meer stabiel en dus ook meer voorkomend, want beide groepen staan equatoriaal
mutarotatie
= evenwicht tussen α- en β-vormen via tijdelijke terugkeer naar de lineaire vorm
komt enkel voor bij hemi-acetal
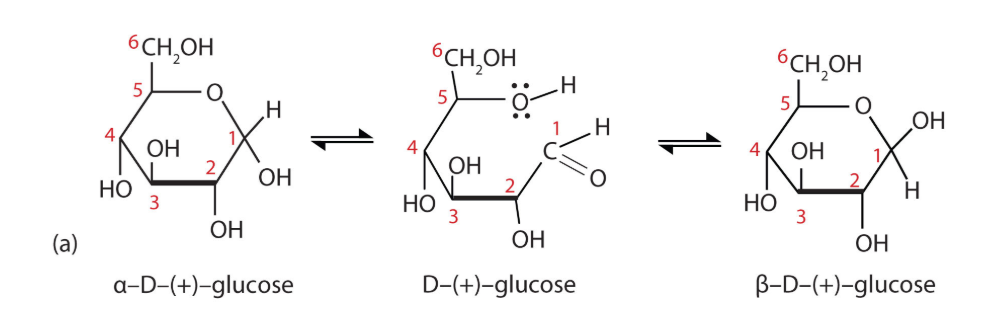
ringvorming en mutarotatie — samengevat
glycosiden
= suikermolecule (glycon) die via een glycosidische binding gekoppeld is aan niet-suikergedeelte (aglycon)
veel voorkomend in natuur
vb. digitoxine (behandeling hartziekten)
glycosiden — eigenschappen
stabiel in neutraal water
geen mutarotatie
want is geen hemi-acetal, maar wel acetal
hydrolisatie in waterig zuur
glycosiden — vorming
suiker → glycoside
reactie aan het anomeer centrum
(cyclisch) hemi-acetal → acetal
zuur-base; protonering hydroxylgroep
eliminatie; vorming oxonium-ion
nucleofiele additie; aanval alcohol
zuur-base; deprotonering
reductie monosacchariden
monosaccharide → alditol
alditol = aldehyde + alcohol
gebeurt in open vorm, minder stabiel
hoewel open vorm in mindere mate aanwezig is, gaat reactie toch vlot door;
continue reductie
principe le Châtelier
oxidatie monosacchariden
monosaccharide → aldonzuur
Tollens reagens
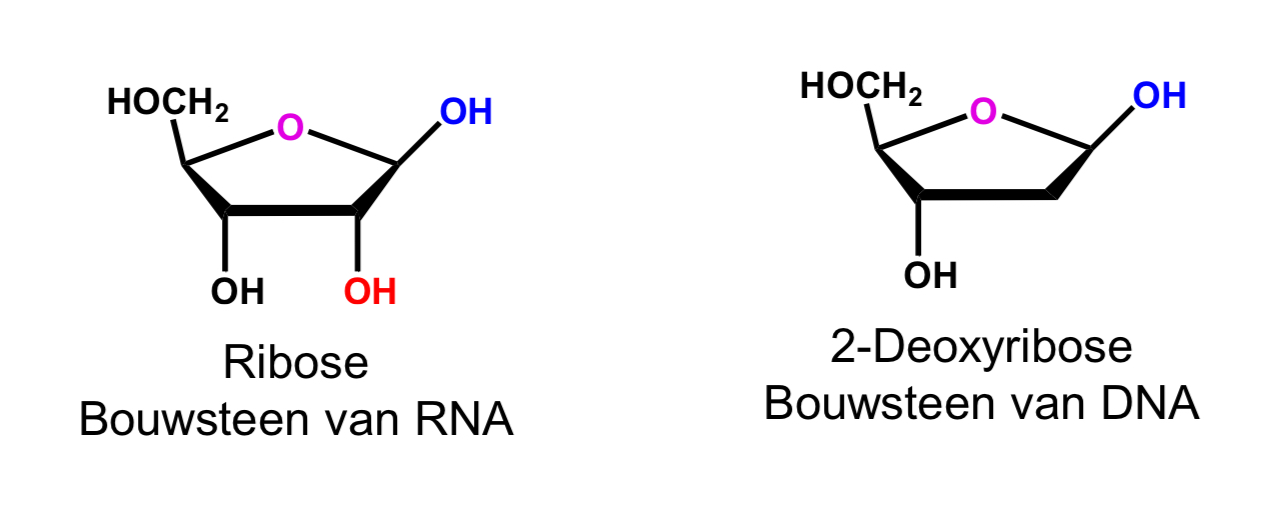
(deoxy)ribose