Biokemi
0.0(0)
Card Sorting
1/111
Earn XP
Description and Tags
Last updated 3:42 PM on 5/28/23
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
112 Terms
1
New cards
Enkel diffusion
Kräver ingen transportör. Molekyler som rör sig längs koncentrationsgradienten, t.ex. syrgas och koldioxid.
2
New cards
Passiv transport
Kräver en transportör som gör att diffusionen går snabbare. Spontan rörelse som sker längs koncentrationsgradienten.
3
New cards
Primär aktiv
Ej spontan. Går från låg till hög koncentration. Kräver en transportör som minskar energin som behövs för transporten. Kräver ATP.
4
New cards
Sekundär aktiv
Aktiv transport av ena molekylen mot koncentrationsgradienten, men också spontan transport av en annan från låg till hög koncentration. Kräver annan energikälla än ATP.
5
New cards
Synport
Två molekyler passerar åt SAMMA håll.
6
New cards
Antiport
Två molekyler som passerar åt MOTSATT håll.
7
New cards
Jonkanal
Kanaler som är specialiserade för att låta joner flöda igenom.
8
New cards
Jonofor
Protein som finns utanför cellen och som kan binda en jon och sedan gå igenom membranet. På insidan kan den släppa jonen och gå ut igen.
9
New cards
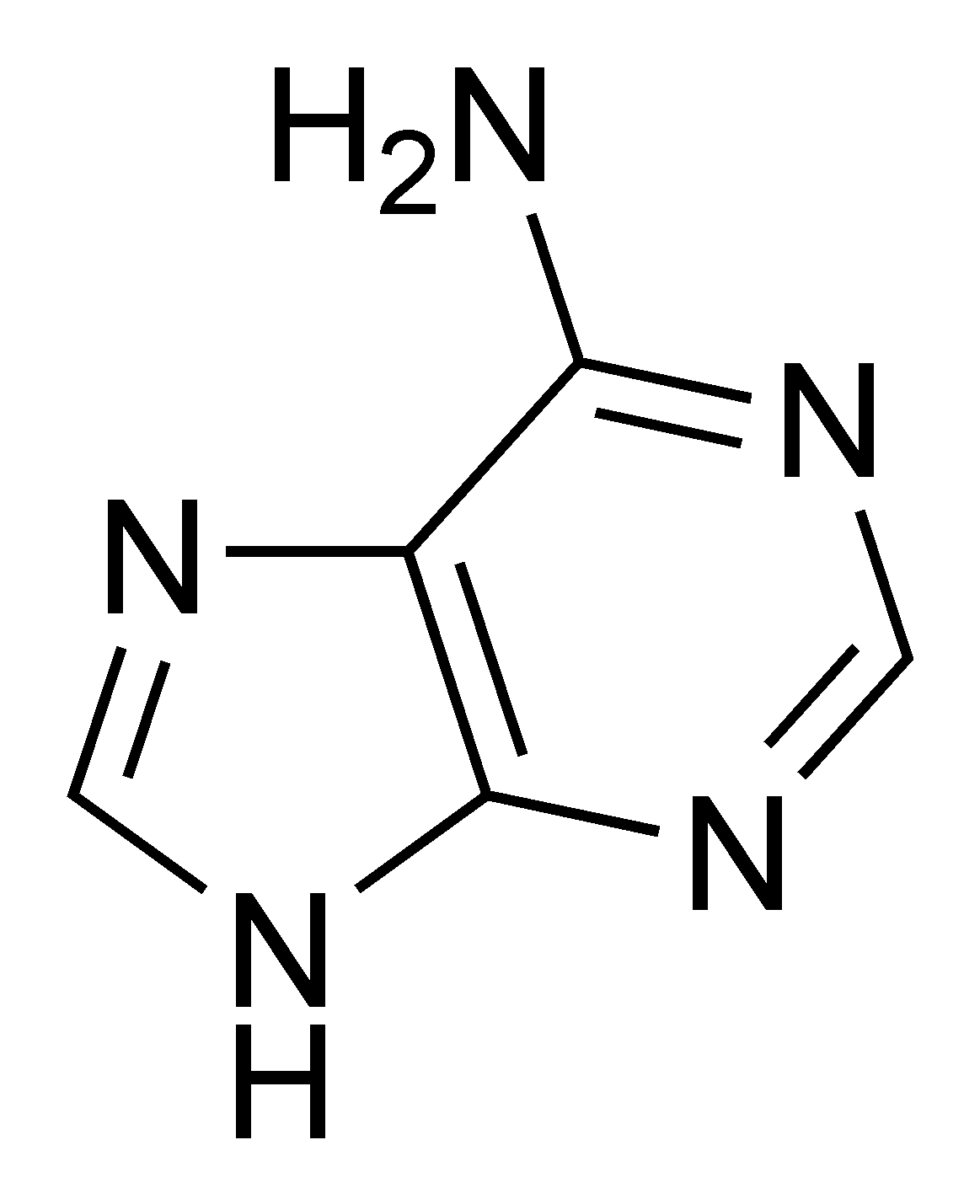
Adenin
10
New cards
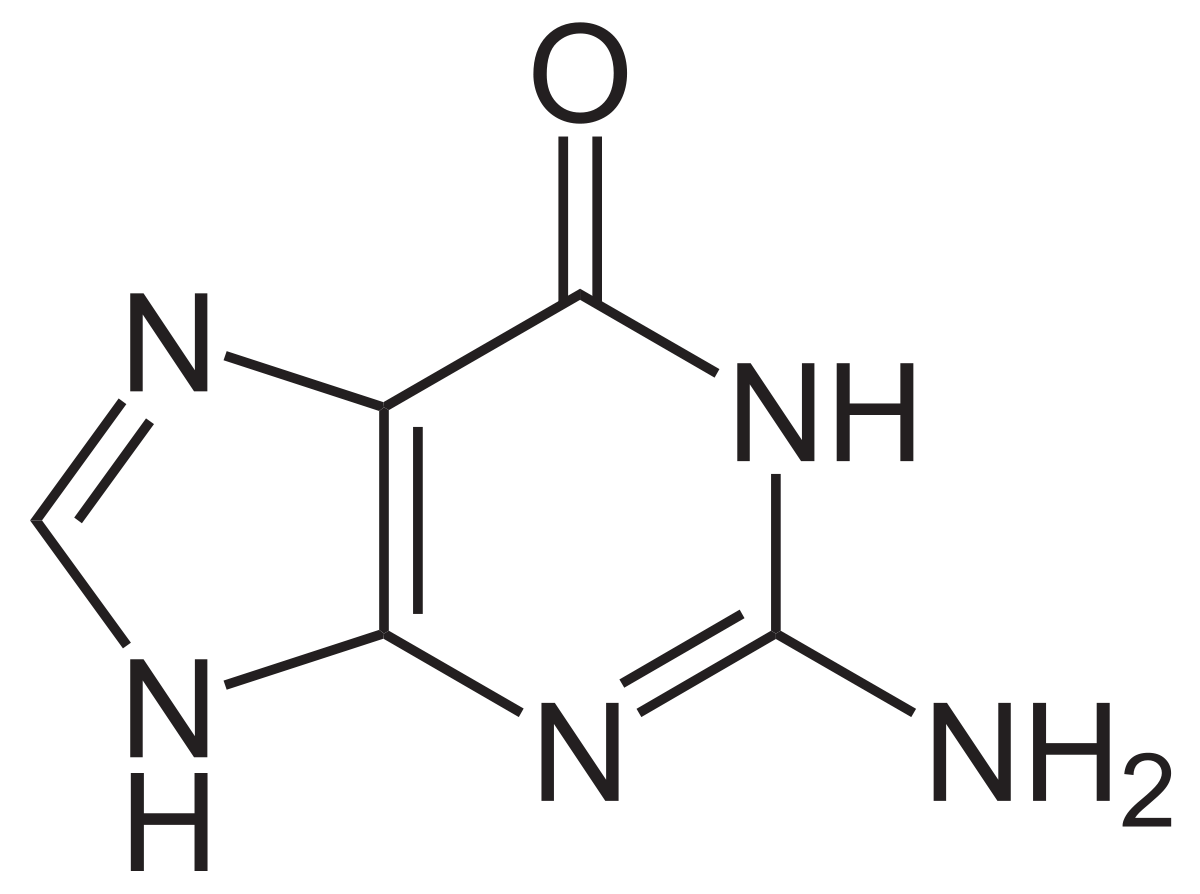
Guanin
11
New cards
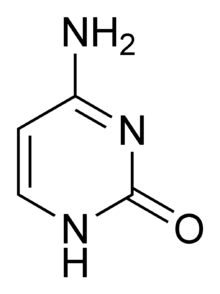
Cytosin
12
New cards
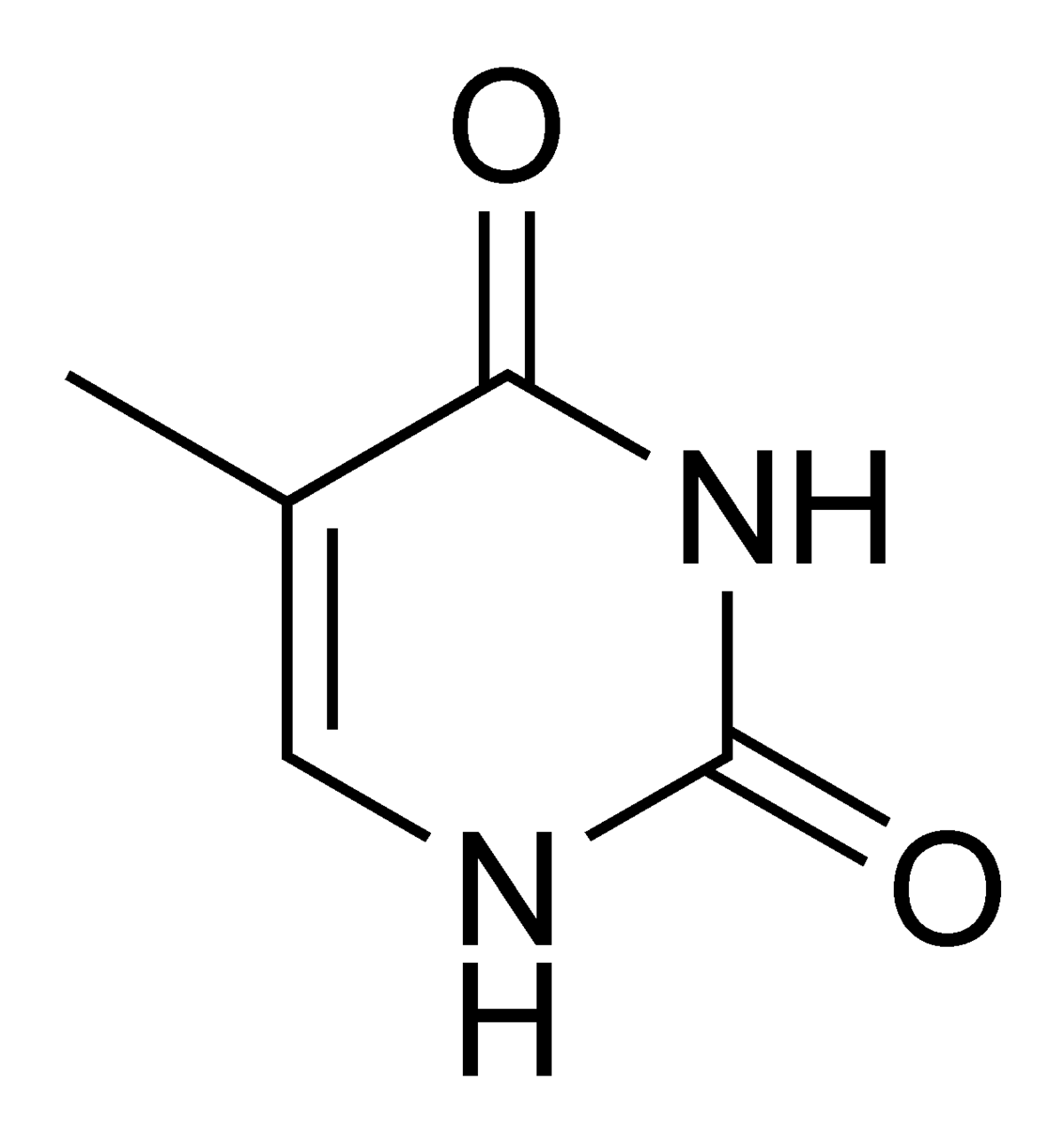
Tymin
13
New cards
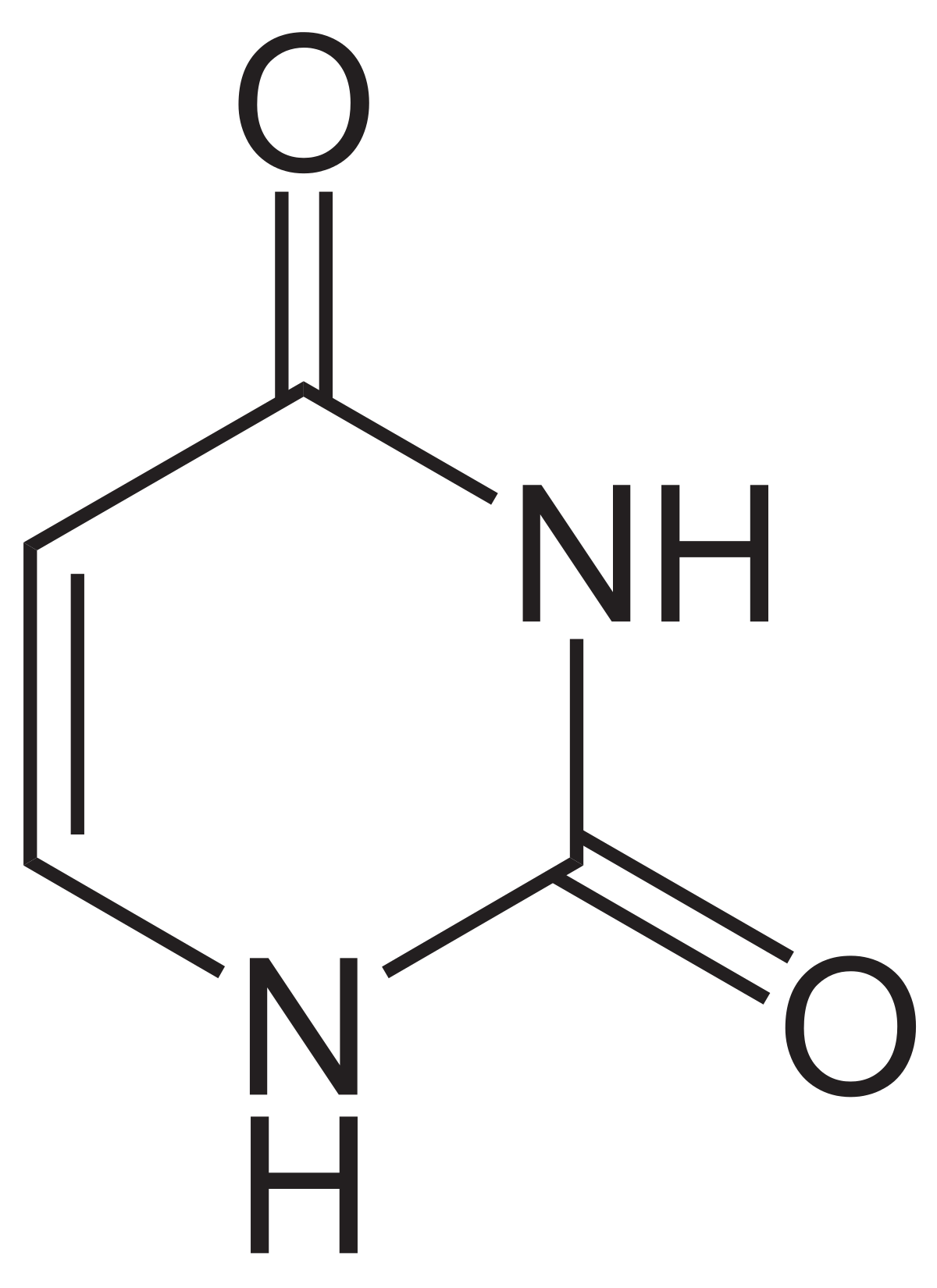
\
Uracil
14
New cards
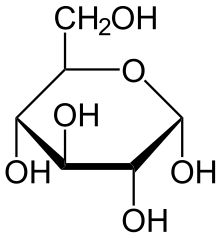
\
Glukos
15
New cards
Pyrimidiner
Enkel ring. Cytosin, tymin, uracil.
16
New cards
Puriner
Dubbla ringar. Adenin, guanin.
17
New cards
ATP
Består av ribos, tre fosfatgrupper och adenin.
18
New cards
Vad är tre exempel på föreningar där adenin kan ingå?
ATP, cykliskt AMP (cAMP) och olika typer av elektronbärare (t.ex. NAD+).
19
New cards
Fri energi
Energi som är tillgänglig för att omvandlas i kemiska reaktioner.
20
New cards
Heterolytisk klyvning
Elektronerna som tidigare delads i en kovalent bindning förblir med en av atomerna och den andra blir utan. Bildas en negativt laddad jon och en positivt laddad.
21
New cards
Homolytisk klyvning
Elektronerna som tidigare delades i en kovalent bindning fördelas jämt till båda atomerna så att det bildas fria radikaler.
22
New cards
Katabolism
Nedbrytningsprocesser. ATP utvinns. Glukos och andra näringsämnen oxideras, medan NAD+ reduceras till NADH.
23
New cards
Anabolism
Syntesreaktioner. ATP används. Komplexiteten hos molekyler ökar. Glukos och andra näringsämnen reduceras medan NADH oxideras.
24
New cards
Metabolism
Summan av reaktioner för katabolism och anabolism.
25
New cards
Spontan reaktion
Delta G har ett negativt värde. Reaktionen kommer spontant att ske åt det håll som ger upphov till något mer stabilt.
26
New cards
Hur blir det energi från ATP?
Genom hydrolys där en fosfatgrupp spjälkas bort. Produkterna är ADP och en fri fosfatgrupp.
ATP är INTE den molekyl med störst energiskillnad för hydrolysen, vilket är fördelaktigt då ADP kan få fosfatgrupper från molekyler som har ännu större tendens att lämna ifrån sig dem.
ATP är INTE den molekyl med störst energiskillnad för hydrolysen, vilket är fördelaktigt då ADP kan få fosfatgrupper från molekyler som har ännu större tendens att lämna ifrån sig dem.
27
New cards
Vad gör ADP och Pi mer stabila än ATP?
Jonisering, färre negativa laddningar och resonansstrukturer (ATP har flera negativa bindningar väldigt nära varandra vilket repellerar och destabiliserar).
28
New cards
Primärstruktur
Sekvensen av aminosyror som bildar en peptidkedja.
29
New cards
Sekundärstruktur
Alfahelix och betaflak.
30
New cards
Tertiärstruktur
När sekundärstrukturen veckar sig och bildar en 3D-struktur.
31
New cards
Kvartärstruktur
Flera sammansatta subenheter.
32
New cards
Zwitterjon
Har både positiv och negativ laddning i molekylen.
33
New cards
Disulfidbryggor
Kemisk bindning som stabiliserar strukturen efter veckning till nativ struktur.
34
New cards
Peptidbindning
Bildas mellan två aminosyror när en karboxylgrupp reagerar med en aminogrupp och en vattenmolekyl frigörs. Bindningen är plan och stel p.g.a. en viss delokalisering av elektronerna.
35
New cards
N-terminal
Markerar “start”. Fri aminogrupp.
36
New cards
C-terminal
Markerar “slut”. Fri karboxylgrupp.
37
New cards
Nettoladdning
Summan av alla laddningar på en peptid.
38
New cards
Isoelektriska punkten
Ett specifikt pH-värde där laddningen för proteinet är lika med noll.
39
New cards
Hur påverkar pH laddningen av aminosyror?
Lågt pH (t.ex. under pi) ger mer protonerade aminosyror och fler positiva laddningar.
Högt pH (t.ex. över pi) ger mer deprotonerade aminosyror och fler negativa laddningar.
Högt pH (t.ex. över pi) ger mer deprotonerade aminosyror och fler negativa laddningar.
40
New cards
Vilka är vanliga exempel på aminosyror som brukar ingå i en alfa-helix?
Arginin, alanin, leucin och glutaminsyra.
41
New cards
Vilka aminosyror brukar inte ingå i en alfa-helix?
Prolin, eftersom den har en cyklisk sidokedja och därför kan göra helixen sned.
Glycin, eftersom den har en sådan kort sidokedja.
Cystein, eftersom den innehåller en SH-grupp vilket kan bilda disulfidbryggor som gör helixen böjd.
Glycin, eftersom den har en sådan kort sidokedja.
Cystein, eftersom den innehåller en SH-grupp vilket kan bilda disulfidbryggor som gör helixen böjd.
42
New cards
Vad påverkar stabiliteten av en alfa-helix?
Närvaro och frånvaro av vissa aminosyror.
Två mycket stora sidokedjor bredvid varandra bildar ett steriskt hinder vilket destabiliserar helixen.
Samma laddningar väldigt nära varandra repellerar varandra, vilket också destabiliserar.
Negativt laddade sidokedjor vid N-terminalen och positivt laddade vid C-terminalen stabiliserar.
Två mycket stora sidokedjor bredvid varandra bildar ett steriskt hinder vilket destabiliserar helixen.
Samma laddningar väldigt nära varandra repellerar varandra, vilket också destabiliserar.
Negativt laddade sidokedjor vid N-terminalen och positivt laddade vid C-terminalen stabiliserar.
43
New cards
Parallella beta-flak
Varje segment går åt samma håll. N-terminalen på det ena segmentet ligger bredvid N-terminalen på det andra.
44
New cards
Antiparallella beta-flak
Segmenten alternerar riktning. N-terminalen på det ena segmentet ligger bredvid C-terminalen på det andra.
45
New cards
Beta-turns
Bindning som bildas för att stärka strukturen i beta-flak. Prolin är en vanlig aminosyra i beta-turns.
46
New cards
Domän
Självstabiliserande region som veckar sig oberoende av resten.
47
New cards
Nativt protein
Funktionellt protein med unik 3D-struktur som ej påverkats av denaturering.
48
New cards
Intrinsically disordered protein
Naturligt ostrukturerat protein som saknar ordnad 3D-struktur. Är ändå funktionella. Strukturen kan förändras beroende på vad de gör i cellen.
49
New cards
Preparativa metoder (för proteinrening)
I slutet av dessa metoder har man ett helt, funktionellt protein.
50
New cards
Analytiska metoder (för proteinrening)
Ger information om proteinet. Har ej som huvudsakligt mål att fortsätta använda det.
51
New cards
Vilka typer av homogenisering är vanliga?
Mekanisk sönderdelning, ultraljud och osmotisk lysering.
52
New cards
Vilka typer av fraktionering är vanliga?
Centrifugering, differentialcentrifugering (högre och högre hastigheter under olika tidsintervall), och utfällning (tillsatts av salt så att proteinerna bildar aggregat).
53
New cards
Gelfiltrering
Separation baserat på storleken av proteinerna. Stora vandrar snabbare (har tillgång till 0% av volymen inuti kulorna).
Delen som de har tillgång till är proportionell med log(Mr).
Delen som de har tillgång till är proportionell med log(Mr).
54
New cards
Jonutbyte
Separation baserat på laddning. Finns antingen negativt eller positivt laddade kulor i kolonnen.
För att få ut det som har fastnat kan man ändra pH eller salthalten.
För att få ut det som har fastnat kan man ändra pH eller salthalten.
55
New cards
Hydrofob effekt (proteinrening)
Vissa kulor är hydrofoba medan andra är hydrofila och binder därför olika proteiner.
56
New cards
Affinitetskromatografi
Använder sig av ligander med specifik igenkänning för vissa proteiner.
För att få ut det som har fastnat kan man ändra salthalten, pH eller tillsätta ett överskott av ligander.
För att få ut det som har fastnat kan man ändra salthalten, pH eller tillsätta ett överskott av ligander.
57
New cards
SDS-page
Separerar utifrån storlek. Består av ett nätverk av polyakrylamidgel. SDS binder och denaturerar. Proteinerna blir negativt laddade och vandrar mot pluspolen. Korta segment vandrar snabbast.
58
New cards
2D-elektrofores
Separeras utifrån sin isoelektriska punkt och sedan m.h.a. SDS-page.
59
New cards
Desolvatisering
Spontan reaktion. När substratet och enzymet binder tillsammans och vattenmolekyler frigörs. Interaktionerna mellan enzymet och substratet ersätter interaktionerna mellan vatten och substrat.
Resulterande ökning i entropi är drivkraften för bildandet av enzym-substrat-komplex.
Resulterande ökning i entropi är drivkraften för bildandet av enzym-substrat-komplex.
60
New cards
Kcat
Hastighetskonstanten för katalys. Motsvarar antalet substratmolekyler som kan omvandlas då enzymerna är mättade.
61
New cards
Km
Koncentrationen av substrat när hastigheten är hälften av Vmax (hälften av alla enzymer är inbundna i enzym-substrat-komplex).
x intercept = -1/Km (på lineweaver-burk plot)
x intercept = -1/Km (på lineweaver-burk plot)
62
New cards
Vmax
Maximala hastigheten då enzymerna är helt mättade.
y-intercept = 1/Vmax (på lineweaver-burk plot)
y-intercept = 1/Vmax (på lineweaver-burk plot)
63
New cards
Steady state
Koncentrationen av enzym-substrat-komplex är konstant. Kommer bildas lika mycket komplex som det förbrukas.
64
New cards
Irreversibel hämmare
Binder starkt till enzymets aktiva säte med kovalenta bindningar, vilket hindrar substratet från att binda dit.
65
New cards
Reversibel hämmare
Binder till enzymet med icke-kovalenta bindningar som är lättare att upphäva. Två olika typer av inhibitorer: kompetitiva och icke-kompetitiva.
66
New cards
Kompetitiva hämmare
Binder till enzymets aktiva säte. Minskar katalyshastigheten genom att minska andelen enzymmolekyler som är bundna till substrat.
Vmax är detsamma, men Km ökar då mer substrat behövs för att uppnå halva Vmax.
Graden som inhibitorn påverkar beror på relativa koncentrationer mellan inhibitor och substrat. Tillsats av mer substrat minskar inhibitorns effekt.
Vmax är detsamma, men Km ökar då mer substrat behövs för att uppnå halva Vmax.
Graden som inhibitorn påverkar beror på relativa koncentrationer mellan inhibitor och substrat. Tillsats av mer substrat minskar inhibitorns effekt.
67
New cards
Icke-kompetitiv hämmare
Binder till ett annat ställe på enzymet än det aktiva sätet vilket ändrar 3D-strukturen så att det inte längre är specifikt med substratet.
Km är oförändrat.
Liknar ej substratet, kommer därför inte att hjälpa att tillsätta mer substrat.
Km är oförändrat.
Liknar ej substratet, kommer därför inte att hjälpa att tillsätta mer substrat.
68
New cards
Epimerer
Monosackarid som endast skiljer sig genom positionen av EN hydroxylgrupp.
D- och L-strukturer är epimerer av varandra.
D- och L-strukturer är epimerer av varandra.
69
New cards
Pyran
Ring med fem kolatomer och en syreatom.
70
New cards
Furan
Ring med fyra kolatomer och en syreatom.
71
New cards
Anomeriskt kol
Den kolatom som ursprungligen hade karbonylgruppen och som avgör om strukturen på glukosidbindningen ska vara beta eller alfa.
72
New cards
Glukosidbindning
Bindning som uppstår mellan två monomerer. Vattenmolekyl har eliminerats så att en syreatom är bunden till de två monomererna.
Kan vara alfa (nedåt) eller beta (uppåt).
Kan vara alfa (nedåt) eller beta (uppåt).
73
New cards
Homopolysackarider
Består av samma sorters byggstenar.
T.ex. amylos eller cellulosa.
T.ex. amylos eller cellulosa.
74
New cards
Heteropolysackarider
Består av olika sorters byggstenar. Befinner sig i den extracellulära matrisen.
T.ex. hemicellulosa.
T.ex. hemicellulosa.
75
New cards
Tautomeriska former (kvävebaser)
Samma molekyler men atomerna ligger på lite olika ställen. Påverkas av pH.
76
New cards
Nukleotider
Består av en pentosring (socker), antingen deoxyribos eller ribos. Består också av en fosfatgrupp och en kvävebas.
77
New cards
Nukleosid
Saknar fosfatgrupp.
78
New cards
5’-ände
Består av fri fosfatgrupp.
Markerar “start” (5’-3'-riktning).
Markerar “start” (5’-3'-riktning).
79
New cards
3’-ände
Har en fri OH-grupp.
80
New cards
Fosfodiesterbindning
Uppstår mellan nukleotider i DNA.
81
New cards
Hur många vätebindningar mellan kvävebaserna?
Två mellan A och T.
Tre mellan C och G.
Tre mellan C och G.
82
New cards
Stacking interactions
Van der Waals bindningar som uppstår när kvävebaserna är tättpackade. Stabiliserar.
83
New cards
Deaminering
Cytosin förlorar sin amingrupp.
84
New cards
Apurinic site (AP-site)
Puriner plockas bort så att endast sockret är kvar.
85
New cards
Tymin dimer
Induceras av UV-strålning. Två tymin sitter nära varandra så att det bildas en “bulky region” vilket blockerar DNA-replikation.
86
New cards
Mättade fettsyror
Har inga dubbelbindningar. Ger ett fastare membran.
87
New cards
Omättade fettsyror
Har en eller flera dubbelbindningar. De flesta har cis-konformation. Krökningarna tar upp mer utrymme så att membranet blir mer flexibelt och rörligt.
88
New cards
Triglycerider
Estrar som sitter mellan tre fettsyramolekyler och en glycerolmolekyl. Används som energi i kroppen. I flytande form kallas de för oljor.
89
New cards
Essentiella fettsyror
Behöver få dem genom kosten. Alfa-linolensyra och linolensyra.
90
New cards
Sfingolipid
Finns i cellmembran och runt neuroner. Syntetiseras från sfingosin. Består av en sfingosindel som är länkad till en fettsyra genom en peptidbindning.
91
New cards
Glykolipider
Lipider med en sockermolekyl på.
92
New cards
Fosfolipider
Består av ett hydrofilt huvud (fosfatgrupp) och två hydrofoba svansar (fettsyror).
93
New cards
Kolesterol
Består av fyra sammanbundna kolringar och en förgrenad kolvätekedja.
Ingår i biologiska membran och har som roll att hålla strukturen konstant (om det sitter bredvid mättade fettsyror blir strukturen mer fluid. Om det sitter bredvid omättade fettsyror blir den mer fast).
Hydrofoba delen är dominerande.
Används för att bilda hormoner, gallsyror och vissa vitaminer.
Ingår i biologiska membran och har som roll att hålla strukturen konstant (om det sitter bredvid mättade fettsyror blir strukturen mer fluid. Om det sitter bredvid omättade fettsyror blir den mer fast).
Hydrofoba delen är dominerande.
Används för att bilda hormoner, gallsyror och vissa vitaminer.
94
New cards
Uncatalyzed transbilayer
Lipider förflyttar sig från det yttre skiktet av membranet till det inre, eller vice versa.
Långsam process som sker väldigt sällan (eftersom den hydrofila gruppen måste passera genom den hydrofoba delen).
Långsam process som sker väldigt sällan (eftersom den hydrofila gruppen måste passera genom den hydrofoba delen).
95
New cards
Uncatalyzed lateral diffusion
Lipider förflyttar sig fram och tillbaka inom samma skikt.
Snabb process.
Snabb process.
96
New cards
Lipid rafts
Regioner som är mer tätt packade och utgör tjockare skikt med samlade lipider.
Naturliga delar i membranet.
Naturliga delar i membranet.
97
New cards
Integrala proteiner
Proteiner som går igenom hela membranet och som hålls på plats via interaktioner med lipider (hydrofob effekt).
Laddade aminosyror är oftast i delen av proteinet som är utanför membranet (den hydrofila delen).
Laddade aminosyror är oftast i delen av proteinet som är utanför membranet (den hydrofila delen).
98
New cards
Periferala proteiner
Sitter inte lika hårt fast som integrala proteiner, men är ändå associerade med elektrostatiska bindningar eller kovalenta bindningar.
Går ej genom hela membranet.
Går ej genom hela membranet.
99
New cards
Amfitropiska proteiner
Associeras och dissocieras från membranet.
100
New cards
Exempel på signaler
Dofter, antigener, ljus, hormoner.