1R + 2N TRIM 2N BATX
1/70
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
71 Terms
Tipus d’isomeria constitucional
Isomeria cadena: “esquelet” diferent (cadena de carbonis)
Isomeria de posició: posició del mateix grup funcional
Isomeria de funció: Grup funcionals diferents però mateix nombre i tipus d’àtom
→ Aldehid (COH) - cetona (-CO)
→ Alcohol (OH) - éter (-O-)
→ Àcid (COOH) - éster (COO)
Tipus d’estereoisomeria
Isomeria geomètrica: cis/trans en alquens, 2 substituents diferents i han d’estar en carbonis diferents
Isomeria óptica: compostos no superponibles (enantiomers), han de tenir almenys 1 carboni quiral (4 substituents diferents)
Notació cis/trans
Cis - àtoms al mateix costat horitzontalment
Trans - àtoms en costats diferents diagonalment
Notació E/Z
E → substituents amb nombre atòmic superiors estan separats diagonalment
Z → substituents amb atòmic superior estan al mateix costat horitzontalment
Polímers per addició
Polímers s’uneixen en cadenes llargues i NO es perd cap molècula
Polímers per condensació
Reacció de 2 monòmers que cadascun té mínim 2 grups funcionals i SÍ es perd/elimina una molècula
Quan s’assoleix un equilibri químic?
Quan les velocitats de la reacció directa i indirecta s’igualen i es mantenen invariables la concentració de reactius i productes

La temperatura afecta l’equilibri?
Sí, perquè en cada temperatura s’assoleix un valor de la constant d’equilibri diferent
Explica que passa quan Qc < Kc?
La reacció avança (→), és a dir, és una reacció directa perquè haurà d’augmentar la concentració de productes per assolir l’equlibri.
Explica el principi de Le Chatelier. Quins tipus de pertorbacions hi ha?
Si un sistema en equilibri està sotmès a una pertorbació externa, es modifiquen les condicions i el sistema es desplaça en el sentit en què es contraresti la pertorbació introduïda per poder tornar a assolir l’equilibri.
Tipus de pertorbacions: Concentració, temperatura i pressió-volum
Que passa quan Qc > Kc?
La reacció retrocedeix (←), és a dir, és una reacció indirecta perquè haurà d’augmentar la concentració de reactius per assolir l’equilibri.
Segons el principi de Le Chatelier, que passa si s’augmenta la concentració de reactius o productes?
Reactius: La reacció es desplaça cap als productes (→) per poder formar-ne de més (perquè hi hagi la mateixa concentració de react. i prod.)
Productes: La reacció es desplaça cap als reactius (←) per poder formar-ne de més (perquè hi hagi la mateixa concentració de react. i prod.)
Que passa quan Qc = Kc
La reacció/sistema està en equilibri
Segons el principi de Le Chatelier, que passa si es disminueix la concentració de reactius o productes?
Reactius: La reacció es desplaça cap als reactius (←) per poder formar-ne de més (perquè hi hagi la mateixa concentració de react. i prod.)
Productes: La reacció es desplaça cap als productes (→) per poder formar-ne de més (perquè hi hagi la mateixa concentració de react. i prod.)
Segons el principi de Le Chatelier, que passa si s’augmenta o es disminueix la temperatura en una reacció exotèrmica?
Augment de T: La reacció es desplaça cap als reactius.
Disminució de T: La reacció es desplaça cap als productes.
Segons el principi de Le Chatelier, que passa si s’augmenta o es disminueix la temperatura en una reacció endotèrmica?
Augment de T: La reacció es desplaça cap als productes.
Disminució de T: La reacció es desplaça cap als reactius.
Segons el principi de Le Chatelier, que passa si s’augmenta la pressió i es disminueix el volum?
El sistema es desplaça cap a on hi hagi menys mols
Segons el principi de Le Chatelier, que passa si es disminueix la pressió i s’augmenta el volum?
El sistema es desplaça cap a on hi hagi més mols
Els catalitzadors poden modificar l’equilibri?
No, només modifiquen la velocitat del sistema
Teoria de les col·lisions (TC)
Per formar productes, els reactius s’han de xocar amb una correcta orientació espacial i suficient energia cinètica (L’Ek del xoc > E d’activació)
Teoria de l’estat de transició/complex activat (TET)
Abans que els reactius donin lloc als productes quan es xoquin, es forma una configuració molecular inestable de màxima energia (el complex activat).
Energia d’activació
Segons TC: Energia addicional que han d’absorbir les molècules dels reactius perquè, en xocar, es trenquin els seus enllaços i es puguin acabar formant els productes.
Segons TET: Energia addicional que han d’absorbir les molècules dels reactius perquè, en xocar, formi el complex activat i es puguin acabar formant els productes.
Com afecta la temperatura a la velocitat de la reacció?
Si augmenta la temperatura, augmenta la velocitat de reacció.
Segons TC: augment de T → augment d’energia cinètica (Ek) de les molècules dels reactius → augmenta l’energia dels xocs
Com afecta la concentració dels reactius a la velocitat de la reacció?
Si augmenta la concentració dels reactius, augmenta la velocitat de reacció.
Segons TC: augment de concentració de les molècules dels reactius → augmenta la probabilitat de xocs entre aquestes molècules
Com afecta l’estat físic dels reactius a la velocitat de la reacció?
Segons TC: v (gas) < v (líquid, dissolució) < v (sòlid)
Com afecta la naturalesa química dels reactius a la velocitat de la reacció?
Segons TET: més gran sigui el nombre d’enllaços de les molècules dels reactius i més forts siguin → Energia d’activació gran → reacció més lenta
(Si els reactius són ions en dció, normalment no cal trencar enllaços i les reaccions acostumen a ser més ràpides)
Com afecta un catalitzador a la velocitat de la reacció? Què és un catalitzador?
Un catalitzador és una substància que s’afegeix a la reacció que no es consumeix i augmenta la velocitat de la reacció. Modifiquen el mecanisme de reacció, disminuint l’energia d’activació, però no modifiquen el valor de la variació d’entalpia de la reacció.
Què és un mecanisme de reacció? Què és un intermedi de reacció? Quina etapa determina la velocitat de la reacció?
Un mecanisme de reacció és un conjunt de reaccions parcials anomenades etapes/reaccions elementals
Un intermedi de reacció és una substància que es forma en una de les etapes/reaccions elementals, però reacciona en una altra etapa. No apareix en la reacció global.
L’etapa lenta (amb energia d’activació més gran) determina la velocitat de la reacció (limita la concentració de reactius i productes) i els ordres parcials (són els coeficients estequiomètrics).
Què vol dir que la variació d’entalpia sigui negativa? I positiva?
Variació entalpia POSITIVA: reacció endotèrmica
“ “ NEGATIVA: reacció exotèrmica
Què vol dir que la variació d’entropia sigui negativa? I positiva?
Variació d’entropia POSITIVA: reacció tendeix al desordre
Variació d’entropia NEGATIVA: reacció tendeix a l’ordre
Com es pot saber si una reacció és espontània o no?
Es pot saber l’espontaneïtat d’una reacció a partir de l’entalpia lliure de Gibbs
G < 0 → Espontani
G > 0 → NO espontani
G = 0 →Condicions d’equilibri
Condicions estàndard
T = 298 K
P = 1 atm
Condicions normals
T = 273 K
P = 1 atm
Isotèrmic
Temperatura constant
Isocor
Volum constant
Isobàric
Pressió constant
Adiabàtic
Sense intercanvi d’energia
Exotèrmic
Despren calor (entalpia negativa)
Endotèrmic
Absorbeix calor
Entalpia de vaportizació
Quantitat d’energia en forma de calor a pressió constant per passar d’estat líquid a estat gasós a una determinada temperatura
Defineix la primera energia d’ionització i posa’n la reacció. Quin signe té?
L’energia d’ionització és l’energia necessària per arrencar un electró d’un àtom en estat fonamental i gasos. És un procés NO espontani. Té un signe positiu perquè és endotèrmic i absorbeix energia.
X (g) →X⁺ (g) + 1e⁻
Defineix la segona energia d’ionització i posa’n la reacció. Quin signe té? Com va variant les energies d’ionització cada vegada que s’arrenca un electró? Augmenten o disminueixen?
L’energia d’ionització és l’energia necessària per arrencar un electró d’un ió en estat gasos amb càrrega +1. És un procés NO espontani. Té un signe positiu perquè és endotèrmic i absorbeix energia.
X (g) →X⁺² (g) + 2e⁻
L’energia d’ionització va augmentant (1r Ei > 2n Ei > 3r Ei) perquè arrencar un electró d’un ió positiu costa més. Com Més carregat positivament està l’ió, costa més vèncer l’atracció que exerceix el nucli sobre els electrons.
Defineix l’afinitat electrònica i justifica quin signe té. Escriu la reacció.
Canvi d’energia que es produeix quan un àtom neutre en estat gasós capta un electró i forma un anió en estat gasós. Té un signe negatiu perquè és un procés exotèrmic.
X (g) + 1e⁻ →X⁻ (g)
Què és l’electronegativitat?
Tendència d’un àtom a atraure electrons quan és combina
Que és el volum atòmic?
L’espai que ocupa un àtom
Defineix el radi atòmic i iònic. Quin és més gran, el radi d’un anió, d’un àtom neutre o d’un catió?
R. atòmic: metitat de la distància del nucli de 2 àtoms que formen una estructura diatòmica, un enllaç covalent o un metàl·lic.
R. iònic: radi de l’ió resultant d’un àtom quan perd o guanya electrons.
R. aniònic > r. neutre > r. catiònic
El radi aniònic és més gran que el de l’àtom neutre perquè té més electrons.
(més e⁻ → més força de repulsió i apantallament → menys força d’atracció al nucli = + volum i + radi
El radi catiònic és més petit que el de l’àtom neutre perquè té menys electrons.
(menys e⁻ →menys força de repulsió i apantallament → més força d’atracció al nucli = - volum i - radi
Què és el caràcter metàl·lic i no-metàl·lic?
Metàl·lic: facilitat de perdre electrons (forma cations)
No-metàl·lic: facilitat de guanyar electrons (forma anions)
Què és el caràcter oxidant i reductor?
Oxidant: tendència a captar electrons (forma anions)
Reductor: tendència a perdre electrons (forma cations)
Apantallament
Disminució de la força d’atracció del nucli sobre un electró per culpa de la repulsió entre electrons
Els electrons a prop del nucli (interns) apantallen (bloquegen parcialment) la càrrega positiva que exerceix el nucli sobre els electrons de valència (els que estan a la capa exterior)
electrons de valència → a < 1
electrons interns → a = 1
ex: un electró extern, més allunyat del nucli → més apantallat (hi haurà més electrons “davant” i “al voltant” seu → atracció que exerceix el nucli sobre l’electró és menor
Carga nuclear efectiva
Càrrega positiva neta que experimenta un electró degut a l’apantallament
Z eff = Z - a
Z = n.atómic
a = apantallament
Halogenació d’alcans

Substitució d’un halogen per un altre

Transformació d’un derivat halogenat en un alcohol

Transformació d’un derivat halogenat en un èter

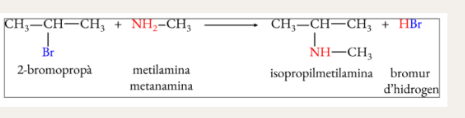
Transformació d’un derivat halogenat en una amina primària

Transformació d’un derivat halogenat en una amina secundària (o terciària)
Hidrogenació catalítica d’alquens
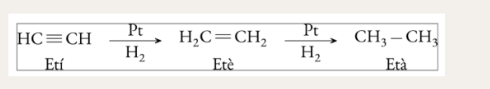
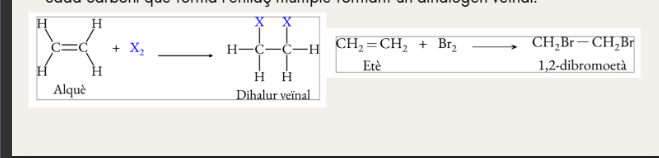
Halogenació d’alquens
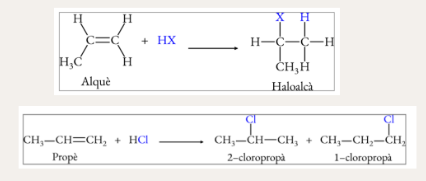
Hidrohalogenació d’alquens
Hidratació d’alquens
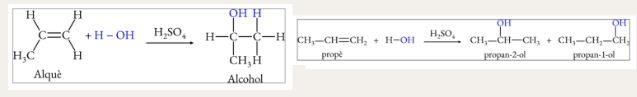
Deshidrogenació

Deshidrohalogenació d’halurs d’alquil
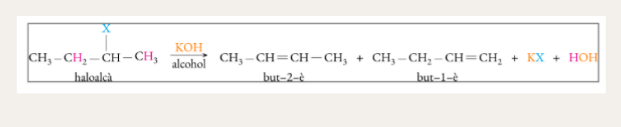
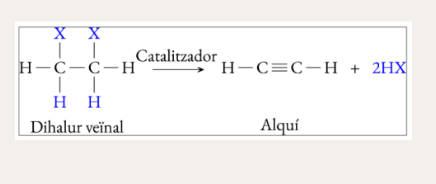
Deshidrohalogenació de dihalurs veïnals
Deshidratació d’alcohols

Oxidació-reducció (redox): alcohols primaris
OXDIANT: Com a substància oxidant [Ox] pot usar-se dicromat de potassi K2Cr2O7 permanganat de potassi KMnO4 en medi àcid.
REDUCTORA:
Com a substància reductora [Red] sol usar-se LiAlH4
![<p><strong>OXDIANT: </strong>Com a substància oxidant [Ox] pot usar-se dicromat de potassi <strong>K2Cr2O7 </strong><span style="font-size: 1.6rem">permanganat de potassi <strong>KMnO4</strong> en medi àcid.</span></p><p><strong>REDUCTORA: </strong></p><p>Com a substància reductora [Red] sol usar-se <strong>LiAlH4</strong></p>](https://knowt-user-attachments.s3.amazonaws.com/901dc0d6-2acc-4194-97bd-8a50a419e302.png)
Oxidació-reducció (redox): alcohols secundari
OXDIANT: Com a substància oxidant [Ox] pot usar-se dicromat de potassi K2Cr2O7 permanganat de potassi KMnO4 en medi àcid.
REDUCTORA:
Com a substància reductora [Red] sol usar-se LiAlH4
![<p><strong>OXDIANT: </strong>Com a substància oxidant [Ox] pot usar-se dicromat de potassi <strong>K2Cr2O7 </strong><span>permanganat de potassi <strong>KMnO4</strong> en medi àcid.</span></p><p><strong>REDUCTORA: </strong></p><p>Com a substància reductora [Red] sol usar-se <strong>LiAlH4</strong></p>](https://knowt-user-attachments.s3.amazonaws.com/86af5553-8e5b-4110-9f00-156d4540c1d0.png)
Oxidació-reducció (redox): alcohols terciaris
OXDIANT: Com a substància oxidant [Ox] pot usar-se dicromat de potassi K2Cr2O7 permanganat de potassi KMnO4 en medi àcid.
REDUCTORA:
Com a substància reductora [Red] sol usar-se LiAlH4
![<p><strong>OXDIANT: </strong>Com a substància oxidant [Ox] pot usar-se dicromat de potassi <strong>K2Cr2O7 </strong><span>permanganat de potassi <strong>KMnO4</strong> en medi àcid.</span></p><p><strong>REDUCTORA: </strong></p><p>Com a substància reductora [Red] sol usar-se <strong>LiAlH4</strong></p>](https://knowt-user-attachments.s3.amazonaws.com/5e8c812d-a0ca-4348-bf1e-3e6d697e6a04.png)
Combustió

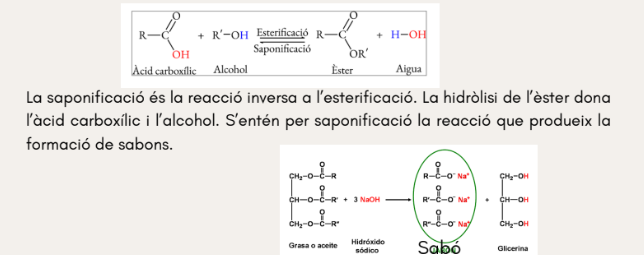
R. Condensació i hidròlisis: esterificació i saponificació
R. Condensació i hidròlisis: condensació d’alcohols

R. Condensació i hidròlisis: condensació per a donar amides
