Orgo I eksam
1/181
Earn XP
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
182 Terms
SN2 ja E2 on 1-etapilised, seega on vaja ... alust/Nu
Tugevat/head
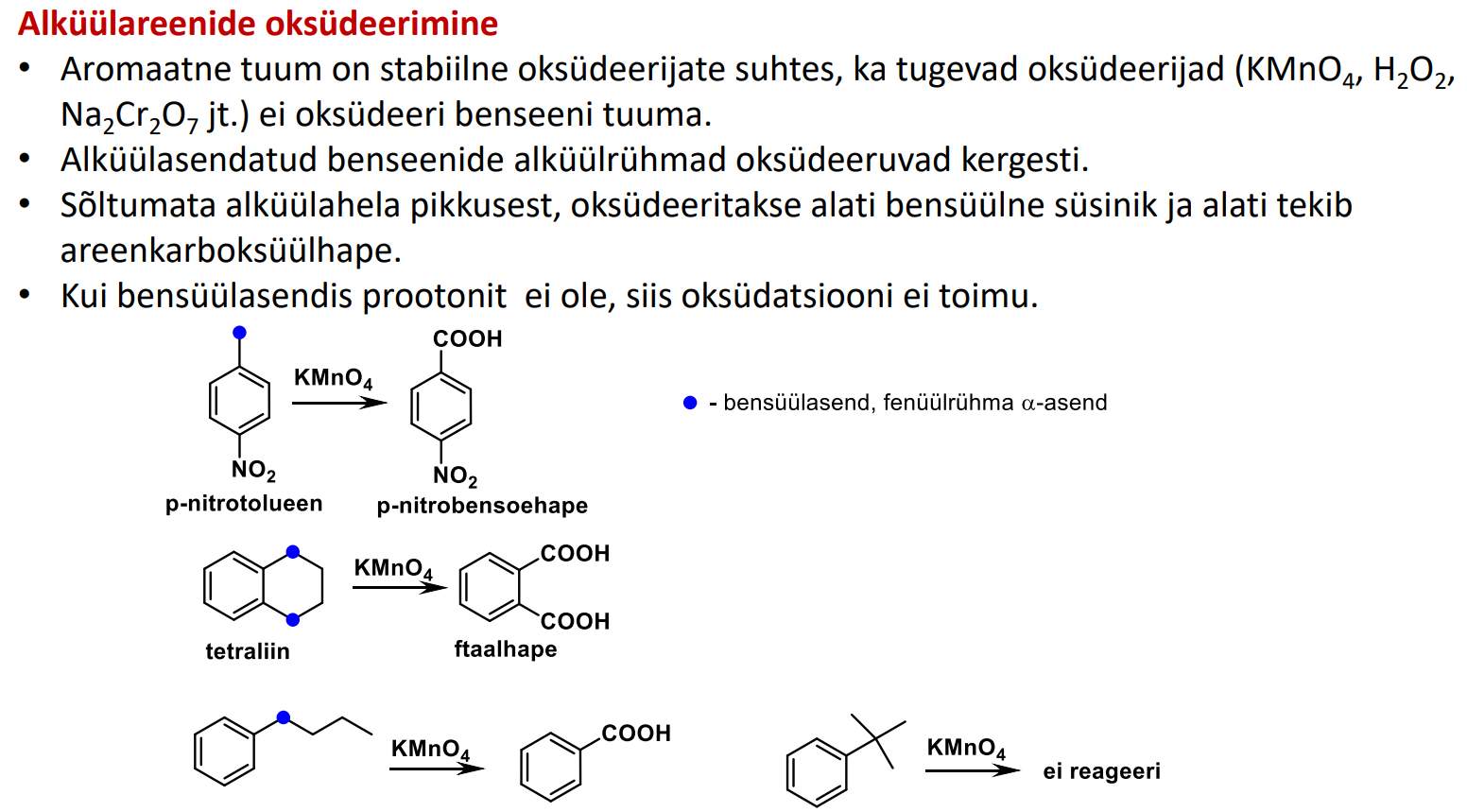
KMnO4 omadused
Tugev oksüdeerija - tekitab COOH, aga ainult BENSÜÜLSE süsiniku puhul.
Big Bulky Base
E2
perhapped
C(O)-O-OH
hübridiseerunud orbit. kuju ja hübridiseerimata orbit kuju
hübridiseerunud on ühest otsast väiksemad, hübridiseerimata on nagu kaheksa ning risti
Elektronegatiivsus
Elementide võimet hoida kinni (tõmmata enda poole) elektrone kovalentses sidemes
kui on CH3-OH2, siis kui polaarne on CO side?
see on väga polaarne, sest hapnikul on pluss laeng ehk elektronide defitsiit. ta proovib tõmmata süsinikult elektrone (kuigi süsinik on vähem elektronegatiivsem kui hapnik - sp veelgi polaarsem ühend prg). St kontrolliks: hapnikul on 3 sidet ja 2 vaba elektroni. Kokku 5 elektroni. Tavaliselt peaks olema kuus, seega +1
Mida suurem on aatom, seda nõrgemini hoiab ta oma väliskihi elektrone kinni ning seda kergem on teda polariseerida
"pehme" ehk "soft"
Mida nimetatakse elektronegatiivse aatomi mõju edasikandumist mööda sigma-sidemeid?
Induktsiooniks
Induktsiooni saab omistada ka peale üksikute aatomite ka funkts. rühmadele
+I on elektrone tõukavad (elektrontihedust suurendavad. Nt kõik CHx asjad. Polariseeruvad ise elektronegatiivsemate asendajate mõjul)
-I on elektrone tõmbavad (elektrontihedust vähendavad ehk deaktiveerivad arom. tuuma. Nt Hal, NO2, CO(O)R, CH2Cl jne. Polariseerivad endaga seotud asendajaid)
(jäta nii meelde, et -I tõmbab elektrone ehk saab lõpuks "negatiivse laengu" nagu ka delta + ja delta - puhul)
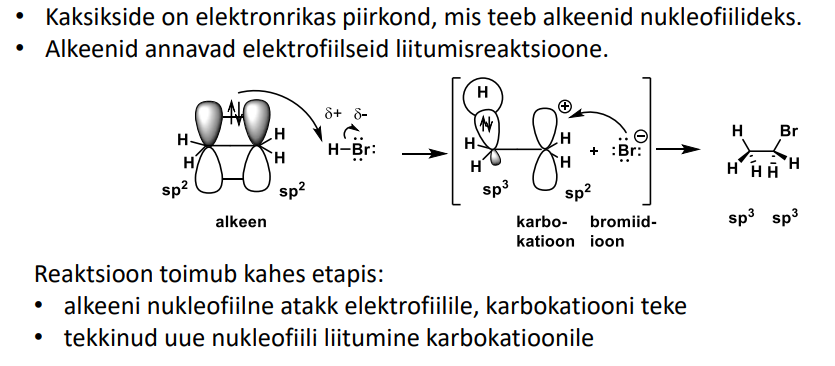
ELEKTROFIILNE LIITUMISREAKTS mõiste
nuc ründab, elec liitub.
ALKEENID annavad elektrofiilsed liitumisreaktsioone (nuc on kaksikside)
alkeen + H-X
Markovnikov
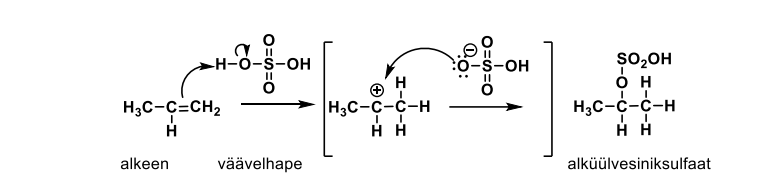
alkeen + H2SO4
Markovnikov (btw see sulforühm on hea lahkuv rühm edaspidiseks reaktsiooniks. Vaja lihtsalt uut Nuc)
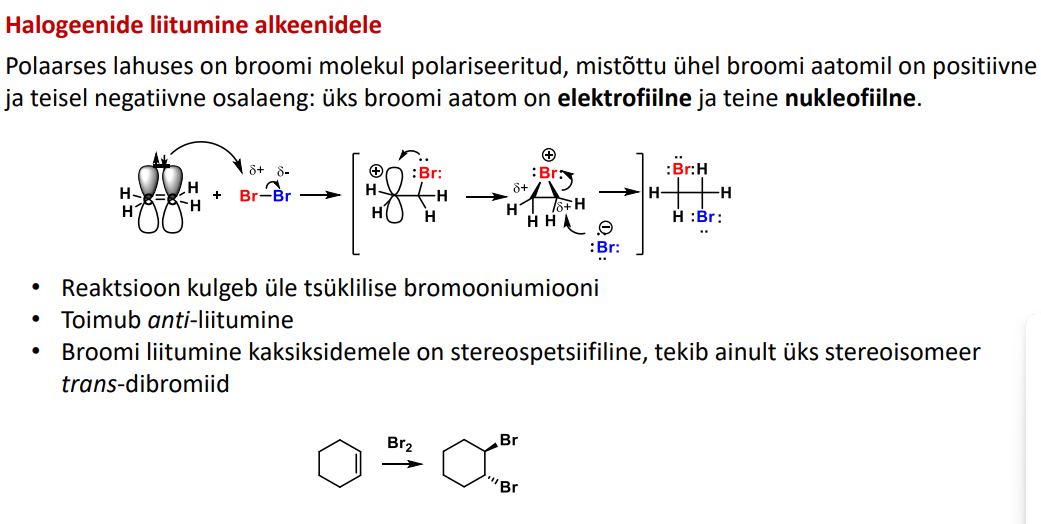
alkeen + halogeen
TOIMUB PROTOONSES LAHUSTIS. St. Hal peab minema polariseerituks!
Kulgeb üle halogeeniooni ja pärast seda on anti liitumine (anti asend tekib)
alkeen + halogeen VESIlahuses
nt Hal-ks võtame Br.
tavaline Br liitumine ja Br-iooni moodust.
Siis liitub OH2. selle tulemusel on O-l nüüd positiivne osalaeng.
Nüüd teine negatiivse osalaenguga Br on Nuc ja atakeerib ühte H-d ja tekib peale põhiprodukti ka hape.
Põhiproduktiks on OH rühm ühes otsas ja teises otsas Br. anti-liitumine
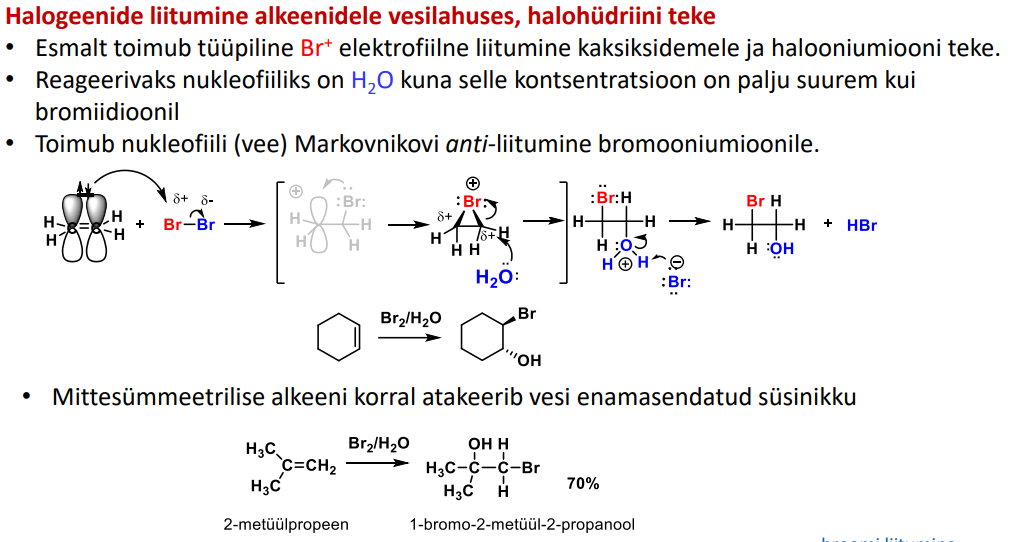
vesi + alkeen
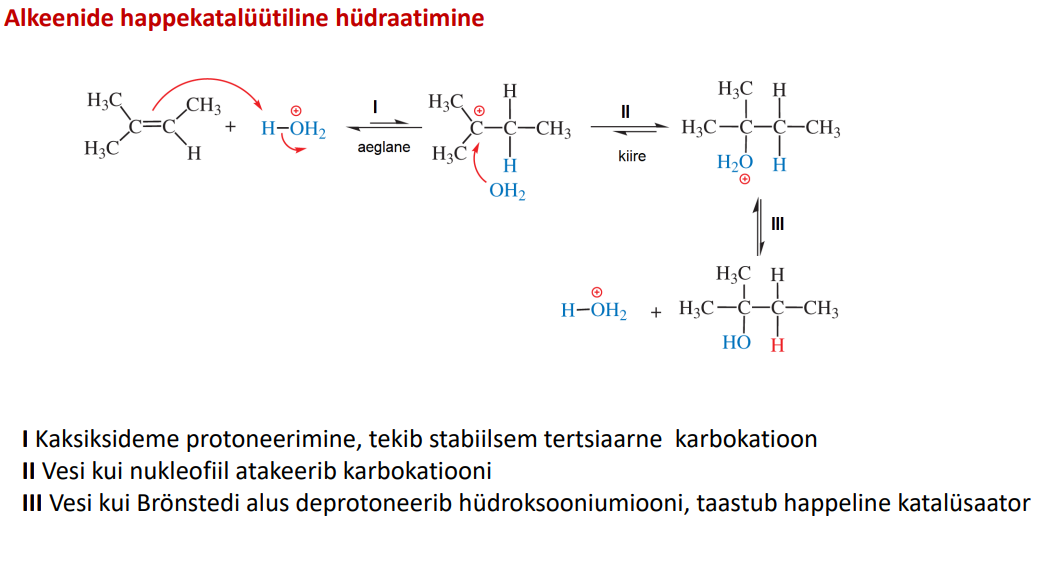
vesi pole piisavalt tugev elektrofiil, see reaktsioon peab toimuma happekat.
alkeeni ja happe (prg H3O) vaheline reakts, kus alkeen võtab endale H+ iooni happest.
nüüd atakeerib OH2 vakantset süsinikku.
Tugev Nuc, mis tekkis esimeses etapis happest, ründab nüüd alkaani ühte H-d. Seejärel pole enam O-l posit laengut ja meil on produkt käes. See on samuti anti-liitumine
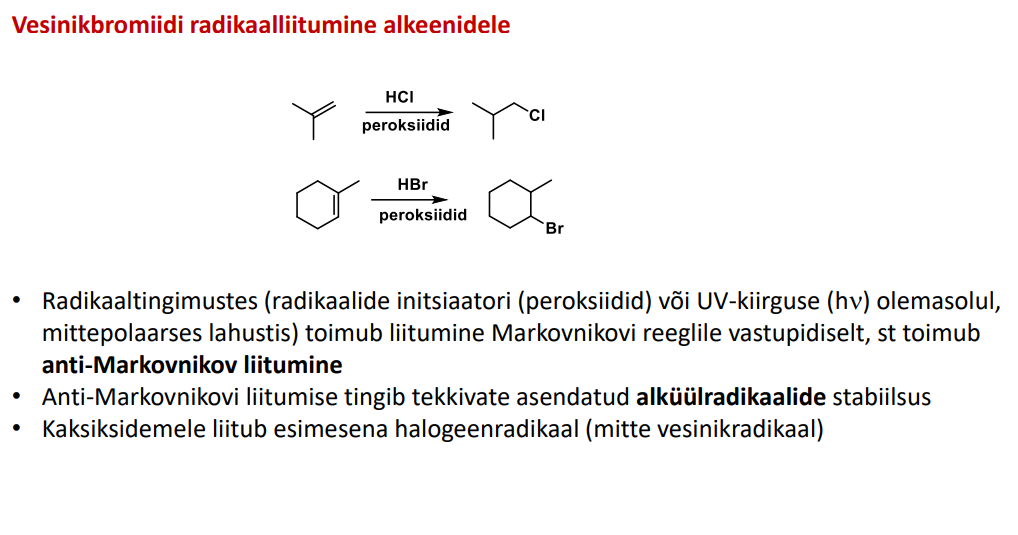
alkeen + HBr
Esimesena liitub Br ning teisena liitub H. Anti-Markovnikov
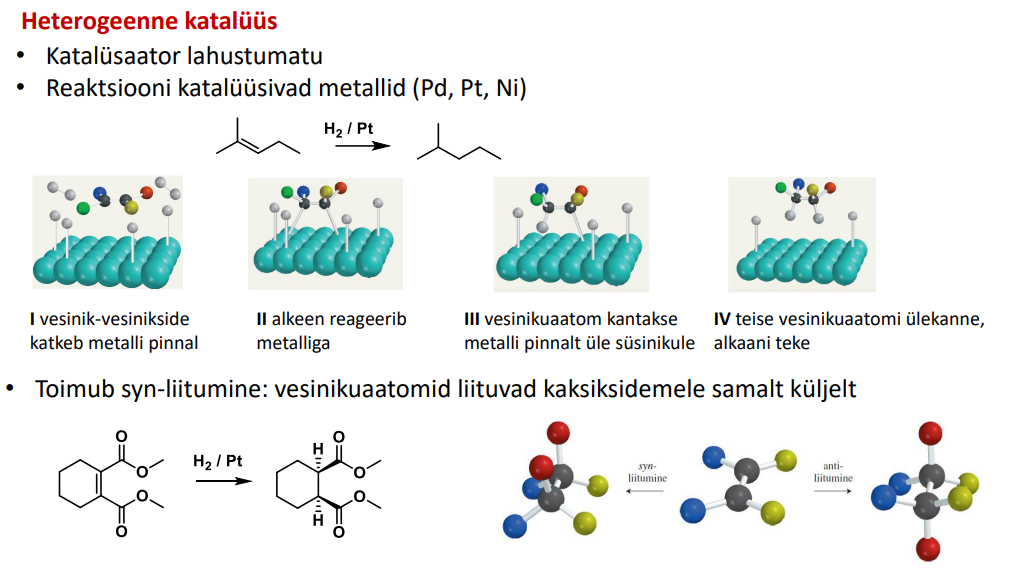
alkeen + H2/Pd
syn-liitumine
epoksiid
kolmelüliline hapnikku sisaldav tsükkel

alkeen + perhape või H2O2
tekib epoksiid. phm loe kokku eelnevalt süsinikud ja pärast süsinikud. C arv peab jääma samaks.
NB! trans-alkeenist tekib trans-epoksiid ja cis-alkeenist tekib cis-epoksiid!
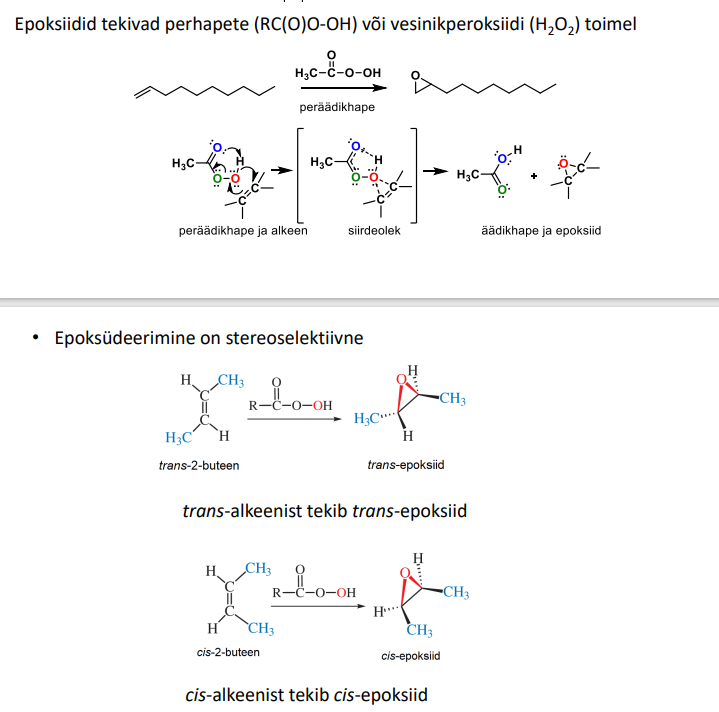
Osata KMnO4 struktuuri
Kolmes kohas Mn seotud kaksiksidemeid moodustavate hapnikutega. Viimane O on seotud K-ga (kaks üksiksidet)
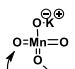
Alkeeni dihüdroksüleerimine e.
alkeen + KMnO4 (al. keskk ehk +vesi) või OsO4
OH rühmade lisamine
MÕLEMAL JUHUL TEKIB CIS-DIOOL
1) KMnO4 toimel: Enne tekib tsükliline ester, ning siis H2O reag. selle estriga ning tekib diool
2) OsO4 toimel niisama
((kuna KMnO4-ga on 2 reakts. alkeenidel, siis jäta meelde, et KMnO4-ga OH- keskk.-s tekib diool (2OH))
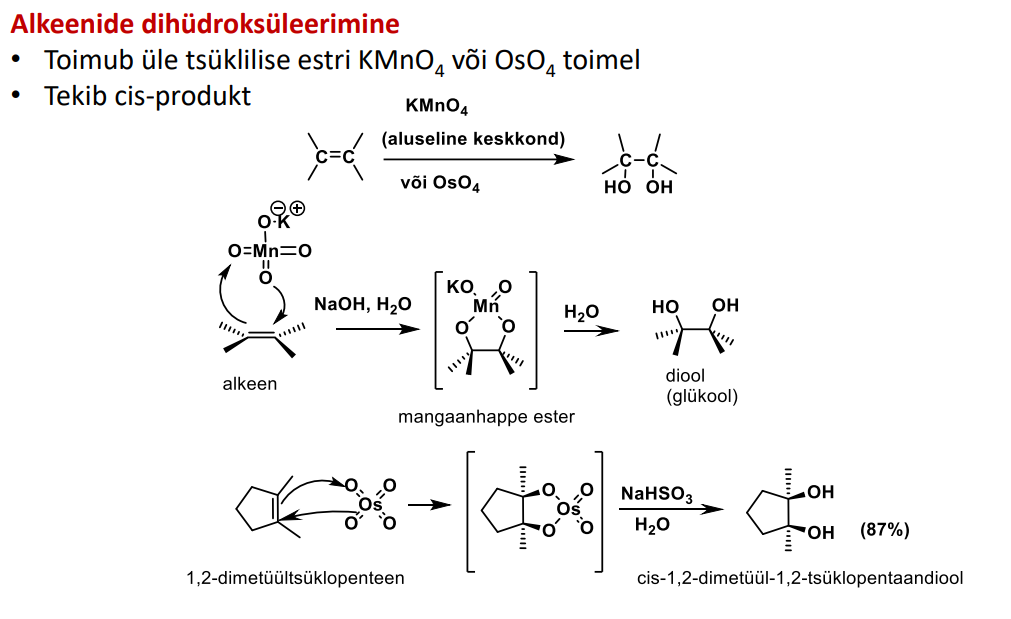
Kaksiksideme oksüdatiivne lõhustamine
OSONOLÜÜS (O3 + Zn + happel. keskk)
Kõige agressiivsem kaksiksideme lõhustaja. Tekib 5 tsükliline vaheühend.
DIASENDATUD KAKSIKSIDEME KORRAL (mõlemad C-d seotud veel süsinikega ehk on mõlemal 1 H- aatom) - tekib 2 aldehüüdi (nad ei muuda omavahel kohti phm)
2. TETRAASENDATUD KAKSIKSIDEME KORRAL - tekib 2 ketooni
NB! Sümmeetrilisel tekib 2 produkti. Asümmeetrilisel 1 produkt
(ehk siis mõtle nii, et diasendatud juhul H-d “jäävad alles” ehk tekib aldehüüd, mille valem on ju R-(C=O) -H)
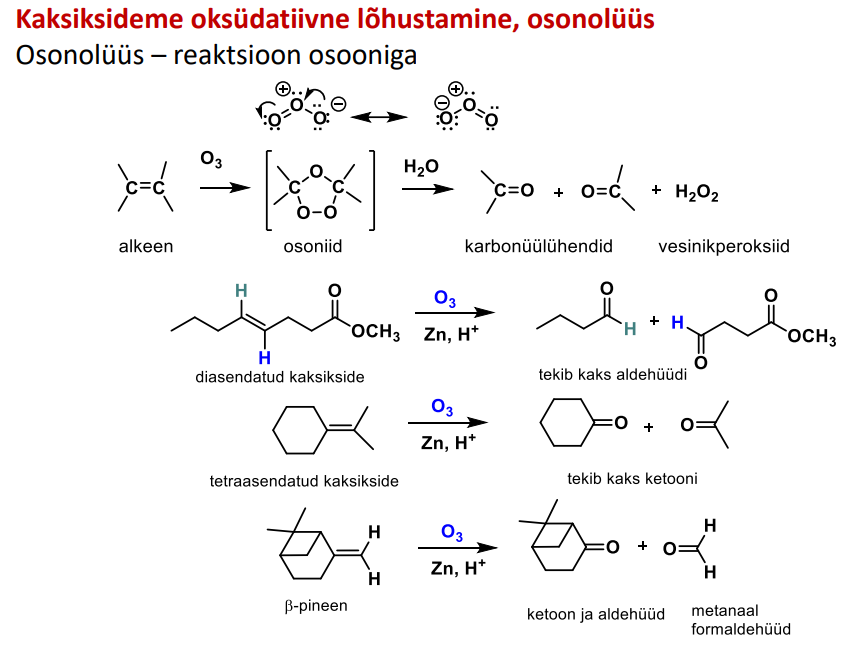
Osata NO2 struktuuri joonistada
ühe hapnikuga kaksikside, teise hapnikuga üksikside
Mis on steeriline takistus
1,3 - diaksiaalne ja 1,5 - diaksilaane. Seda saab vältida ring flipi kaudu (trans-asendi korral üldiselt ei saa vältida. ring flipil jääb diaksiaalne takistus alles)
Kui on 1,2-diklorotsükloheksaanis on asendajad üles, siis...
siis tuleb mõlemad joonistada ülevale positsiooni. Vastavalt üks aksiaalsesse üles ja teine ekvatoriaalsesse üles
+R rühmad benseeni juures
Doneerivad elektrone ehk suurendavad benseeniringi elektrontihedust ja seetõttu on kergem läbi viia reaktsioone.
Vastupidi -R tõmbab enda poole elektrone (jäta nii meelde, et tõmbab enda poole elektrone ehk saab miinus laengu. sama naq deltadel ja induktsioonil)
Kumb on tugevam - induktsioon või resonants?
Resonants
Radikaalide stabiilsus
Sama, mis karbokatioonide stabiilsus (stabiilseim on tertsiaalne).
Miks alkeeni reaktsioonil HBr radikaalsetes tingimustes, reageerib esimesena Br radikaal?
Sest siis tekib stabiilsem radikaal
Inversion in stereochemistry
SN2
Kõiki +R ja -R saad määrata tänu nipile, v.a CHx ja -Hal
Need mõlemad on +R rühmad!
Hückeli reegel
(4n + 2) ehk peab olema 2, 6, 10, 14; .... pii elektrone
Konjugeeritud
single-double-single-double-...
Kui reakts. kulgeb ümber tsüklilise asja, siis alati tekib meil...
tekib cis produkt
Reaktsioon kulgeb alati suunas, mis muudab tugevama happe ja tugevama aluse nõrgemaks ehk teisiti öelduna...
... reaktsioon kulgeb, kui tugevam hape on vasakul ja nõrgem hape on paremal pool.
Tasakaal on selle happe suunas, mis seob prootonit tugevamini
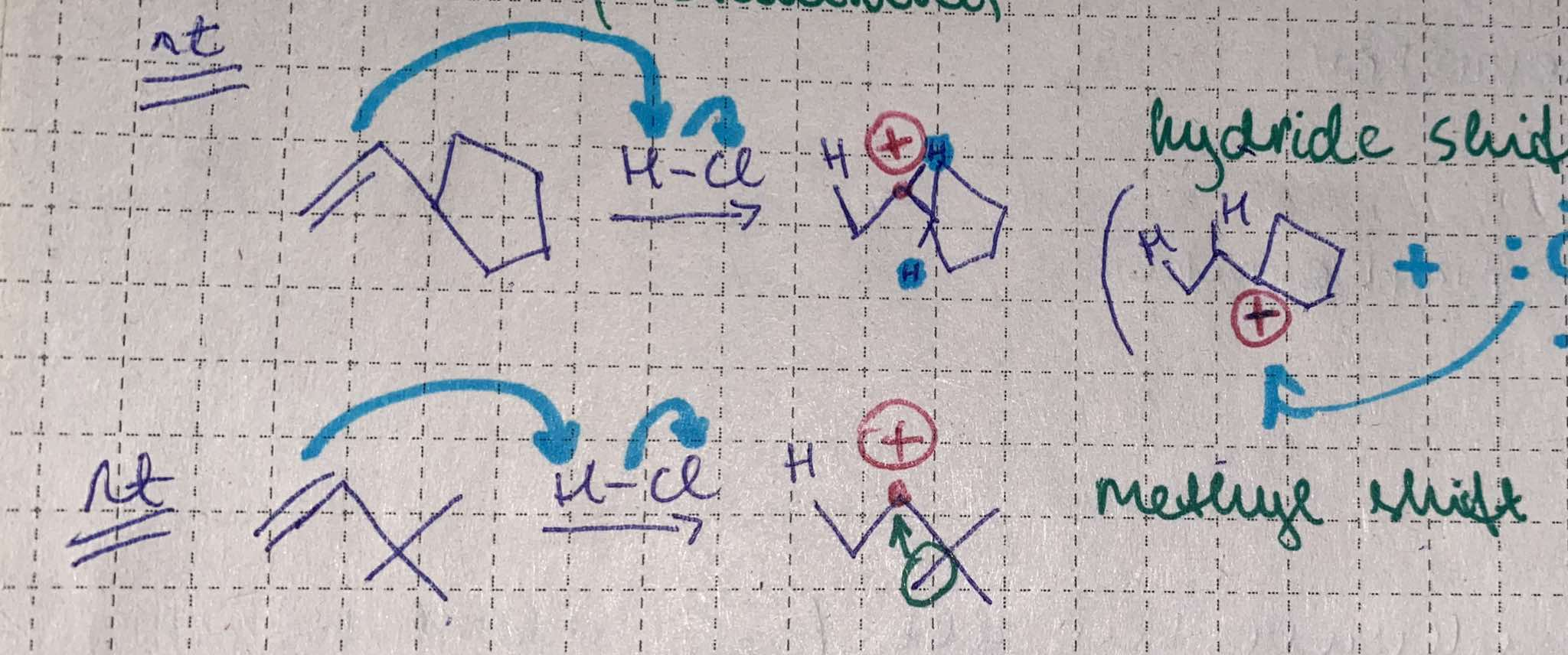
Hüdriidnihe - kui kaksikside on lähedal ... süsinikule
Metüülnihe - kui kaksikside on lähedal ... süsinikule
Hüdriidnihe - kui kaksikside on lähedal 2´ või 3´ süsinikule
Metüülnihe - kui kaksikside on lähedal 4´ süsinikule
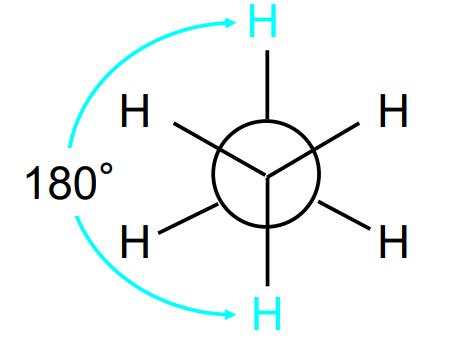
anti-asend newmani projektsioonis
Kaks sidet on anti-asendis kui nendevaheline nurk on 180°
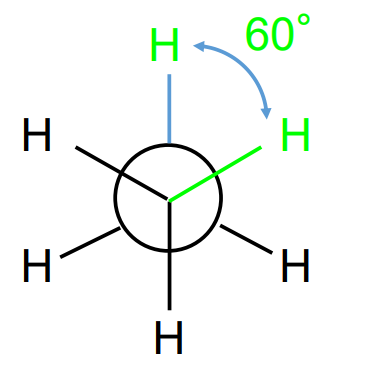
kald-asend newmani projektsioonis
Kaks sidet on kald-asendis kui nendevaheline nurk on 60°
varjestatud konformatsiooni puhul newmani projektsioonis on dieedriline nurk...
dieedriline nurk on 0 kraadi
Mis on kõige stabiilsem konformeer ja kõige ebastabiilsem konformeer newmani projektsioonis?
Kõige stabiilsem on sulustatud antikonformeer, kõige ebastabiilsem varjestatud konformeer
Mis on stereoisomeerid
Rühmade ruumiline paigutus on vaid erinev. Nt ühel on cis ja teisel molekulil trans asend
Mis asendis tahavad olla suured rühmad toolkonformatsioonis?
Ekvatoriaalsel
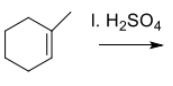
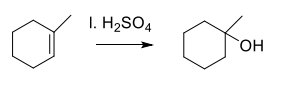
Nt 1-metüültsüklohekseen + LAHJENDATUD väävelhape
Kõigepealt on tavaline H liitumine (H2SO4st) Markovnikovi reegli järgi.
Tekib tertsiaarne karbokatioon
Vesi ründab karbokatiooni
Tekib OH2 nüüd (O-l pluss laeng)
Esimeses etapis tekkinud ioon HSO4 võtab ühe vee vesiniku endale.
Tekib OH rühm lõpuks
Lahustid
• mittepolaarsed (alkaanid, benseen, tolueen)
• polaarsed protoonsed (vesi, metanool, etanool)
• polaarsed aprotoonsed (atsetonitriil AcCN; dimetüülsulfoksiid DMSO; dimetüülformamiid DMF)
sh kuulub polaarsete gruppi ka CCl4
peräädikhape
CH3C(O)OOH
Missuguses hübridisatsiooniastmes on karbokatioon? Miks?
Karbokatioon on sp2 -hübriidne. Energeetiliselt on madalama energiaga karbokatiooni kolme valentselektroni paiknemine sp2 -hübriidsetel orbitaalidel.
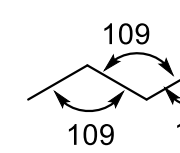
SIDEMETEVAHELISED NURGAD sik-sak
109 kraadi
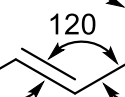
SIDEMETEVAHELISED NURGAD kaksikside-üksikside
120 kraadi
SIDEMETEVAHELISED NURGAD kolmikside-üksikside
180 kraadi
Mis on isomeerid?
sama brutovalemiga erinevad ühendid.
Seoseisomeerid - erineb aatomite järjestus
asendiisomeerid - erinevad üksteisest funkt.rühmade paigutuse poolest
Mitu ja milliseid sidemeid annab iga hübridisatsiooniliik?
sp3 - annavad üksiksidemeid (sigma-sidemeid),
sp2 - annavad kaksiksidemeid (s- ja pii-sidemeid)
sp- annavad kolmiksidemeid (s- ja 2 pii-sidet)
sulustatud newmani projektsioon
kõikjal ühtlased vahed nn "sulud vahel"
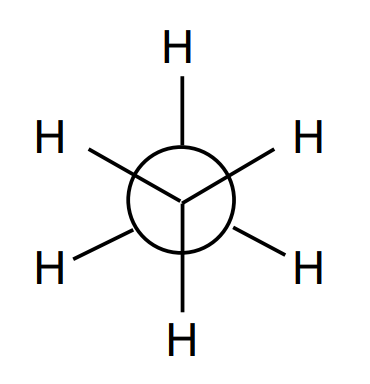
varjestatud newman
eclipse
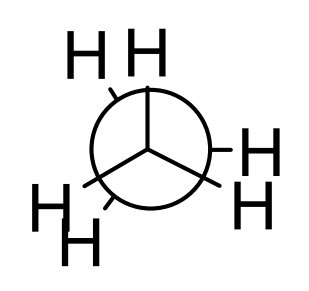
Hargnenud alkaanid on stabiilsemad/ebastabiilsemad kui mittehargnenud?
stabiilsemad
Heterolüüsil tekivad ...
ioonid
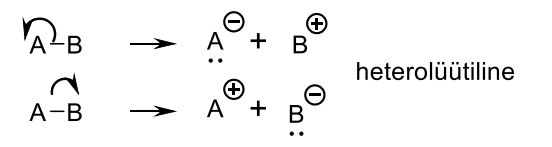
Homolüüsil tekivad ...
radikaalid
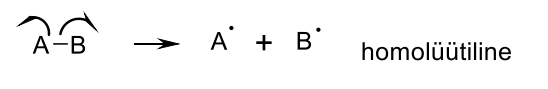
Konformeerid e konformatsioonilised isomeerid on ...
ümber üksiksideme toimuva vaba pöörlemise tulemusel tekkivad isomeerid
Dashes (alla) and wedges (üles)
4 tk korral: alati kas a) dash ja wedge mõlemad üleval
b) dash ja wedge mõlemad all
MITTE KUNAGI: wedge üleval sik-sakist ja dash all

Allüülasend
kaksiksideme alfa-asend. ehk kaksikside + üksikside + üksiksideme otsas asuv nt halogeen

-R rühmad (Elektronakseptoorsed rühmad):
(jäta nii meelde, et saab elektrone juurde ehk miinusega R)
COOR, C=O, CN, S=O, SO2 , NO2, CHO
"Cool Cows Knit Soft Socks, Noticeably C(h)ozy."
COO: COOR (ester group)
CO: C=O (carbonyl group)
KN: CN (nitrile group)
SO: S=O (sulfine group)
SO: SO₂ (sulfonyl group)
NO: NO₂ (nitro group)
CHO: CHO (aldehyde group)
+R rühmad:
-OR, -OH, -O(miinusega), -NH2, -Hal, - NHR, NR2
sidet mood. aatom omab vaba elektronpaari
Happe tugevuse ja pKa võrdlus
Mida väiksem pKa, seda tugevam hape
Happe tugevuse ja Ka võrdlus
Mida suurem Ka, seda tugevam hape
pKa = ...
pKa = -log Ka
Kumb on nõrgem alus, kas OH lõpuga või ONa lõpuga?
ONa lõpuga
Kumb on nõrgem hape, kas NaNH2 või NH3?
NH3 on nõrgem
Geminaalne alküüldihaliidid
C - C ja viimase süsiniku küljes on 2 asendajat
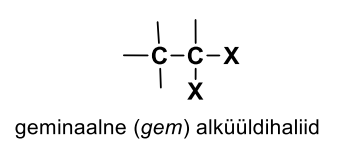
Vitsinaalne alküüldihaliid
C - C ja X asendajad on mõlemal 1 küljes
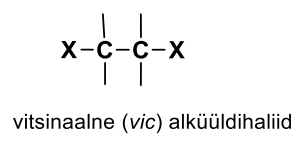
Mis elemendi asendajaga on alküülhaliididest on kõrgeim keemistemp? Miks?
Joodiga. Sest seda on kerge polariseerida (mida vähem polaarne, seda parem on polariseeida. Jood on kõige vähem elektronegatiivsem halogeen) ja seega on tal tugevam dispersioonijõud
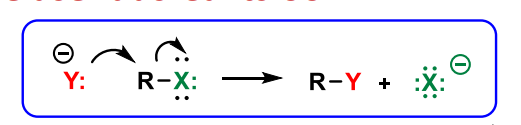
NUKLEOFIILSE ASENDUSREAKTS MÕISTE
Nuc asendab elektrofiilse tsentri juures lahkuva rühma nt ALKÜÜLHALIIDIDE korral
Kumb on tugevam, kas negatiivse laenguga nuc või talle vastav konjug. hape?
Negat laenguga nuc
Nuc asendusreakts annavad haliididest vaid ...
alküülhaliidid. btw arüül- ja vinüülhaliid ei reageeri
Osata N3 (miinusega) struktuuri
Keskel N seotud mõlemalt poolt kahe kaksiksidemega. Äärmistel N-idel miinuslaeng. Keskmisel plusslaeng
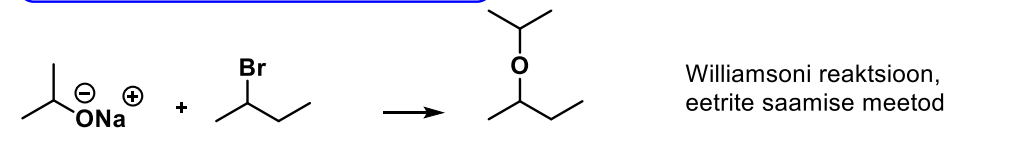
NUKLEOFIILNE ASENDUSREAKTSIOON 1) Williamsoni reaktsioon (eetrite saamine)
Alkoholid on nõrgad nuc, et reageerida haliidide elektrofiilse tsentriga.
Seepärast muudetakse alkoholid tugevamaks nukleofiiliks, moodustades alkoholide soolad - alkoholaadid.
Alkoholaadid on väga tugevad nukleofiilid (stabiliseerimata negatiivne laeng ja vabad elektronpaarid hapnikul)
NUKLEOFIILNE ASENDUSREAKTSIOON 2) klassikaline estrite sünteesimeetod
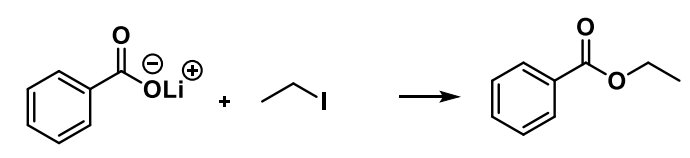
NUKLEOFIILNE ASENDUSREAKTSIOON 3) süsinikahela pikendamine
nt reakts. alküülhaliidi ja NaCN-iga (C ja N vahel kolmikside)
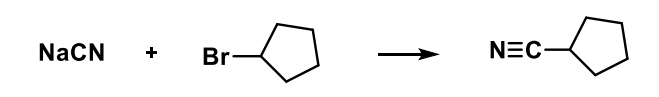
NUKLEOFIILNE ASENDUSREAKTSIOON 4) lämmastikku sisaldava rühma sisestamine
nt reakts. alküülhaliidi ja NaN3-ga
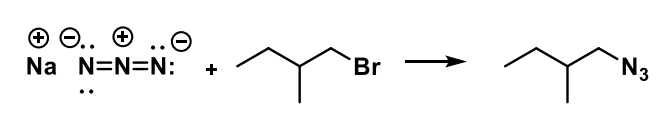
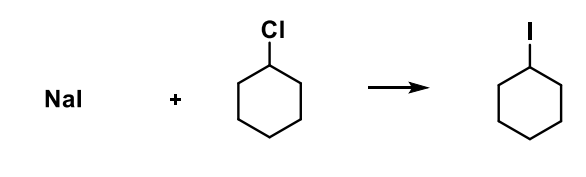
NUKLEOFIILNE ASENDUSREAKTSIOON 5) kulgeb atsetoonis
alküülhaliid + NaI. Tekib lahustumatu NaCl
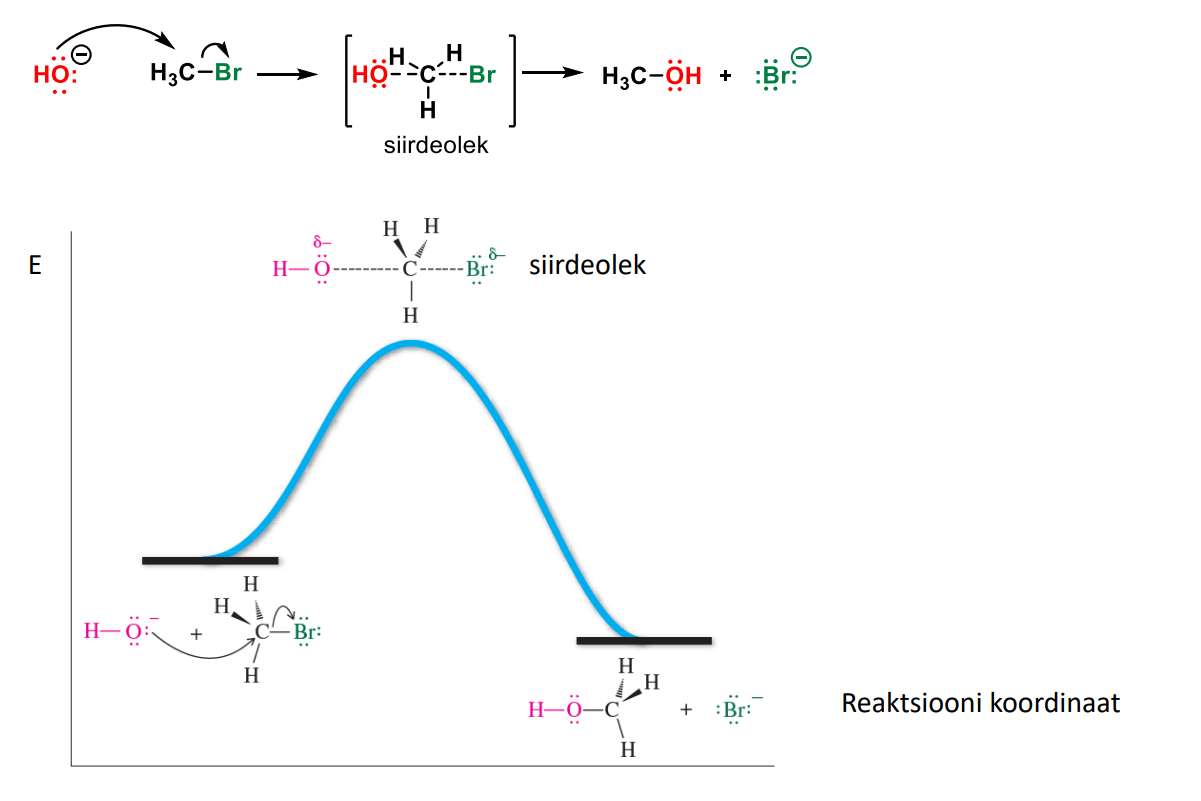
SN2 graafik
SN2 mehhanism
SÕLTUB kahe osaleva aine konts-ist.
nuc atakeerib süsinikku lahkuva rühma vastasküljelt - oluline on, et see pole takistatud (ei ole palju asendajaid).
toimub lahkuva rühmaga seotud süsiniku konfig. pöördumine (inversioon)
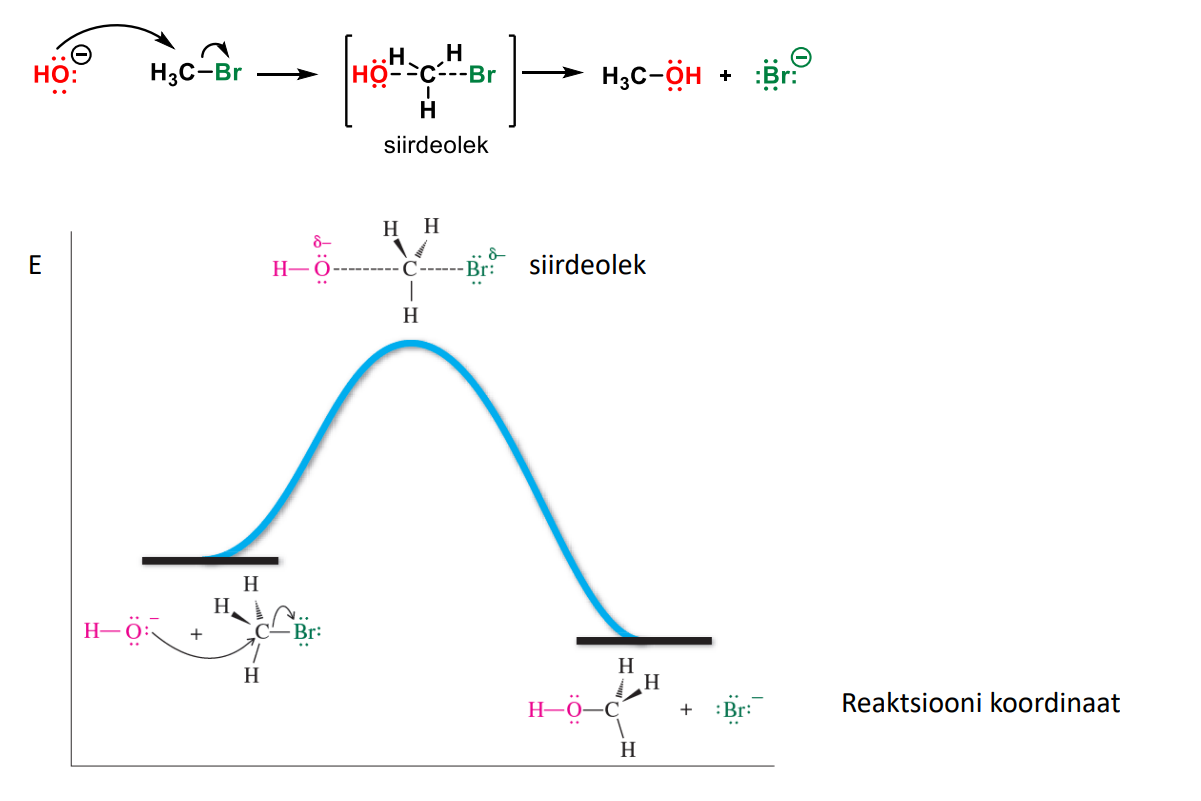
SN1 omadused
Mida stabiilsem on tekkiv karb.kat vaheühend, seda kiirem on SN1 reakts.
Kuna karb.kat on sp2 planaarses, siis ei takista seda reakts eriti mahukad rühmad.
SN1-reaktsioonile ei avalda eriti nukleofiilsus mõju, sest tekkinud karb kat on väga tugev elektrofiil.
SN1 ei ole stereospetsiifiline st. nuc võib atakeerida mõlemalt poolelt!
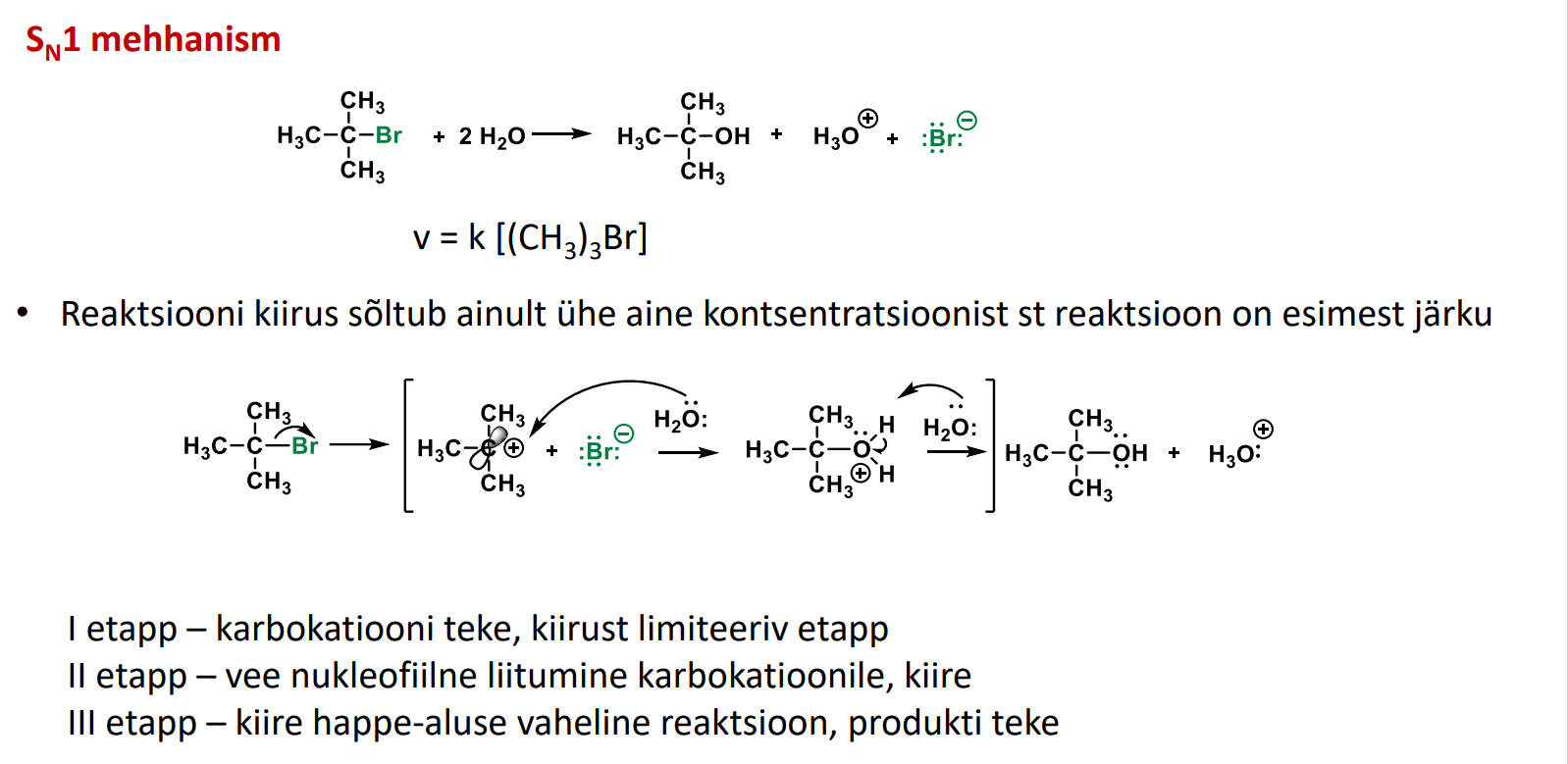
SN1 graafik
Lähteaine [(CH₃)₃CBr, H₂O] hakkab lagunema, Br⁻ lahkub. kulub palju E → kõrge aktiveerimisenergia Eaktiv.
Karbokat. [(CH₃)₃C⁺] moodustum. ja Br on eraldunud.
Karbokat. on väga ebastabiilne, see on reakts. keskne vaheühend
H₂O kui Nuc ründab karbokat. ja moodust vaheühendi [(CH₃)₃C--OH₂⁺].
Vee liitumisel graafik korraks tõuseb, sest sidemete moodustamiseks on vaja lisaE.
kui H2O on täielikult liitunud, siis E taas langeb
hapnikul on pluss laeng. ta ei taha seda. sideme katkemiseks on vaja E.
kui H on ära läinud, moodustub stabiilne ühend madala E-ga
LÜHIDALT:
lähteained keskmise Ega
LG LEAVES - kõrge E
karb kat - keskmine
sideme moodust. - kõrge E
lõpuks side teostub - madal E
deprotoneerimine - kõrge E
MADAL E LÕPP-PRODUKT
![<ul><li><p>Lähteaine [(CH₃)₃CBr, H₂O] hakkab lagunema, Br⁻ lahkub. kulub palju E → kõrge <strong>aktiveerimisenergia E<sub>aktiv.</sub></strong></p><ul><li><p>Karbokat. [(CH₃)₃C⁺] moodustum. ja Br on eraldunud.</p><ul><li><p>Karbokat. on väga ebastabiilne, see on reakts. keskne vaheühend</p></li></ul></li><li><p>H₂O kui Nuc ründab karbokat. ja moodust vaheühendi [(CH₃)₃C--OH₂⁺].</p><ul><li><p>Vee liitumisel graafik korraks tõuseb, sest sidemete moodustamiseks on vaja lisaE.</p></li><li><p>kui H2O on täielikult liitunud, siis E taas langeb</p></li></ul></li><li><p>hapnikul on pluss laeng. ta ei taha seda. sideme katkemiseks on vaja E.</p></li><li><p>kui H on ära läinud, moodustub stabiilne ühend madala E-ga</p></li></ul></li><li><p><span style="color: red"><strong>LÜHIDALT:</strong></span></p><ul><li><p>lähteained <span style="color: rgb(188, 187, 49)"><strong>keskmise </strong></span>Ega</p></li><li><p>LG LEAVES - <span style="color: red"><strong>kõrge </strong></span>E</p></li><li><p>karb kat - <span style="color: rgb(182, 181, 42)"><strong>keskmine</strong></span></p></li><li><p>sideme moodust. - <span style="color: red"><strong>kõrge </strong></span>E</p></li><li><p>lõpuks side teostub - <span style="color: green"><strong>madal </strong></span>E</p></li><li><p>deprotoneerimine - <span style="color: red"><strong>kõrge </strong></span>E</p></li><li><p><span style="color: green"><strong>MADAL </strong></span>E LÕPP-PRODUKT</p></li></ul></li></ul><p></p>](https://knowt-user-attachments.s3.amazonaws.com/6d2fcf41-7c7d-46a5-bc57-c01ba2e48a49.png)
NUKLEOFIILNE ASENDUSREAKTSIOON alküülhaliidid 1) primaarsed 2) sekund. 3) terstiaarsed
primaarsed-
1) head nuc domin. (RS- , I- , CN- , NH3, Br- ) = SN2
2) tugev, mahukas alus domin. (t-BuO-) = E2
MIKS? sest SN1 ja E1 ei saa, sest tekkiv karb.kat on ebastabiilne
sekund. - reag. nii SN2 kui ka E2 = segu
1) hea nuc/nõrk alusega domin. SN2 aprotoonses
2) tugeva aluse (HO- , RO- , -NH2) domin. E2
terstiaarsed
1) protoonses SN1
2) tugevate alustega E2
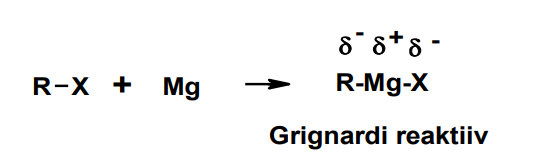
Grignard reagent
alküülhaliid + Mg = R-Mg-X
Head lahkuvad rühmad
ROMs, ROTf jms sulfohapete estrid
SN1 reaktiivsus
kõige kiiremini tert (kõige stab. karb.kat)
SN2 reaktiivsus (millega kõige kiiremini?)
kõige kiiremini metüül (vähim steeriliselt takistatud)
SN1 MEHHANISM
LG LEAVES (slow)
NUC ATTACK KARBOKATIOONILE (quick)
Solvendi mõju SN1-le
reakts. toimub kiiremini polaarsetes aprotoonsetes (AcCN, DMSO, DMF) ja polaarsetes (vesi, alkoholid) mis STABILISEERIVAD karbokatiooni
Solvendi mõju SN2-le
Kuna SN2 sõltub nukleofiilsusest ka (SN1 mitte), siis vaja APROTOONSET (AcCN, DMSO, DMF), sest protoonne soodustab nukleofiilsuse VÄHENEMIST (seob H muidu)
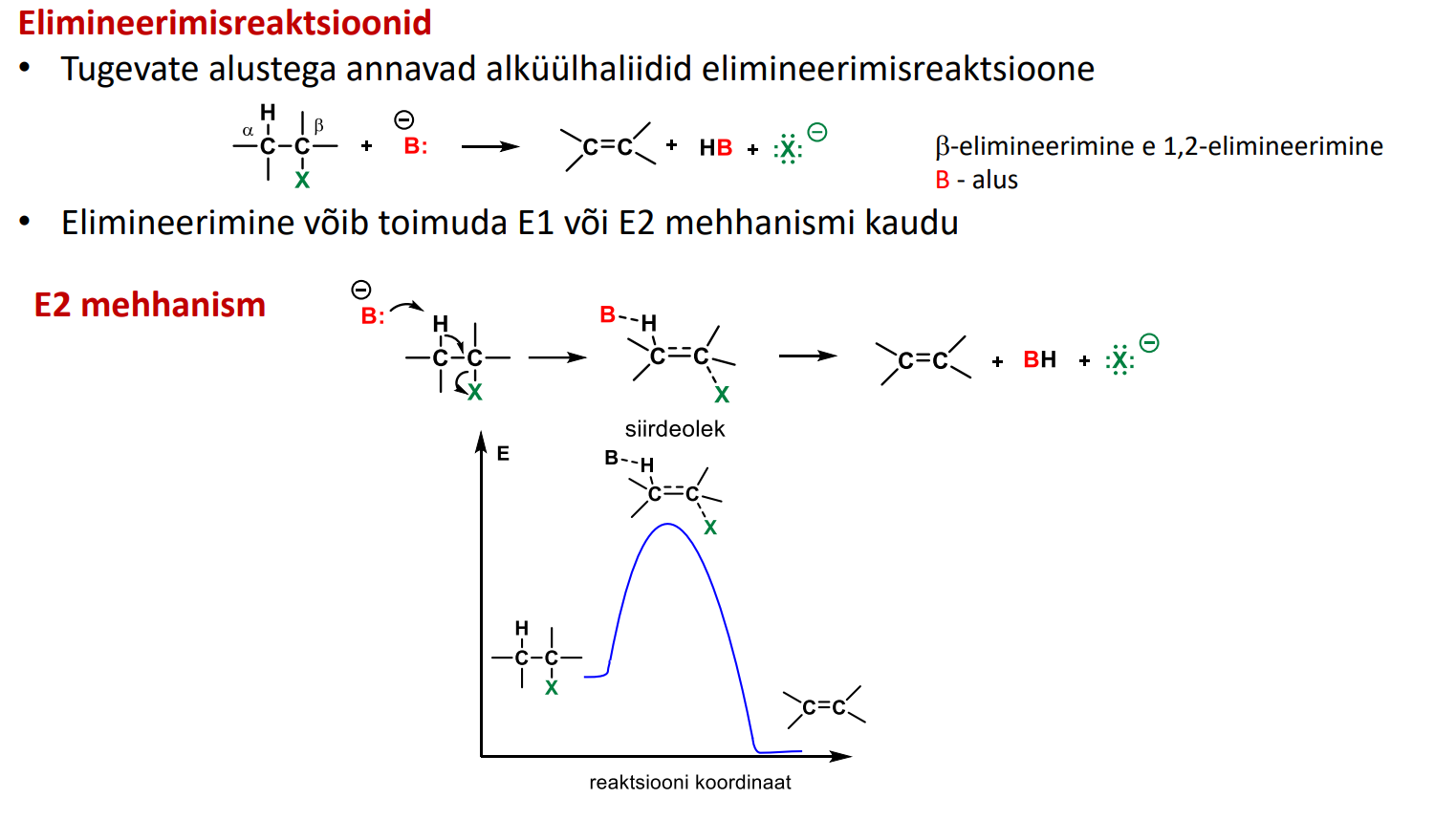
E2 MEHHANISM
otsi delta pluss süsinik
otsi H, mis on grabbed on beta carbon
3 NOOLT tekib kaksikside! + LG-
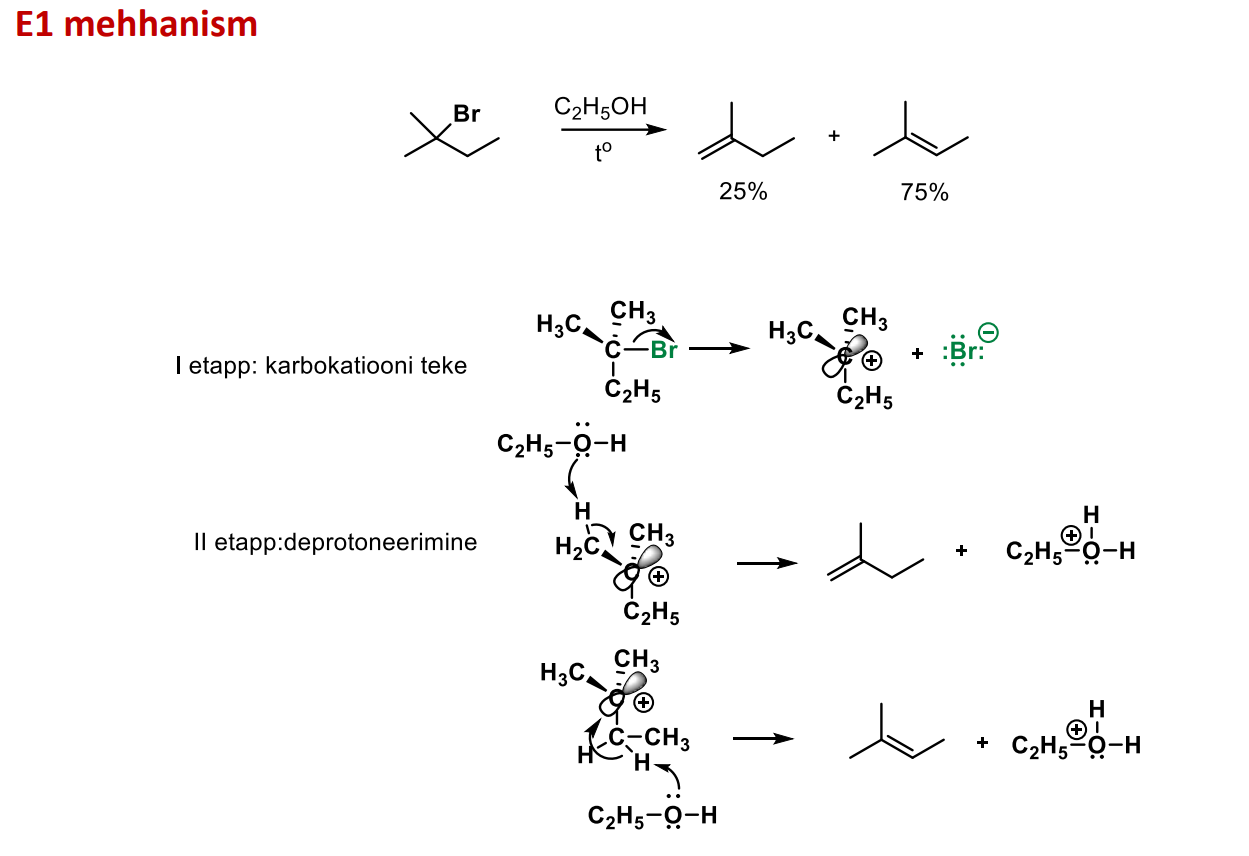
E1 MEHHANISM
otsi delta pluss süsinik
otsi H, mis on grabbed on beta süsinikul
LG LEAVES
tekib karb.kat
Zaitsevi reegel: alus atakeerib seda beta süsiniku H-d, et tekiks enam asendatud alkeen (stabiilseim). kõige stabiilsem alkeen on tetraasendatud ehk ss teine produkt oleks Nuc koos liidetud H-ga
Head nukleofiilid
RS- , I- , CN- , NH3 , RO- , Br- , alkoholaadid
Mida tähendab, kui lahusti on polaarne aprotoonne?
Ei ole ühtegi happelist vesinikku/prootonit. Nt CH3-CN ehk AcCN
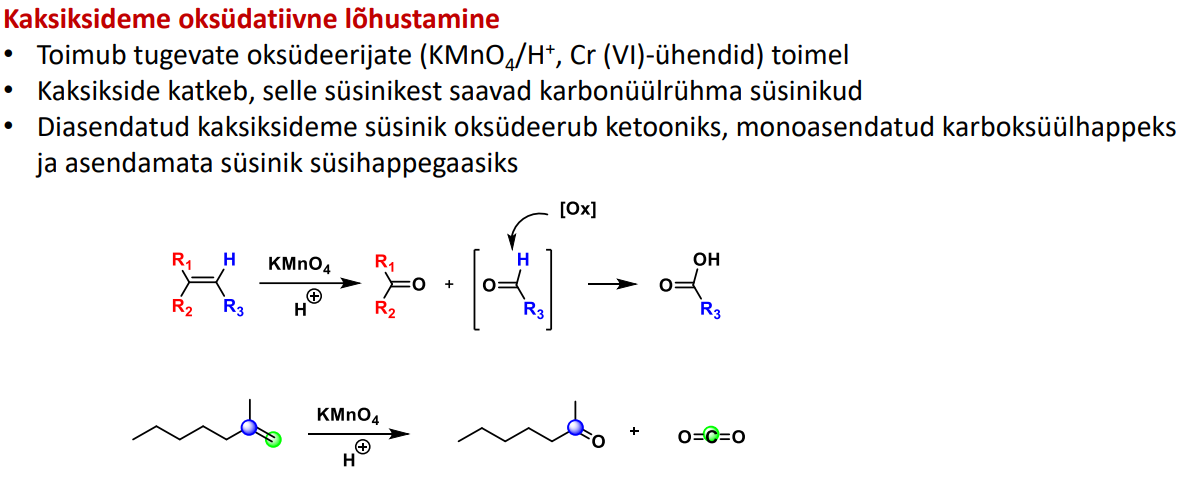
Kaksiksideme oksüdatiivne lõhustamine ehk
alkeen + KMnO4 koos H+
või
alkeen + Cr(VI)-ühendid
Kaksikside katkeb, läheb pooleks.
Diasendatud süsinik oksüdeerub ketooniks (lihtsalt pooleks ja O otsa)
Monoasendatud karb happeks (vaja hapniku olemsaolu)
Asendamata süsinik CO2-ks
(kuna KMnO4-ga 2 eri reaktsiooni alkeenidel, ss jäta nii meelde, et see on KMnO4 koos H+-iga, ehk olenevalt asendusest, võib olla mitu (“+”) varianti)
osata OsO4 struktuuri
Igalt poolt kaksiksidemega
ALKÜÜLHALIIDID
metüülhaliid reageerib naatriumetoksiidiga etanoolis ainult selle mehhanismiga
SN2. Sest metüülhaliid on kõige ebastabiilsem karbokatioon (ei saa SN1 olla).
((Meeldetuletuseks: SN2 reaktiivsus tert<sec<prim<metüül))
metüül on CH3X
primaarne on RCH2X sest ühe süsinikuga seotud.
Naatriumetoksiidist pilt:
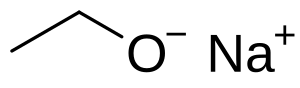
ALKÜÜLHALIIDID
steeriliselt takistamata primaarsed haliidid reageerivad naatriumetoksiidiga etanoolis peamiselt selle mehhanismiga
SN2
SN2-reaktsioonile on hea, kui ei ole steerilist takistust + primaarsel ei saakski ju SN1 toimuda
ALKÜÜLHALIIDID
tsükloheksüülbromiidi töötlemisel naatriumetoksiidiga etanoolis tekib selle mehhanismiga põhiprodukt
E2. Substraat on sekundaarne. Tugev alus reageerib.
