Organická chemie
5.0(1)
Card Sorting
1/98
Earn XP
Description and Tags
Last updated 7:09 PM on 4/3/23
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
99 Terms
1
New cards
Co je organická sloučenina?
sloučenina uhlíku s výjimkou nejjednodušších (oxid uhličitý, hydrogenuhličitany,…)
2
New cards
Je rozdělení látek na organické a anorganické vědecky podložené?
Ne, rozdělení je umělé
3
New cards
Platí chemické a přírodní podmínky pro obě skupiny?
Ano
4
New cards
Popiš organické látky
* Citlivé k teplu
* Ve vodě nerozpustné
* Rozpustné v org. rozpouštědlech
* Špatně vodivé
* Většina lze spálit (za uvolnění vody a CO2)
* Pomalé reakce
* Ve vodě nerozpustné
* Rozpustné v org. rozpouštědlech
* Špatně vodivé
* Většina lze spálit (za uvolnění vody a CO2)
* Pomalé reakce
5
New cards
Popiš anorganické látky
* Odolnější vůči teplu
* Ve vodě většinou rozpustné
* Nerozpustné v org. rozpouštědlech
* Dobrými vodiči
* Rychlé reakce
* Ve vodě většinou rozpustné
* Nerozpustné v org. rozpouštědlech
* Dobrými vodiči
* Rychlé reakce
6
New cards
Jak lze získat organické látky?
* Z přírodních zdrojů - dřevo, ropa,…
* Syntézou - umělá příprava org. látek
* Syntézou - umělá příprava org. látek
7
New cards
Rozdělení přírodních zdrojů
* Fosilní
* Recentní
* Recentní
8
New cards
Fosilní zdroje (vznik, vlastnosti, příklady)
* Vznikly geometrickou přeměnou těl rostlin a živočichů v dávných dobách
* Jsou využívané, těží se, vyčerpatelné, nenahraditelné
* Př: uhlí, rašelina, zemní plyn, jantar, ozokerit
* Jsou využívané, těží se, vyčerpatelné, nenahraditelné
* Př: uhlí, rašelina, zemní plyn, jantar, ozokerit
9
New cards
Recentní zdroje (vznik, vlastnosti, příklady)
* Tvoří se v součastnosti
* Využívané v menší míře, nevyčerpatelné, obnovitelné
* Př: rostliny, živočichové, dřevo, biomasa
* Využívané v menší míře, nevyčerpatelné, obnovitelné
* Př: rostliny, živočichové, dřevo, biomasa
10
New cards
Základní suroviny organické chemie
Ropa, zemní plyn, uhlí, biomasa
11
New cards
Popiš ropu (co to je, zpracování)
* Směs alkanů, cykloalkanů a arenů
* Zpracovává se frakční destilací
* Zpracovává se frakční destilací
12
New cards
Produkty ropy
* Uhlovodíkové plyny - (palivo, chem. suroviny (propan, butan))
* Benzinová frakce - (palivo, rozpouštědlo,…)
* Petrolejová frakce - (petrolej)
* Plynový olej - (dieselové motory)
* Destilační zbytek - (mazut, asfalt)
* Benzinová frakce - (palivo, rozpouštědlo,…)
* Petrolejová frakce - (petrolej)
* Plynový olej - (dieselové motory)
* Destilační zbytek - (mazut, asfalt)
13
New cards
Popiš zemní plyn (co to je, použití, produkt)
* Směs plynných uhlovodíků (především methanu)
* Používá se jako palivo a při výrobě org. sloučenin
* Rozkladem za vysokých teplot vzniká syntézní plyn (výroba methanolu)
* Používá se jako palivo a při výrobě org. sloučenin
* Rozkladem za vysokých teplot vzniká syntézní plyn (výroba methanolu)
14
New cards
Popiš uhlí (co to je, příklady, využití, zpracování)
* Hořlavá hornina, směs vysokomolekulárních látek
* Př: lignit, antracit, černé a hnědé uhlí
* Používá se jako palivo
* Zpracovává se karbonizací (zahřívání za nepřístupu vzduchu)
* Př: lignit, antracit, černé a hnědé uhlí
* Používá se jako palivo
* Zpracovává se karbonizací (zahřívání za nepřístupu vzduchu)
15
New cards
Jaké produkty vznikají karbonizací?
* Karbonizační plyn - (svítiplyn)
* Dehet - (výroba naftalenu a aromatických uhlovodíků)
* Koks - (palivo, redukční prostředek)
* Dehet - (výroba naftalenu a aromatických uhlovodíků)
* Koks - (palivo, redukční prostředek)
16
New cards
Popiš biomasu (co to je, druhy, využití)
* Organická hmota, obnovitelný zdroj energie
* Podle obsahu vody:
\- suchá (dřevo, sláma)
\- mokrá (tekuté odpady - kejda)
\- speciální (olejniny, škrobové a cukernaté plodiny)
* Výroba elektřiny, tepla (bioplyn, pelety), pohon vozidel (bionafta)
* Podle obsahu vody:
\- suchá (dřevo, sláma)
\- mokrá (tekuté odpady - kejda)
\- speciální (olejniny, škrobové a cukernaté plodiny)
* Výroba elektřiny, tepla (bioplyn, pelety), pohon vozidel (bionafta)
17
New cards
Metody izolace organických látek ze směsi
* Destilace
* Extrakce
* Krystalizace
* Chromatografie
* Extrakce
* Krystalizace
* Chromatografie
18
New cards
Prvky organických sloučenin
C, H, O, N, P, S, halogeny, některé kovy
19
New cards
Vlastnosti uhlíku
* Pevná látka, dvě modifikace:
\- Tuha (šestiúhelníkové vrstvy)
\- Diamant (krychlová krystalová soustava)
* 2. perioda, 14. skupina
* Čtyřvazný
* Tvoří acyklické, cyklické i kombinované řetězce
\- Tuha (šestiúhelníkové vrstvy)
\- Diamant (krychlová krystalová soustava)
* 2. perioda, 14. skupina
* Čtyřvazný
* Tvoří acyklické, cyklické i kombinované řetězce
20
New cards
Vlastnosti vodíku
* CH - uhlovodíky, nahrazení H - deriváty uhlovodíků
* Jednovazný
* Důkaz vodíku pomocí tvorby vody
* Další rozdělení dle chem. vazby (alkany, alkeny, alkyny, aromatické uhlovodíky)
* Jednovazný
* Důkaz vodíku pomocí tvorby vody
* Další rozdělení dle chem. vazby (alkany, alkeny, alkyny, aromatické uhlovodíky)
21
New cards
Vlastnosti kyslíku
* Dvouvazný
* Důkazové rekce pomocí tvorby vody
* Rozdělení do funkčních skupin:
\- Hydroxylová skupina -OH
\- Aldehydy, ketony - karbonylová skupina =O
\- Karbocidová skupina -COOH
\- Ethery -O-
* Důkazové rekce pomocí tvorby vody
* Rozdělení do funkčních skupin:
\- Hydroxylová skupina -OH
\- Aldehydy, ketony - karbonylová skupina =O
\- Karbocidová skupina -COOH
\- Ethery -O-
22
New cards
Vlastnosti dusíku
* Trojvazný
* Rozdělení: nitrosloučeniny, aminy, amidy, imidy, bílkoviny
* Důkazové reakce pomocí tvorby amoniaku a zásady
* Rozdělení: nitrosloučeniny, aminy, amidy, imidy, bílkoviny
* Důkazové reakce pomocí tvorby amoniaku a zásady
23
New cards
Vlastnosti síry
* 16. skupina, 3. perioda
* Dvouvazná
* Thioly, thioethery, disulfidy
* Důkaz dle sulfidového aniontu, tvorba černé sloučeniny
* Dvouvazná
* Thioly, thioethery, disulfidy
* Důkaz dle sulfidového aniontu, tvorba černé sloučeniny
24
New cards
Vlastnosti halogenů
* Jednovazné
* Halogenderiváty: teflon (→ polytetrafluorethylen), chloroform, jódovaný povidon (betadine)
* Důkaz Beilsteinovou zkouškou (využití měděného drátu a hoření)
* Halogenderiváty: teflon (→ polytetrafluorethylen), chloroform, jódovaný povidon (betadine)
* Důkaz Beilsteinovou zkouškou (využití měděného drátu a hoření)
25
New cards
Vlastnosti kovů
* Organotvorné sloučeniny
* Př: tetraethylolovo (CH3CH2)4Pb
* Ferrocen C10H10Fe
* Organohořečnaté sloučeniny, tzv. Grinadova činidla
* Př: tetraethylolovo (CH3CH2)4Pb
* Ferrocen C10H10Fe
* Organohořečnaté sloučeniny, tzv. Grinadova činidla
26
New cards
Rozdíl mezi molekulou prvku a molekulou sloučeniny
Atomy stejného prvku x atomy různých prvků
27
New cards
Co je chemická vazba a čím je tvořena?
Je to silové působení mezi prvky, je tvořena valenčními elektrony prvků
28
New cards
Co určuje délka chemické vazby?
Vzdálenost mezi jádry prvků
29
New cards
Co je vazebná a disociační energie?
* Vazebná energie je energie, která se uvolňuje tvorbou vazby
* Disociační energie je energie, kterou je nutno dodat k přerušení vazby
* Disociační energie je energie, kterou je nutno dodat k přerušení vazby
30
New cards
Co je to elektronegativita?
Schopnost atomu přitahovat vazebné elektrony
31
New cards
Jak vznikají molekulové orbitaly?
Prekryvem atomových orbitalů
32
New cards
Druhy chemických vazeb
sigma, π
33
New cards
Vazba sigma
* Vzniká pokud se jedná o překryv spojnice jader (s, px)
* Je silnější než π
* Vznik jednoduchých vazeb
* Je silnější než π
* Vznik jednoduchých vazeb
34
New cards
Vazba π
* Vzniká pokud se jedná o překryv mimo spojnici jader (p)
* Je slabší než sigma (sloučeniny s touto vazbou jsou reaktivnější)
* Podílí se na vzniku násobných vazeb
* Je slabší než sigma (sloučeniny s touto vazbou jsou reaktivnější)
* Podílí se na vzniku násobných vazeb
35
New cards
Jak přejde atom do excitovaného stavu?
* Pro zahájení rce je potřeba velké množství aktivační energie
* Po dodání energie (např. teplem) přechází valenční e- do excitovaného stavu (dočasný přísun elektronů do eneregeticky bohatších hladin)
* Po dodání energie (např. teplem) přechází valenční e- do excitovaného stavu (dočasný přísun elektronů do eneregeticky bohatších hladin)
36
New cards
Jsou excitované atomy stabilní?
Ne, musí se zúčastnit reakce nebo přejde zpět do základního stavu
37
New cards
Jak značíme excitovaný stav?
\* za značkou prvku
38
New cards
Co je molekulový orbital?
Prostor, ve kterém se nacházejí elektrony tvořící vazbu v molekule
39
New cards
Kdy dochází ke vzniku vazeb v molekulách, kde centrální atom váže symetrické atomy?
Až po prostorovém přizpůsobení atomových orbitalů centrálního atomu
40
New cards
Jak dochází k hybridizaci?
* Původní atomové orbitaly se mísí a vznikají hybridní atomové orbitaly
* Ty se váží s orbitaly připojovaných atomů → vznik molekulových orbitalů
* Ty se váží s orbitaly připojovaných atomů → vznik molekulových orbitalů
41
New cards
Co nám teorie hybridizace umožňuje popsat
Tvar molekuly na základě tvaru hybridních orbitalů
42
New cards
Hybridizace sp3 (orbitaly, výsledek, symetrie, příklad)
* Účastní se 1s a 3p
* Vytvoří se 4 hybridní sp3: 4 vazby sigma (jednoduchá vazba)
* Tetragonální symetrie, pravidelný čtyřstěn
* Př: methan
* Vytvoří se 4 hybridní sp3: 4 vazby sigma (jednoduchá vazba)
* Tetragonální symetrie, pravidelný čtyřstěn
* Př: methan
43
New cards
Hybridizace sp2 (orbitaly, výsledek, symetrie, příklad)
* Účastní se 1s a 2p
* Vytvoří se 3 hybridní sp2: 3 vazby sigma, 1 π (dvojná vazba)
* Hybridní a. orbitaly poskytují sigma, nehybridní π
* Trigonální symetrie, rovnostranný trojúhelník
* Př: ethylen
* Vytvoří se 3 hybridní sp2: 3 vazby sigma, 1 π (dvojná vazba)
* Hybridní a. orbitaly poskytují sigma, nehybridní π
* Trigonální symetrie, rovnostranný trojúhelník
* Př: ethylen
44
New cards
Hybridizace sp (orbitaly, vazby, symetrie, příklad)
* Účastní se 1s a 1p
* Vazby 3 sigma, 2 π (trojná vazba) - nejkratší a nejpevnější vazba
* Lineární symetrie
* Př: acetylen, ethin
* Vazby 3 sigma, 2 π (trojná vazba) - nejkratší a nejpevnější vazba
* Lineární symetrie
* Př: acetylen, ethin
45
New cards
Shrnutí hybridizace
* = smíšení
* Teorie vysvětluje vznik rovnocenných vazeb z energeticky nerovnocenných orbitalů atomů a jejich prostorové uspořádání
* Je to pouze teorie = matematický model
* Počet orbitalů se nemění
* Využívají e- a. orbitalů, které se příliš nemění
* Teorie vysvětluje vznik rovnocenných vazeb z energeticky nerovnocenných orbitalů atomů a jejich prostorové uspořádání
* Je to pouze teorie = matematický model
* Počet orbitalů se nemění
* Využívají e- a. orbitalů, které se příliš nemění
46
New cards
Rozdělení vazeb
Kovalentní, iontová, kovová, koordinačně-kovalentní
47
New cards
Kovalentní vazby (princip, jaké mohou být)
* Dvojici elektronů sdílejí oba atomy
* Mohou být polární/nepolární
* Mohou být násobné/jednoduché
* Př: H2O
* Mohou být polární/nepolární
* Mohou být násobné/jednoduché
* Př: H2O
48
New cards
Iontová vazba (princip)
* Extrémní případ kovalentní vazby (rozdíl elektronegativit vyšší než 1,7)
* Elektropozitivnější atom předá e- druhému a vzniká tak anion a kation
* Př: NaCl
* Elektropozitivnější atom předá e- druhému a vzniká tak anion a kation
* Př: NaCl
49
New cards
Typ vazby x rozdíl elektronegativit
Nepolární < 0,4 (N2)
Polární 0,4 - 1,7 (H2O)
Iontová > 1,7 (NaCl)
Polární 0,4 - 1,7 (H2O)
Iontová > 1,7 (NaCl)
50
New cards
Které prvky se skládají pouze z volných atomů (netvoří molekuly)?
Vzácné plyny (He, Ne, Ar, Kr, Xe, Rn)
51
New cards
Kovová vazba (princip)
* V kovové mřížce se nacházejí kationty kovů a volně se pohybující elektrony (elektronový plyn)
* Val. e- jsou příčinou vysoké el. a tep. vodivosti
* Val. e- jsou příčinou vysoké el. a tep. vodivosti
52
New cards
Koordinačně-kovalentní vazba (princip)
* Celý vazebný elektronový pár poskytuje jeden atom - DONOR
* Druhý poskytuje volný orbital - AKCEPTOR
* Druhý poskytuje volný orbital - AKCEPTOR
53
New cards
Jaké (slabší) vazebné síly existují kromě pevných vazeb?
Vodíkové vazby, Van der Waalsovy síly
54
New cards
Vodíkové vazby (princip)
* Tvoří se tam, kde je atom vodíku v polární vazbě (s prvkem s vyšší elektroneg.) a je přitahován k negativní části druhé molekuly
* Př: H2O
* Př: H2O
55
New cards
Van der Waalsovy síly (princip)
* Jsou to slabé interakce nacházející se mezi všemi atomy a molekulami
* Umožňují zkapalňování vzácných plynů
* Umožňují zkapalňování vzácných plynů
56
New cards
Co jsou nasycené a nenasycené sloučeniny?
* Nasycené jsou sloučeniny s jednoduchými vazbami, Př: etan
* Nenasycené jsou s násobnými vazbami, Př: eten
* Nenasycené jsou s násobnými vazbami, Př: eten
57
New cards
Rozdělení nenasycených sloučenin dle polohy násobné vazby
* Izolované -C=C-C-C=C-
* Konjugované -C=C-C=C-
* Kumulované -C=C=C-C=C-
* Konjugované -C=C-C=C-
* Kumulované -C=C=C-C=C-
58
New cards
Rozdělení dle místa
* Lokalizované - methan
* Delokalizované - benzen (není přesně známá lokace vazby)
* Delokalizované - benzen (není přesně známá lokace vazby)
59
New cards
Jak mohou vzniknout chem. vazby? (+příklad)
* Má-li každý z prvků po 1 nespárovaném elektronu,
Př: koligace (interakce 2 radikálů)
* Má-li jeden z prvků volný orbital a jeden celý e- pár,
Př: koordinace (interakce mezi ionty)
Př: koligace (interakce 2 radikálů)
* Má-li jeden z prvků volný orbital a jeden celý e- pár,
Př: koordinace (interakce mezi ionty)
60
New cards
Jak mohou zanikat vazby? (+příklad)
* Nepolární - každý prvek získá 1 e-
Př: homolýza (vznik radikálů)
* Polární - jeden prvek má celý e- pár i záporný náboj, druhý ztratí e- (→ kladný náboj)
Př: heterolýza (vznik iontů)
Př: homolýza (vznik radikálů)
* Polární - jeden prvek má celý e- pár i záporný náboj, druhý ztratí e- (→ kladný náboj)
Př: heterolýza (vznik iontů)
61
New cards
4 typy reakcí v organické chemii
Substituce, adice, eliminace, přesmyk
62
New cards
Substituce
= záměna
CH4 + Cl2 → CH3Cl + HCl
CH4 + Cl2 → CH3Cl + HCl
63
New cards
Adice
= připojení, zvyšování nasycenosti
C2H4 + Br2 → C2H4Br2 + H2
C2H4 + Br2 → C2H4Br2 + H2
64
New cards
Eliminace
= odštěpování, snižování nasycenosti
C2H4Br2 + 2Na - 2NaBr → C2H4
C2H4Br2 + 2Na - 2NaBr → C2H4
65
New cards
Přesmyk
= přeskupení vazeb v rámci 1 molekuly
C2H3OH (ethol) → C2H4O (keto forma)
C2H3OH (ethol) → C2H4O (keto forma)
66
New cards
Názvy látek v chemických reakcích
Reaktanty, produkty, substrát, reagent
67
New cards
Vysvětli význam reaktantů, produktů, substrátu a reagentu
* Reaktanty → produkty
* Substrát - výchozí látka podléhající změnám
* Reagent (činidlo) - výchozí látka reagující se substráty
* Substrát - výchozí látka podléhající změnám
* Reagent (činidlo) - výchozí látka reagující se substráty
68
New cards
Typy činidel
* Radikál - částice s nespárovaným e-
* Ion - anion/kation
* Ion - anion/kation
69
New cards
Anion
* Částice disponující e-
* Vyhledává v substrátu místo s nejmenší e- hustotou
* Nukleofil (Nu-)
* Vyhledává v substrátu místo s nejmenší e- hustotou
* Nukleofil (Nu-)
70
New cards
Kation
* Částice s nedostatkem e-
* Vyhledává v substrátu místo s největší e- hustotou
* Elektrofil (E+)
* Vyhledává v substrátu místo s největší e- hustotou
* Elektrofil (E+)
71
New cards
Rozdělení reakcí podle činidla a reagujících látek
* Elektrofilní
* Nukleofilní
* Radikálová
* Nukleofilní
* Radikálová
72
New cards
Rozdělení reakcí podle způsobu štěpení
* Heterolýza - rozpad na kationt (charakter E+) a aniont (Nu-)
* Homolýza - vznik radikálů, reakce zlomku vteřiny
* Homolýza - vznik radikálů, reakce zlomku vteřiny
73
New cards
Rozdělení reakcí podle reagujících částic
* Iontové
* Radikálové
* Radikálové
74
New cards
Zvláštní typy chemických reakcí (9)
* Hydrogenace - dehydrogenace
* Hydratace - dehydratace
* Halogenace
* Nitrace
* Sulfonace
* Oxidace - redukce
* Hydratace - dehydratace
* Halogenace
* Nitrace
* Sulfonace
* Oxidace - redukce
75
New cards
Hydrogenace a dehydrogenace
* Hydrogenace = reakce s vodíkem
* Dehydrogenace = odštěpení vodíku
eten + 2H → etan
* Dehydrogenace = odštěpení vodíku
eten + 2H → etan
76
New cards
Hydratace a dehydratace
* Hydratace = reakce s vodou
* Dehydratace = odštěpení vody
* Dehydratace = odštěpení vody
77
New cards
Halogenace, nitrace a sulfonace
* Halogenace = bromace, chlorace,…
* Nitrace = reakce s kationtem NO2+
* Sulfonace = reakce s kys. sírovou
* Nitrace = reakce s kationtem NO2+
* Sulfonace = reakce s kys. sírovou
78
New cards
Oxidace a redukce
* Oxidace = zvyšování nasycenosti, dehydrogenace
* Redukce = snižování nasycenosti, hydrogenace etylenu
* Redukce = snižování nasycenosti, hydrogenace etylenu
79
New cards
Jaký je rozdíl mezi sumárním a strukturním vzorcem?
* Sumární - prvkové složení
* Strukturní - uspořádání prvků
* Strukturní - uspořádání prvků
80
New cards
Jaké sloučeniny jsou izomerní?
Takové, jejichž sumární vzorec se liší od vzorce strukturního
81
New cards
Typy izomerie
Konstituční
* Řetězová
* Polohová
* Skupinová
Prostorová
* Konformační
* Geometrická
* Optická
* Řetězová
* Polohová
* Skupinová
Prostorová
* Konformační
* Geometrická
* Optická
82
New cards
(K) Řetězové izomery
Liší se větvením řetězce

83
New cards
(K) Polohové izomery
Liší se polohou funkční skupiny (skupina atomů, která molekule přidává charakteristické vlastnosti)

84
New cards
(K) Skupinové izomery
Liší se typem obsažené funkční skupiny

85
New cards
(K) Tautomerie
Liší se druhem a polohou dvojné vazby a umístěním protonu/H
* Př: enol forma a keto forma
* Př: enol forma a keto forma

86
New cards
(P) Konformační izomery
Liší se uspořádáním v prostoru, atomy se mohou překrývat
* Př: zákrytová a nezákrytová
* Židličková a vaničková
* Př: zákrytová a nezákrytová
* Židličková a vaničková
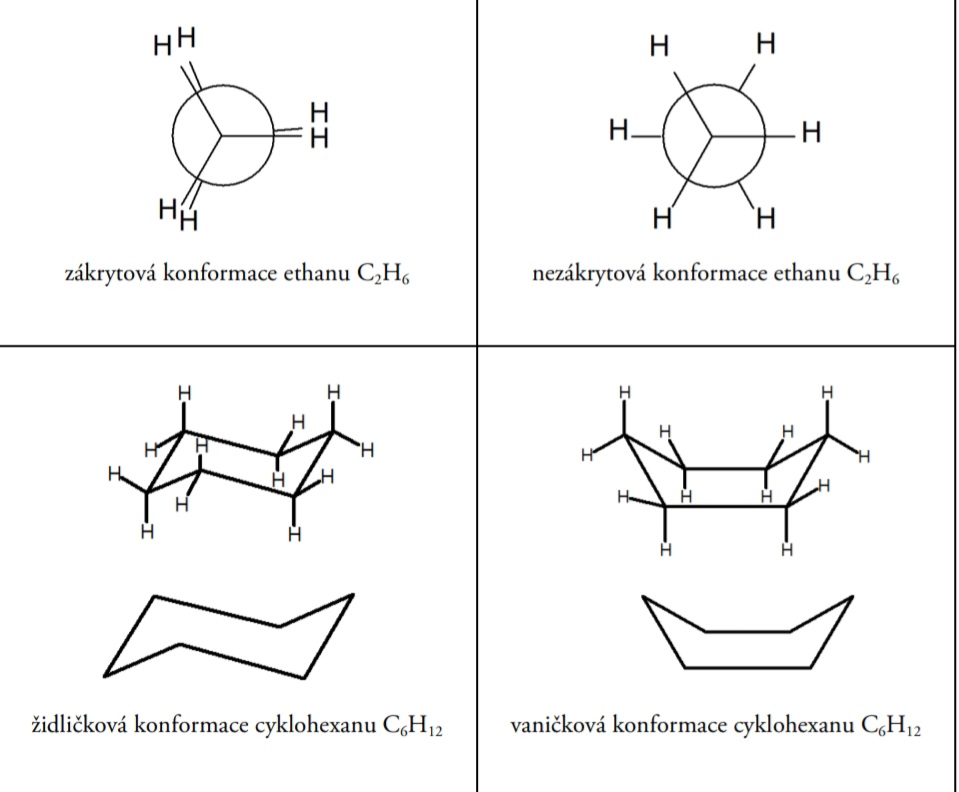
87
New cards
(P) Geometrické izomery
Liší se umístěním funkčních skupin vůči rovině určené násobnou vazbou
* E (trans), Z (cis)
* (E = židlička, Z = vanička)
* E (trans), Z (cis)
* (E = židlička, Z = vanička)

88
New cards
Kdy se používá cis/trans a kdy Z/E?
* Cis/trans - stejné substituenty
* Z/E - různé substituenty
* Z/E - různé substituenty
89
New cards
(P) Optické izomery
= enantiomery
Molekuly jsou svými zrcadlovými obrazy
Rozdělení na:
* Levotočivé (+) R
* Pravotočivé (-) S
Molekuly jsou svými zrcadlovými obrazy
Rozdělení na:
* Levotočivé (+) R
* Pravotočivé (-) S
90
New cards
Racemát (racemická směs)
Směs 2 enantiomerů v poměru 1:1
91
New cards
Polarita chem. vazby
* Způsobena nerovnoměrným rozložením e- hustoty v molekule
* Rozložení:
Symetrické
Nesymetrické
* Rozložení:
Symetrické
Nesymetrické
92
New cards
Symetrické rozložení e- hustoty
* Mezi stejnými atomy → nepolární vazby
93
New cards
Nesymetrické rozložení e- hustoty
* Polární
* Vazba atomů o různé elektronegativitě → vznik částečného náboje (delta)
* Molekuly tak mají povahu dipólu
* Vazba atomů o různé elektronegativitě → vznik částečného náboje (delta)
* Molekuly tak mají povahu dipólu
94
New cards
Příklad dvouatomových molekul s polárními a nepolárními vazbami
* Polární - HCl, HBr, HF
* Nepolární - H2, N2, Cl2
* Nepolární - H2, N2, Cl2
95
New cards
Příklad polyatomových molekul s polárními a nepolárními vazbami
Nepolární - P4, S8
Polární:
* nepolární - stejně velké dipólmomenty → ruší se (CF4, CCl4, CH4)
* polární - dipólmomenty nejsou stejně velké (CH3Cl, NH3)
Polární:
* nepolární - stejně velké dipólmomenty → ruší se (CF4, CCl4, CH4)
* polární - dipólmomenty nejsou stejně velké (CH3Cl, NH3)
96
New cards
Polarizovatelnost vazby
* Schopnost vazby být polarizovaná
* Lépe se polarizují vazby sigma než π
* Ovlivňuje reaktivitu molekul
* Lépe se polarizují vazby sigma než π
* Ovlivňuje reaktivitu molekul
97
New cards
Co je indukční efekt?
Posuny e- vyvolané přítomností polární vazby (týká se vazeb sigma)
98
New cards
Kladný indukční efekt +I
* Vyvolávají atomy nebo skupiny atomů, které přitahují vazebné e- slaběji než H
* Uplatňuje se přítomností elektropozitivního prvku
* Uplatňuje se přítomností elektropozitivního prvku
99
New cards
Záporný indukční efekt -I
* Vyvolávají atomy nebo sk. atomů, které přitahují vazebné e-silněji než H
* Uplatňuje se přítomností elektronegativního prvku
* Uplatňuje se přítomností elektronegativního prvku