Enzymer og kofaktorer - fra forelesning
1/14
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
15 Terms
Hva avgjør reaksjonshastigheten?
enzymkonsentrasjonen
substratkonsentrasjon (hastighet flater ut på et bestemt nivå)
temperatur
pH
hemmere
På hvilke måter kan enzymer reguleres?
Allosterisk regulering
Kovalent modifikasjon
Enzymsyntese (genuttrykk)
Hvordan fungerer alloaterisk regulering?
Enzymer som er allosterisk regulert har et aktivt sete og et eget regulatorisk subenhet; et allosterisk sete.
Det aktive setet er for å kombinere to stoffer, for å danne et produkt.
Det allosteriske setet er laget for et annet modulatormolekyl /effektor, som gjør om på strukturen til det aktive setet/endrer affiniteten - slik at det fungerer enten dårligere eller bedre enn utgangspunktet.
hemmer eller aktiverer enzymet

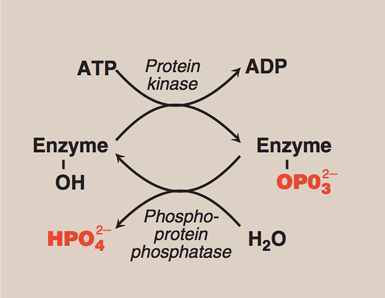
Hvordan fungerer kovalent modifikasjon?
Protein fosforylering/defosforylering
Aktiverer eller hemmer enzymet, kommer an på enzymet
Fosforylering
Kinaser fester på fosfatgrupper (PO4-) på serine, treonin eller tyrosin
Defosforylering
Fosfataser fjerner fosfatgrupper
Fortell litt om inhibitorer
substans som fester seg til enzymet og reduserer reaksjonshastigheten, kan deles i 2 deler:
konkurrerende inhibitorer (fester seg i samme aktive sete som det oprinnelige substratet skal feste seg til)
Ikke-konkurrerende inhibitorer (fester seg et annet sted på enzymet enn det aktive setet, endrer fasongen til det aktive setet) (allosterisk)
Hva er kofaktorer? Har du noen eksempler?
Ikke-protein del nødvendig for optimal aktivitet eller funksjonalitet
fasiliterer overføring av elektroner ( eller kjemiske grupper) når bindinger dannes eller brytes
Eksempler på kofaktor:
Koenzymene NAD+, FAD, coenzym A
