1er Parcial Biologia Celular PASO A PASO
1/155
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
156 Terms
Que es la célula? Cómo se diferencian?
Menor cantidad de materia considerada con vida
Función estructural en el ser vivo
Se diferencian por:
Tamaño y forma
Función (especialización)
Estrctura
Forma de vida (requerimientos químicos)
Teoría celular
Todos los seres vivos estamos formados por una o más células que son la unidad estructural y funcional
Todas las células contiene la información genética necesaria para poder cumplir su función
Todas las células proviene de una preexistente
Niveles de organización de la materia
Subatomico (protones, neutrones, electrones)
Atómico (componentes de la tabla periódica)
Molecula (H2O, CO2, C₆H₁₂O₆ )
Macromolécula (proteínas, lípidos, glúcidos, ácidos nucleicos)
Macromoléculas complejas/subcelular (virus, organelas -mitocondria, ribosomas-)
Célula
Tisular (tejido nervioso, tejido muscular)
Órganos (corazón, piel, páncreas)
Sistemas/aparatos (sistema respiratorio, sistema cardiovascular)
Individuo
Población/comunidad
Ecosistema
Biosfera
Que son las propiedades emergentes?
Propiedades nuevas que aparecen cuando los componentes se organizan en un nivel superior de materia
Características de los seres vivos
Crecen (tamaño y cantidad de células) y se desarrollan (mayor especialización en funciones)
Metabolismo específico
Tienen que estar formados por células
Alto nivel de organización
Sistema abierto
Se reproducen
Homeostasis (mantener el medio interno constante)
Irritabilidad (contestar frente a estímulos físicos o químicos)
Evolucionan - adaptación al ambiente
Químicamente están compuestos similarmente (C, H, N, ,O)
Tienen componentes inorganicos (Agua, sales, minerales)
Z
Número atómico
Cantidad de protones
Uniones químicas
Solo participan los electrones de la última capa para completar el octeto y ser estables
Dan origen a compuestos
Dos tipos: enlace ionico y enlace covalente
Electronegatividad
Capacidad de un átomo de atraer a sí mismo electrones de otro átomo menos electronegativo que el, formando un enlace químico
Que es el enlace ionico?
Un átomo le cede electrones a otro átomo más electronegativo
Uno queda con carga + y el otro con carga -. Lo que produce una atracción que los mantiene unidos
Entre átomos con electronegatividades muy distintas entre sí
Que es el enlace covalente?
2 átomos que comparten electrones de la última capa
Entre electronegatividades altas y similares
Enlace más fuerte en un medio acuoso
Característico de C, H, N, O -96% del ser vivo, S, P.
Hay dos tipos:
Asimétrica = Polar = la nube electronegativa no queda en el medio, se atraen con distinta intensidad
Simétrica = No Polar = la nube electronegativa queda en el medio, se atraen con la misma intensidad
¿Cómo se mide la fuerza de un enlace?
Con la cantidad de fuerza que se necesita para romperlo
Orden de la fuerza de los enlaces químicos en medios acuosos
Enlace covalente
Enlace ionico (atracciones electroestáticas)
Enlaces NO covalentes (puente de hidrógeno, fuerzas de Van Der Waals)
¿Cuál es el principal solvente en la celular?
Agua
Moléculas hidrofilicas
Interactúan bien con el agua, se disuelven rápidamente en esta
Polares
Asimétricas
Ej; alcohol, iones, azucar
Moléculas hidrofóbicas
Poco solubles en agua
Simétricas
No polares
No pueden formar enlaces de hidrógeno
Moléculas anfipaticas
Tiene una parte hidrofilica y una parte hidrofóbica
¿Que son los ácidos?
Sustancias que cuando se disuelven en agua pierden protones de hidrógeno
Quedan en negativo y H3O en el medio
pH < 7
¿Que son las bases?
Cuando una sustancia gana protones de hidrógeno.
El medio queda como hidroxilo (-OH) Y la sustancia en positivo
pH>7
¿Que son los buffers/amortiguadores?
Buscan mantener la homeostasis del pH en el cuerpo
En ácidos captura H+ y en bases libera H+
Hidrocarburos
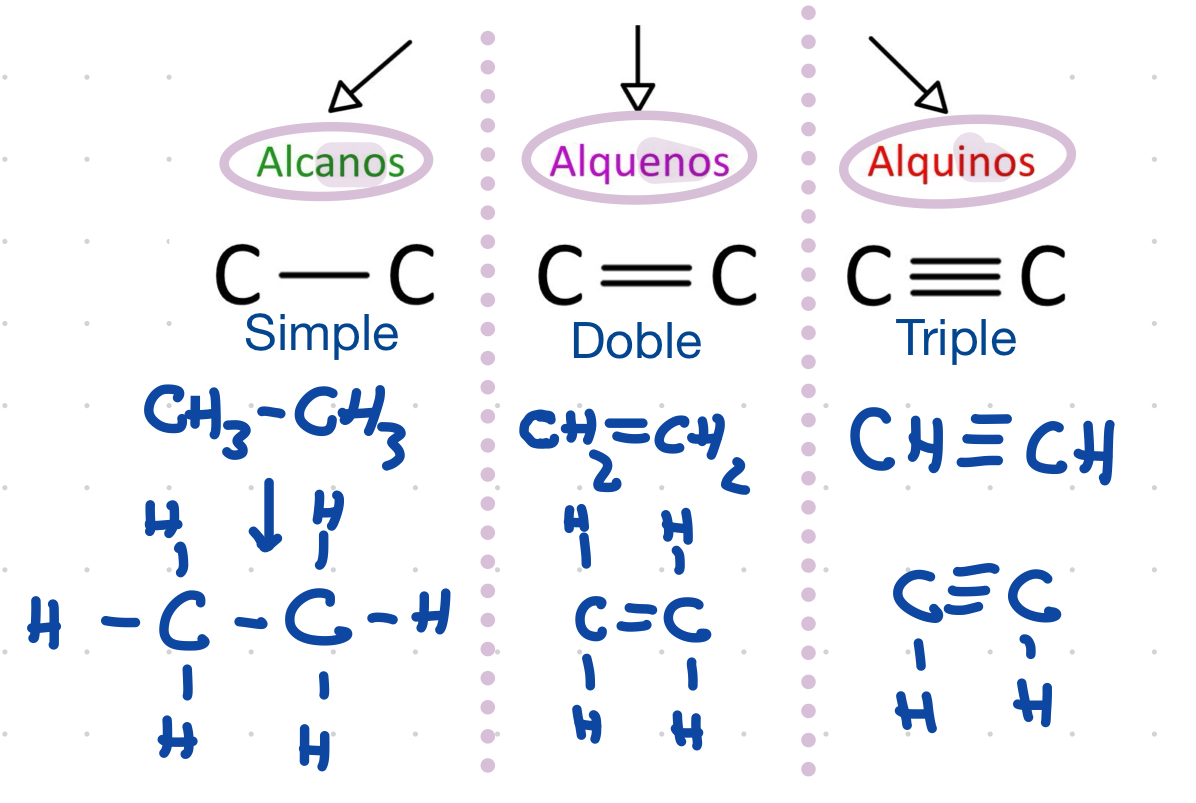
Hidroxilo
-OH
-COOH
C-OH
||
O
Carboxilo
Alcoholes
C-OH
Cetonas
C
|
C=O
|
C
Aldehido
C=O
|
H
Carbonilo
C=O
Éteres
Oxigenos
C-O-C
Ester
C=O
|
O
Amino
NH2
Aminas
C-NH2
Amidas
C=O
|
NH2
Grupo Sulfhidirico
C-SH
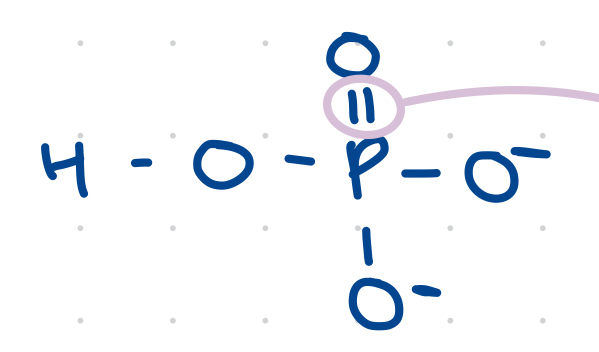
Grupo Fosfato
PO4H3
Biomoleculas orgánicas
Lípidos, glúcidos, proteínas y ácidos nucleicos
Conformados por un esqueleto de carbono y hidrógeno
Macromoléculas
¿Que son los monomeros?
Estructura más pequeña que a través de enlaces de condensación forma macromoléculas/polimeros
Monomero de las proteínas
Aminoácidos
Monomero de los glúcidos
Monosacaridos
Monomero de los ácidos nucleicos
Nucleotidos
Monomero de los lípidos
No hay uno específico porque son muy heterogéneas. Algunos tienen ácidos grasos (cadenas hidrocarbonadas), otros isopremo, entre otros
¿Qué es el enlace de condensación?
Se unen dos monomeros liberando una molécula de agua.
Tipos:
Enlace alfa/beta glucosidico —> entre monosacaridos
Enlace tipo Ester —> Alchol (cabeza hidroxilo) y Ácido graso (lípidos)
Enlace peptidico/amina —> entre la terminal-C y terminal-N (proteínas)
Enlace fosfoanhidro —> entre Ps (ácido nucleico)
Enlace N-glucosidico —> base nitrogenada y glúcidos (azúcar 5pentosa) (ácido nucleico)
Enlace fosfoester —> entre glúcidos y fosfatos (forma ácidos nucleicos)
**Fosfodiester en ARN y ADN
Que es la hidrolisis?
Inverso de la condensación
Se adquiere una molécula de agua para separar dos monomeros
Características y Funciones de los glúcidos
Principal fuente de energía rápida (monosacaridos y discaridos)
Soporte mecánico/estructural (oligosacaridos y polisacaridos)
Hidrofilicas
(CH2O)n —> forman distintas estructuras cambiando la orientacion de determinados grupos = isomero optico (-oh a la izquierda =L | -oh a la derecha =D
Monosacaridos: ejemplos y clasificación
Ejemplos: glucosa, galactosa, fructosa, manosa, ribosa, desoxirribosa
2 clasificaciones:
Grupo funcional: (en la cabeza, que le da al característica)
Aldehidos = COOH
Cetona + COO
Numero de carbonos en la cola
Triosa = 3C
Tetrosa = 4C
Pentosa = 5C
Hexosa = 6C
Disacaridos
Monosacarido + monosacaridos (enlace glucosidico)
Ejemplos:
Maltosa = glucosa + glucosa (a1-4)
Lactosa (azucar de leche) = glucosa + galactosa (b1-4)
Sacarosa (azucar de mesa) = glucosa + fructosa (a1-2)
Celobiosa (b1-4)
Hizomaltosa
Oligosacaridos
3-10 monosacaridos
Protección de la membrana celular y reconocimiento celular. Ejemplo; grupos sanguíneos
Ejemplos: glicolipidos, glicoproteinas
Polisacaridos
10+ monosacaridos
Protección de la membrana celular y reconocimiento celular
Ejemplos: (todos homo polisacaridos de glucosa)
Almidón = reserva energética en vegetales
Celulosa = función estructural en vegetales
Quitina = función estructural en insectos y homos
Glucógeno = reserva energética en animales (a1-4 / a1-6)
¿Cómo funciona el enlace glucosidico?
Alfa/beta 1-4 (el carbono del primer monosacárido y el carbono al Que se une en el segundo monosacárido)
Alfa = oh abajo
Beta = oh arriba
Carbono anomerico = dónde está el grupo función
Funciones, características y ejemplos de lípidos
Funciones:
Reserva energética
Integrar moléculas de mayor tamaño
Aislante térmico
Transporte y absorción de vitaminas liposolubles (A, D, E, K)
Protección
Precursores de hormonas
Características:
Anifapticas
Heterogéneas
Ejemplos: glucolipidos, glicéridos, fosfolipidos, esfingolipidos
Clasificación de los lípidos
Cantidad de carbonos que tiene la cola (hidrocarbonada + hidrofobica)
Corta = 4-6
Media = 6-12
Larga = 13-21
Muy larga = 21+
Grado de saturación:
Saturados:
Enlaces simple
Cadenas largas
Temperatura de fusion alta
Salidos
Animales
Insaturados
1/+ enlaces dobles (monosaturados/polisaturados)
Cadena corta
Temperatura de fusion baja
Líquido
Vegetal
Glicéridos
Lípidos
Reserva energética en sus colas hidrocarbonadas (rompen el enlace cuando necesitan energía)
Hidrofobicos
En solido grasa y en liquido aceite
Monoglicéridos, Digliceridos, Triglicéridos
Fosfolipidos
Lípidos
Función estructural, proteger a la membrana
Anfipaticos:
Cabeza hidrofilicas = carboxilo + glicerol + fosfato
Cola hidrofobica = ácidos grasos
Forman:
Micelas (para encerrar moléculas liposolubles y transportarlas)
Bicapa lipidica
Liposomas
Glucolipidos
Lipidos + glúcido
Caracterización celular/estructural
Cerebrocidos = Ceramida (a.g. + esfingol) + monosacarido
Gangliosidos = Ceramida (a.g. + esfingol) + polisacarido
Esteroides y esteroles
Tienen ISOPREMO
Precursores de hormonas sexuales
Estructura ciclopentano perhidrofenantreno = hidroxilo + ABCD + cadena hidrocarbonada
Esteroides = precursores de hormonas sexuales
Esteroles = precursores de vitaminas liposolubles y colesterol
Características y funciones de las proteínas
Muy específico, un cambio puede modificar su forma tridimensional y anular su función
Estructura y función correlacionadas
Funciones:
Especiales (propósitos especiales)
Señal (mensajeras)
Transcripción (unirse al ADN y activar o desactivar genes)
Estructurales
Motoras (generar movimiento en células y tejidos)
Almacenamiento (aminoácidos o iones)
Receptores (detectar señales y transmitirlas)
Transporte (moléculas o iones)
Enzimas (catalizadores)
Aminoácidos estructura y características
Estructura: direccionalidad definida y polaridad estructural
Terminal N = grupo amino
Terminal C = carboxilo
Se unen en un enlace fuerte, rígido y con rotación
Características:
Isomero óptico L
Anfoteras (la terminal N es básica y la terminal C es ácida)
El carbón asimétrico guia el plegamiento
Anfoteras
Pueden actuar cómo ácidos o bases, depende del ph del medio en el que están
Enlaces en proteínas
Covalentes: unir aminoácidos
enlace peptidico/amino. Forman:
Cadena oligopeptidica = 2-10 aa
Cadena polipeptidica = 11-50 a
Proteína = 50+
No covalentes: DE A MUCHOS (restringen el movimiento de la proteínas determinando su forma)
Puentes de hidrógeno
Van der Waals
Atracción electroestática
Fuerzas hidrofobicas
¿Qué es la secuencia de aminoácidos?
Cada proteína tiene un orden único de aminoácidos que es idéntico entre las que son de ese tipo
Estructura primaria (proteínas)
Tipos y secuencia de aminoácidos unidos por enlaces peptidicos
No es una proteína
No tiene plegamienfo
Estructura secundaria (proteínas)
Conformación espacial, plegamientos. Interaccion de los aa de una misma cadena:
Hélice Alfa
Forma espiral, eje longitudinal
Puentes de hidrógeno entre aa1 y aa4
3,6 a la vuelta
En proteínas de transmembrana
Dextrogiro o Levogiro
Hojas/lamina/plegada Beta
Puenfes de hidrógeno paralelos (débil) o antiparalelos (fuerte)
Muy rígido
Forman las bases de las estructuras amiloides
Estructura terciaria (proteínas)
Estructura plegada final o organización tridimensional
Interacción de los grupos R de una misma cadena a través de enlaces no covalentes
ADQUIERE FUNCIÓN BIOLÓGICA = Podemos llamar proteína
Se pliegan de forma que minimiza. La energía libre = liberando calor y aumentando el desorden en el universo
Se dividen en 2:
Proteínas fibrosas:
Estructura alargada
Hidrofobas (miran hacia adentro)
Funciones estructurales (queratina, elastina, filamentos intermedios del citoesqueleto)
Proteínas globulares:
Estructura esférica compacta
Hidrofilicas (miran al medio acuoso)
Muchas funciones
Dominio proteico
Otra forma de organización = subunidades
Cada subunidad (dominio A, B, C, etc) es estable, estructurada (tridimensional) & con una funcionalidad específica. Mantienen todos si se sepa
Forman una secuencia intrínsecamente desordenada = nuevas funciones y desordenadas
Los dominios tienen SITIOS DE UNIÓN = cavidad en la superficie de una proteína donde se unen ligados específicos mediante enlaces no covalentes débiles o enlaces S-S
Que es la desnaturalización de la proteína?
Se pierden todas las estructuras menos la 1* al perder las interacciones no covalentes
Se pierde la función biológica
Por cambio de condiciones
De manera reversible:
Temperatura
pH
Fuerza mecánica
De manera Irreversible:
Hidrolisis, se pierde la estructura 1* por incorporación de agua
Que es la renaturalizacion de proteinas?
En condiciones apropiadas se elimina el solvente y la proteina se vuelve a plegar adiquierendo su forma original y recuperando su función biológica
Que son las proteínas chaperones?
Ayudan a que el proceso de plegamineto sea mas eficiente y fiable
Se unen a ATP para tener energía
Pueden:
Guiar el plegamineto
Actuar como cámaras de aislamiento
Estructura cuaternaria (proteinas). Características - Clasificación - Formas
Complejos proteicos = cadenas polipeptidicas unidas por:
Enlaces no covalente
Puente disulfuro (covalente)
No es obligatorio, se juntan de a mas para adquirir funciones nuevas
Sitio de unión de una es complementaria de la otra
Clasificación:
Tipos de subunidades:
Homo… (todo proteina)
Hetero… (tienen un grupo prostetico) Ej; hemoglobina
Cant de subunidades
Dimero
Trimeros
Tetramero
Polímeros 5+
Formas:
Filamentos (larga y lineal)
Anillo (circular cerrada)
Cáscara esférica (esfera hueca que encierra al virus)
Tubo hueco (cilindro hueco)
Colageno
Triple hélice (espiral)
De Tropocolageno
Proteína fibrosa
Contragiro = rígido, resistente y estable
Interior hidrofóbico, exterior hidrofilico
20 grupos R = aminoácidos
Fenalinina
Histidina
Isoleucina
Leucina
Lisina
Metionina
Treonina
Triptofano
Valina
ESENCIALES
Ácido Aspartico
Ácido Glutamico
Alanina
Arginina
Asparagina
Cisteina
Glucina
Glutamina
Prolina
Serina
Tirosina
Estructuras amiloides
Formadas por priones
Plegamineto incorrecto de las proteinas
Dana a células o tejidos y contribuye a trastornos degenerativos (ej; Alzheimer)
La forma prionica se puede convertir en la correcta y reproducirse
Son infecciosos (sangre, alimentos, instrumentos quirúrgicos)
Funciones y Estructura de los nucleotidos
Funciones:
Transportador de energía a corto plazo
Coenzimas
Almacenamiento y recuperacion de informacion genetica
Estructura:
Base nitrogenada:
Pirimidinas (anillo 6 átomos)
Citosina
Uracilo (ARN)
Timina (ADN)
Purinas (anillo pirimidico de 6 + 5 átomos)
Adenina
Guanina
Azúcar 5pentosa:
Ribosa (ribonucleotidos)
Desoxirribosa (desoxirribonucleotidos)
Grupo fosfato (P)
Monosusfato (MP)
Difosfato (DP)
Trifosfato (TP)
ADN
Timina
Bicateriana = doble hélice antiparalela (tiene estructura 2* porque sus bases son
Complementariedad de bases: 3’ - 5’ | 5’ - 3’
Adenina - Timina (2 p.H)
Guanina - Citocina (3 p.H)
Desoxirribosa
Almacena información codificada
(Histidina)
ARN
Uracilo
Ribosa
Monocatenario
Regula la expresión genética y participa en el proceso de expresión y síntesis de proteínas
3 tipos
ARNm (mensaje) = transporte
ARNt (transferencia) = traductor del código genético al idioma de los aminoácidos
ARNr (ribosomico) = estructural
Que es el nucleosido?
Base nitrogenada + azucar pentosa
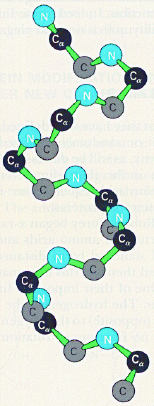
Modelo esqueleto
Para comparar átomos
Estructura global se ven los enlaces
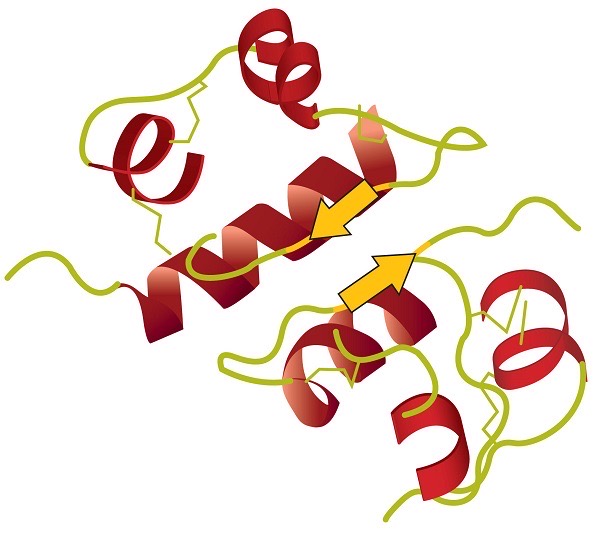
Modelo de cintas
Muestra el plegamiento (estructura secundaria)
Modelo de alambres
Para ver estructuras grandes
La forma general de la molécula
Modelo espacial
Forma tridimensional
Contorno de la superficie
Que es y para que sirve la red compleja de reacciones interconectadas?
Las células deben hacer interminables reacciones químicas para:
Mantener su estructura
Satisfacer sus necesidades metabólicas
Evitar el deterioro químico
Difusión
Conserva energía total = libera energía calórica cuando hay un movimiento
Movimiento constante de forma aleatoria
Leyes de la Bioenergetica
La energía no se crea ni se destruye, se transforma
Todo proceso que ocurre en el medio interno genera entropia, tiende al desorden
La célula es un sistema abierto que genera desorden en el universo
Entropia
Energia desordenada = calor = energía libre/util. Se usa para hacer trabajos
Todo tiende al desorden en el entorno tras cambios en el sistema
△G = Mide el desorden que se genera en el entorno en consecuencia de una reacción
△G- = el desorden tiene a aumentar = reaccion química espontánea y estrecha. Exergonica, liberan energía, favorable
△G+ = el desorden tiende a disminuir. Endergonica, necesita energía. Desfavorable
△G0 = equilibrio, no hay trabajos
Quienes son los intermediarios energéticos? Cómo lo hacen?
ATP
GTP
A través del metabolismo (reacciones bioquímicas que ocurren en una célula para producir energía). Ocurren en simultaneo. OXIREDUCCION
Catabolismo
Ruptura de una macromolécula = se libre energía y una molecula de baja energía
Oxidación (cede e-)
Reacción exergonica
Liberan energía, favorable (un poco se usa para el anabolismo, y el resto para la funcion requerida)
Hay enzimas especificas
Anabolismo
Sintetizan macromoléculas
Reducción = hidrogenizacion = toma e-
Reacciones endergonicas
Desfavorable
Necesitan energía que toman del acoplamiento (como ocurren en simultáneas las dos, una impulsa a la otra)
Energía de activación
Energía necesaria para superar la barrera energética y que ocurra la reaccion
Las enzimas catalizadores ayudan a los dos sustratos a bajar la E.A y que la reaccion ocurra rápidamente
Ciclo de ATP: funcion y proceso
Energía para:
Reacciones moleculares
Contracción muscular
Transporte
Metabolismo
Cómo funciona:
ATP lleno de energía en sus enlaces
Catabolismo, hidrolisis, desfosforilacion se libera un P = energía (para el anabolismo y funciones del cuerpo)
ADP + Pi = fosforilacion, anabolismo. Enlace de condensación y se vuelve a forma ATP
¿Qué son las enzimas?
Catalizadores biológicos (aceleran reacciones químicas)
Disminuyen la energía de activación
Específicos y re utilizables
Sitio activo (donde se une un sustrato específico y lo modifican)
Vía relacionada
Se repiten muchas veces proceso hasta llegar al producto final que estamos buscando
¿Que es la cinética enzimatica?
Medir la velocidad de una reacción química (actividad de una enzima) = producto generado/cantidad de tiempo
Mayor sustrato = mayor velocidad
Se llega a la velocidad maxima de reaccion cuando las enzimas están saturadas, para revertirlo aumento las enzimas
Medir la afinidad enzima sustrato = Km
Depende de las condiciones del ambiente
Km mayor = menor afinidad
Km menor = mayor afinidad (fuerte y estrecha)
¿Que afecta la actividad enzimatica?
pH
Temperatura
Actividad mecánica
Uniones covalentes
Fosforilacion y desfosforilacion
Controlar la vía metabólica por un cambio conformacional (se agregan o sacan gruposP)
Reversible
Rápido y continuo
Fosforilacion:
Proteína cinasa
Agrega grupoP a (serina, treonina, tirosina)
Transferencia catalizada
Desfosforilacion:
Proteína fosfatasa
Quita grupoP
Estimula o inhibe
Algunas especificas y otras variadas
Grupo acetilos
Agregan un grupo acetilo a la lisina
Ubiquitina
Proteína que se una a una proteina que va a ser desintegrada
Ayuda a manetener el orden en la célula y acumulamiento de proteínas dañinas mal plegadas
Inhibidores
A sitio activo con inhibidor (no lo podemos controlar)
Competitivo
Hay un inhibidor que compite por el sitio de uniones con un sustrato
Km mayor = bajan la afinidad por el sustrato
Velocidad = constante
No competitivo
Tiene 1+ sitios de uniones, nadie compite
Km = constante
Velocidad = baja
El sustrato se une pero la reaccion esta bloqueada
Sitio de regulación (así regulan la actividad enzimatica) con enzimas alostericas
Inhibición por retroalimentación (negativa)
Una molecula producida en los pasos finales inhibe a una enzima de los pasos iniciales uniéndose al sitio regulador, así bajando la afinidad enzima-sustrato
Desencadena un cambio conformacional en la enzima
Activació por retroalimentación (positiva)
La molécula activadora se une a lsiti regulador y así mejora la forma del sitio activo, haciendo que el sustrato encaje mejor
Entre vías: un producto o intermediario de la vía metabólica, así haciendo que las rutas metabólicas trabajen en cadena, que la célula produzca cosas cuando realmente las necesita
Activa otra vía metabólica
Estimula una enzima de una etapa anterior de su propia via
Coenzimas “ayudantes” = facilitan la acción de la enzima y pueden unirse temporal o permanentemente a ellas. Ej: cofactor
¿Que son las enzimas alostericas?
1 cadena polipeptidica
Se le pueden unir otras proteinas ademas de sustratos
Sitio activo (sustrato)
Sitio regulador (ligando)
Cambia ligeramente la forma tridimensional de la enzima para regular su actividad
Se comunican para poder influenciarsea
¿Que es la apoenzima y en qué se transforma?
Enzima inactiva, al unirse a un cofactor se activa cambiando de nombre a holoenzima
Que son las proteinas de andamiaje?
Juntan enzimas o proteínas en un orden y lugar especifico para que se pasen señales mas rápido y sin errores
Son elásticas
Que son los zimogenos?
Apoenzimas
Cuando cambia la estructura de la proteina se activan
Se producen inactivas porque si estuvieran activas pueden dañar la célula o tejidos donde se producen
Que son los anticuerpos?
Proteinas producids en respuesta a una molécula extraña
Se unen e a una molécula diana (antígeno) específica y la inactivan o marcan para destruccion
Producidos por linfocitosB y celulasB
Tipos de enzimas
Hidrolasa = catalizan una reacción hidrolitica
Nucleasa = degrada ácidos nucleicos por hidrolisis
Proteasa = degrada las proteinas por hidrolisis
Ligasa = une dos moléculas
Isomerasa = cataliza el reordenamiento de enlaces dentro de una molécula
Polimerasa = cataliza reacciones de poliemerizacion (síntesis)
Cinasa = agregado de grupo P
Fosfatasa = elimina un grupo P
Oxidorreductasa = molécula oxidada
ATPasa = hidrolizándose el ATP
CÉLULAS PROCARIOTAS:
Estructura
Cant células
Organelas
Núcleo
ADN
Recubierta
Reproducción
Tipo
Formas
Características
DATOS EXTRA
Simple y pequeña
Unicelulares
No tienen organelas (solo ribosomas)
No tienen núcleo
ADN circular (una sola molécula)
Membrana plasmatica + pared celular (protección)
Fusión binaria (rápida)
Tipo:
Bacterias (viven en el suelo y causan enfermedades)
Arqueadas (viven en el suelo, causan enfermedades y ambientes hostiles)
Esférica - bicilformes - espiral
Características:
Anaerobios = viven sin oxigeno
Aeróbicos = necesitan oxigeno degradar alimentos y tener energía (de acá evolucionan las mitocondrias)
Fotosintéticos = sol a energía (de acá evolucionan las células vegetales)
Se reproducen y evolucionan rápidamente porque no tienen núcleo, unicelulares y fusion binaria —> por esto muy diversos
CÉLULAS EUCARIOTAS:
Estructura
Cant células
Organelas
Núcleo
ADN
Recubierta
Reproducción
Tipo
Grande y compleja
Pluricelulares o unicelulares (levadura)
Organelas: (por esto tiene una gran organización interna = compartimentacion).
Ribosomas
Lisosomas
Sistema endomembranas (retículo endoplasmatico + aparato de Golgi)
Vesículas
Claroplastos (solo vegetal)
Tienen núcleo
ADN lineal (1+ moléculas)
Membrana plasmatica (en vegetales + pared celular)
Meiosis y mitosis
Tipo:
Animal
Vegetal (pared celular + cloroplastos)
Celula eritrocitos
Única eucariota sin núcleo
¿Que estructuras hay en células eucariotas y procariotas?
Citosol = gel acuosos + permite el movimiento + disperso
Citoesqueleto = filamentos proteicos = le da soporte y forma a la célula + facilita la movilidad y transporte
Citoplasma = todo lo que está adentro de la membrana plasmatica
Características del virus
Parasito intracelulares obligatorio
Agente causante de enfermedades
No tiene vida
Son móviles para poder acceder a células e invadirlas
Tiene genoma (ARN o ADN)
Cúspide (cubierta de proteinas)
No se pueden replicar por si solos
¿Que es la lisis?
Muerte celular generada por la ruptura de la membrana plasmatica cuando el virus termino de infectar a su célula hospedadora y quiere salir para afuera a infectar nuevas células