CM4-CM5: Les enzymes, acteurs du métabolisme
1/23
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
24 Terms
🔹 Voies métaboliques Questions
Qu’est-ce qu’une voie métabolique et quels sont les différents types ?
Qu’est-ce qu’un carrefour métabolique ?

Qu’est-ce qu’une voie métabolique et quels sont les différents types ?
Suite de réactions enzymatiques transformant un substrat en produit.
Types :
Linéaires (ex : glycolyse).
Ramifiées (un intermédiaire vers plusieurs voies).
Cycliques (ex : cycle de Krebs).
Qu’est-ce qu’un carrefour métabolique ?
Métabolite reliant plusieurs voies.
Exemples : pyruvate, acétyl-CoA, glucose-6-phosphate.
Rôle : orienter les flux métaboliques selon les besoins (énergie ou biosynthèse)
Rappels sur les enzymes Questions
Qu’est-ce qu’une enzyme ? Un substrat ? Un produit ?
Qu’est-ce que le site actif d’une enzyme ?
Comment se fait la classification fonctionnelle des enzymes ? Les 7 classes d’enzymes ?
Quelles sont les deux étapes dans la réaction catalysée par une enzyme ?
Que représente l’acronyme Ea ?
Quels sont les deux types d’enzymes ?


Réponses
Qu’est-ce qu’une enzyme ? Un substrat ? Un produit ?
Une enzyme est un biocatalyseur (souvent protéique, parfois un ARN catalytique appelé ribozyme) qui accélère la vitesse des réactions chimiques sans être consommée.
Un substrat est la molécule initiale qui se fixe spécifiquement sur l’enzyme.
Un produit est la molécule obtenue après la transformation du substrat par l’enzyme.
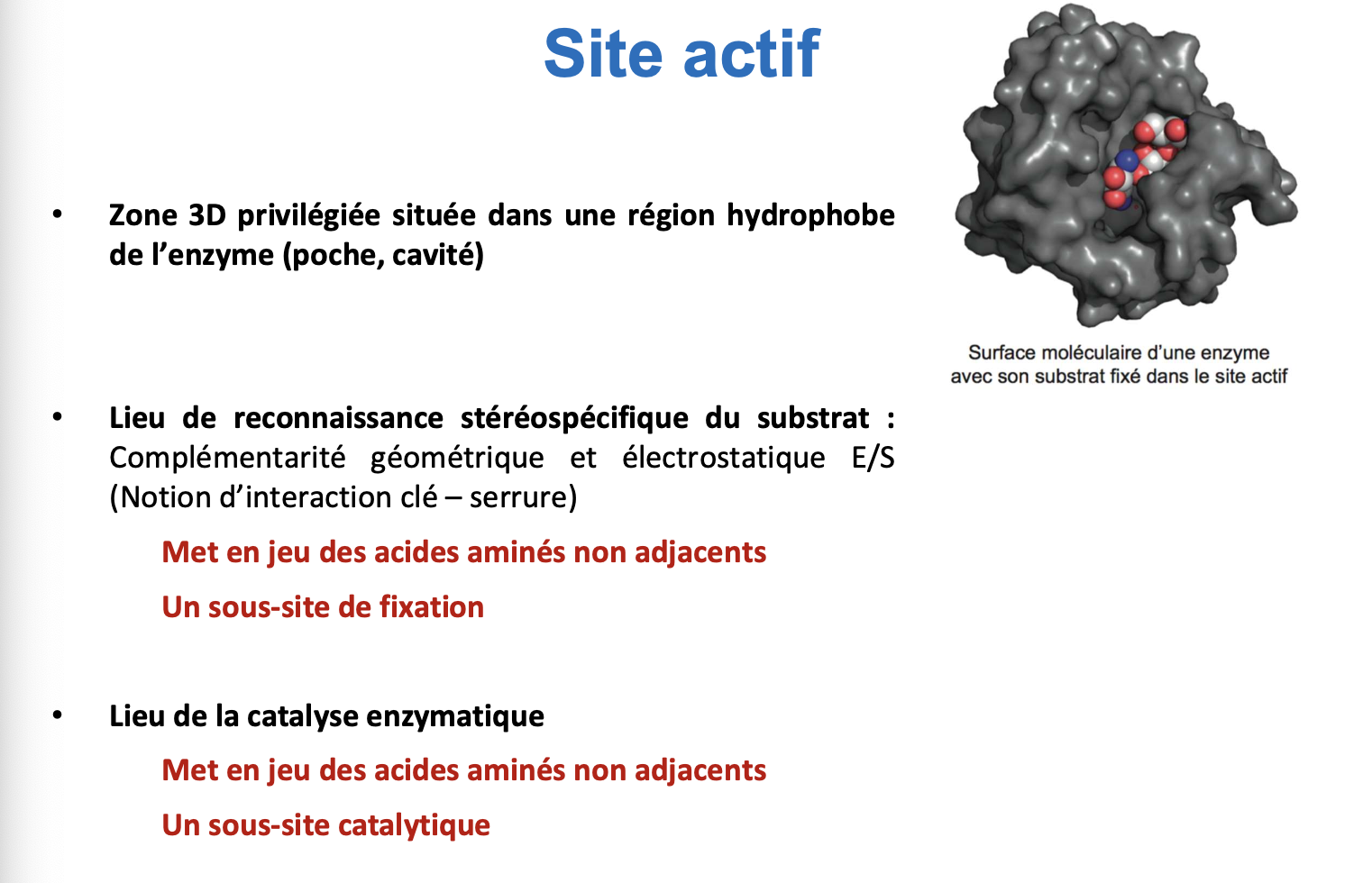
Qu’est-ce que le site actif d’une enzyme ?
C’est une région tridimensionnelle spécifique de l’enzyme, formée d’acides aminés clés rapprochés par le repliement.
Il comporte :
un site de fixation → reconnaît et lie le substrat avec spécificité,
un site catalytique → contient les résidus qui participent à la réaction.
Il assure la spécificité et permet la diminution de l’énergie d’activation (Ea).
Comment se fait la classification fonctionnelle des enzymes ? Les 7 classes d’enzymes ?
Les enzymes sont classées en 7 grandes catégories selon la réaction catalysée :Oxydoréductases → réactions d’oxydo-réduction (ex : déshydrogénases).
Transférases → transfert de groupements fonctionnels (ex : kinases).
Hydrolases → hydrolyse de liaisons (ex : protéases, lipases).
Lyases → ajout ou élimination de groupements sans hydrolyse (ex : décarboxylases).
Isomérases → réarrangements intramoléculaires (ex : racémases).
Ligases → formation de liaisons covalentes avec consommation d’ATP (ex : ADN ligase).
Translocases → catalysent le transport de molécules ou d’ions à travers une membrane.
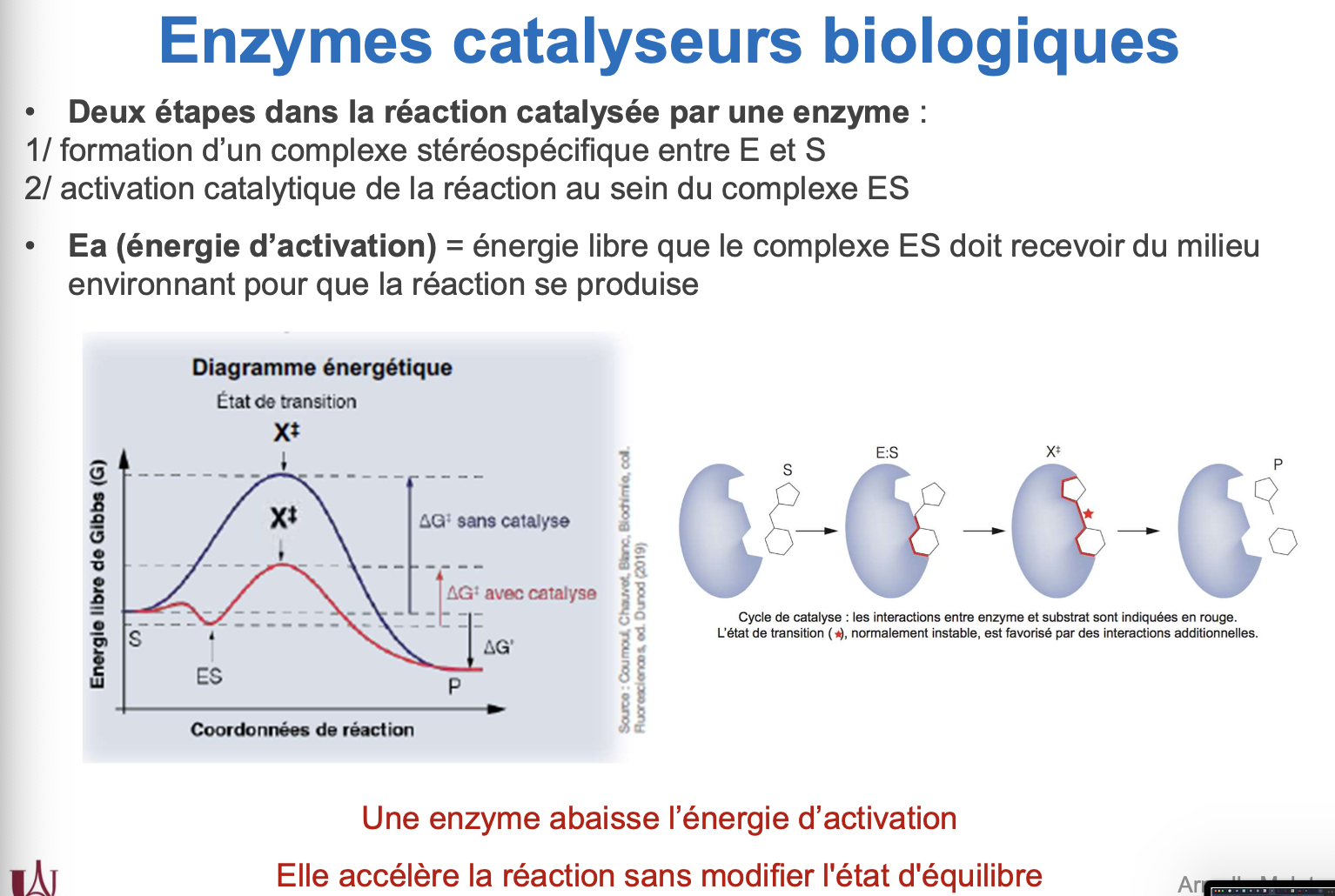
Quelles sont les deux étapes dans la réaction catalysée par une enzyme ?
Formation du complexe enzyme-substrat (ES) → reconnaissance et fixation.
Transformation en produit(s) + libération, l’enzyme étant régénérée.
Que représente l’acronyme Ea ?
Énergie d’activation : énergie minimale nécessaire pour qu’une réaction se produise.
Les enzymes abaissent Ea en stabilisant l’état de transition, ce qui augmente la vitesse de réaction.
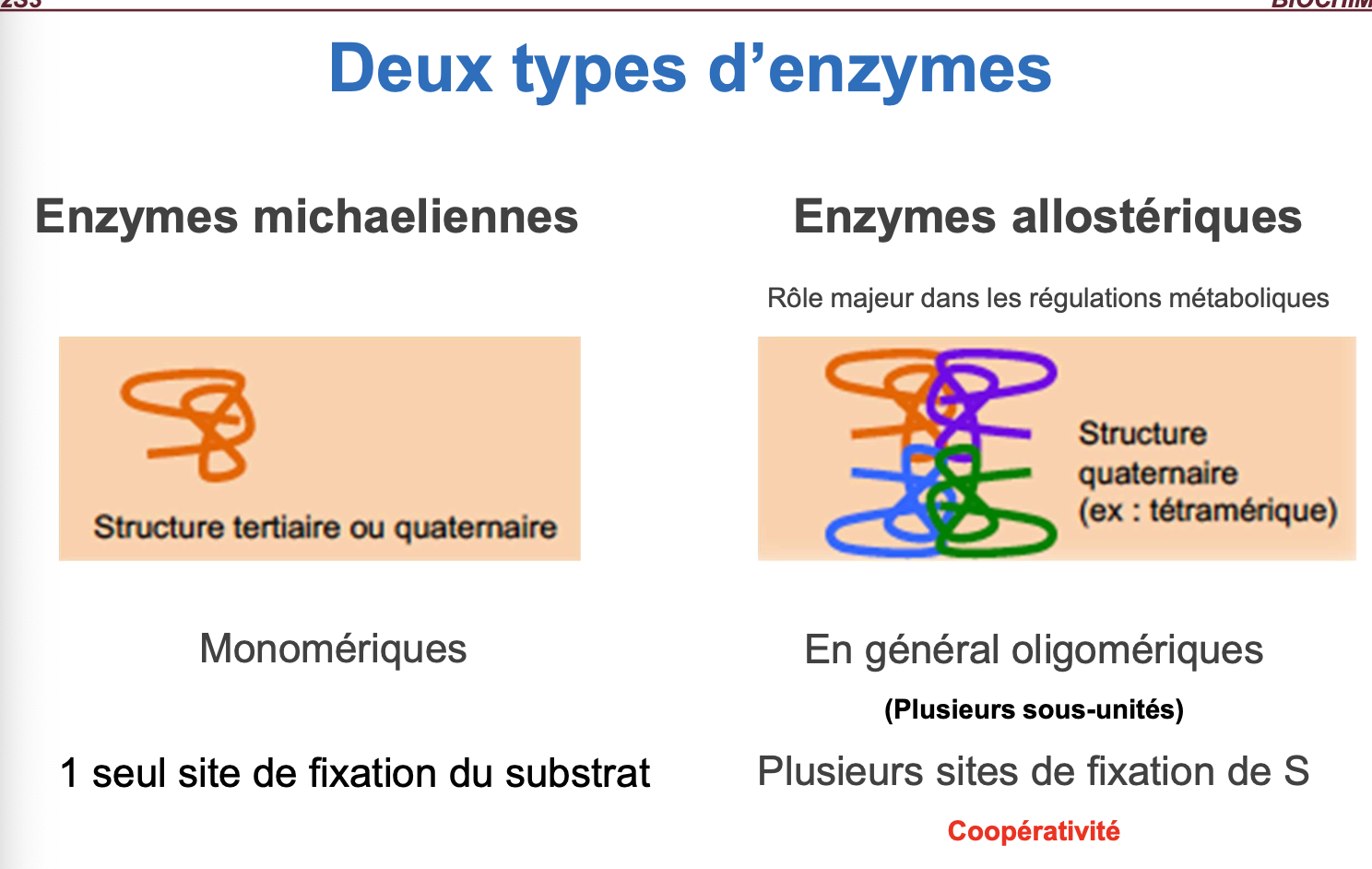
Quels sont les deux types d’enzymes ?
Enzymes simples : uniquement composées d’acides aminés.
Enzymes conjuguées : association d’une apoenzyme (partie protéique) et d’un cofacteur (partie non protéique).
Cofacteur minéral : ion métallique (Zn²⁺, Mg²⁺, Fe²⁺/³⁺).
Coenzyme organique : souvent dérivée de vitamines (NAD⁺, FAD, Coenzyme A).
Ensemble = holoenzyme (apoenzyme + cofacteur).
II- rappel enzymes michaellienes : flashcard de l’année derniere

Qu’est-ce que le mode de régulation allostérique ?
Schématiser une enzyme allostérique : quelles sont ses deux formes ?
Quels sont les systèmes, les types de courbes associés et quel système est majoritaire ?
Réponses
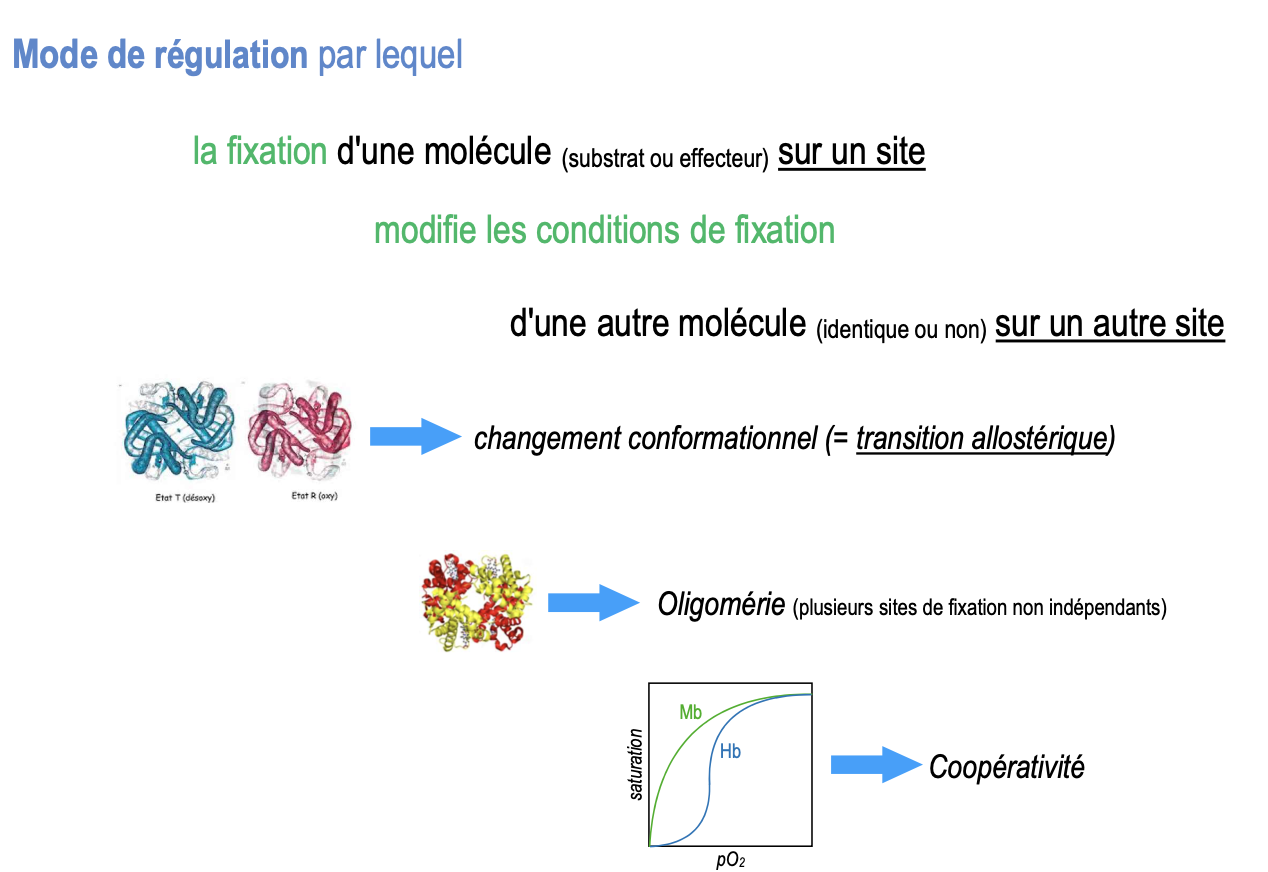
Qu’est-ce que le mode de régulation allostérique ?
C’est un mode de régulation enzymatique où la fixation d’une molécule (substrat ou effecteur) sur un site modifie l’affinité ou l’activité d’un autre site.
Mécanisme : changement conformationnel (= transition allostérique).
Nécessite une oligomérie (plusieurs sous-unités, sites non indépendants).
Conduit souvent à une coopérativité (fixation facilitée ou défavorisée par celle des autres).
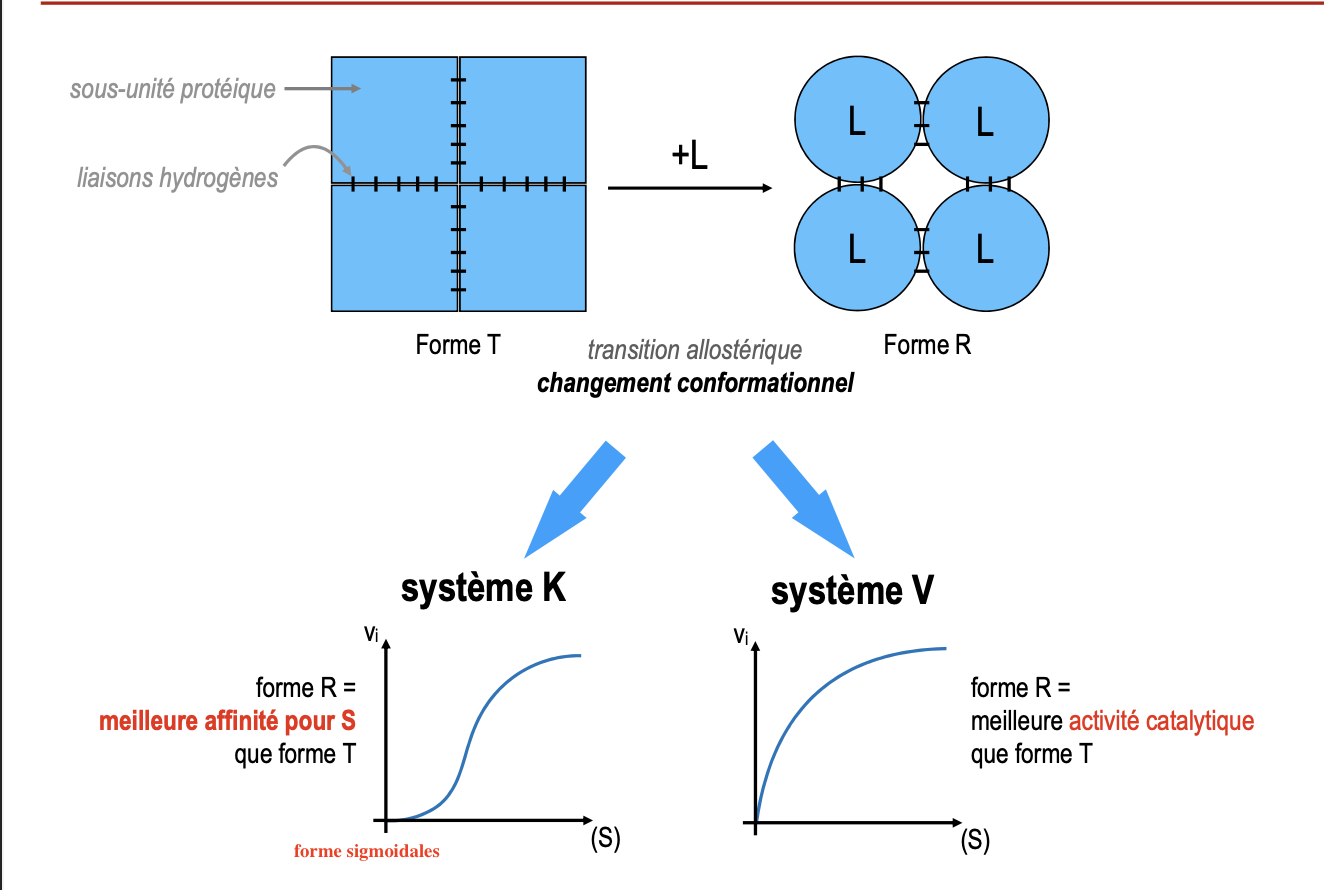
Schématiser une enzyme allostérique : quelles sont ses deux formes (Tendue et Relâchée) ?
Forme T (Tendue) : plus de liaisons faibles internes, conformation rigide, faible affinité/activité.
Forme R (Relâchée) : moins de liaisons faibles, conformation flexible, forte affinité/activité.
Passage T → R facilité par la fixation du ligand (substrat ou effecteur).
Quels sont les systèmes (K et V), les types de courbes associés et quel système est majoritaire ?
Système K : la transition T ↔ R modifie l’affinité pour le substrat → courbe sigmoïdale.
Système V : la transition T ↔ R modifie l’activité catalytique (Vmax) → courbe hyperbolique.
Majoritaire : Système K (≈ 99 % des enzymes allostériques).
🔹 III – Allostérie Questions
Qu’est-ce que le système K des enzymes allostériques ?
Quel paramètre est utilisé à la place du Km pour ces enzymes ?
Comment varie ce paramètre avec l’affinité de l’enzyme pour le substrat ?
Quel est l’effet des activateurs et inhibiteurs allostériques sur ce paramètre et sur la courbe ?
Réponses
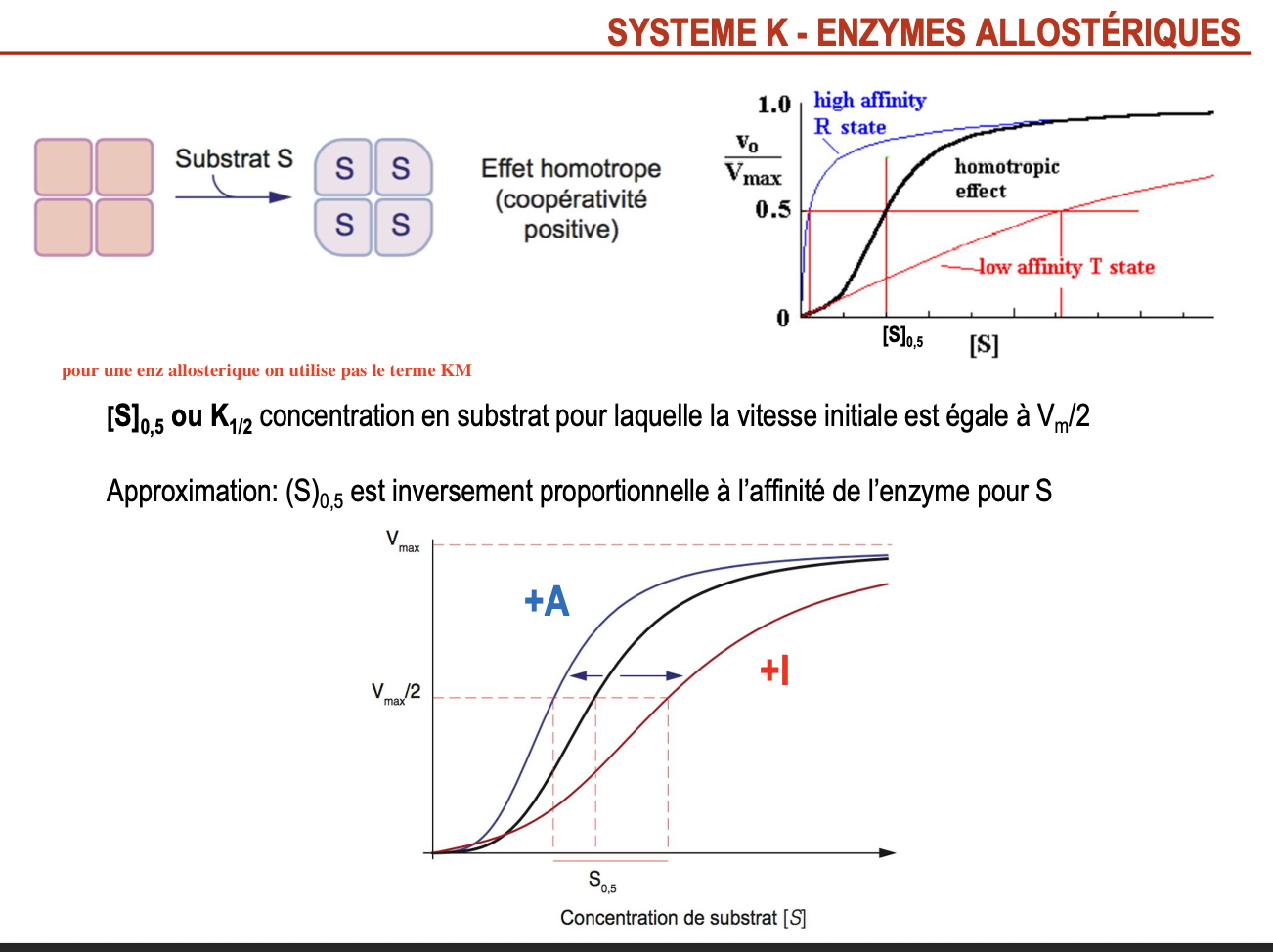
Qu’est-ce que le système K des enzymes allostériques ?
C’est un mode de régulation où la transition T ↔ R modifie l’affinité de l’enzyme pour le substrat.
Résultat : courbe de saturation sigmoïdale (coopérativité).
Quel paramètre est utilisé à la place du Km pour ces enzymes ?
On utilise [S]₀,₅ ou K₁/₂ : concentration en substrat où la vitesse initiale est Vmax/2.
Comment varie ce paramètre avec l’affinité de l’enzyme pour le substrat ?
Inversement proportionnel : plus [S]₀,₅ est faible → plus l’affinité est forte.
Quel est l’effet des activateurs et inhibiteurs allostériques sur ce paramètre et sur la courbe ?
Activateurs (+A) : diminuent [S]₀,₅ → courbe déplacée vers la gauche → affinité ↑.
Inhibiteurs (+I) : augmentent [S]₀,₅ → courbe déplacée vers la droite → affinité ↓.
III – Allostérie
1) Structure et classes d’enzymes allostériques
ENZYMES ALLOSTÉRIQUES: intérêt physiologique
Quels sont les deux avantages physiologiques des enzymes allostériques ?
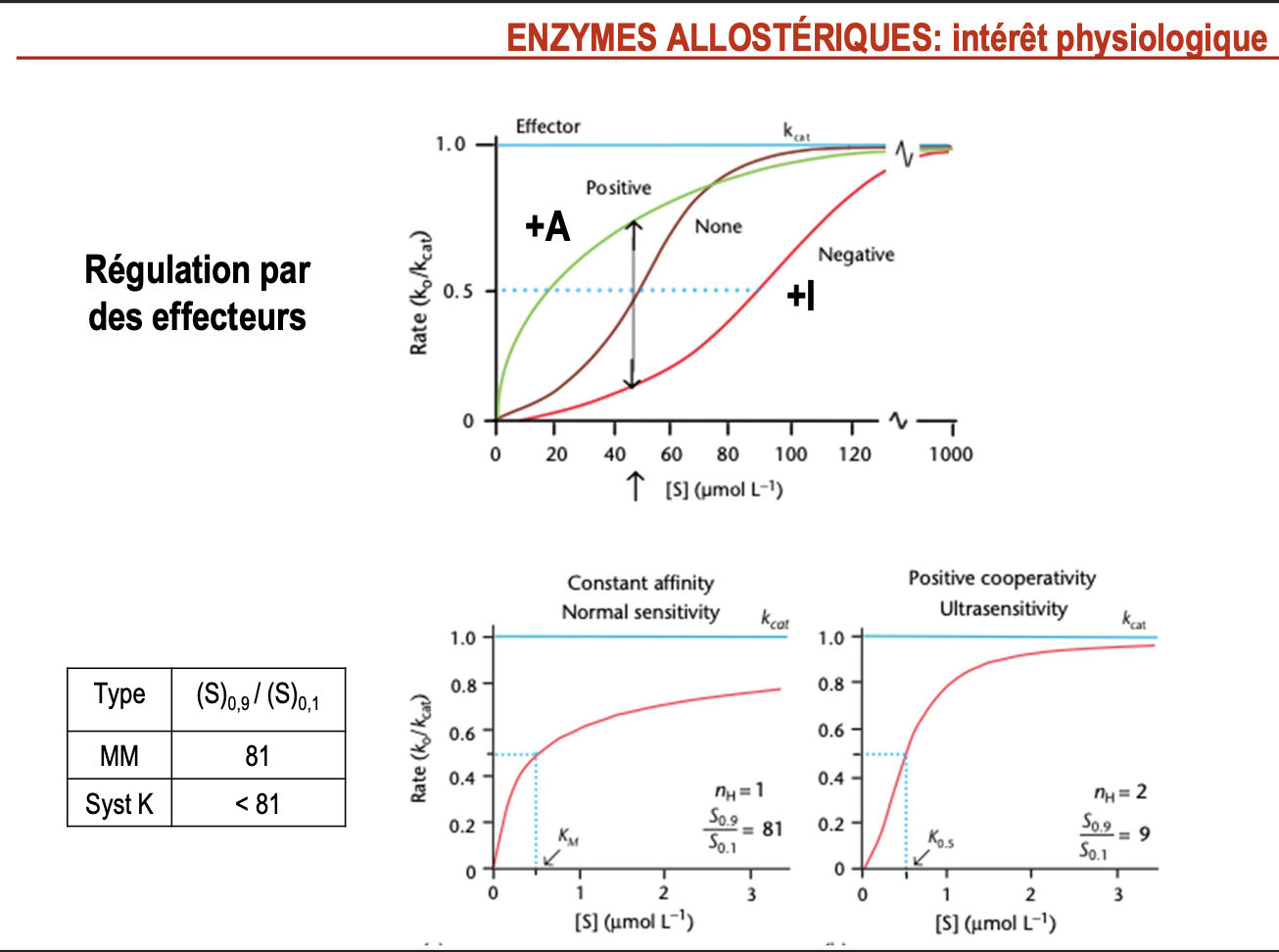
Réponses
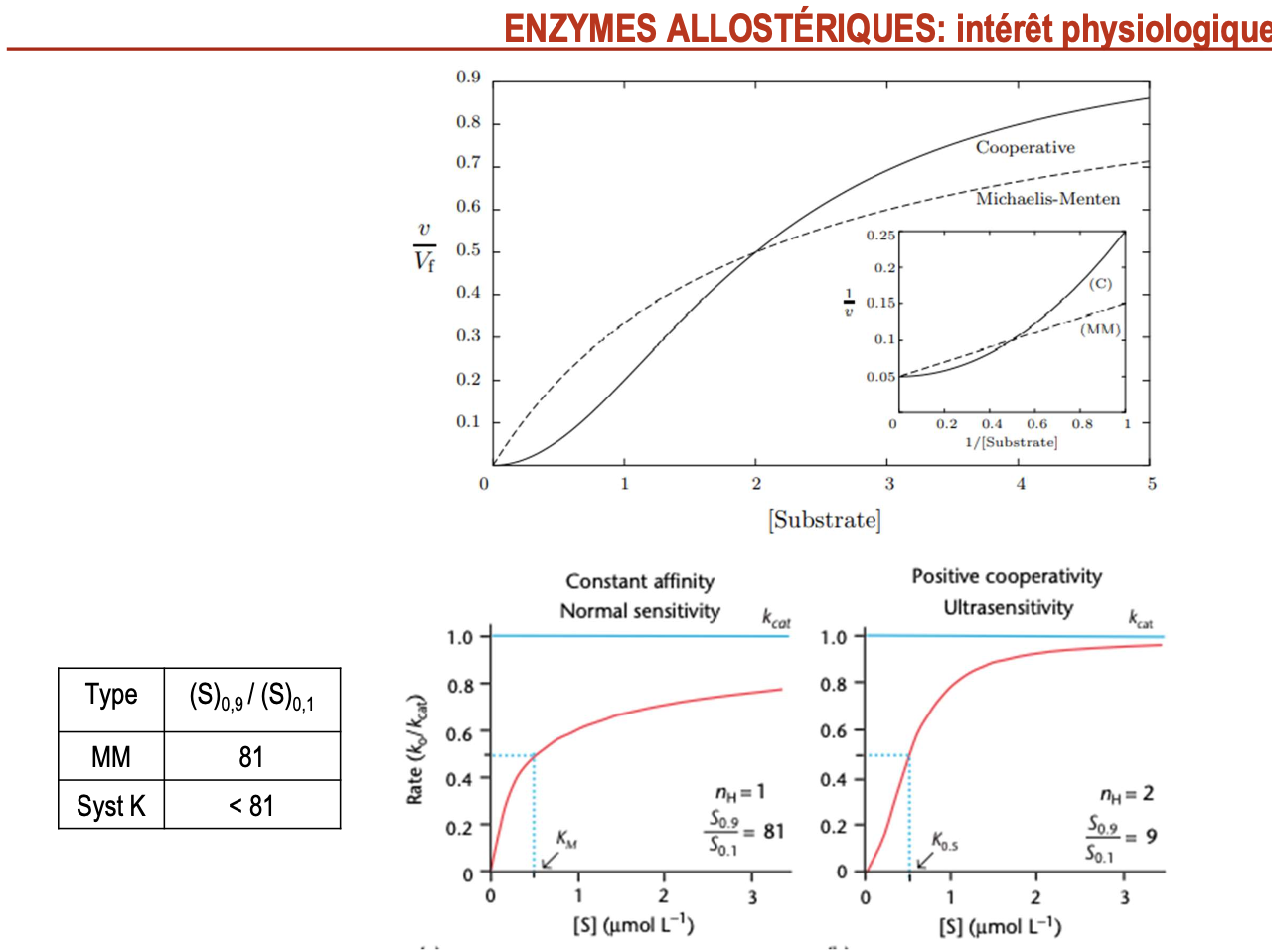
Quels sont les deux avantages physiologiques des enzymes allostériques ?
Homéostasie : grande sensibilité aux faibles variations de concentration en substrat → permet un ajustement fin et rapide du flux métabolique.
Régulation par des effecteurs : activité modulée par des activateurs (+A) ou inhibiteurs (+I) allostériques → intégration des signaux cellulaires et adaptation aux besoins.
III – Allostérie
1) Structure et classes d’enzymes allostériques
Quelle est la première protéine allostérique découverte et quelles sont ses caractéristiques ?
À quelle protéine est-elle souvent comparée ?
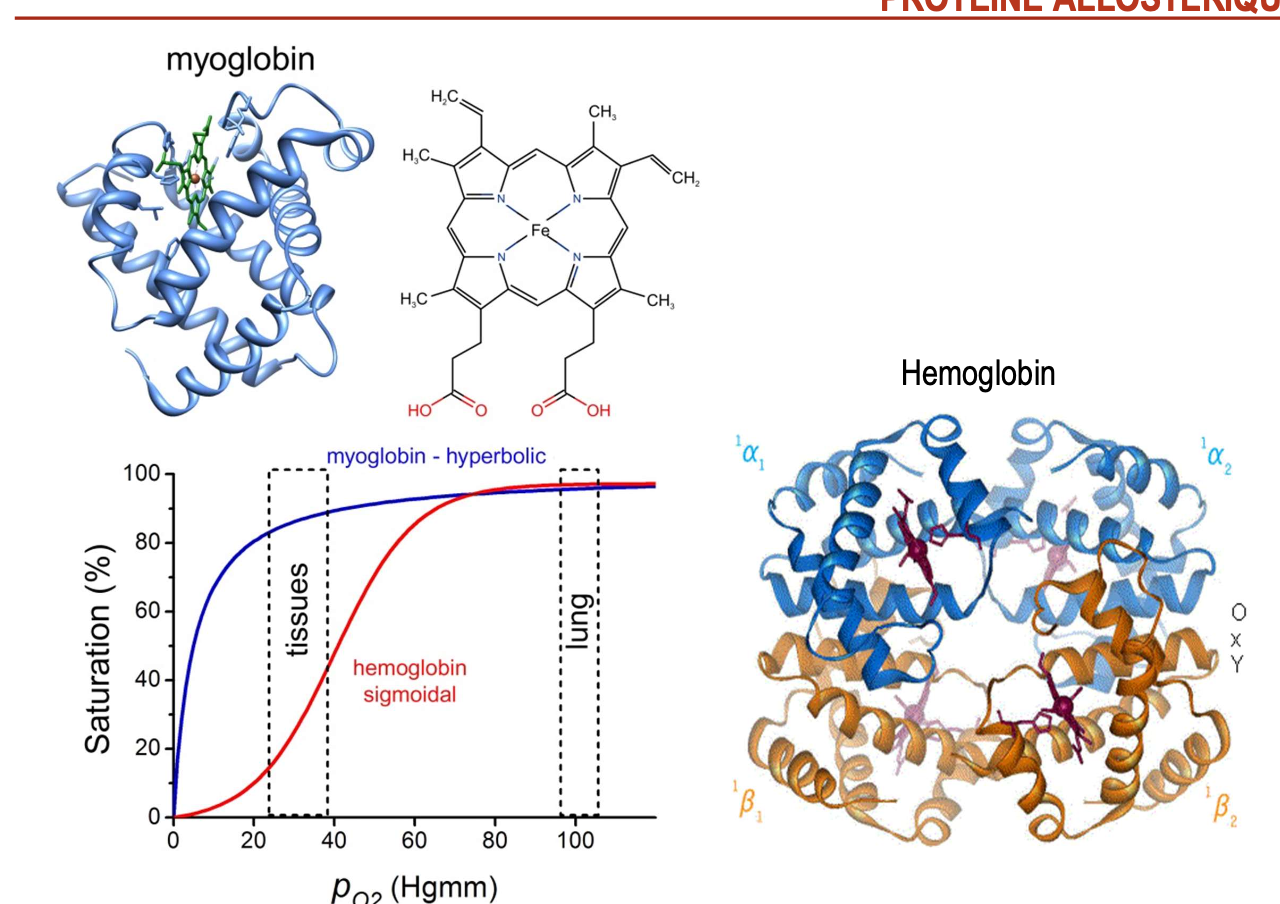
Réponses
Quelle est la première protéine allostérique découverte et quelles sont ses caractéristiques ?
C’est l’hémoglobine.
Protéine tétramérique (2 sous-unités α + 2 sous-unités β).
Fixe l’oxygène de manière coopérative → courbe de saturation sigmoïdale.
Transition T (faible affinité) ↔ R (forte affinité).
Permet de capter l’O₂ dans les poumons et de le relâcher efficacement dans les tissus.
À quelle protéine est-elle souvent comparée ?
À la myoglobine : protéine monomérique musculaire, courbe hyperbolique, forte affinité pour l’O₂ mais pas de coopérativité.
Comparaison met en évidence le rôle allostérique unique de l’hémoglobine.
III – Allostérie
2) Les modèles de transition allostérique
Quels sont les deux modèles de transition allostérique et leurs caractéristiques ? Les schématiser.
Par quoi est induite la transition allostérique dans le système V et dans le système K ?
Comment se déroule la transition allostérique dans le système V ?
Comment se déroule la transition allostérique dans le système K ?
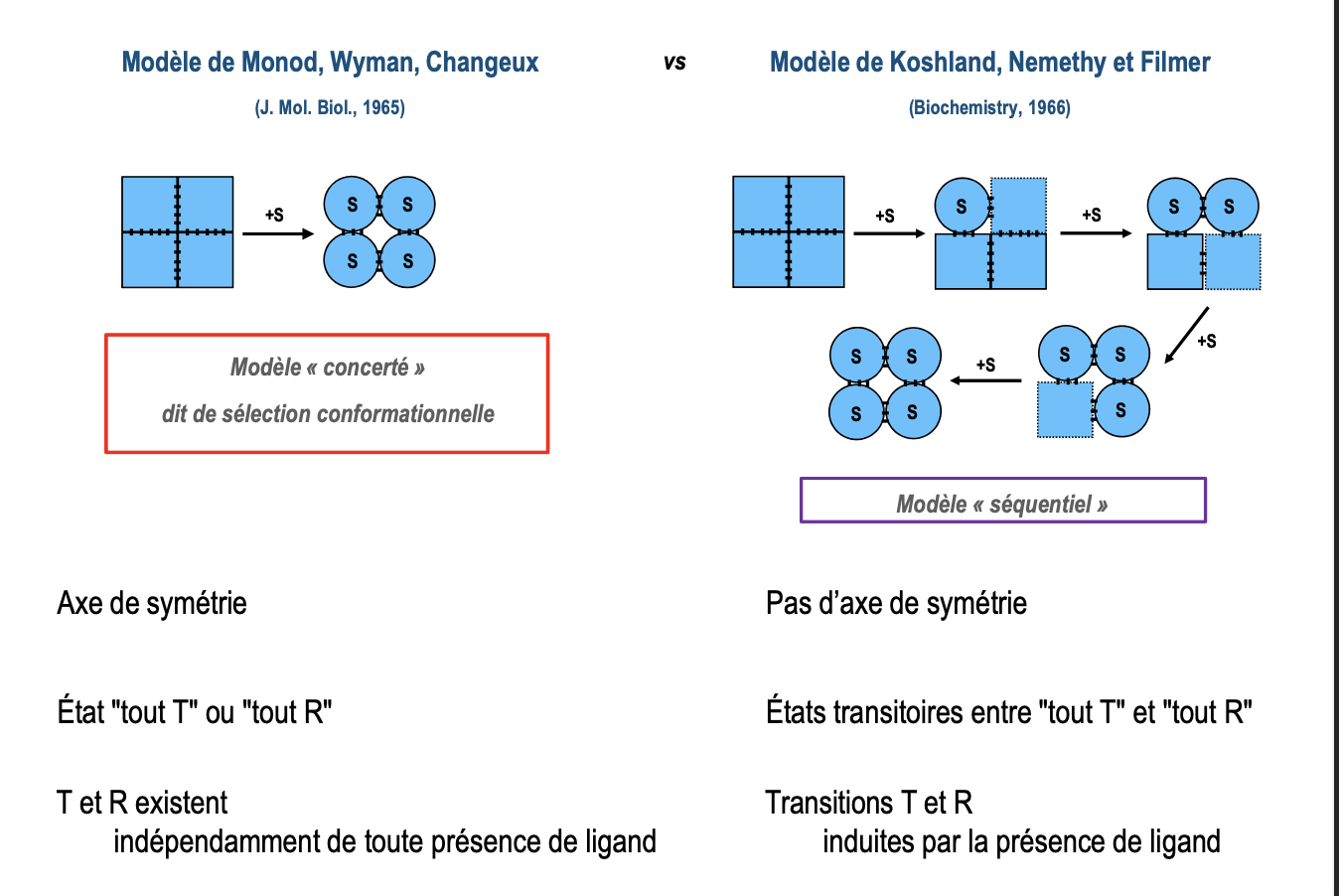
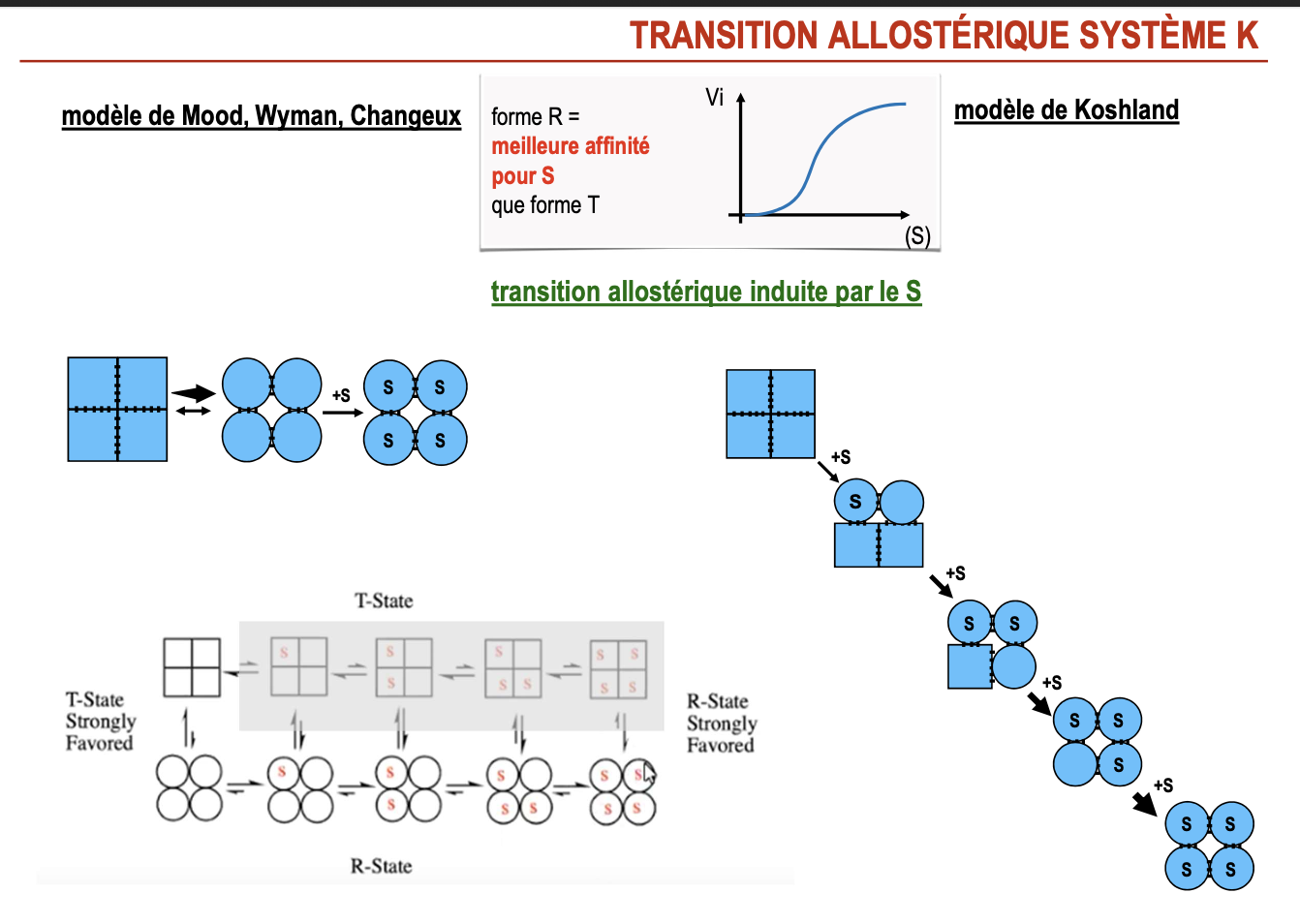
Réponses
Quels sont les deux modèles de transition allostérique et leurs caractéristiques ?
Modèle concerté (Monod, Wyman, Changeux, 1965)
Toutes les sous-unités passent en même temps de T → R.
États « tout T » ou « tout R ».
La fixation du substrat stabilise la forme R.
Modèle séquentiel (Koshland, Nemethy, Filmer, 1966)
Pas d’axe de symétrie.
Transition progressive : une sous-unité qui fixe le substrat change de conformation, entraînant les voisines.
États intermédiaires possibles entre T et R.
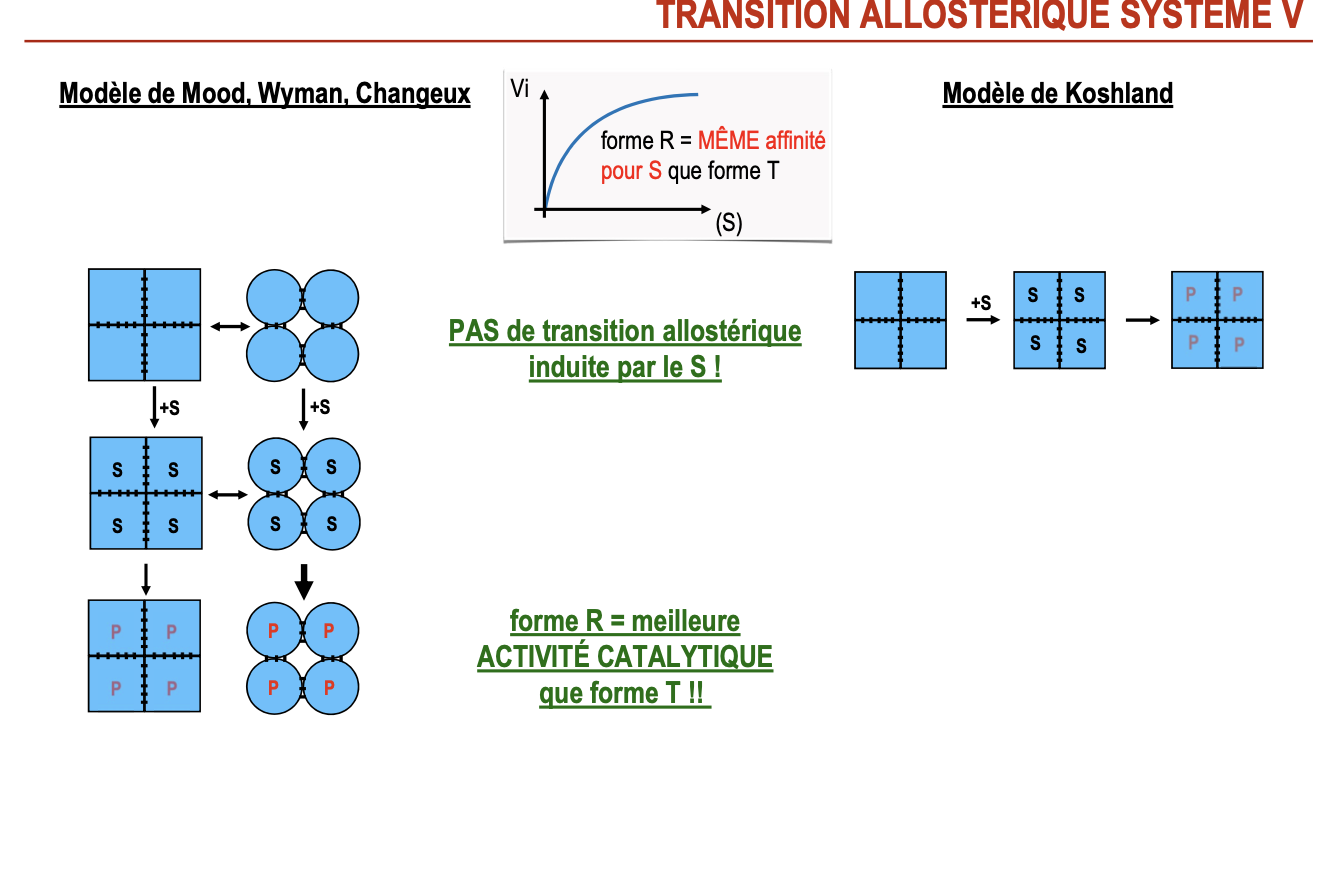
Par quoi est induite la transition allostérique dans le système V et K ?
Système K : induite par la fixation du substrat (S).
Système V : induite par des effecteurs allostériques (+A ou +I).
Transition allostérique dans le système V ?
La forme R a même affinité pour le substrat que la forme T.
Mais la forme R a une meilleure activité catalytique.
La transition T ↔ R est déclenchée par des effecteurs allostériques (activateurs ou inhibiteurs).
Transition allostérique dans le système K ?
La forme R a une meilleure affinité pour le substrat que la forme T.
La fixation du substrat favorise la transition T → R.
Résultat : courbe sigmoïdale (coopérativité).
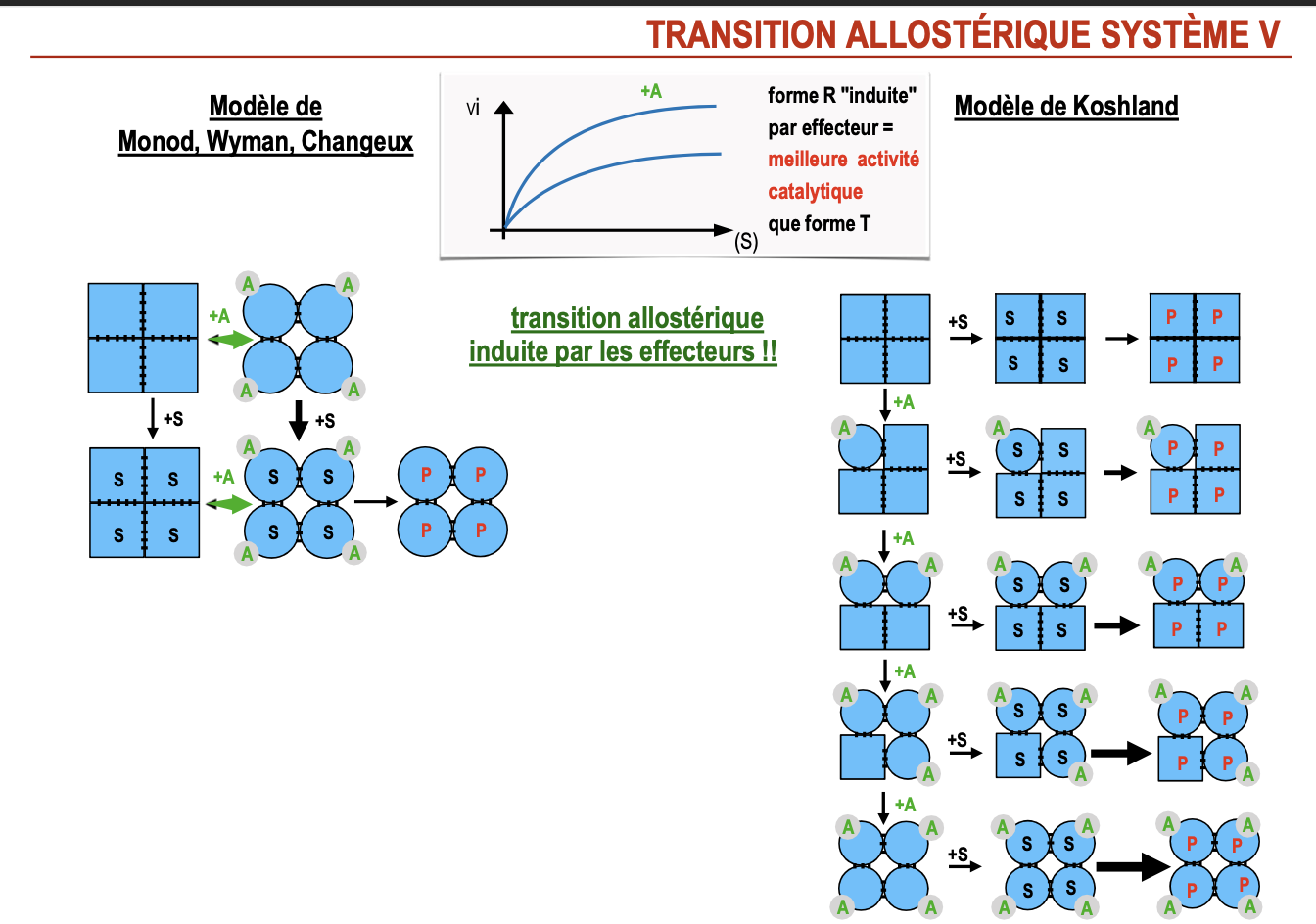

quest ce quon voit dans cette image (toute les conformations dune enzyme allosterique)?
🔹 III – Allostérie Question
Que représente cette image (toutes les conformations d’une enzyme allostérique) ?
Réponse
L’image montre l’ensemble des conformations possibles d’une enzyme allostérique oligomérique (ici tétramère).
Chaque carré = une sous-unité ; “L” = ligand fixé.
On distingue :
Modèle de Koshland (séquentiel) : transitions progressives, états intermédiaires possibles (certaines sous-unités en T, d’autres en R).
Modèle MWC (Monod-Wyman-Changeux, concerté) : transitions globales → soit tout en T, soit tout en R (pas d’intermédiaire mixte).
Donc : l’image compare toutes les configurations possibles de fixation du ligand selon les deux modèles :
Koshland → diversité d’états hybrides.
MWC → uniquement deux états extrêmes (tout T / tout R).

NOUVEAU
III – Allostérie
3) Les effecteurs allostériques
Qu’est-ce qu’un effecteur allostérique et comment agit-il sur l’enzyme ?
Quelle est la différence entre effet allostérique homotrope et hétérotrope ?
Quels sont les deux types d’effets allostériques hétérotropes et leur action sur l’équilibre T/R ?
Comment un effecteur allostérique négatif modifie-t-il l’activité enzymatique et la courbe de vitesse ?
Comment un effecteur allostérique positif modifie-t-il l’activité enzymatique et la courbe de vitesse ?
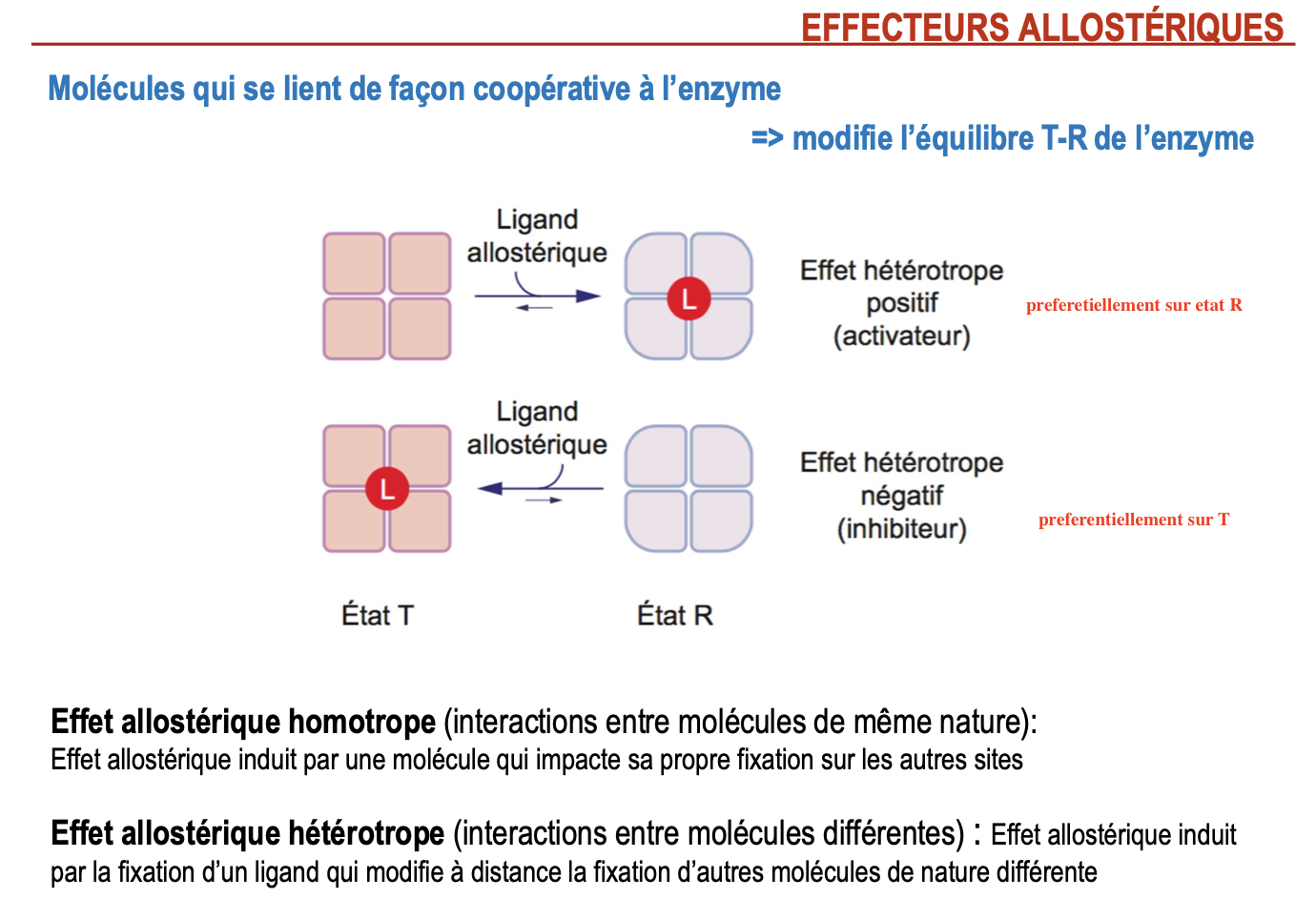
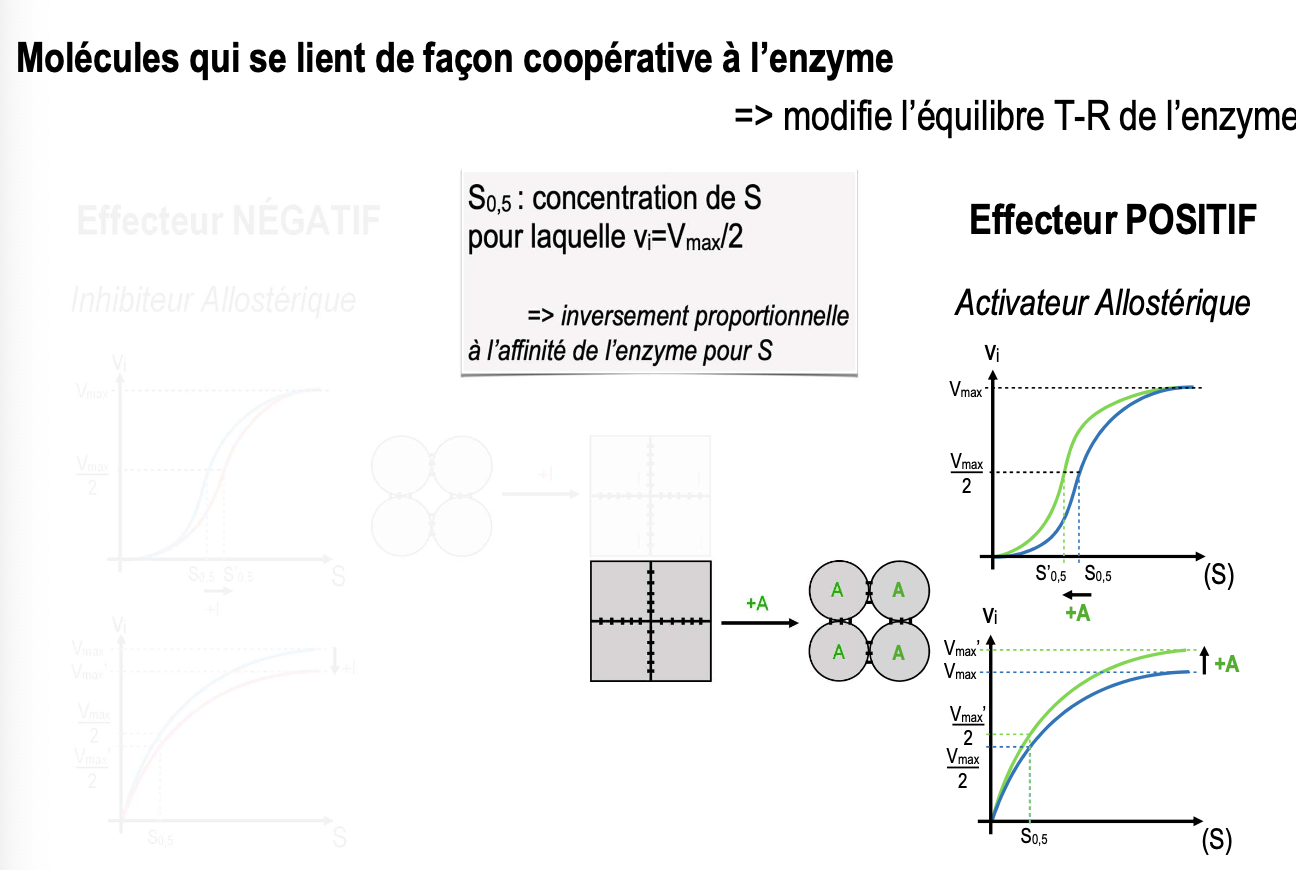
Un effecteur allostérique est une molécule qui se fixe de façon coopérative sur un site allostérique de l’enzyme, différent du site actif. Cette fixation modifie la conformation globale de l’enzyme et l’équilibre entre les états T (tendu, faible affinité pour S) et R (relâché, forte affinité pour S).
Effet allostérique homotrope : interactions entre molécules de même nature (ex. substrat qui facilite sa propre fixation).
Effet allostérique hétérotrope : interactions entre molécules de nature différente (ex. un activateur ou inhibiteur qui agit sur l’enzyme et modifie la fixation du substrat).
Effet hétérotrope positif (activateur) : stabilise l’état R → augmente l’affinité de l’enzyme pour le substrat.
Effet hétérotrope négatif (inhibiteur) : stabilise l’état T → diminue l’affinité de l’enzyme pour le substrat.
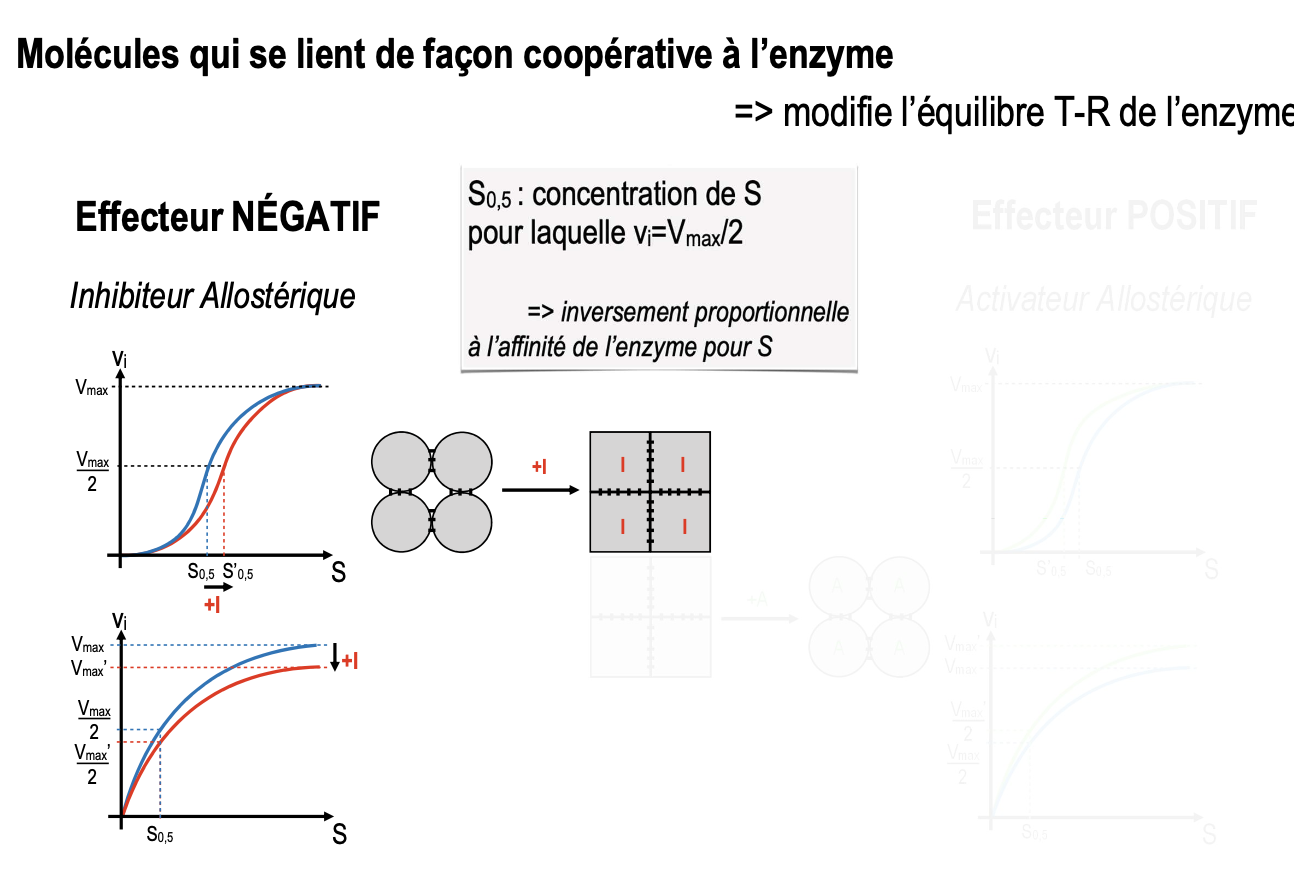
L’inhibiteur allostérique déplace la courbe de vitesse vers la droite (↑ S0,5), traduisant une baisse de l’affinité pour le substrat. Il peut aussi réduire la Vmax selon le mécanisme.
L’activateur allostérique déplace la courbe de vitesse vers la gauche (↓ S0,5), traduisant une augmentation de l’affinité pour le substrat. Il peut également augmenter la Vmax.
III – Allostérie
3) Les effecteurs allostériques
Comment distinguer une enzyme allostérique de type système V d’une enzyme de type Michaelienne ?
Quels sont les effets possibles des effecteurs (inhibiteurs ou activateurs) sur une enzyme allostérique par rapport à une enzyme Michaelienne ?
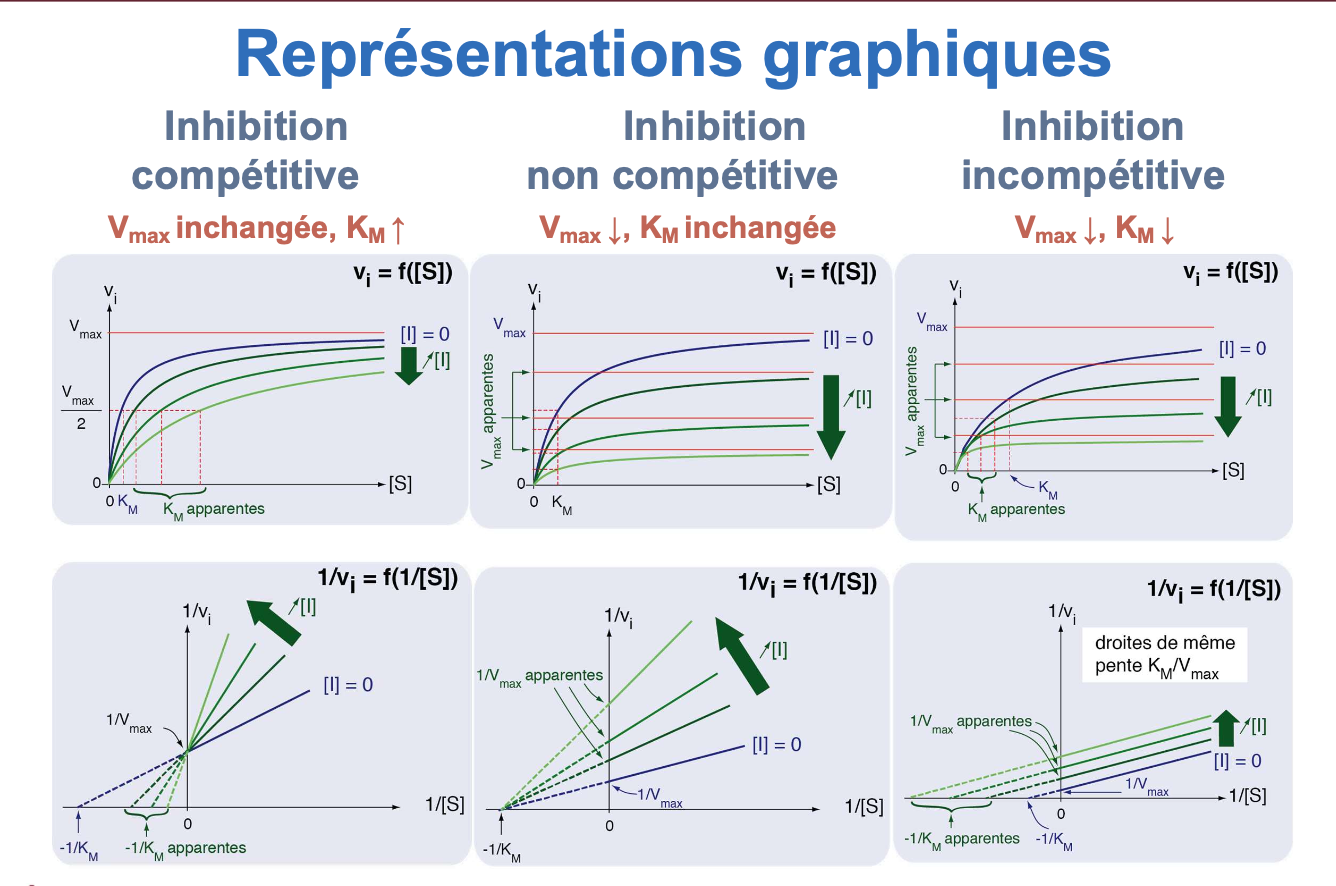
Quel test permet de différencier une inhibition allostérique d’une inhibition non compétitive ?
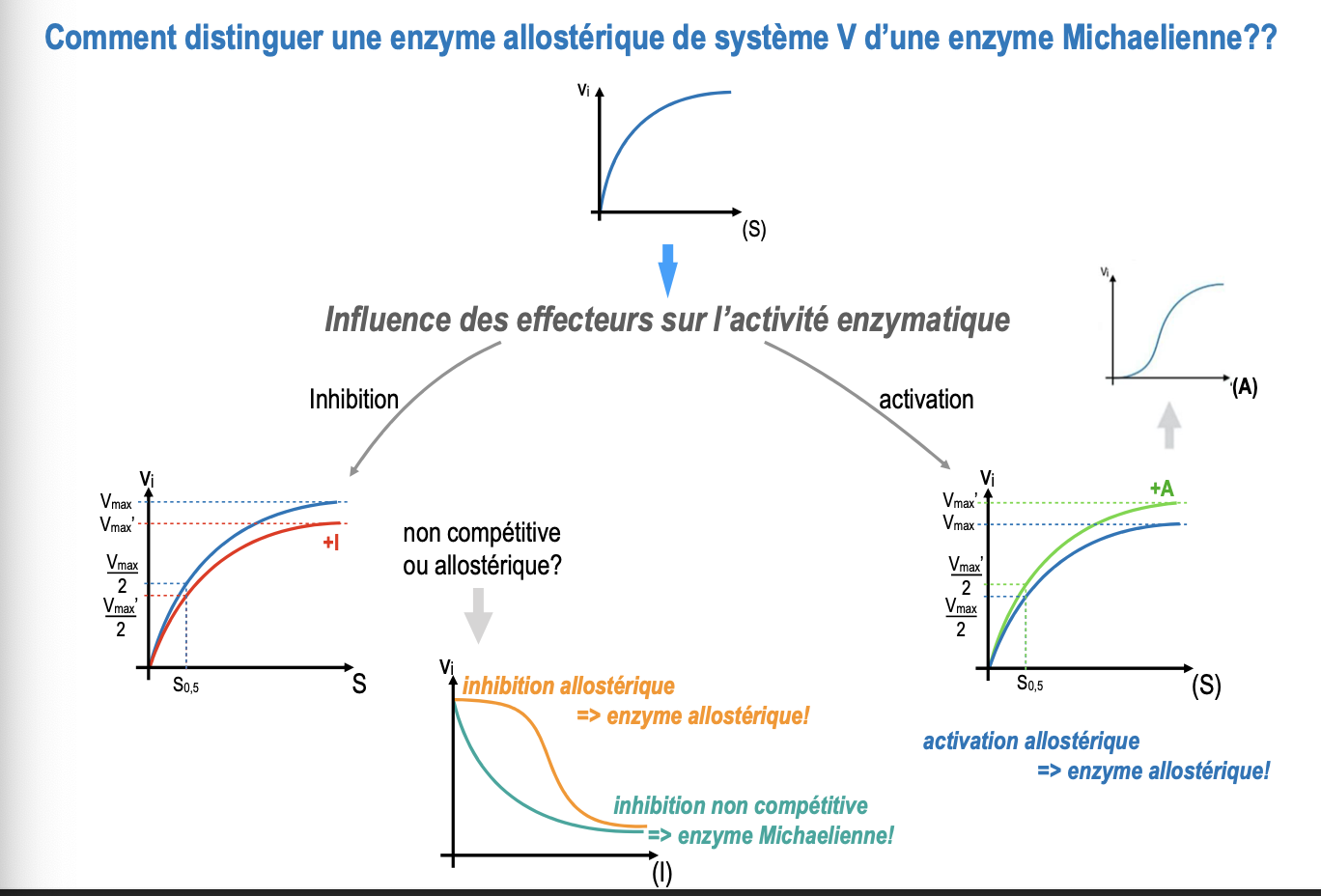
Une enzyme Michaelienne suit une cinétique hyperbolique classique (courbe de Michaelis-Menten), tandis qu’une enzyme allostérique présente une cinétique sigmoïde (système V), due à la coopération entre sous-unités.
Enzyme Michaelienne : un inhibiteur non compétitif réduit la Vmax mais n’affecte pas le Km, et il n’existe pas d’activation allostérique.
Enzyme allostérique :
Un inhibiteur allostérique déplace la courbe vers la droite (↑ S0,5 ou ↓ Vmax selon le cas).
Un activateur allostérique déplace la courbe vers la gauche (↓ S0,5) et/ou ↑ Vmax.
Le test repose sur la réponse de l’activité enzymatique à l’ajout croissant d’inhibiteur :
Si l’inhibition est non compétitive → on observe une baisse progressive de l’activité, indépendante de la concentration en substrat (enzyme Michaelienne).
Si l’inhibition est allostérique → l’inhibiteur modifie la forme de la courbe sigmoïde, signe que l’enzyme est régulée allostériquement.
III – Allostérie
3) Les effecteurs allostériques
Qu’est-ce qu’un effet allostérique homotrope et hétérotrope ?
Comment les effecteurs allostériques influencent-ils l’équilibre T ⇄ R de l’enzyme ?
Quelle est la différence entre un effecteur allostérique négatif et un effecteur positif ?
Comment distinguer une inhibition allostérique d’une inhibition non compétitive ?
Quelles sont les caractéristiques principales des systèmes allostériques K et V ?
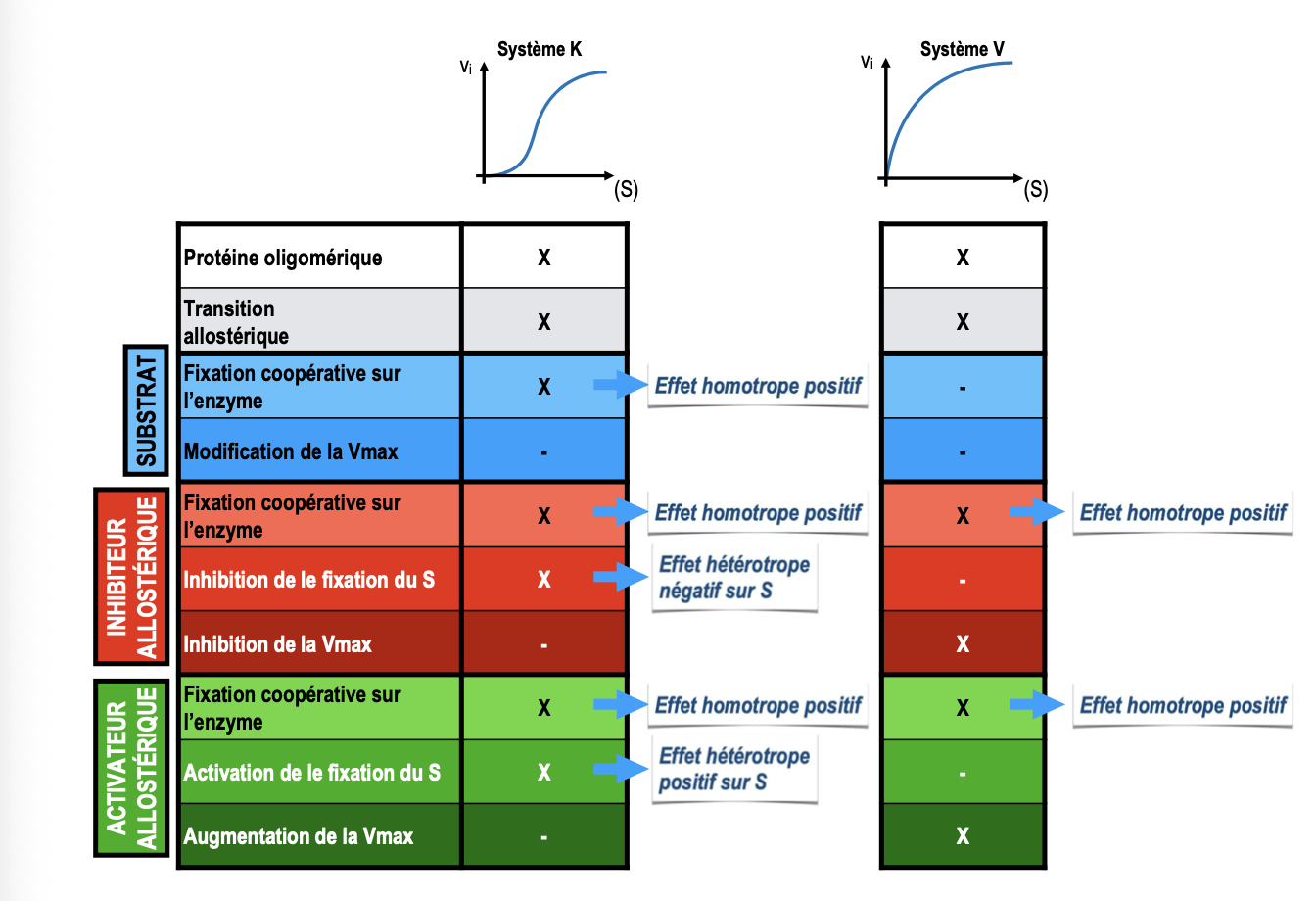
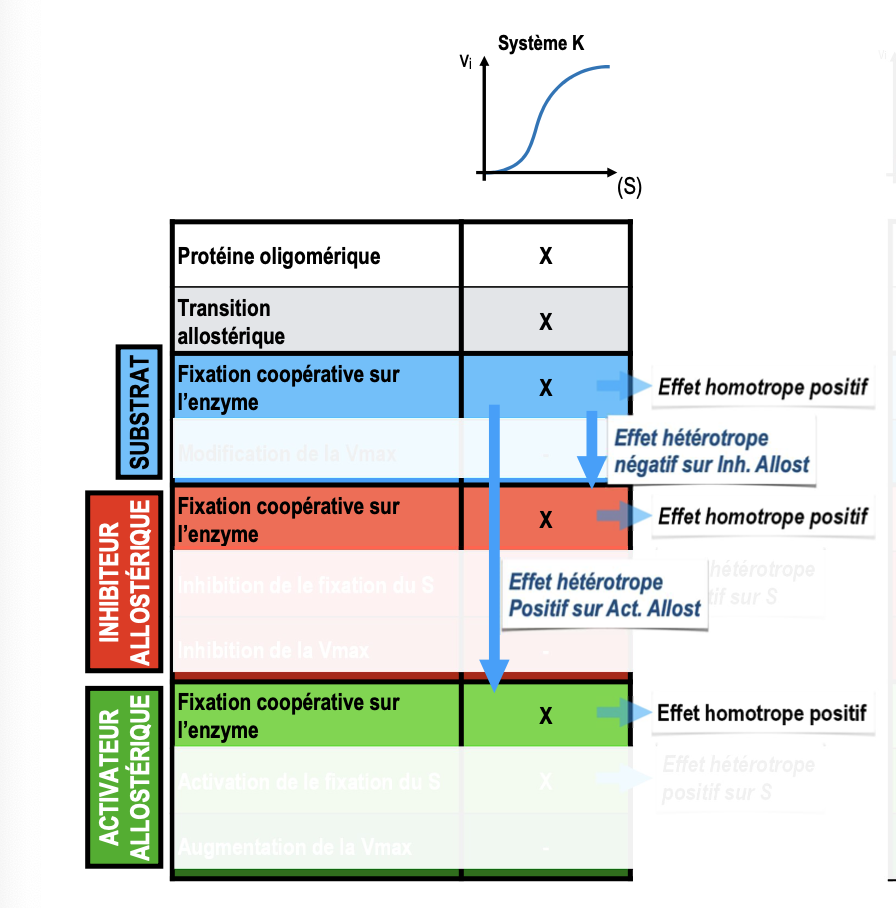
Effet allostérique homotrope : il concerne les interactions entre molécules de même nature. Exemple : le substrat agit lui-même comme ligand allostérique et sa fixation influence la fixation des autres substrats (coopérativité).
Effet allostérique hétérotrope : il concerne des interactions entre molécules de nature différente. Exemple : fixation d’un ligand (activateur ou inhibiteur) modifiant à distance la fixation du substrat.Les effecteurs allostériques modifient l’équilibre entre état T (tendu, peu actif) et état R (relâché, actif) :
Les activateurs allostériques stabilisent l’état R, favorisant l’activité enzymatique.
Les inhibiteurs allostériques stabilisent l’état T, réduisant l’activité enzymatique.
Effecteur négatif (inhibiteur allostérique) : augmente la valeur de S₀,₅ (diminution de l’affinité pour S) ou diminue la Vmax. → Ex : déplacement de la courbe vers la droite.
Effecteur positif (activateur allostérique) : diminue S₀,₅ (augmentation de l’affinité pour S) et/ou augmente Vmax. → Ex : déplacement de la courbe vers la gauche ou vers le haut.
Pour distinguer :
Inhibition allostérique : la courbe de vi en fonction de [I] est typiquement sigmoïde → caractéristique des enzymes allostériques.
Inhibition non compétitive : la diminution d’activité suit une courbe hyperbolique → typique des enzymes michaeliennes.
Système K : le substrat agit comme effecteur homotrope positif. L’allostérie modifie la valeur de S₀,₅ (affinité), mais pas la Vmax.
Système V : l’effet allostérique modifie surtout la Vmax, sans affecter la valeur de S₀,₅.
III – Allostérie
4) La coopérativité et l’équation de Hill
Quelle est la différence entre l’équation de Michaelis-Menten et l’équation de Hill dans la modélisation de la cinétique enzymatique ?
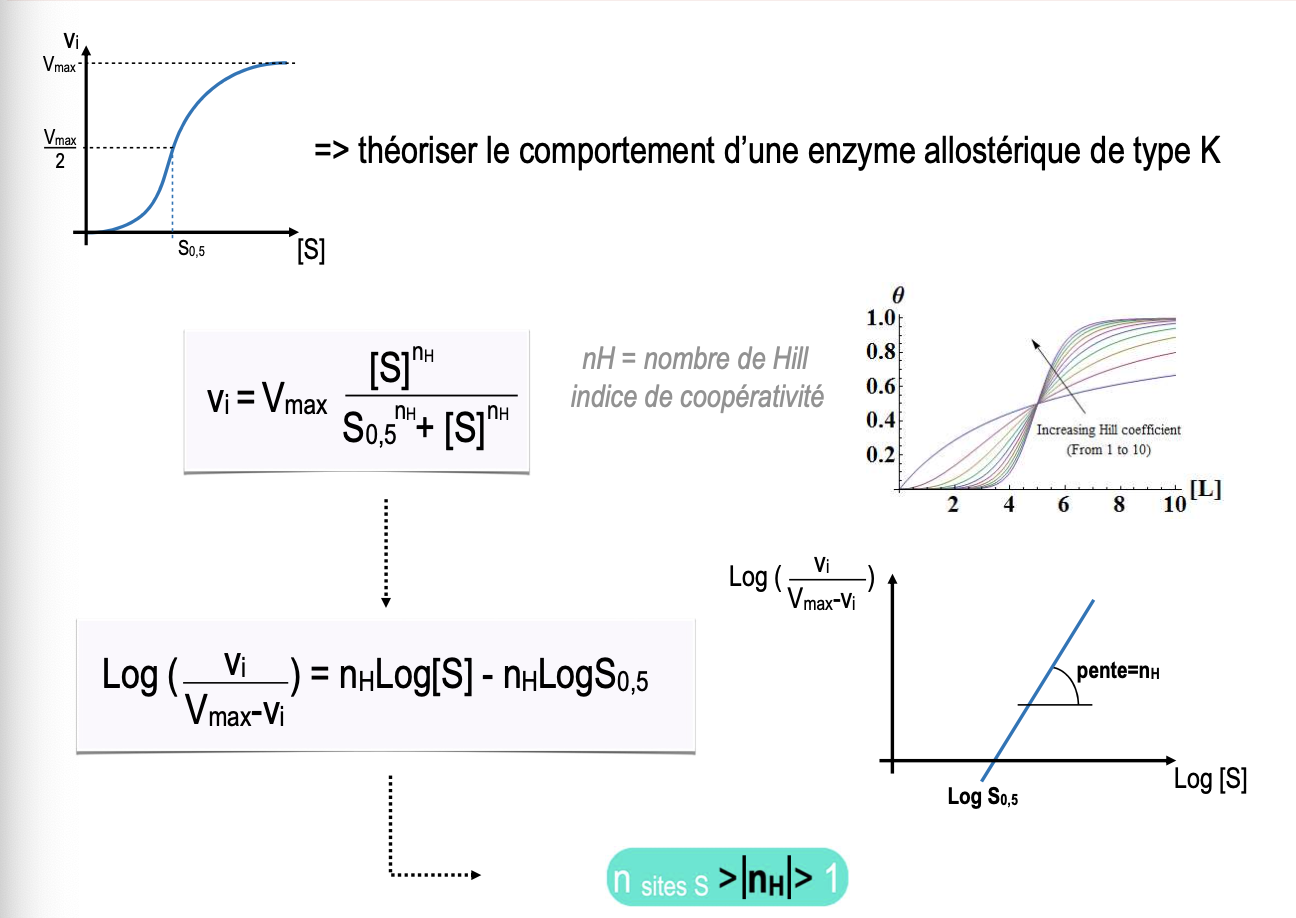
Qu’est-ce que le coefficient de Hill (nH) et que reflète-t-il sur le comportement coopératif d’une enzyme allostérique ?
Comment interpréter les valeurs de nH (nH < 1, nH = 1, nH > 1) en termes de coopérativité enzymatique ?
Comment l’équation de Hill permet-elle de représenter graphiquement la coopérativité des enzymes allostériques ?
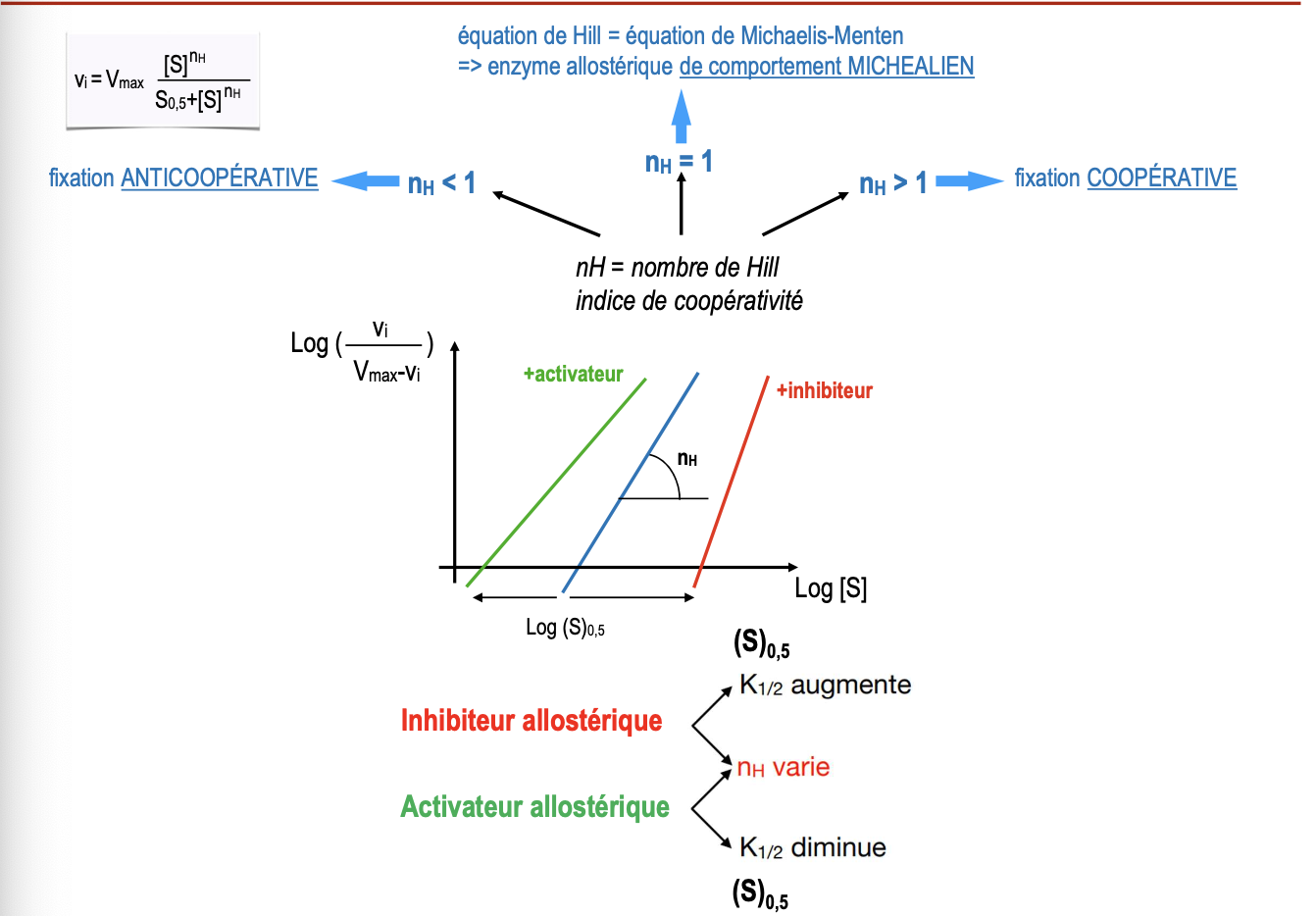
Quelle est l’influence des effecteurs allostériques (activateurs et inhibiteurs) sur (S₀.₅), K₁/₂ et nH dans le modèle de Hill ?
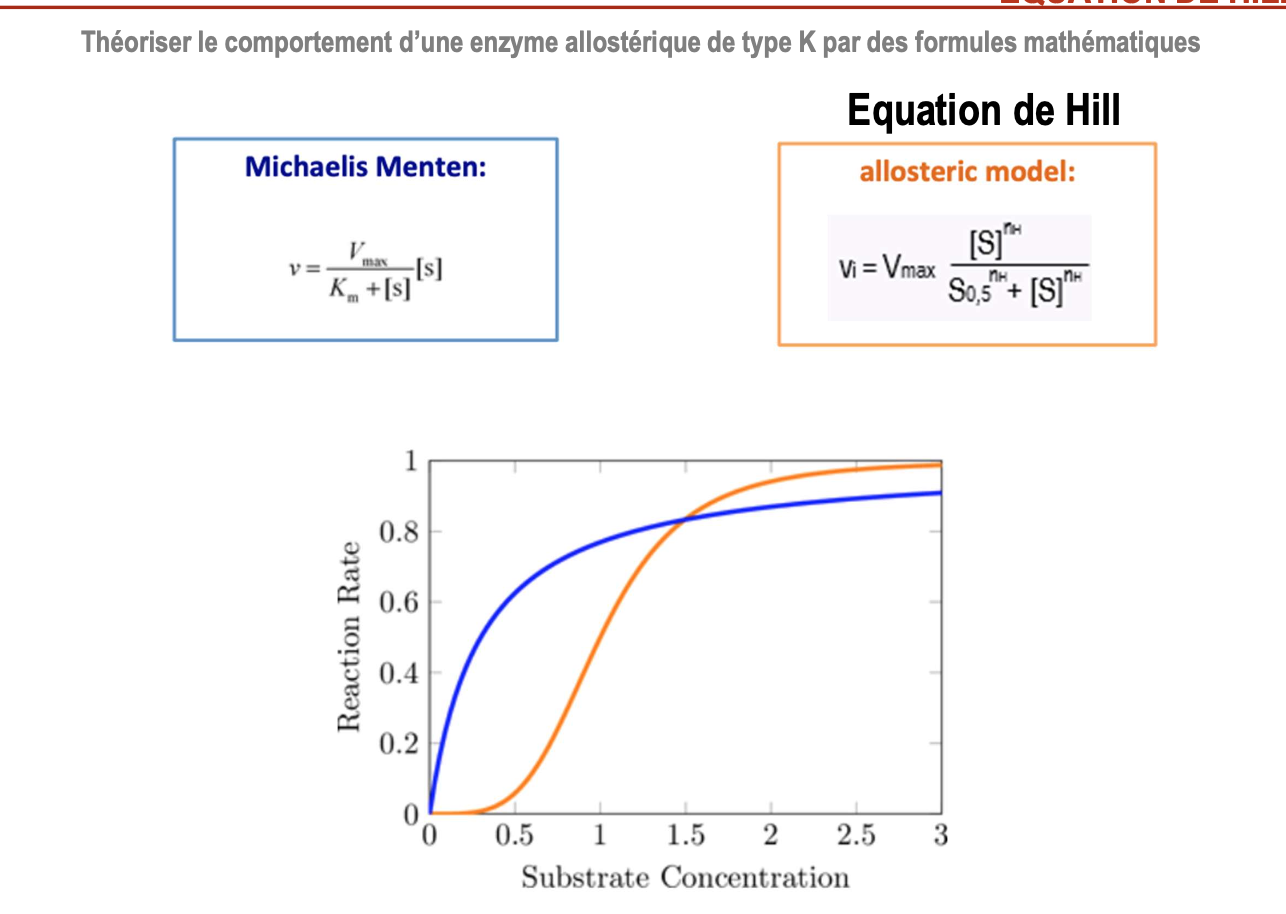
Différence entre Michaelis-Menten et Hill :
L’équation de Michaelis-Menten décrit la cinétique d’enzymes classiques (Michaeliennes) et suppose une fixation indépendante du substrat sur les sites actifs :
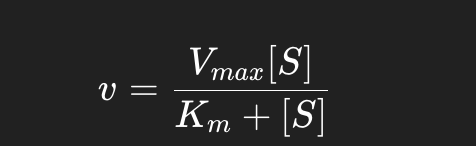
L’équation de Hill introduit un paramètre de coopérativité (nH) et s’applique aux enzymes allostériques. Elle décrit la fixation coopérative du substrat :
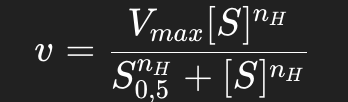
Graphiquement, la courbe de Michaelis-Menten est hyperbolique, tandis que celle de Hill est sigmoïde, typique de la coopérativité.
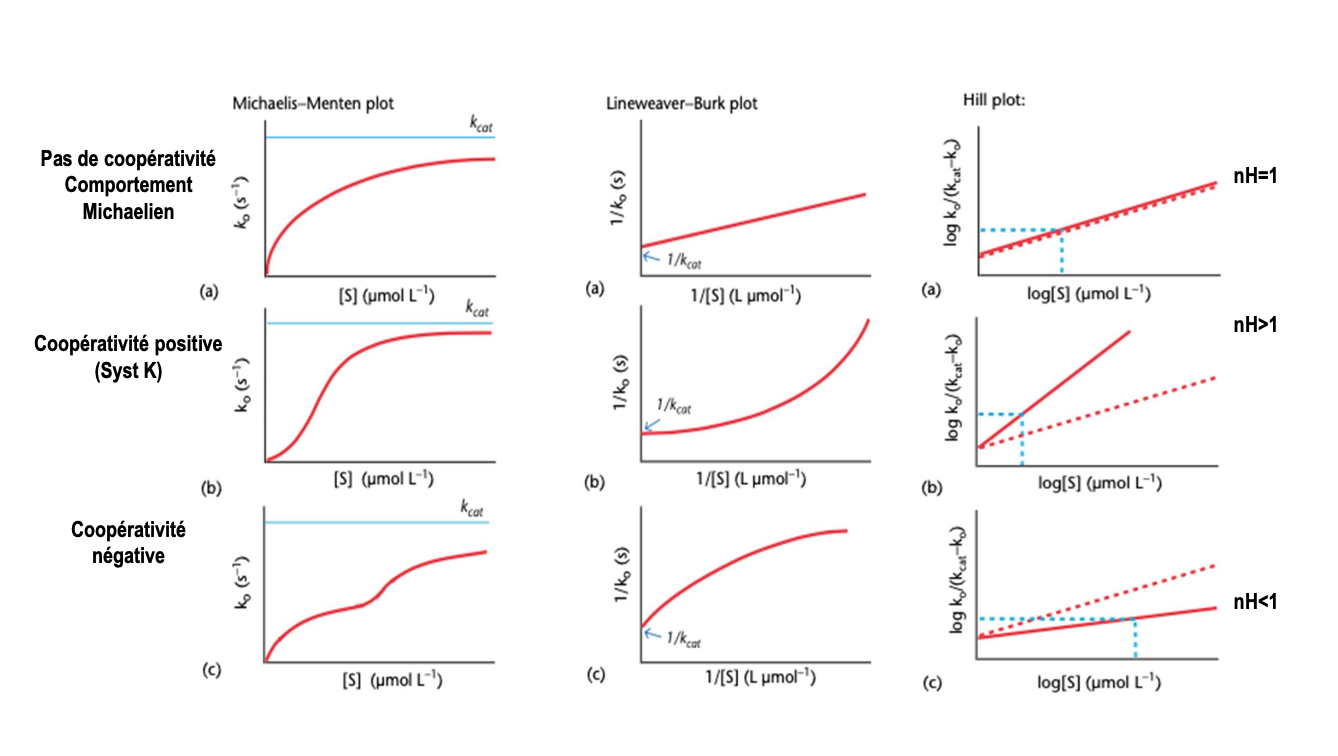
Coefficient de Hill (nH) :
C’est un indice de coopérativité qui reflète la manière dont les sites actifs interagissent entre eux.
Si nH > 1 : fixation coopérative positive (la fixation d’un substrat facilite celle des autres).
Si nH = 1 : comportement Michaelien classique (pas de coopérativité).
Si nH < 1 : fixation anticoopérative (la fixation d’un substrat réduit la probabilité de fixation des autres).
Interprétation des valeurs de nH :
nH < 1 → fixation anticoopérative, l’affinité diminue au fur et à mesure que les substrats se fixent.
nH = 1 → absence de coopérativité, l’équation de Hill se réduit à celle de Michaelis-Menten.
nH > 1 → fixation coopérative positive, la fixation d’un substrat augmente l’affinité des sites restants.
Représentation graphique :
L’équation de Hill permet de tracer une courbe sigmoïde de la vitesse initiale (v) en fonction de la concentration de substrat ([S]).
Plus nH est élevé, plus la courbe est abrupte, traduisant une transition nette entre l’état T (faible affinité) et l’état R (forte affinité).
On peut également tracer un Hill plot (log(vi/(Vmax - vi)) vs log[S]) dont la pente correspond à nH.
Influence des effecteurs allostériques :
Activateurs allostériques : diminuent (S₀.₅), ce qui augmente l’affinité de l’enzyme pour le substrat → la courbe se déplace vers la gauche. Ils peuvent aussi augmenter nH (coopérativité renforcée).
Inhibiteurs allostériques : augmentent (S₀.₅), ce qui diminue l’affinité pour le substrat → la courbe se déplace vers la droite. Ils peuvent aussi réduire nH (coopérativité atténuée).
Ainsi, l’équation de Hill permet de quantifier à la fois la coopérativité (nH) et l’affinité apparente de l’enzyme (S₀.₅).
im occ





III – Allostérie
4) La coopérativité et l’équation de Hill
Qu’est-ce qui distingue la glucokinase des autres hexokinases en termes de cinétique enzymatique ?
Pourquoi la glucokinase (hexokinase IV) présente-t-elle une coopérativité apparente malgré le fait qu’elle soit une enzyme monomérique ?
Que signifie le concept d’allostérie appliqué à la glucokinase ?
Que désigne le phénomène d’allokaïry et en quoi diffère-t-il de l’allostérie classique ?
Comment la transition entre les états binding-incompetent et binding-competent de la glucokinase influence-t-elle son activité catalytique (kcat) ?
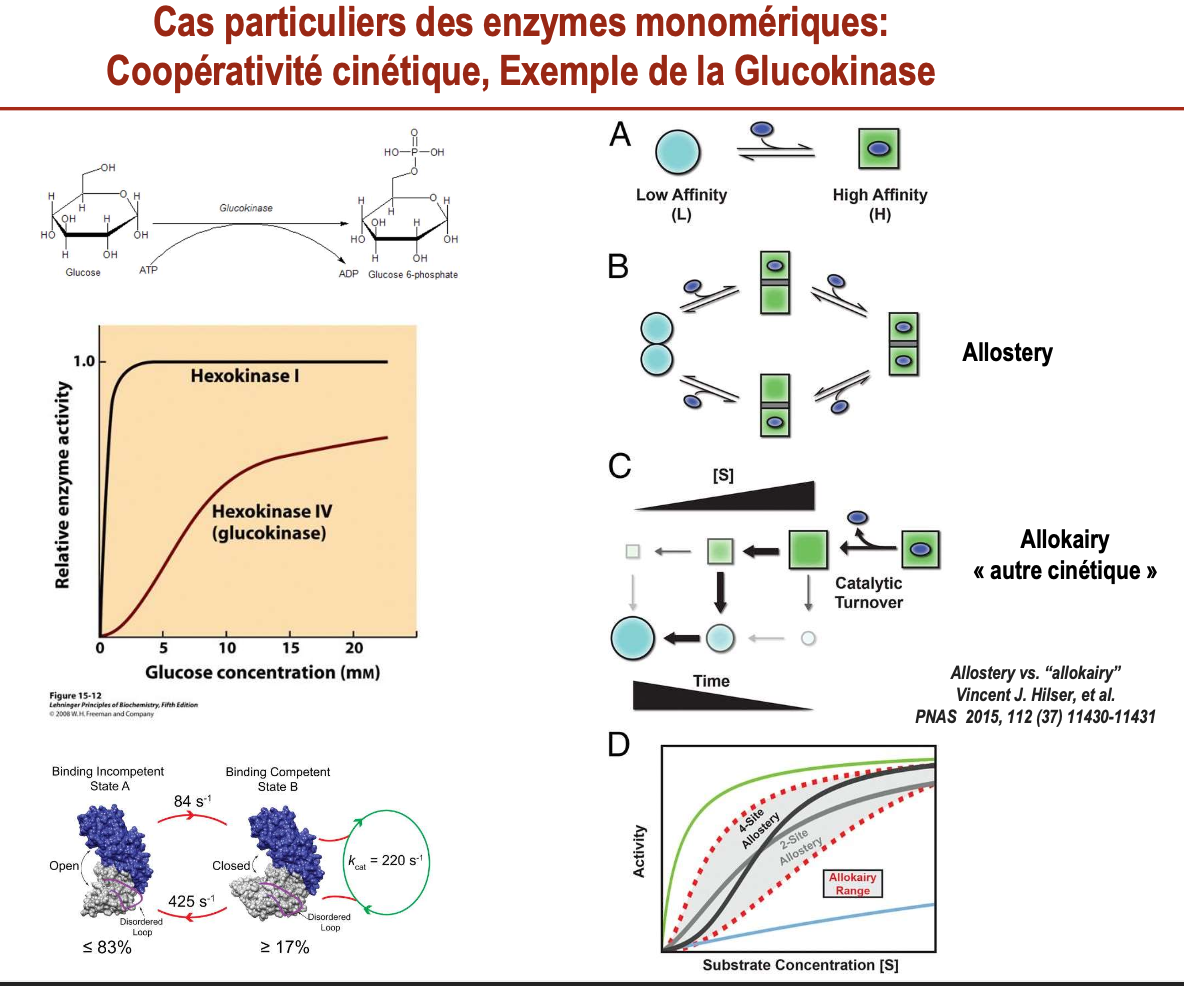
Différence entre glucokinase et autres hexokinases :
Les hexokinases I–III suivent une cinétique Michaelienne classique (courbe hyperbolique).
La glucokinase (hexokinase IV), spécifique du foie et du pancréas, présente une cinétique sigmoïde, indiquant une forme de coopérativité apparente vis-à-vis du glucose.
Coopérativité apparente chez une enzyme monomérique :
Bien que la glucokinase soit une enzyme monomérique (un seul site actif), elle montre une cinétique coopérative due à un mécanisme particulier.
Cela résulte de transitions lentes entre différents états conformationnels de l’enzyme (faible affinité ↔ forte affinité).
Cette cinétique particulière permet à la glucokinase de jouer un rôle de capteur de glucose, ajustant son activité selon la concentration en glucose.
Allostérie de la glucokinase :
L’allostérie classique repose sur la fixation d’un substrat ou effecteur qui influence la conformation d’autres sites.
Dans le cas de la glucokinase, l’allostérie reflète le passage réversible entre des états d’affinité différente pour le glucose.
Ainsi, la fixation du glucose déplace l’équilibre entre les états de faible et de forte affinité, produisant une réponse sigmoïde.
Allokaïry :
L’allokaïry est un phénomène cinétique particulier, décrit comme une autre forme de coopérativité distincte de l’allostérie.
Ici, l’histoire récente de l’enzyme (conformation adoptée précédemment) influence sa réactivité future → une sorte de mémoire cinétique.
Contrairement à l’allostérie, ce n’est pas seulement un équilibre statique entre conformations, mais une dynamique temporelle liée au turnover catalytique.
États conformationnels et activité catalytique :
La glucokinase alterne entre un état binding-incompetent (A) (enzyme ouverte, ne peut pas lier efficacement le glucose, 83 % du temps) et un état binding-competent (B) (enzyme fermée, capable de fixer le glucose, 17 % du temps).
La transition vers l’état B permet un cycle catalytique avec une vitesse kcat d’environ 220 s⁻¹.
Cette dynamique entre états détermine la cinétique sigmoïde de la glucokinase et explique sa sensibilité particulière aux variations de concentration en glucose.
IV – Régulations métaboliques
1) Généralités
Pourquoi la régulation du métabolisme est-elle indispensable ?
Quelles sont les principales situations environnementales nécessitant une adaptation métabolique ?
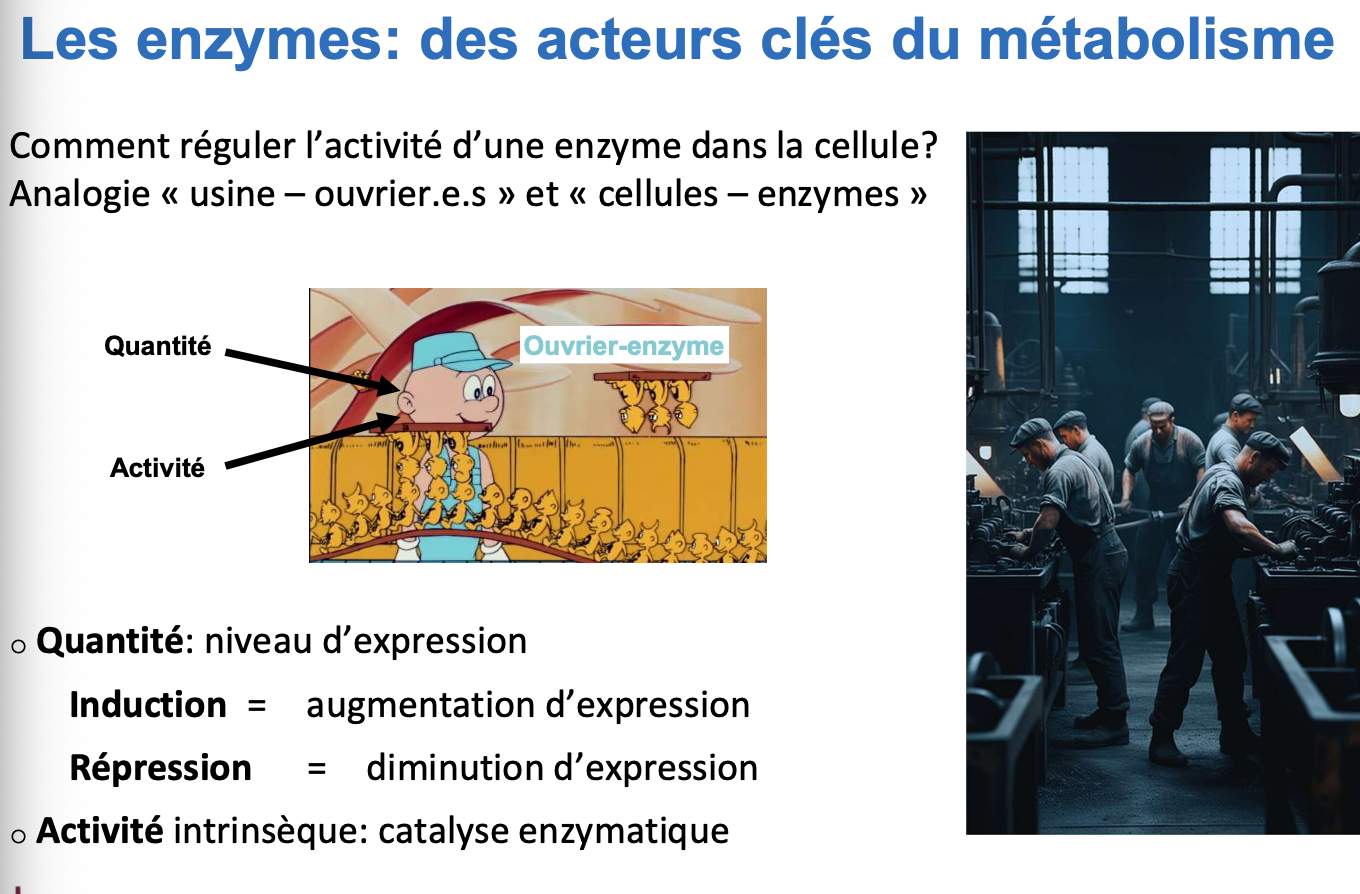
2) Les enzymes comme acteurs clés
Quelles sont les deux grandes manières de réguler l’activité enzymatique ?
Qu’entend-on par quantité d’enzyme et comment peut-elle être régulée ?
Qu’entend-on par activité enzymatique intrinsèque et comment peut-elle être modulée ?
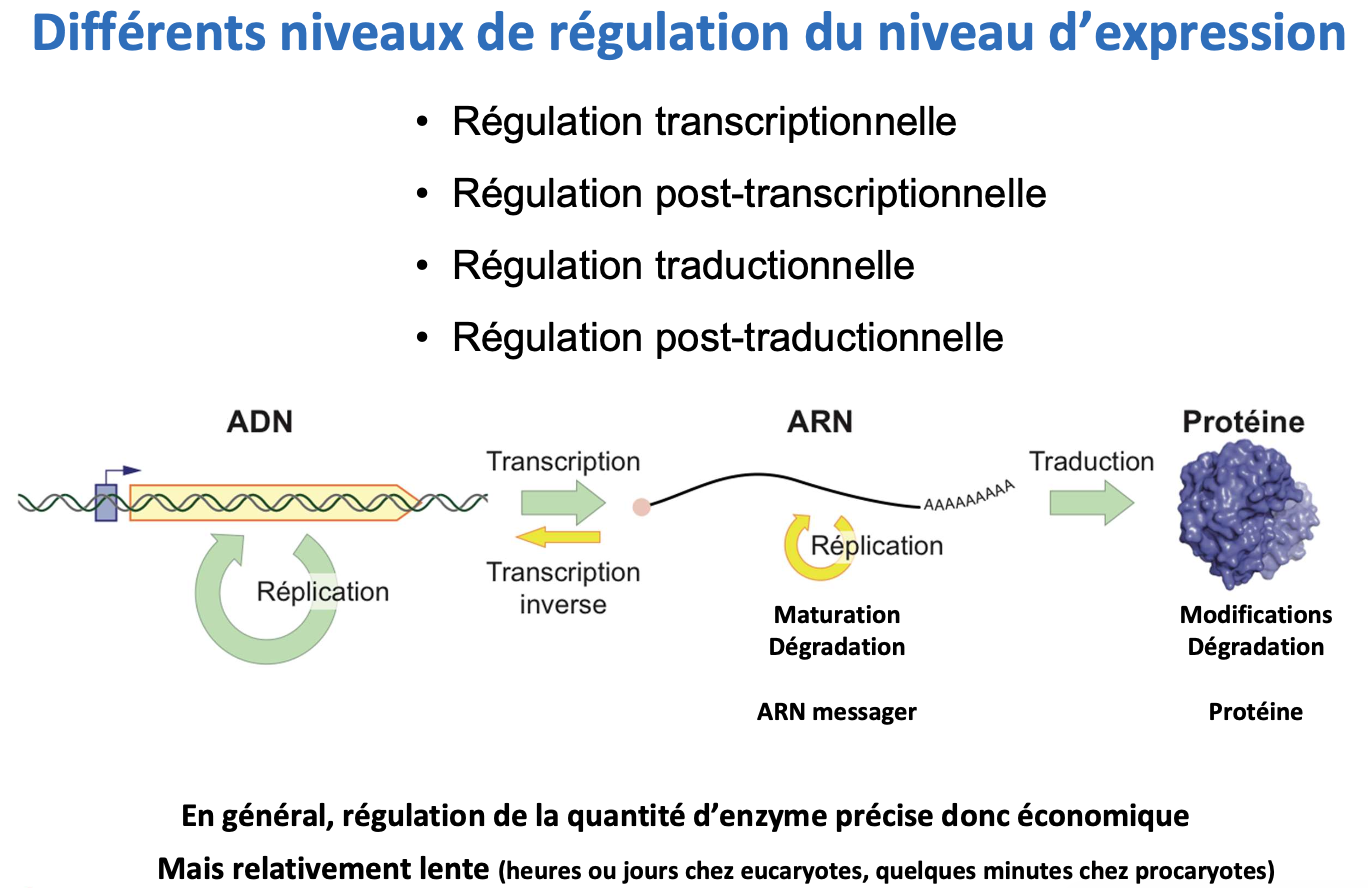
3) Niveaux de régulation de l’expression enzymatique
Quels sont les différents niveaux de régulation de l’expression d’une enzyme ?
Quels sont les avantages et limites d’une régulation au niveau de l’expression ?
4) Régulation de l’activité enzymatique
Pourquoi la régulation de l’activité enzymatique est-elle considérée comme plus rapide que la régulation de l’expression ?
Quelles enzymes d’une voie métabolique sont le plus souvent régulées ?
Quels sont les principaux types de régulation de l’activité enzymatique ?
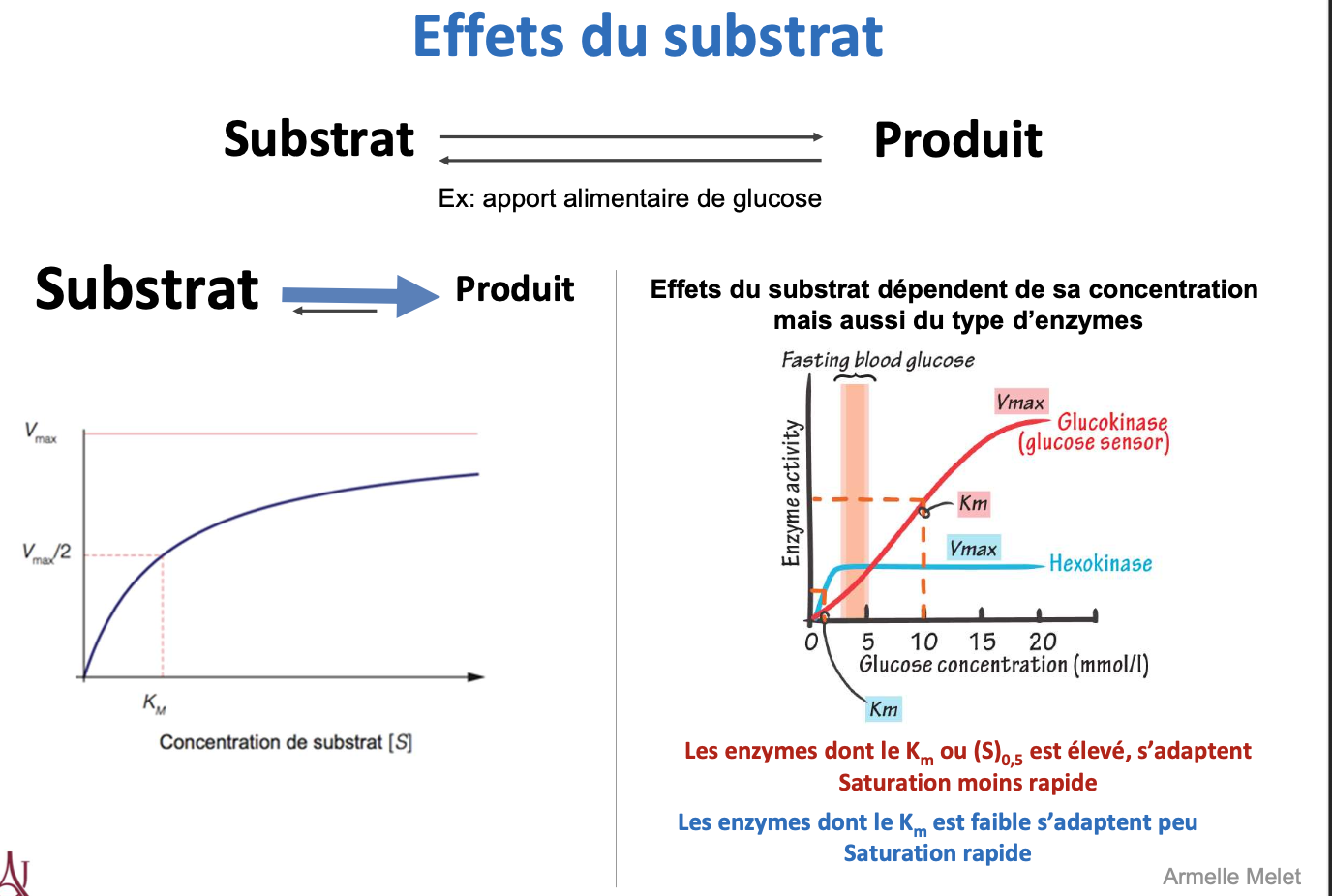
5) Effets du substrat
Comment le substrat peut-il influencer l’activité enzymatique ?
Quelle est la différence de comportement entre une enzyme à Km faible et une enzyme à Km élevé ?
En quoi la glucokinase et l’hexokinase illustrent-elles deux modes de régulation par le substrat ?


1) Généralités
La régulation du métabolisme est indispensable car, sans contrôle, les réactions biochimiques s’emballeraient, entraînant un déséquilibre énergétique et métabolique nuisible pour la cellule et l’organisme.
Les principales situations environnementales sont : le jeûne, la malnutrition (suralimentation ou sous-alimentation), l’activité sportive et le rythme circadien. Dans chacune de ces situations, l’organisme doit ajuster l’utilisation des substrats énergétiques et l’intensité des voies métaboliques.
2) Les enzymes comme acteurs clés
On peut réguler une enzyme de deux façons :
par sa quantité (niveau d’expression),
par son activité catalytique intrinsèque.
La quantité d’enzyme correspond au nombre de molécules enzymatiques présentes dans la cellule. Elle est modulée par :
induction (augmentation d’expression),
répression (diminution d’expression).
→ Cela agit sur le "nombre d’ouvriers" disponibles dans la cellule.
L’activité enzymatique intrinsèque correspond à la capacité catalytique d’une enzyme déjà présente. Elle peut être modulée par :
des modifications conformationnelles,
la présence d’effecteurs (activateurs ou inhibiteurs),
ou des modifications post-traductionnelles (phosphorylation, acétylation…).
→ Cela agit sur la "vitesse de travail" de chaque enzyme.
3) Niveaux de régulation de l’expression enzymatique
Les niveaux de régulation sont :
transcriptionnelle,
post-transcriptionnelle,
traductionnelle,
post-traductionnelle.
Avantages : permet une régulation fine et économique de la quantité d’enzyme.
Limites : processus relativement lent (minutes chez les procaryotes, heures ou jours chez les eucaryotes).
4) Régulation de l’activité enzymatique
Elle est plus rapide (secondes à minutes), car elle repose sur des modifications immédiates de protéines existantes (ex : phosphorylation, allostérie), sans nécessiter de nouvelle synthèse d’ARN ou de protéines.
Les premières enzymes d’une voie métabolique sont généralement régulées car elles contrôlent le flux global de la voie → ce sont les "points de contrôle" métaboliques.
Types de régulation :
par le substrat ou le produit,
par les effecteurs (allostérie),
par des protéines de contrôle,
par modifications covalentes (ex : phosphorylation),
par compartimentalisation cellulaire.
5) Effets du substrat
Le substrat agit comme un régulateur car sa concentration influence directement la vitesse enzymatique (selon la cinétique de Michaelis-Menten).
Enzymes à Km faible : haute affinité pour le substrat → saturation rapide → adaptées aux faibles concentrations de substrat.
Enzymes à Km élevé : faible affinité → saturation lente → adaptées aux fortes concentrations de substrat.
Hexokinase : Km faible → fonctionne efficacement même à faible [glucose] (maintient la glycolyse de base).
Glucokinase : Km élevé → agit surtout quand la [glucose] sanguine est élevée (après un repas), jouant un rôle de capteur métabolique.
Effet du substrat
Qu’est-ce que l’effet du substrat sur l’activité enzymatique ?
De quoi dépend l’effet du substrat ?
Comment se comporte une enzyme dont le Km est élevé face aux variations de substrat ?
Comment se comporte une enzyme dont le Km est faible face aux variations de substrat ?
Quel est l’exemple classique de comparaison entre glucokinase et hexokinase ?
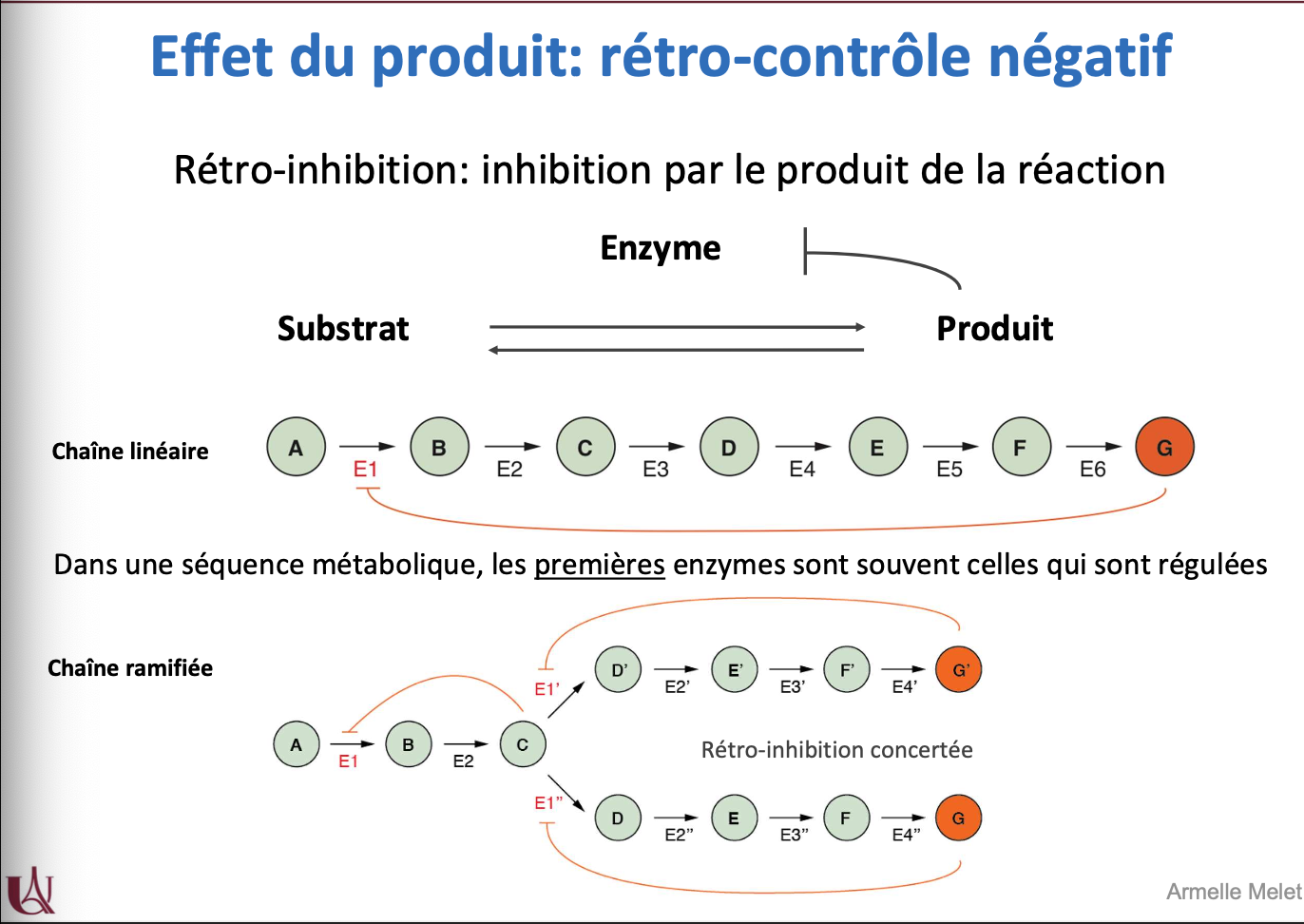
Effet du produit : rétro-contrôle négatif
Qu’est-ce que le rétro-contrôle négatif (ou rétro-inhibition) ?
Sur quelles enzymes agit préférentiellement le rétro-contrôle négatif ?
Quelle est la différence entre rétro-inhibition en chaîne linéaire et en chaîne ramifiée ?
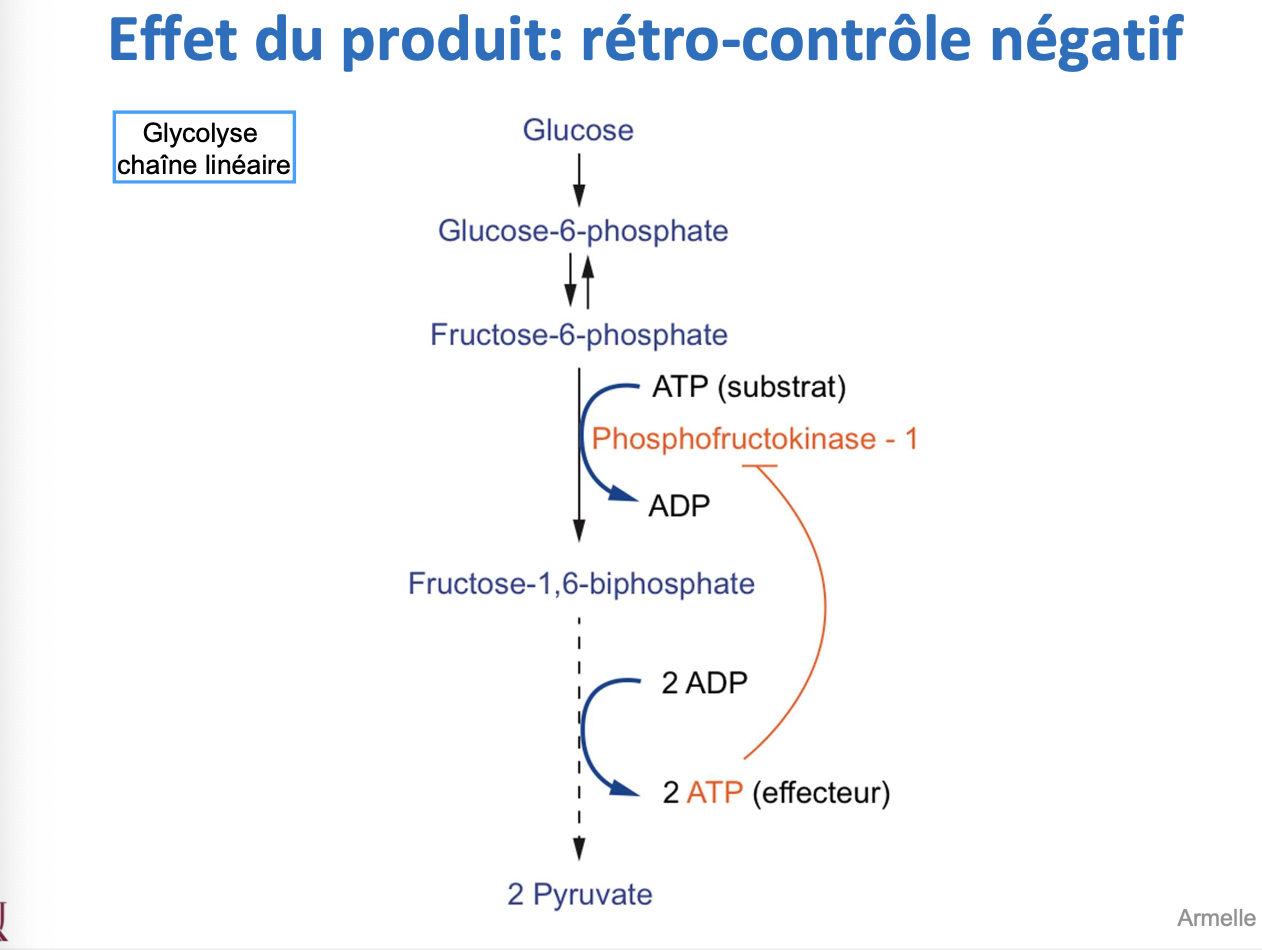
Quel est l’exemple classique de rétro-contrôle négatif dans la glycolyse ?
Quel est l’intérêt physiologique de la rétro-inhibition ?
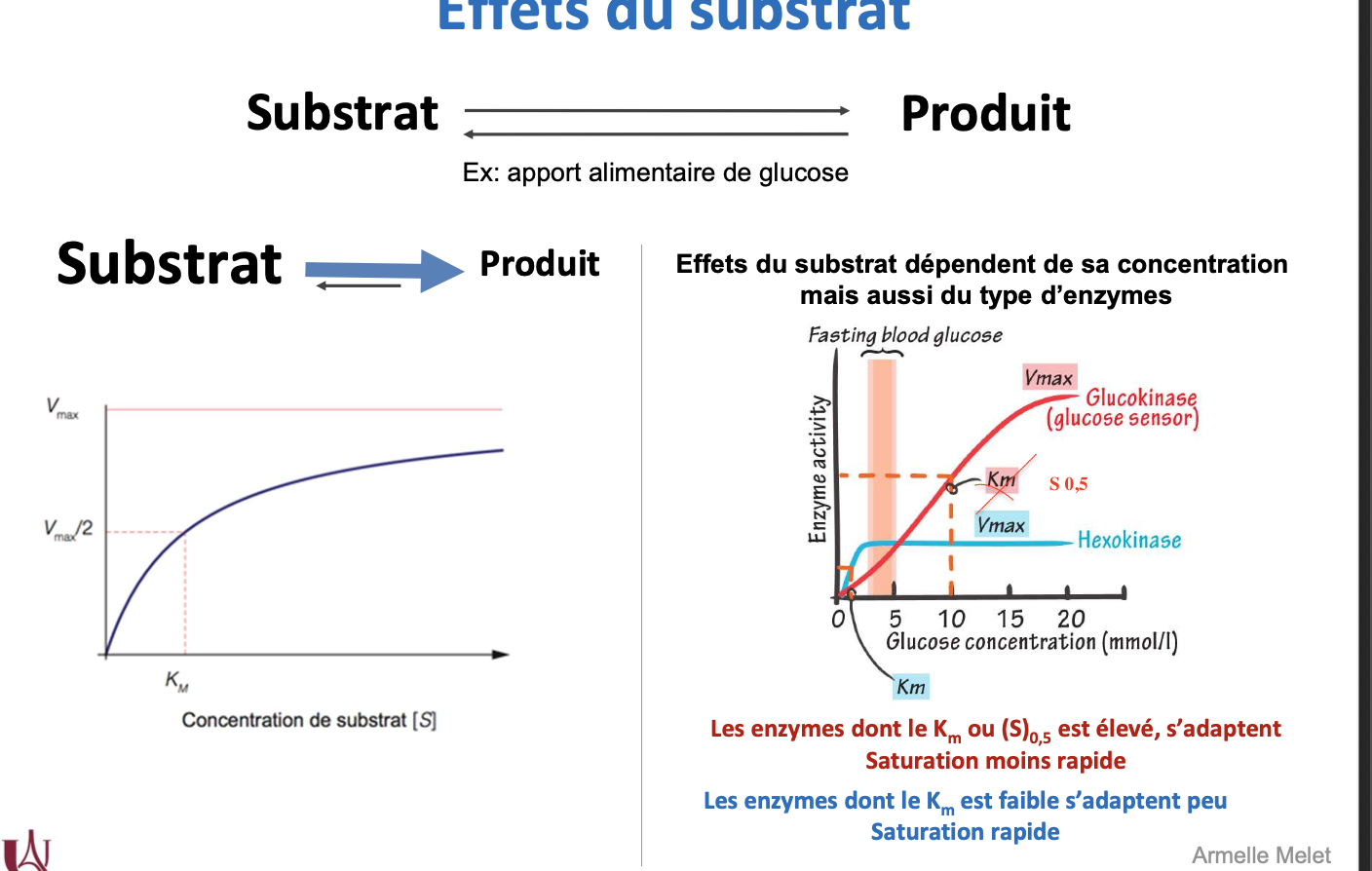
L’effet du substrat correspond à l’influence de la concentration en substrat sur la vitesse enzymatique (transition de l’état basal vers un état de saturation).
Il dépend à la fois de la concentration du substrat et du type d’enzyme (valeur du Km ou S0,5).
Une enzyme à Km élevé s’adapte progressivement aux variations de substrat → saturation plus lente, utile comme capteur (exemple : glucokinase).
Une enzyme à Km faible atteint rapidement sa Vmax → elle est saturée rapidement et donc peu sensible aux variations de substrat (exemple : hexokinase).
La glucokinase (Km élevé) agit comme capteur de glucose dans le foie, tandis que l’hexokinase (Km faible) assure une phosphorylation rapide même à faible concentration de glucose.
Effet du produit : rétro-contrôle négatif
Le rétro-contrôle négatif est l’inhibition d’une enzyme par le produit final de la voie métabolique → limite la production excessive.
Il agit surtout sur les premières enzymes de la voie métabolique, car ce sont elles qui contrôlent le flux global.
Dans une chaîne linéaire, le produit final inhibe la première enzyme (ex : A → B → ... → G, où G inhibe E1).
Dans une chaîne ramifiée, plusieurs produits peuvent rétro-inhiber différentes branches de manière concertée.
Exemple : dans la glycolyse, l’ATP agit comme produit et inhibe la phosphofructokinase-1 (PFK-1), empêchant une production excessive d’ATP.
Le rétro-contrôle négatif évite l’accumulation inutile de produits, permet une adaptation fine aux besoins cellulaires et économise l’énergie.
🔹 Régulation par les effecteurs Questions
Qu’est-ce qu’un effecteur enzymatique ? Quels types d’agents peuvent jouer ce rôle ?
Quelle est la différence entre un effecteur activateur et un effecteur inhibiteur ?
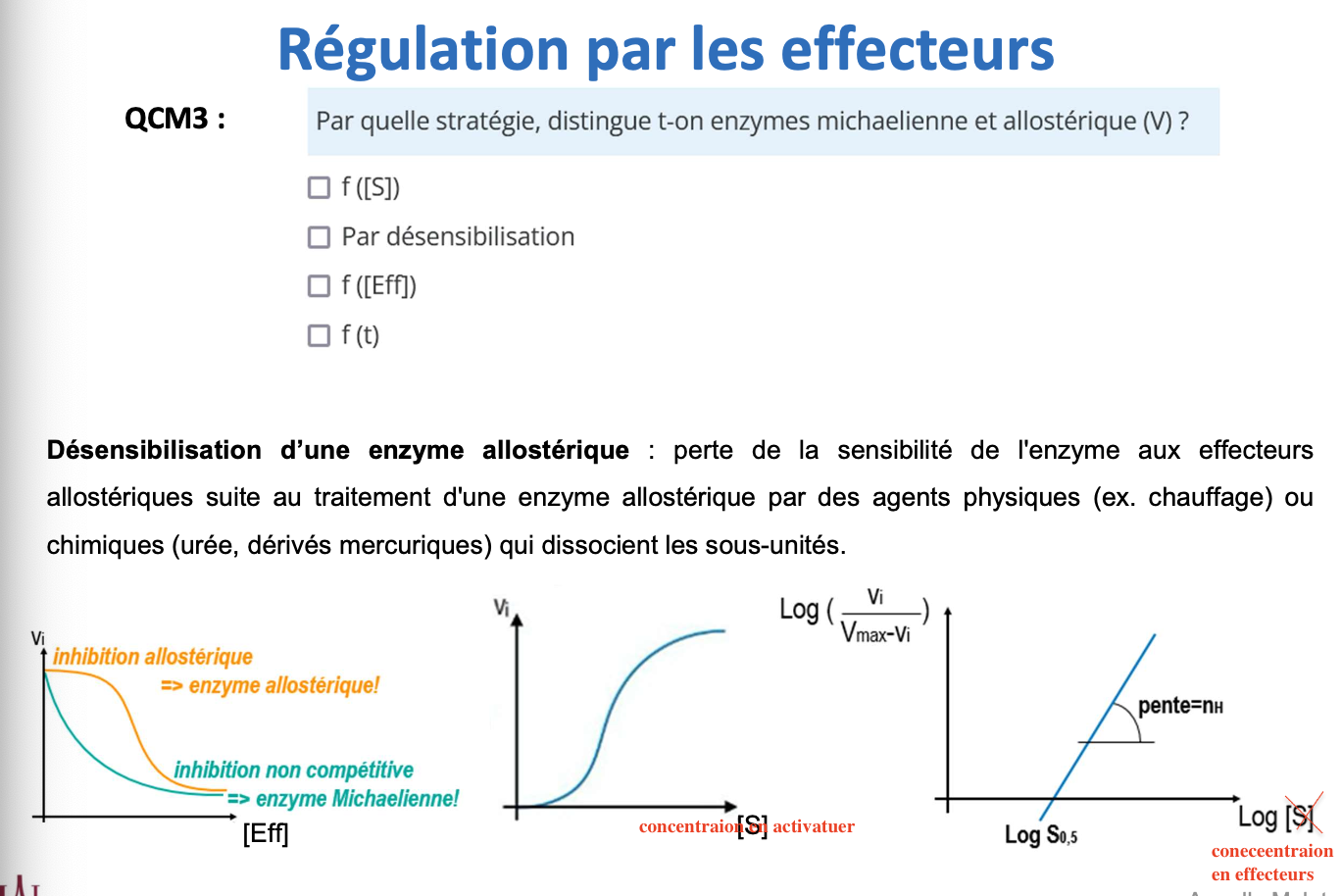
Comment distinguer une enzyme allostérique d’une enzyme Michaelienne grâce aux effecteurs ?
Qu’est-ce que la désensibilisation d’une enzyme allostérique et comment peut-elle être induite ?
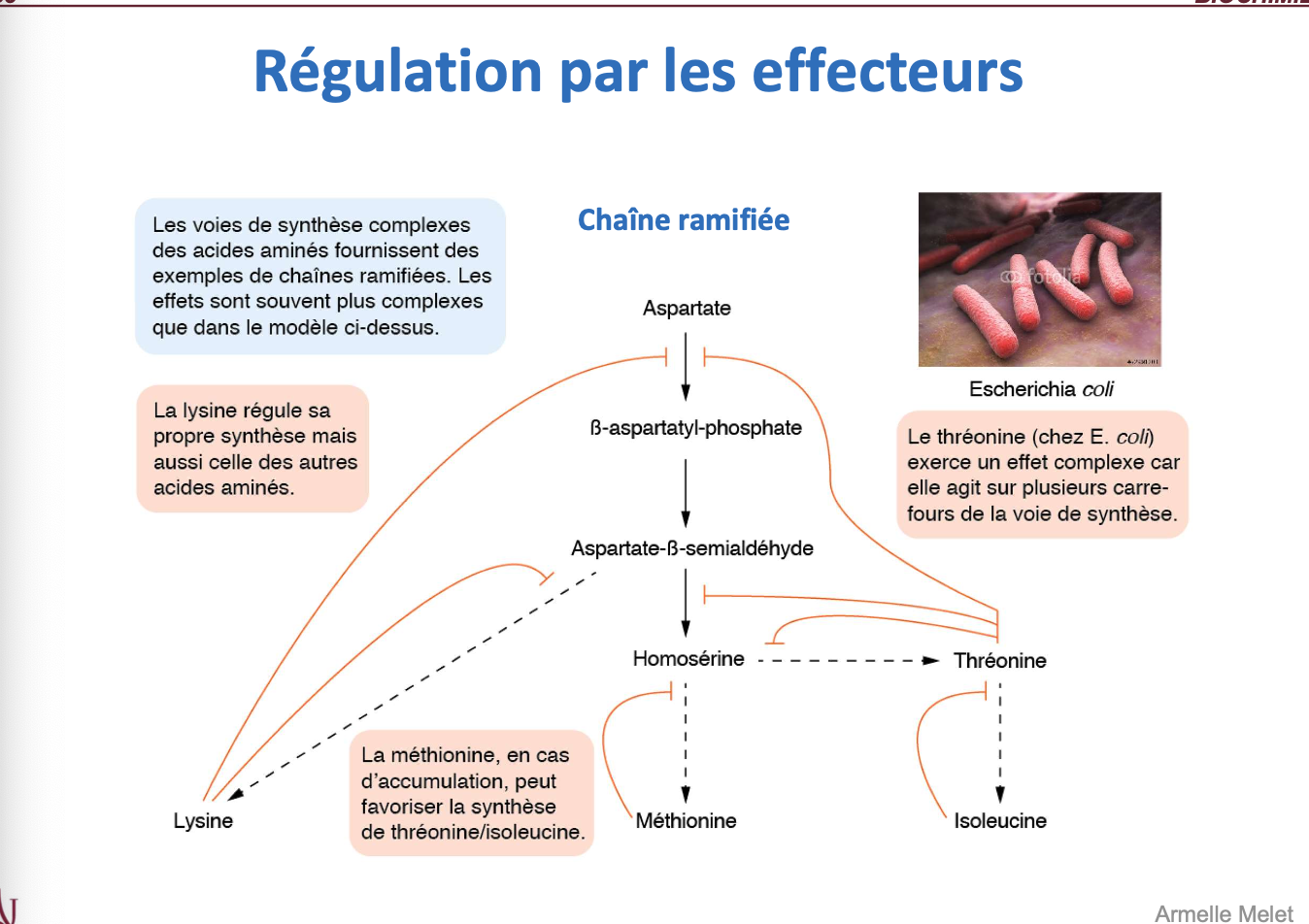
Dans une voie métabolique ramifiée, comment les effecteurs régulent-ils la synthèse des acides aminés (exemple de l’aspartate chez E. coli) ?
Quels types de rétrocontrôles peuvent exister dans les voies ramifiées (ex. lysine, thréonine, méthionine) ?
Comment les courbes d’activité enzymatique permettent-elles de visualiser la régulation par les effecteurs ?

Définition d’un effecteur enzymatique
Un effecteur enzymatique est une petite molécule (métabolite, cofacteur) ou un agent physique (température, pH, ions, etc.) qui se fixe sur une enzyme et en modifie l’activité catalytique.
Exemples : pH, T°, cofacteurs, ions métalliques, inhibiteurs, activateurs.
Ils agissent souvent à distance du site actif (site allostérique).
Activateur vs inhibiteur
Activateur : augmente l’activité enzymatique en facilitant la transition vers l’état actif (R), en abaissant la (S)0,5 ou en augmentant la Vmax.
Inhibiteur : diminue l’activité enzymatique en stabilisant l’état T (inactif), en augmentant la (S)0,5 ou en réduisant la Vmax.
Différence enzymes Michaeliennes vs allostériques via les effecteurs
Enzyme Michaelienne : répond classiquement par inhibition compétitive ou non compétitive, sans transition coopérative.
Enzyme allostérique : son activité change fortement en fonction des effecteurs → apparition de sigmoïdité, activation allostérique (diminution de (S)0,5), inhibition allostérique (augmentation de (S)0,5).
Désensibilisation d’une enzyme allostérique
C’est la perte de la sensibilité de l’enzyme à ses effecteurs.
Elle est provoquée par des agents physiques (ex : chauffage) ou chimiques (urée, mercuriques) qui dissocient les sous-unités oligomériques → l’enzyme se comporte alors comme une enzyme Michaelienne classique.
Voie ramifiée de l’aspartate (E. coli)
L’aspartate est le précurseur de plusieurs acides aminés (lysine, thréonine, isoleucine, méthionine).
La lysine peut inhiber sa propre voie de biosynthèse mais aussi influencer celles des autres AA.
La thréonine agit comme effecteur complexe sur plusieurs étapes.
La méthionine, en cas d’accumulation, peut favoriser la production de thréonine/isoleucine.
Types de rétrocontrôles dans les voies ramifiées
Rétro-inhibition spécifique : le produit final inhibe l’enzyme au début de sa propre voie.
Rétro-inhibition concertée : plusieurs produits finaux peuvent inhiber simultanément la même enzyme d’amont.
Régulation croisée : un produit influence la synthèse d’un autre (ex : méthionine favorisant thréonine).
Courbes d’activité enzymatique et effecteurs
En présence d’activateurs : déplacement de la courbe vers la gauche (diminution de (S)0,5), parfois augmentation de Vmax.
En présence d’inhibiteurs : déplacement vers la droite (augmentation de (S)0,5), parfois diminution de Vmax.
Désensibilisation : disparition de la sigmoïdité → la courbe devient hyperbolique (Michaelienne).
🔹 Régulation par des protéines de contrôle QUESTIONS
Qu’est-ce qu’une protéine de contrôle et comment agit-elle sur une enzyme ?
Quel est l’exemple classique de protéine de contrôle étudié et pourquoi est-elle importante ?
Quelles sont les principales cibles activées par la calmoduline ?
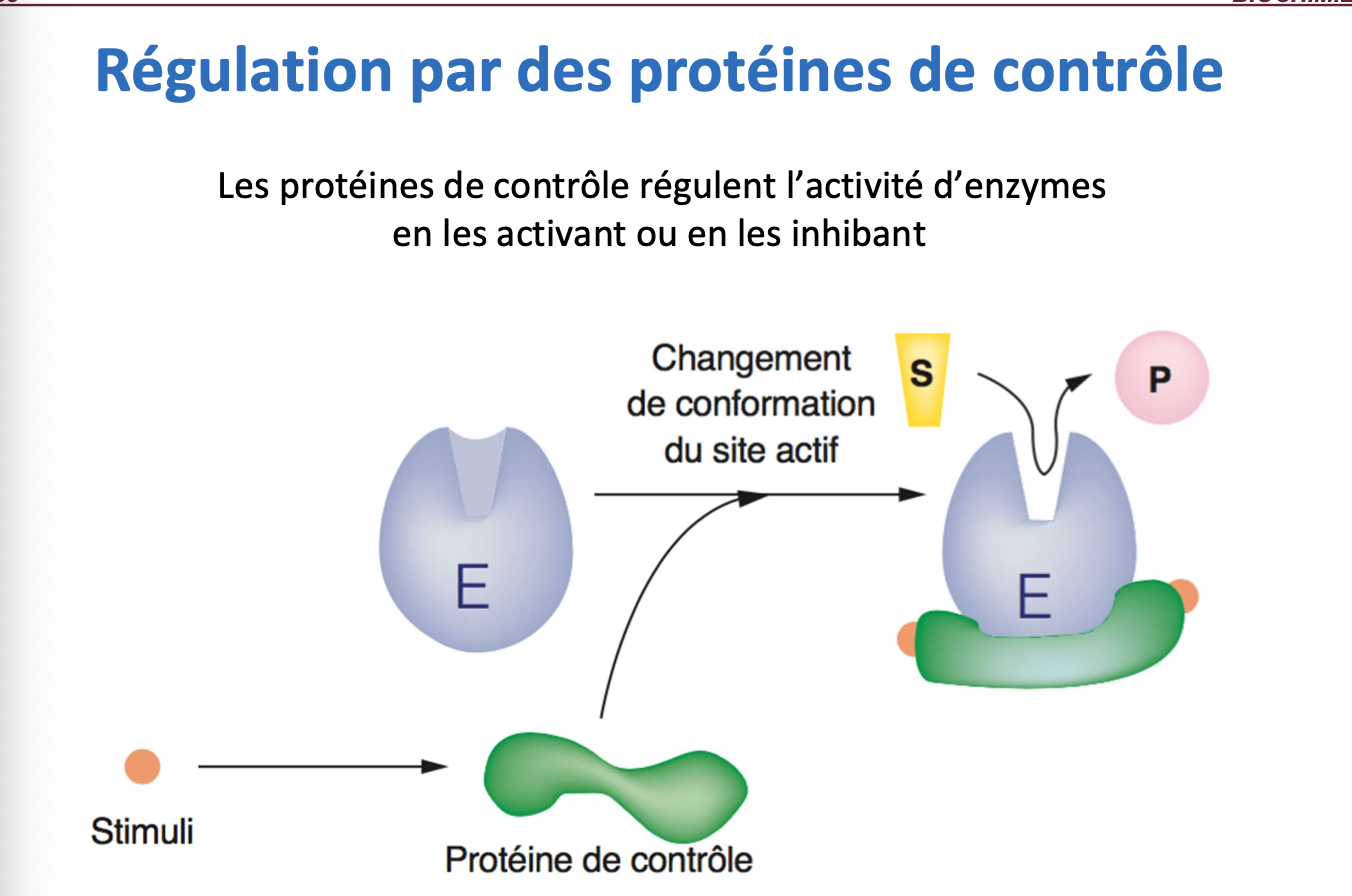
Les protéines de contrôle sont des protéines régulatrices qui modulent l’activité enzymatique. Elles se fixent sur l’enzyme et provoquent un changement de conformation du site actif, permettant soit l’activation (favoriser la fixation du substrat et la catalyse), soit l’inhibition (empêcher la fixation du substrat). Elles permettent donc une régulation fine, rapide et réversible de l’activité enzymatique en réponse à des signaux cellulaires.
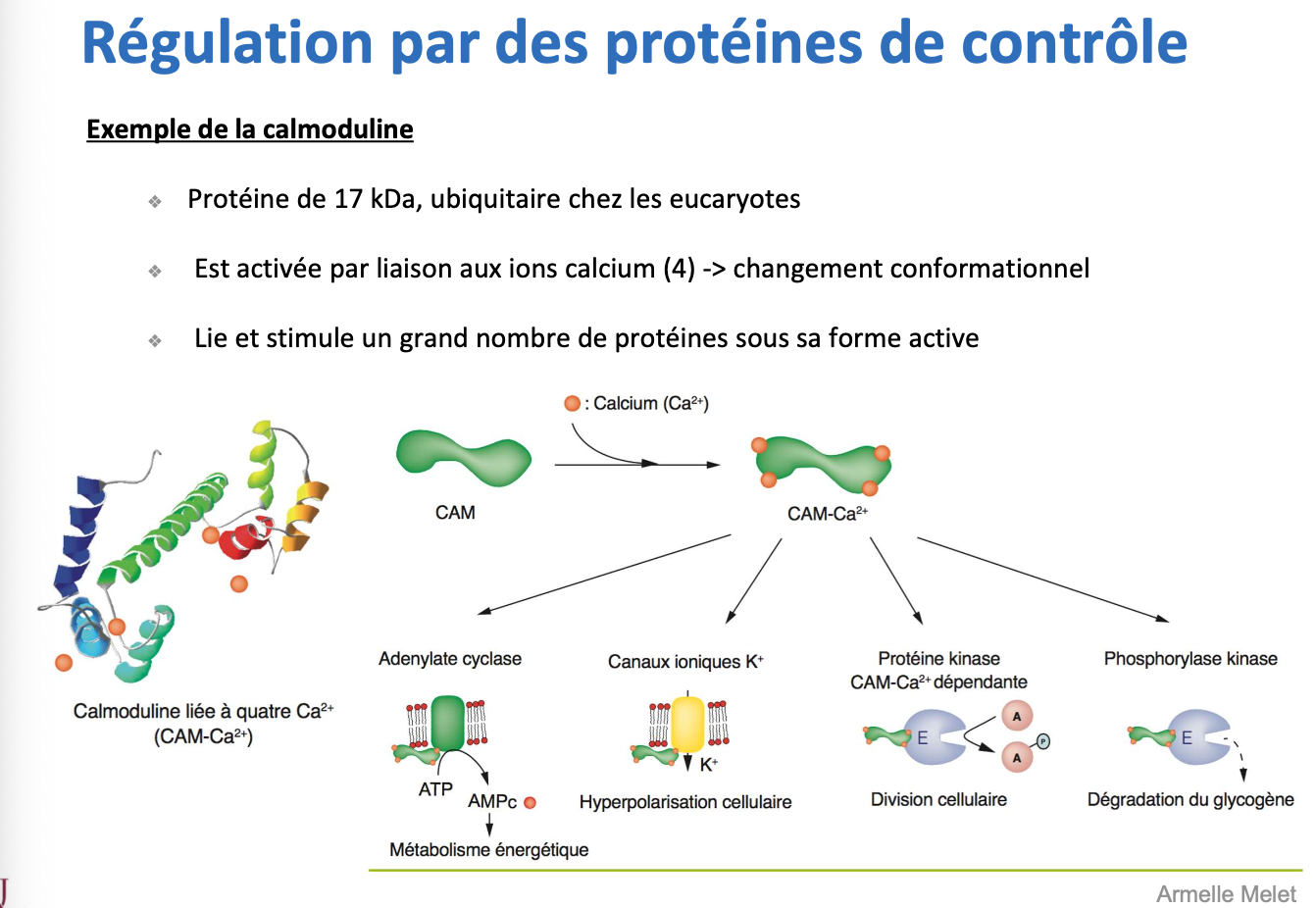
L’exemple type est la calmoduline (CaM) :
Petite protéine de 17 kDa, ubiquitaire chez les eucaryotes.
Elle est activée par la liaison de 4 ions Ca²⁺, induisant un changement conformationnel.
Une fois activée (CAM-Ca²⁺), elle se lie à de nombreuses protéines cibles et les stimule.
👉 Elle est cruciale car elle traduit les variations de calcium intracellulaire en une réponse métabolique ou physiologique adaptée.
Les principales cibles activées par la calmoduline sont :
Adénylate cyclase → augmente la production d’AMPc, donc la signalisation métabolique.
Canaux potassiques (K⁺) → provoque une hyperpolarisation membranaire.
Protéines kinases CAM-Ca²⁺ dépendantes → régulent la signalisation intracellulaire et la division cellulaire.
Phosphorylase kinase → stimule la dégradation du glycogène, libérant du glucose pour répondre aux besoins énergétiques.
Ainsi, la calmoduline est un nœud central de régulation, capable de coordonner des réponses multiples via le calcium.
🔹 Régulation par modifications covalentes
1. Principes généraux
Q1. Qu’est-ce que la régulation par modification covalente ?
Q2. Quels types de modifications covalentes peuvent activer ou inhiber une enzyme ?
2. Régulation par phosphorylation réversible
Q3. Comment fonctionne la cascade de phosphorylation impliquant l’AMPc et la PKA ?
Q4. Quel est le rôle de l’AMPc dans cette cascade ?
Q5. Quels sont les effets cellulaires d’une phosphorylation réversible ?
3. Exemple : cascade du glucagon
Q6. Comment le glucagon active la dégradation du glycogène par phosphorylation ?
Q7. Comment agit la cascade transcriptionnelle déclenchée par le glucagon ?
4. Régulation par protéolyse limitée (modification covalente irréversible)
Q8. Qu’est-ce que la régulation par protéolyse limitée ?
Q9. Quels sont des exemples d’enzymes activées par protéolyse limitée ?
Q10. Comment se déroule l’activation de la trypsine et de la pepsine ?
🔹 Régulation par modifications covalentes 1. Principes généraux
Q1. Qu’est-ce que la régulation par modification covalente ?
Q2. Quels types de modifications covalentes peuvent activer ou inhiber une enzyme ?
Réponses :
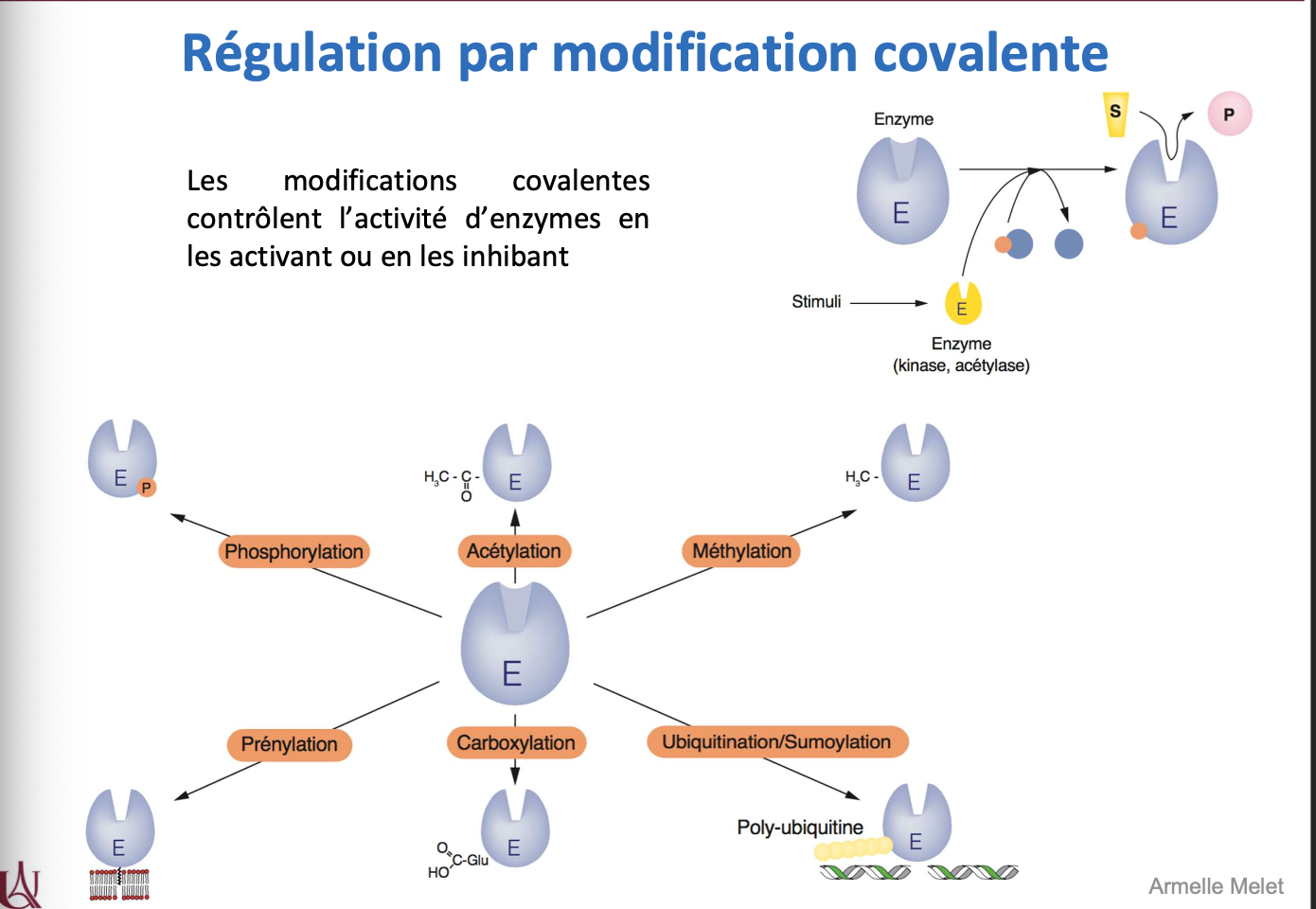
La régulation par modification covalente consiste en l’ajout ou le retrait réversible ou irréversible d’un groupement chimique sur une enzyme. Cela provoque un changement de conformation et donc de son activité (activation ou inhibition). Elle permet une régulation fine et rapide de l’activité enzymatique.
Exemples de modifications covalentes : phosphorylation, acétylation, méthylation, carboxylation, prén ylation, ubiquitination/sumoylation. Ces modifications servent à moduler l’activité, la localisation, ou la stabilité de l’enzyme.
2. Régulation par phosphorylation réversible
Q3. Comment fonctionne la cascade de phosphorylation impliquant l’AMPc et la PKA ?
Q4. Quel est le rôle de l’AMPc dans cette cascade ?
Q5. Quels sont les effets cellulaires d’une phosphorylation réversible ?
Réponses :
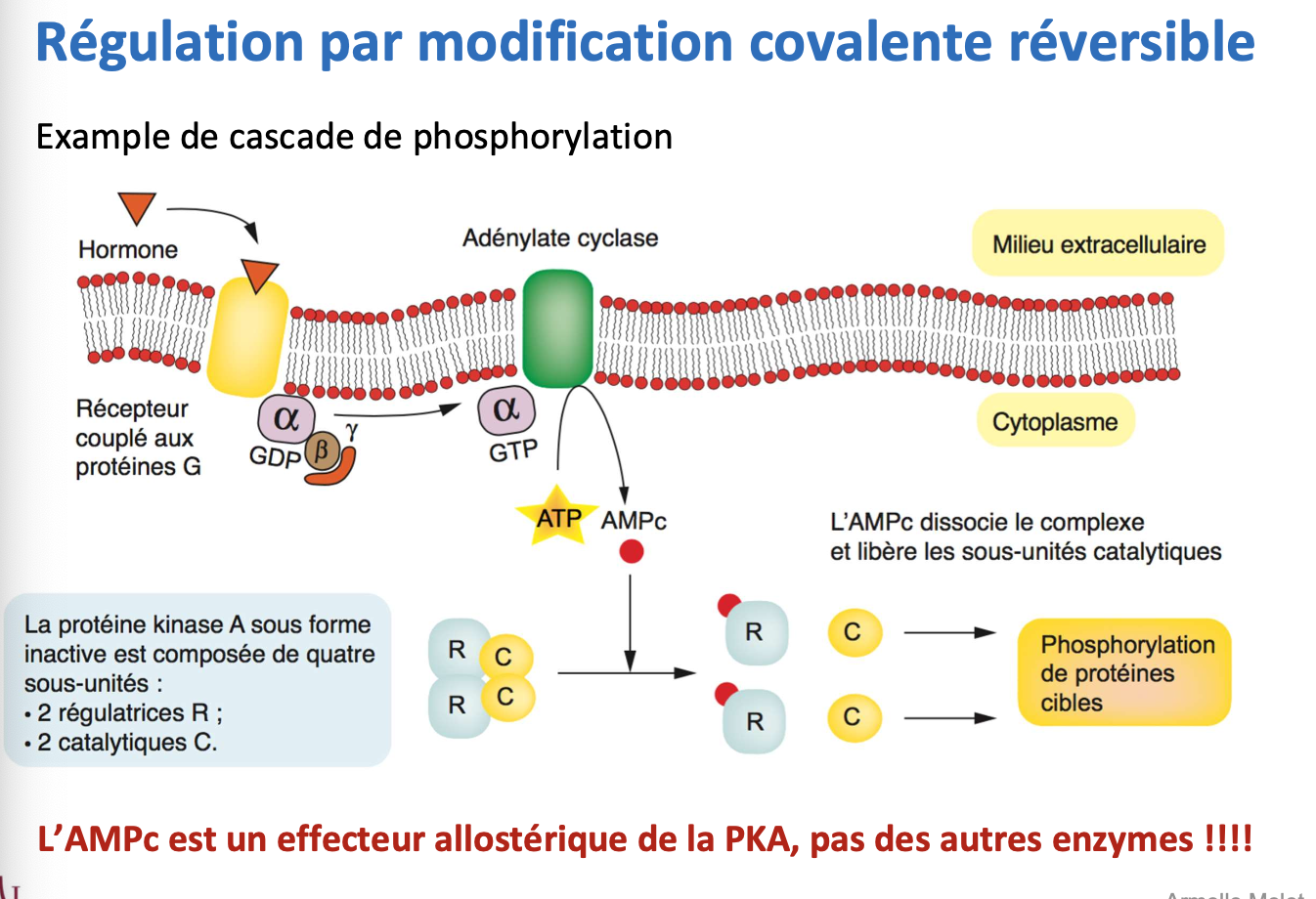
3. Une hormone (ex : adrénaline ou glucagon) se fixe sur un récepteur couplé aux protéines G. Cela active l’adénylate cyclase, qui convertit l’ATP en AMPc. L’AMPc agit sur la protéine kinase A (PKA) en dissociant ses sous-unités régulatrices (R) et catalytiques (C). Les sous-unités catalytiques libres phosphorylent ensuite diverses protéines cibles, modifiant leur activité.
4. L’AMPc est un effecteur allostérique de la PKA : il ne régule pas directement les enzymes cibles, mais active la PKA qui va ensuite phosphoryler d’autres protéines.
5. Les effets de la phosphorylation réversible incluent : activation ou inhibition d’enzymes métaboliques (ex : phosphorylase kinase dans la dégradation du glycogène), régulation transcriptionnelle via des facteurs comme CREB, modulation de l’activité des canaux ioniques, et contrôle du métabolisme énergétique.
3. Exemple : cascade du glucagon
Q6. Comment le glucagon active la dégradation du glycogène par phosphorylation ?
Q7. Comment agit la cascade transcriptionnelle déclenchée par le glucagon ?
Réponses :
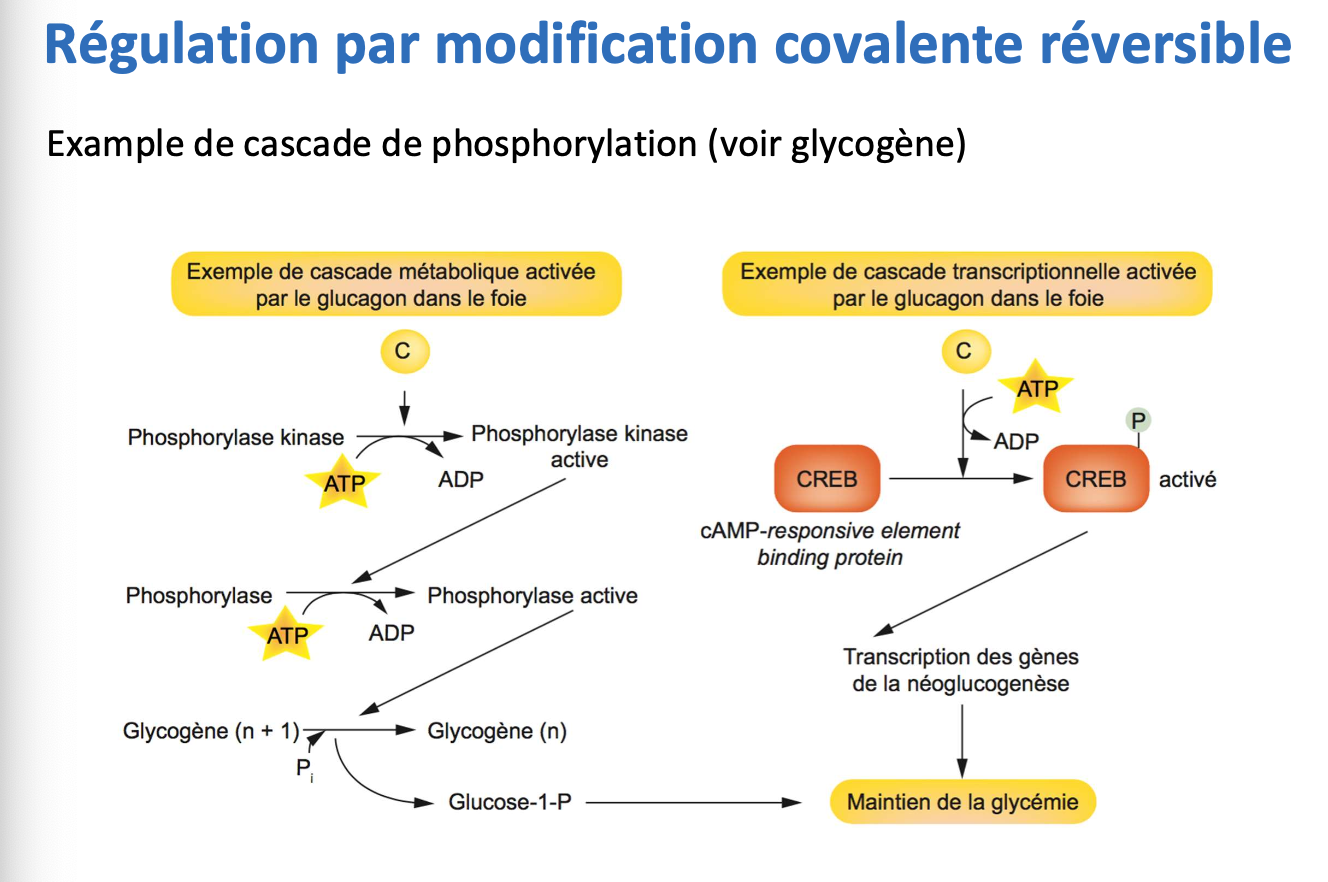
6. Le glucagon active la PKA via l’AMPc. La PKA phosphoryle la phosphorylase kinase, qui devient active. Cette dernière phosphoryle à son tour la phosphorylase, activant la dégradation du glycogène en glucose-1-phosphate, disponible pour la production d’énergie.
7. Le glucagon via l’AMPc active aussi la phosphorylation du facteur de transcription CREB. CREB phosphorylé se fixe à l’ADN et stimule la transcription de gènes impliqués dans la néoglucogenèse, assurant le maintien de la glycémie.
4. Régulation par protéolyse limitée (modification covalente irréversible)
Q8. Qu’est-ce que la régulation par protéolyse limitée ?
Q9. Quels sont des exemples d’enzymes activées par protéolyse limitée ?
Q10. Comment se déroule l’activation de la trypsine et de la pepsine ?
Réponses :
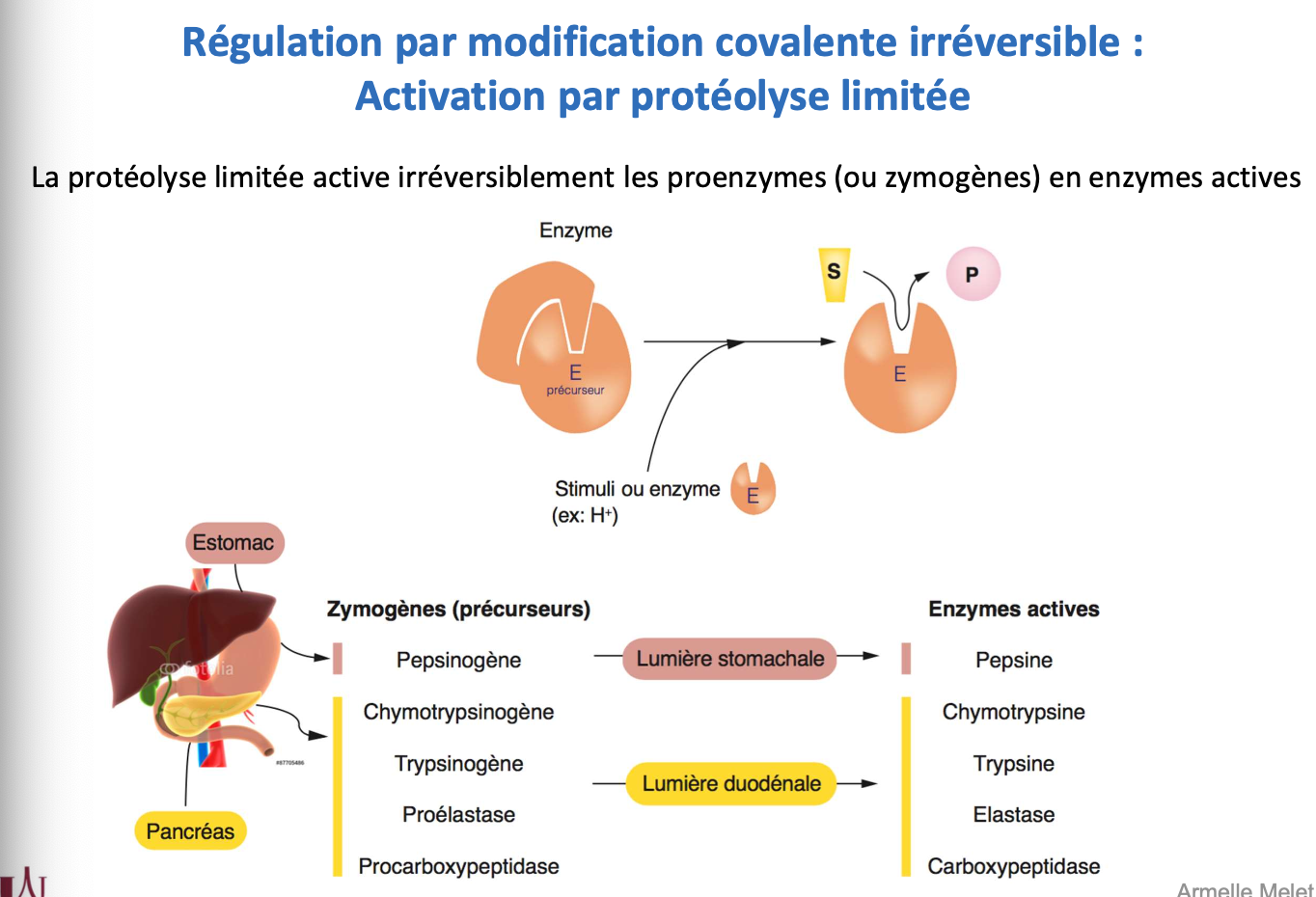
8. La protéolyse limitée consiste à cliver irréversiblement un précurseur enzymatique inactif appelé zymogène pour le transformer en enzyme active. C’est une activation définitive.
9. Exemples : pepsinogène → pepsine (estomac), trypsinogène → trypsine, chymotrypsinogène → chymotrypsine, proélastase → élastase, procarboxypeptidase → carboxypeptidase (pancréas).
10.
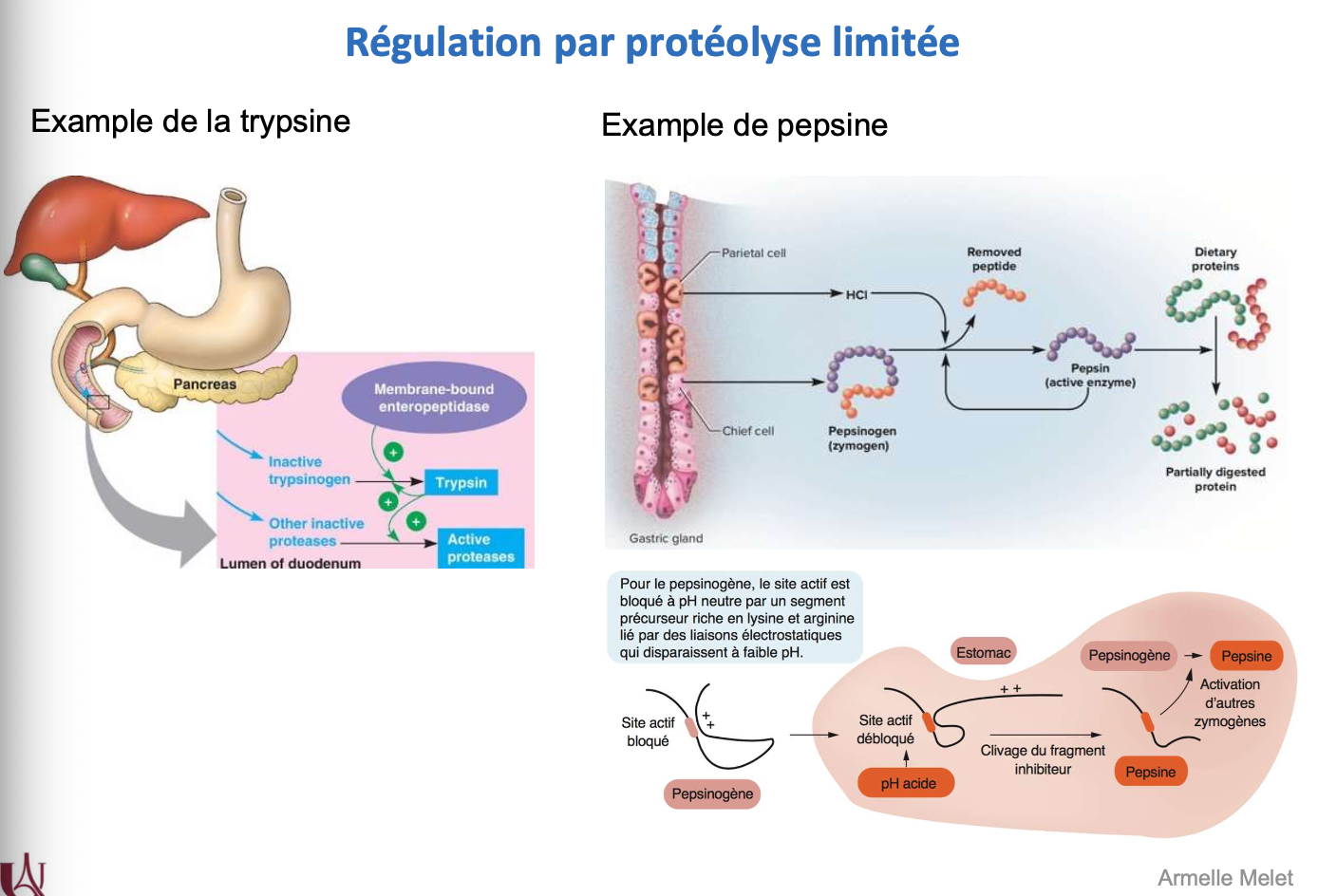
Trypsine : le trypsinogène est activé par une entéropeptidase membranaire dans le duodénum, puis active d’autres protéases pancréatiques.
Pepsine : le pepsinogène est activé par le pH acide de l’estomac qui déstabilise un segment inhibiteur et libère le site actif, permettant son auto-activation et la digestion des protéines.
A. Organisation de l’estomac des ruminants
1) Quelle est la particularité de l’estomac des ruminants ?
2) Quel est le rôle de chaque compartiment (panse, bonnet, feuillet, caillette) ?
B. Caillette et enzymes digestives
3) Qu’est-ce que la caillette et à quoi correspond-elle par rapport aux mammifères monogastriques ?
4) Quelles enzymes sont présentes dans la caillette et quel est leur rôle ?
C. Utilisation de la pepsine et de la chymosine
5) Quelle était l’utilisation ancestrale de la pepsine ?
6) Quel est le rôle spécifique de la chymosine (présure) chez le veau ?
7) Comment évolue la proportion de chymosine et de pepsine avec l’âge chez le ruminant ?

A. Organisation de l’estomac des ruminants
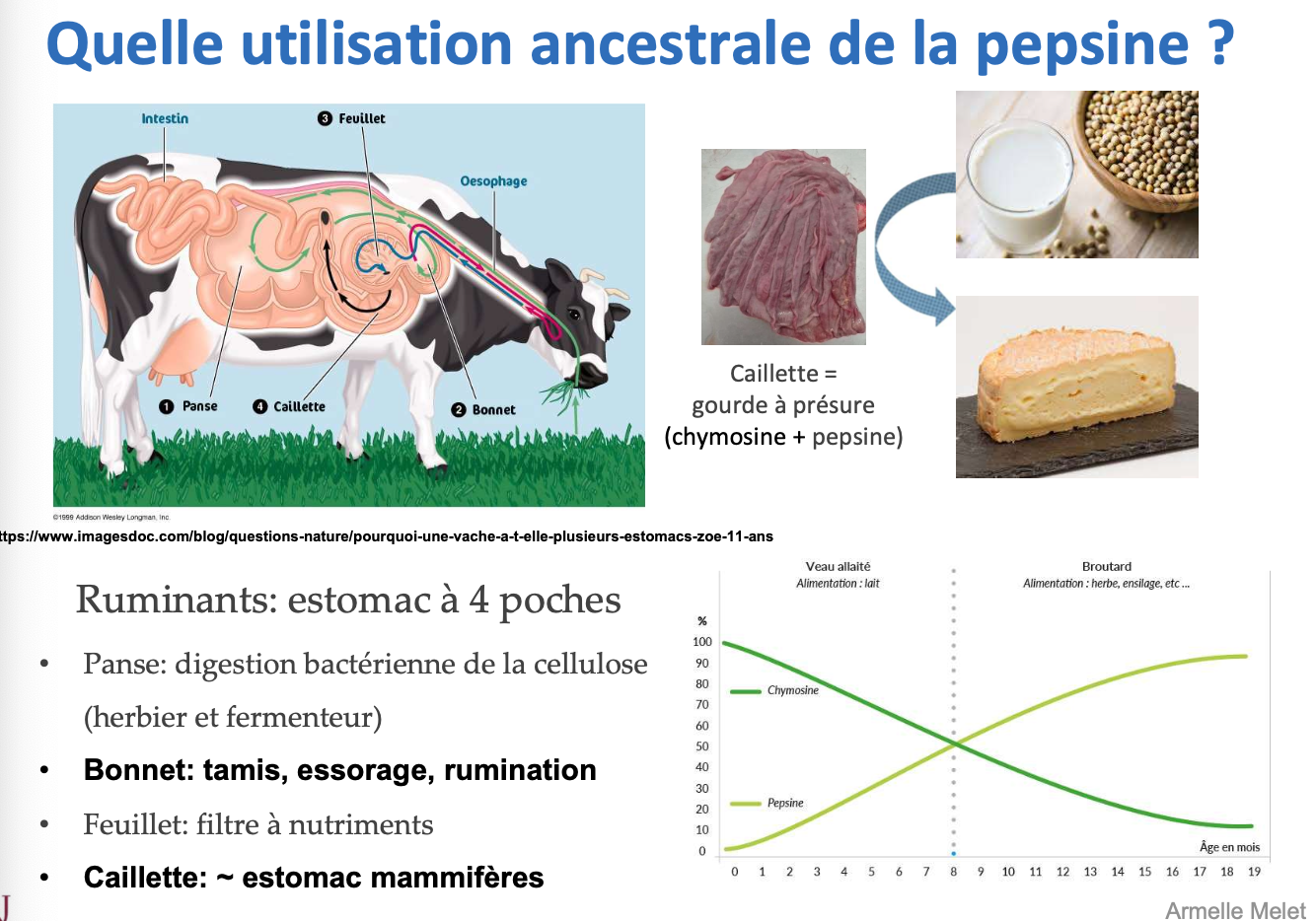
L’estomac des ruminants est composé de quatre poches : la panse (rumen), le bonnet (réticulum), le feuillet (omasum) et la caillette (abomasum).
Panse : lieu de digestion bactérienne de la cellulose grâce à la flore microbienne → fermentation.
Bonnet : joue un rôle de tamis, participe à l’essorage et à la rumination.
Feuillet : agit comme un filtre permettant l’absorption des nutriments.
Caillette : véritable estomac glandulaire comparable à celui des mammifères monogastriques, sécrète pepsine et chymosine.
B. Caillette et enzymes digestives
La caillette est l’équivalent de l’estomac des mammifères classiques chez les ruminants.
On y trouve la pepsine, qui dégrade les protéines, et la chymosine (ou présure), qui coagule les protéines du lait pour faciliter sa digestion chez le jeune ruminant.
C. Utilisation de la pepsine et de la chymosine
L’utilisation ancestrale de la pepsine est la digestion des protéines alimentaires. Elle est également exploitée traditionnellement (avec la chymosine) pour la fabrication de fromages à partir de la caillette séchée (présure).
La chymosine permet de coaguler la caséine du lait, ce qui ralentit le transit et facilite sa digestion par le veau.
Chez le veau, la chymosine est majoritaire et la pepsine peu abondante. Avec l’âge, la proportion de pepsine augmente progressivement, tandis que la chymosine diminue, car l’alimentation passe du lait aux végétaux (ensilage, herbe, etc.).