Transduction du signal 2
1/62
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
63 Terms
En quoi consiste la cascade de phosphorylation impliquant les kinases et qu est ce que ca permet ?
Les kinases se phosphorylent entre elles en cascade. Ca permet d amplifier le signal
Est ce que la proteine G a besoin de GAP pour s hydrolyser ?
Non, elle pourrait le faire toute seule mais ca prendrait beaucoup de temps
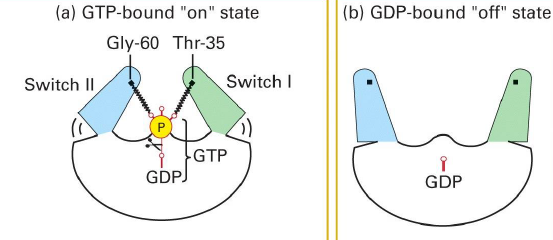
Comment est ce que la proteine G change de conformation en fonction de son hydrolyse du GTP ou pas ?
La proteine G contient des regions comme switch I et switch II qui controlent la conformation de la proteine G lorsqu elle est liee au GTP, ce qui lui permet d’interagir avec les proteines cibles

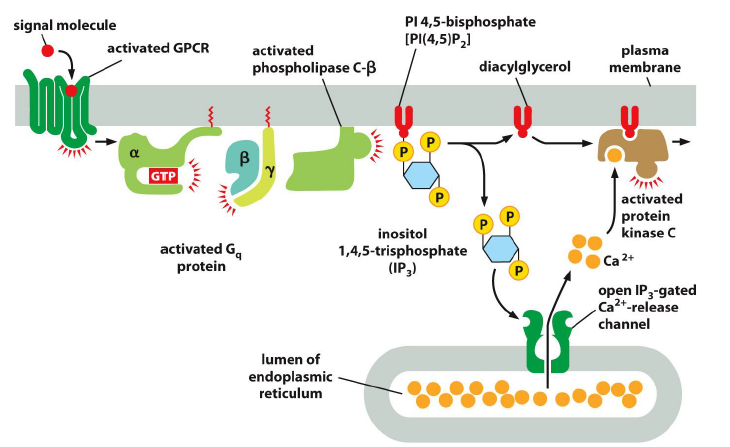
Comment agissent les phospholipases dans la transduction du signal ?
Elles clivent differentes liaisons dans les phospholipides, pour generer deux messagers secondaires de faible masse
Exemple de phospholipase et de produits obetenus ?
Phospholipase C (PLCbeta) qui clive le glycerole du phosphate de la molecule PlP2 (phosphatidylinositol 4,5-biphosphate), pour donner :
DAG (1,2 diaglycerol)
IP3 (inositol 1,4,5 triphosphate)
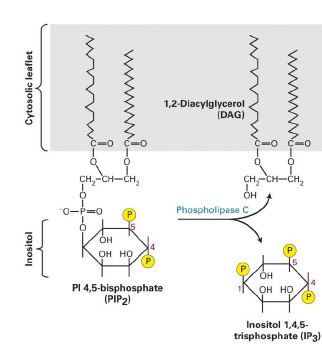

Comment est ce que le PlP2 est forme ?
A partir de la phosphorylation du PlP
Qu est ce qu un messager secondaire ?
Molecule de courte duree de vie et de faible masse moleculaire pour transmettre et amplifier le signal de nombreux recepteurs
Quel est la fonction de DAG ?
Controle l activite d’une Ser/Thr proteine kinase : proteine kinase C (PKC)
Quelle est la fonction de IP3 ?
Ouvrir les canaux de Ca2+ dans le RE
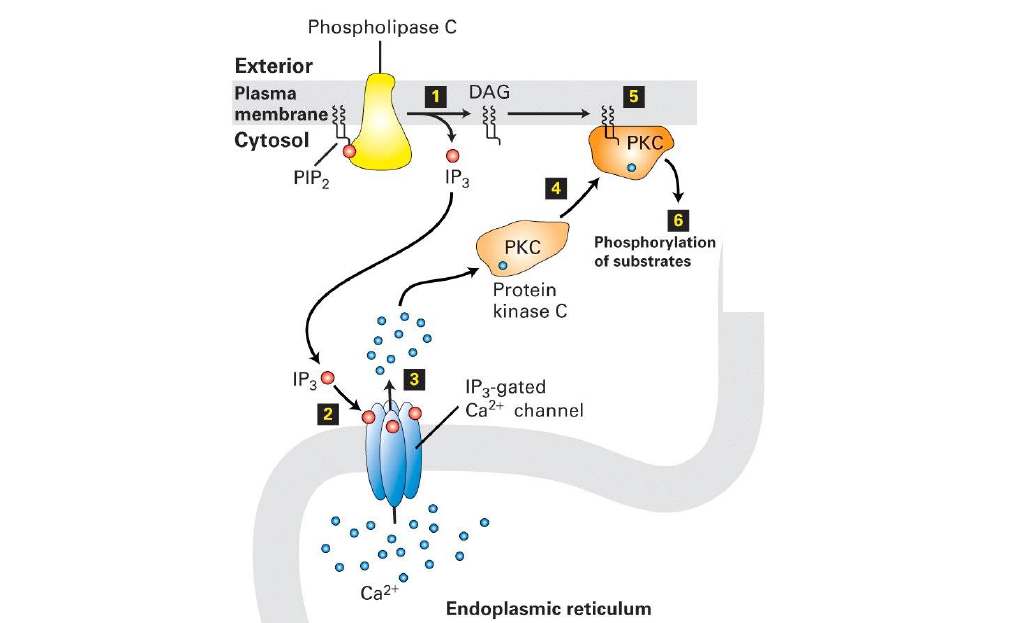
Quel est le processus qui suit le clivage de PIP2 ?
PlP2, ancrer a la membrane par sa chaine d’acides gras, est utilise comme substrat par la Phospholipase C
DAG reste ancre a la membrane et IP3 ouvre les canaux a calcium.
Activation de PKC, attachee a la membrane, par DAG et Ca2+

Ou sont localises les proteines de signalisation vis a vis recepteurs ?
Comme les proteines ne sont pas comme les petits messagers secondaires, ils ne peuvent pas diffuser rapidement vers les recepteurs. Ils doivent donc etre proches de leur cible en aval pour pouvoir fonctionner
Comment est ce que les proteines peuvent etre places en aval de l activation du recepteur ?
complexes de signalisation → regroupes a proximite des recepteurs
proteine echafaudage → organiser les molecules de signalisation sur une proteine echafaudage pour avoir un complexe preassemble
zones membranaires specifiques → regroupement des recpeteurs et leurs proteines de signalisation dans ces zones, comme les radeaux lipidiques
Exemple de complexe de signalisation echafaudage preassemble ?
Proteines echafaudage associee au GPCR
Si les complexes ne sont pas preformes, comment s assemblent les complexes de signalisation ?
formation d un echafaudage
activation de PlP locales, puis transmission du siganl
Processus de formation d un echafaudage pour les complexes qui s assemblent apres la reception du signal ?
Liaison du signal au recepteur induit l assemblage de proteines de signalisation intracellulaires sur les recepteurs actives, suite a une autophosphorylation, qui servent d echafaudage


Exemple de complexe de signalisation qui se forme apres la reception du signal et forme l echafaudage ?
TRK signaling
Processus d activation des PlP locales pour les compelxes de signalisation qui s assemblent apres la reception du signal ?
Le complexe signal-recepteur active les PlP locales, qui hyperphosphoryle les Pl, qui peuvent rassembler les proteines specifiques pour transmettre le signal
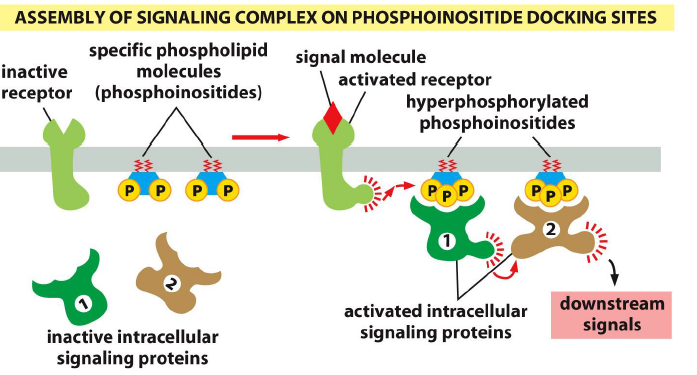

Exemple de recepteur qui active les PlP locales apres la reception du signal ?
Pl3 kinase
Ou se lient les proteines sur les autres proteines dans les complexes de signalisation et qu est ce que c est ?
Se lient sur les domaines de liaison, qui sont des sequences d’acides amines (>50aa) avec une sequence primaire un peu variable mais assez stable avec des structures secondaires stables
Quels sont les differents domaines de liaisons aux proteines ?
PDZ domains
SH2 et PTB domains
SH3 domains
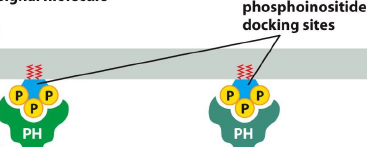
PH domains
Caracteristiques des PDZ domains ?
Domaines qui lient l’extrémité C-terminale des protéines membranaires cibles en reconnaissant des motifs spécifiques. Par ex. Ser/Thr-X-Φ ou Φ-X-Φ (où Φ = résidu hydrophobe (souvent Phe, Leu, Val))
Caracteristiques des SH2 et PTB domains ?
Domaines qui lient la phosphotyrosine dans un contexte de séquence spécifique.
Caracteristiques des SH3 domains ?
Domaines qui lient des sequences riches en proline
Caracteristiques des PH domains ?
Domaines qui se lient aux phosphoinositides, tels que le phosphatidylinositol phosphorylé.

2 moyens d inactiver un signal ?
Au niveau du recepteur
En aval du recepteur
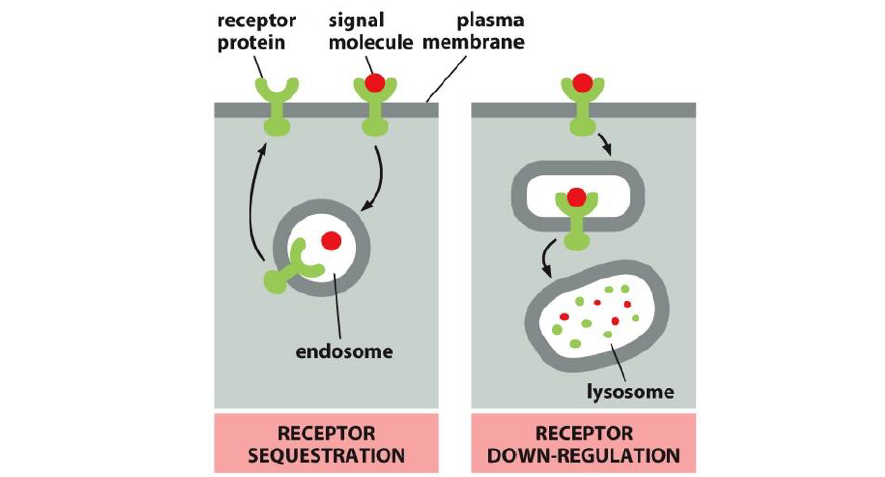
Comment est ce que le signal peut etre inactive au niveau du recepteur ?
desensibilisation du recepteur suite a un signal persistant fort. Peut etre → phosphorylation du recepteur, association avec un inhibiteur
desactivation du recepteur par endocytose puis recyclage ou degradation complete

Comment est ce que le signal peut etre inactive en aval du recepteur ?
degradation du messager secondaire
desactivation des proteines de signalisation (GTP→GDP, (de)phosphorylation de residus)
changement de l’expression genique qui creer un inhibiteur
Combien de proteines GPCR differentes ?
800
A quels stimulis repondent les GPCR ?
homones : glucagon, vasopressine, ACTH
neurotransmetteurs : serotonine, epinephrine
stimuli sensoriels : lumiere, odorants
Quelle est la structure des proteines GPCR ?
7 helices transmembranaires
N terminal du cote extracellulaire
site de fixation a la molecule de signalisation se trouve dans la region transmembranaire
Que se passe t il lorsque la molecule de reception se lie a GPCR au niveau du recepteur ? Qui s active apres l’activation de GPCR ?
Il change de conformation et declenche une cascade de signalisation en activant les proteines G trimeriques
Comment est ce que les proteines G interagissent avec les GPCR ?
Interagissent avec GPCR par l intermediaire des boucles de GPCR intracellulaires, ainsi que le C-terminal
Quelles sont les voies de signalisations activees par les proteines G ?
Souvent, c’est la production de ces messagers secondaires :
IP3 et DAG via PlC
AMPc via l’adenylate cyclase (AC)
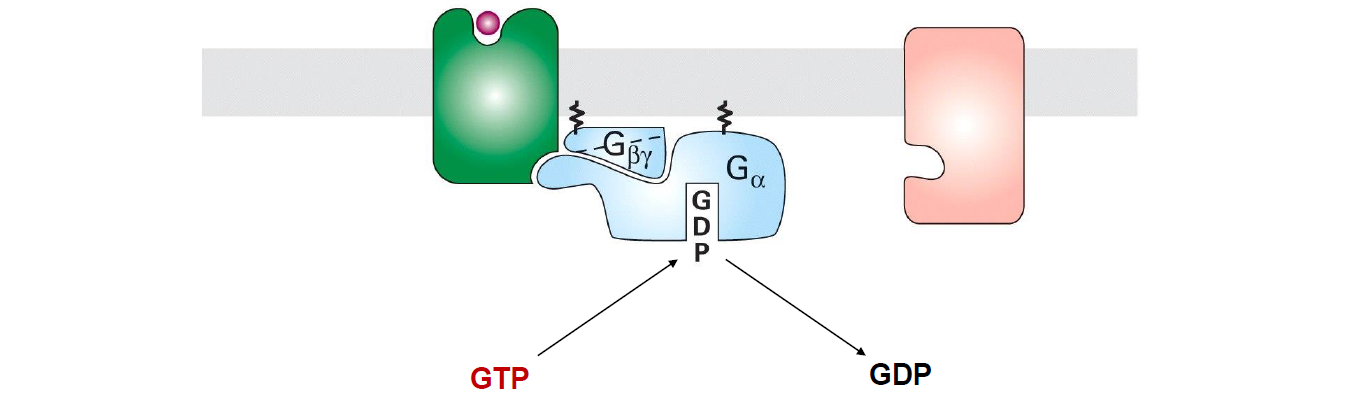
Ou est lie le GTP/GDP dans la proteine G ?
A la sous unite alpha
A quoi servent les sous unites alpha beta gamma de la proteine G ?
alpha → commutateur : permet de transmettre le signal en activant, inhibant les effecteurs en aval
beta/gamma → regulateurs negatifs en augmentant l affinite de Galpha pour GDP, ce qui maintient la proteine inactive
Comment est la proteine G dans le cytosol et pourquoi ?
Ancree a la MP grace a des ancres lipidiques, qui peuvent etre des acides gras ou des ancres GPI, presentes sur les sous unites alpha et gamma.
Cela permet a ce qu il soit proche du recepteur
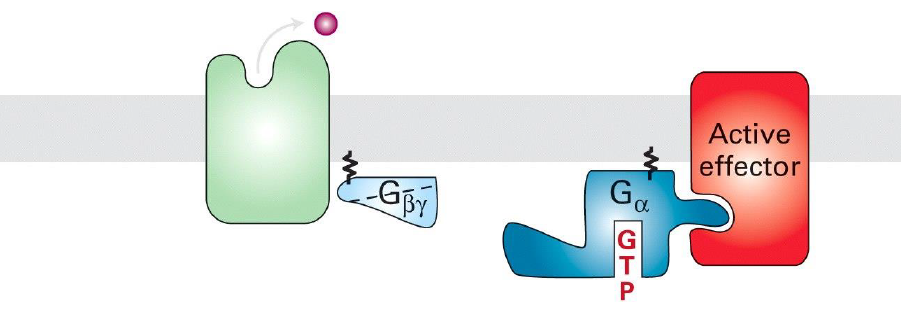
Quelle est le processus d activation de la proteine G avec GPCR ?
recepteur active se lie a la sous unite alpha et echange GDP → GTP du cytoplasme (activite comme GEF)
dissociation de alpha de beta/gamma
Galpha se fixe a l effecteur en aval et l’active
inactivation de Galpha par hydrolyse et liberation de l hormone (apres une auto-phosphorylation peut etre)
retour sous forme inactive de proteine G trimerique

Combien de sous unites de la proteine G differentes existe t il dans le genome humain ?
alpha : 27
beta : 5
gamma : 13
Qu est ce qui influence les differentes voies de signalisation (AMPc ou PLC) actives par les proteines G associes a GPCR ?
Les sous unites alpha qui changent
Quelle sous unite est associee a AMPc ? (roles)
Gαs → active l’adenylate cyclase ce qui entraine la production d’AMPc et l activation de la proteine kinase PKA
Gαi → inhibe l activite enzymatique de l’adenylate cyclase en se liant a differentes regions de la proteine, reduisant la production d’AMPc
Quelle sous unite est associee a PLC ?
Gαq → active PLCbeta lors de l activation du recepteur et de l interaction de Galpha directement avec PLCbeta, declanchant la cascade IP3/DAG et calcium
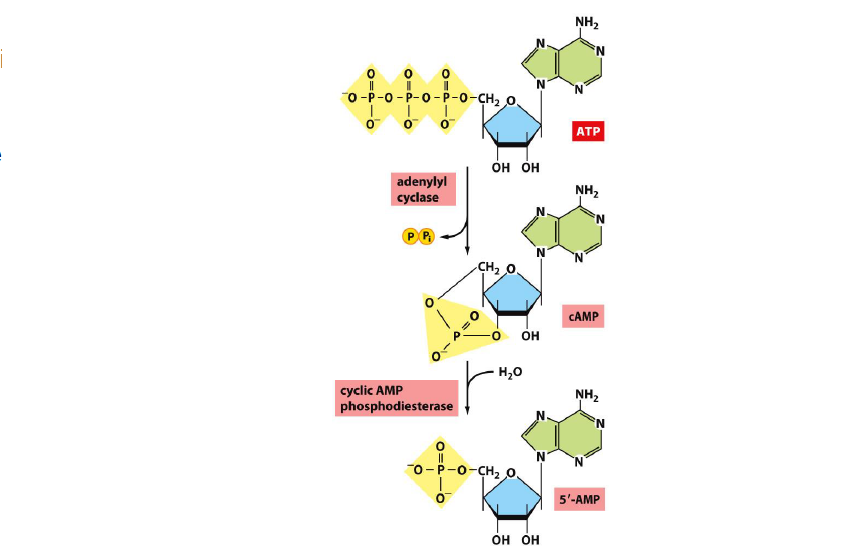
Quelle est la structure de l’adenylate cyclase ?
Grande enzyme avec 2 domaines catalytiques cytosoliques et 2 domaines integres a la membrane, chacun contenant 6 helices alpha transmembranaires.
Les domaines de catalyse ATP → AMPc + pyrophosphate (PPi)


Combien de temps dur la production de l AMPc par catalyse ?
Tres rapide → quelques secondes
Que se passe t il au niveau de l’AMPc apres sa production ?
Il est continuellement degrade par les phosphodiesterases qui le transforment en AMP 5’ (normal en gros)

Quels sont les hormones activant l adenylate cyclase ?
epinephrine
glucagon
ACTH
Quelles sont les hormones inhibant l’adenylate cyclase ?
PGE
Adenosine
Quel est le recepteur de Gαs et Gαi ?
Gαs → Beta2-Adrenergic receptor
Gαi → alpha 2-Adrenergic receptor
Une fois l AMPc produit, que fait elle ?
Se lie au PKA inactif → changement de conformation → libere les sous unites C du PKA, les rendant actives
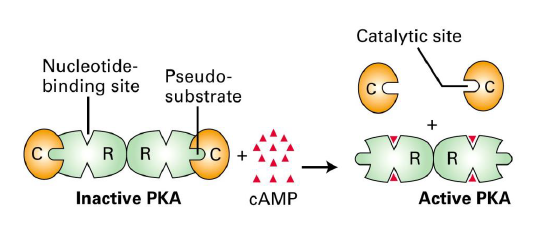

Quelle est la structure de PKA ?
2 sous unites regulatrices et 2 sous unites catalytiques
Que font ensuit les sous unites catalytiques de PKA ?
phosphorylent le facteur de transcription CREB
CREB phoshphoryle se lie a l element de reponse au cAMP → CRE, situe en amont des genes cibles, induisant leur transcription en recrutant le coactivateur CBP/P300


Comment se fait l inactivation du signal de l activation de production d’AMPc ?
hydrolyse GTP → GDP
activation des phosphodiesterases (PDE) qui hydrolysent AMPc en 5’ AMP, reduisant l activation de PKA
desensibilisation du recepteur : phosphorylation par la PKA du recepteur beta-adrenergique lie au ligand → changement d affinite au ligand (Molecule de signalisation)
Est ce que la voie AMPc est une voie d’amplification et pourquoi ?
Oui, car plusieurs messagers secondaires et proteines effectrices formees.
Comment augmenter l’amplification du signal ?
Plus la cascade comporte d’etapes, plus l amplification sera forte
Combien de recepteurs membranaires peuvent activer la voie PLC ?
plus de 25
Quel est le processus de l’activation de la kinase C ?
IP3 diffuse rapidement dans le cytosol ou il se lie aux canaux de liberation du calcium situes dans la membrane du RE
l augmentation des niveaux de calcium entraine une translocation de la PKC vers la MP
activee par une interaction avec DAG et les phospholipides charges negativement

Combien de formes de PKC chez les mammiferes ?
8
Comment est innactive le signal de PLC ?
dephosphorylation de IP3 par des phosphatases
calcium pompe hors du cytosol → extracellulaire ou RE
DAG metabolise
Quels sont les autres roles de DAG ?
DAG peut être clivé pour produire de l'acide arachidonique, qui peut être un messager en soi, ou être utilisé dans la synthèse des eicosanoïdes → impliques dans l inflammation
Combien de calmodulines dans une cellule ?
1E7
Que regule la calmoduline ?
transporteurs membranaires → Ca2+, ATPase
enzymes → phosphatases, … , kinase → CaMKII
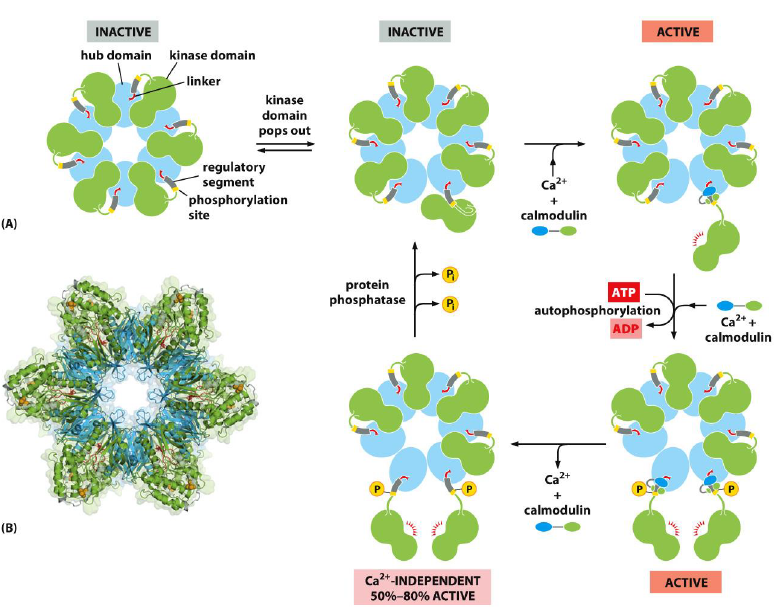
Comment fonctionne CaMKII ?
La CaMKIIse trouve généralement dans une conformation inactive et fermée, où son segment régulateur bloque le site actif.
La liaison de la calmoduline active l’enzyme en provoquant un changement de conformation qui expose le site actif.
L’autophosphorylation peut verrouiller l’enzyme dans un état partiellement actif, la rendant moins dépendante du Calcium et de la calmoduline pour maintenir son activité.
Les phosphatases protéiques inversent ce processus en retirant les groupes phosphate, ce qui ramène l’enzyme à son état inactif.

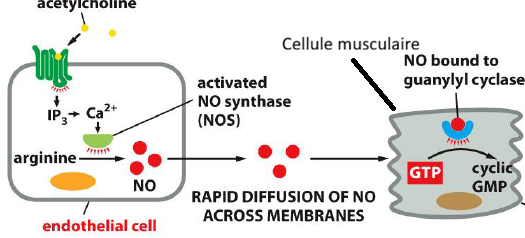
Quels sont les recepteurs a l acetylcholine ?
Recepteurs nicotiniques → canal ionique
Recepteurs muscariniques → GPCR
Comment est ce que l’acetylcholine provoque une relaxation du muscle ?