phraktikum-ue
1/21
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
22 Terms
Was ist die spezifische Wärmekapazität ccc?
Die Wärmemenge, die benötigt wird, um 1 g einer Substanz um 1 K zu erwärmen.
Einheit: [J/g⋅K]
Was ist eine Schmelzenthalpie qs?
Die Wärme, die benötigt wird, um 1 g einer Substanz bei konstanter Temperatur vom festen in den flüssigen Zustand zu überführen.
Was ist eine Verdampfungsenthalpie qv,i?
Die Wärme, die nötig ist, um 1 g einer Flüssigkeit bei konstanter Temperatur vollständig zu verdampfen.
Was beschreibt das Prinzip eines Kalorimeters?
Ein Kalorimeter misst Energieänderungen über Temperaturänderungen in einem geschlossenen System mit bekannter Wärmekapazität.
Wie lautet die Formel zur Berechnung der Wärmekapazität des Kalorimeters?
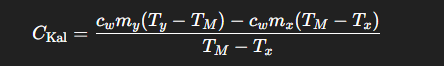
Wie wird die spezifische Schmelzenthalpie von Eis bestimmt?
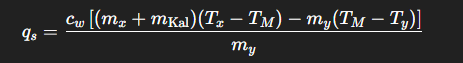
Wie wird die spezifische Verdampfungsenthalpie berechnet?
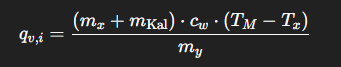
Wie hängt die Temperaturdifferenz vom Energieumsatz ab?
Je größer die Temperaturdifferenz, desto größer die aufgenommene oder abgegebene Wärmemenge – proportional bei konstantem cund m.
Warum wird im Kalorimeterversuch heißes Wasser zu kaltem gegeben (Teilversuch 1)?
Damit es zur Mischung kommt → Temperaturausgleich → über Temperaturdifferenz lässt sich der Energieaustausch bestimmen → daraus CKal.
Was passiert bei Teilversuch 2, wenn Eis nicht vollständig schmilzt?
Die Berechnung von qs wird falsch: Ein Teil des Eises wurde nicht berücksichtigt → zu kleiner Wert.
Was muss bei der Temperaturmessung besonders beachtet werden (Teil 2 und 3)?
Die Temperatur TM muss nach vollständiger Schmelze/Kondensation aufgenommen werden, da sonst nicht die gesamte Energie umgesetzt wurde.
Warum ist es wichtig, dass das Kalorimeter gut isoliert ist?
Um Energieverluste zu vermeiden → sonst fließt Wärme nach außen oder hinein, was die Temperaturänderung verfälscht → falsche Berechnung der gesuchten Größen.
Was passiert mit qv,i wenn du eine größere Masse Wasser als Kondensat auffängst, aber TM sich kaum ändert?
Wenn ΔT klein ist, aber my groß → qv,i wird kleiner → Hinweis auf nicht vollständige Kondensation oder Energieverlust.
Was passiert, wenn sich das Eis im Teilversuch 2 nicht ganz auflöst, aber du trotzdem TM misst?
Du unterschätzt die zugeführte Energie → berechnetes qs ist zu niedrig.
Warum muss man beim Einfüllen heißer Flüssigkeit das Kalorimeter vorher leer wiegen?
Damit man die Masse mx der warmen Flüssigkeit korrekt kennt → Fehler in mx führen direkt zu Fehlern in der Energiebilanz.
Was passiert mit CKal, wenn Ty≈Tx?
Die Temperaturdifferenz ist zu klein → CKal wird sehr unsicher berechnet, da der Nenner klein wird → großer relativer Fehler.
In welcher Größenordnung liegt qs für Eis in J/g?
Etwa 330–340 J/g
Warum ist qv,i deutlich größer als qs?
Weil beim Verdampfen die Moleküle die Kohäsionskräfte vollständig überwinden → höherer Energieaufwand als beim Schmelzen.
Wie hängen Wärmekapazität und Masse zusammen?
Die Gesamtwärmekapazität ist proportional zur Masse:
C=c⋅m
Was ist eine kalorimetrische Messung?
Eine indirekte Temperaturmessung zur Bestimmung von Energieänderungen, meist in geschlossenen Systemen.
Was bedeutet spezifisch (z. B. qs, qv)?
Bezogen auf 1 g Stoff → macht Energieangaben vergleichbar unabhängig von Stoffmenge.
Welche Rolle spielt das Mischungsverhältnis heiß/kalt beim Teilversuch 1?
Es beeinflusst die Lage des Mischwerts TM, der für die Energiebilanz entscheidend ist. Am besten wählt man Massen so, dass TM nicht zu nah an Tx oder Ty liegt.