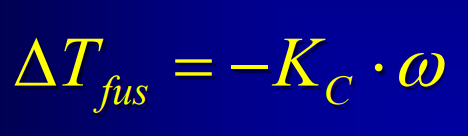MELANGES
0.0(0)
Card Sorting
1/50
Last updated 5:57 PM on 10/16/22
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
51 Terms
1
New cards
Solvant
Espèce majoritaire : liquide
2
New cards
Soluté
Espèce minoritaire : solide, liquide, gaz
3
New cards
Solution cristalloïde
Petites molécules dont la masse molaire est inférieur à 1 kg/mol
4
New cards
Solution macromoléculaire
Grosses molécules, cas limite avec les états dispersés
5
New cards
Solution idéale
Interactions entre les molécules de solvant inchangées par la présence de solutés, solutions diluées contenant peu de soluté
6
New cards
Phénomène de saturation
Existence d'une quantité finie de soluté solide susceptible de se dissoudre dans un solvant
7
New cards
Evolution des quantités
n se conserve
8
New cards
Evolution des volumes
Non prévisible
9
New cards
Fraction molaire
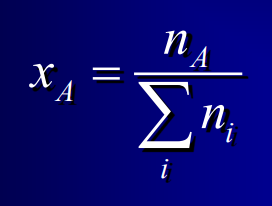
10
New cards
Fraction de masse

11
New cards
Concentration pondérale
en kg/L
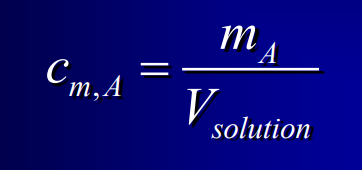
12
New cards
Concentration molaire ou molarité
en mol/L
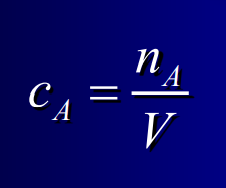
13
New cards
Concentration molale ou molalité
en mol/kg
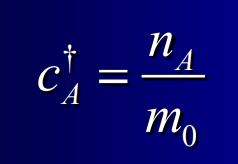
14
New cards
Titre
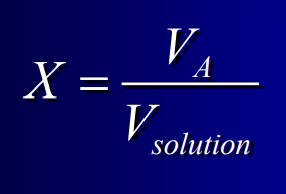
15
New cards
Concentration équivalente pour les ions
en Eq/L
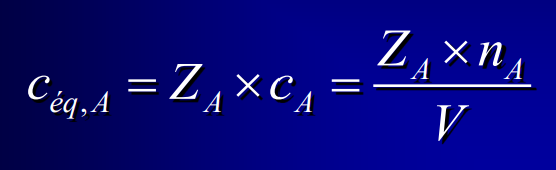
16
New cards
Concentration osmolaire ou osmolarité
en osm/L
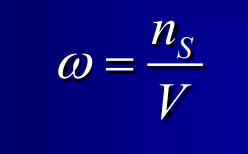
17
New cards
Concentration osmolale ou osmolalité
en osm/kg
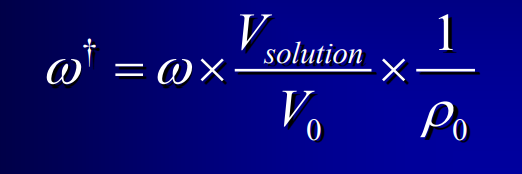
18
New cards
Proportionnalité pour des faibles concentrations
Proportionnalité des phénomènes avec la concentration
19
New cards
Proportionnalité pour des fortes concentrations
Proportionnalité avec l'activité telle que a=gamme*C
20
New cards
Entropie des mélanges
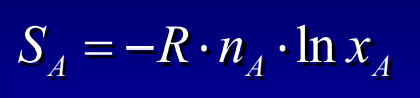
21
New cards
Entropie solution idéale
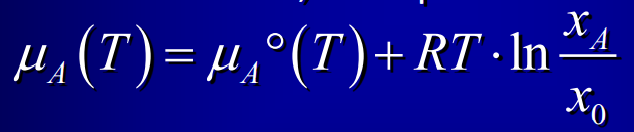
22
New cards
Entropie gaz parfaits
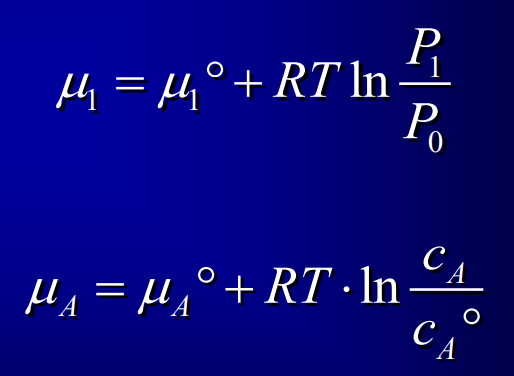
23
New cards
Potentiel électrochimique

24
New cards
Potentiel chimique
La concentration de l'ion Na+ étant plus concentrée dans le compartiment 2 que dans le compartiment 1, on observe la diffusion de l'ion Na+ du compartiment 2 vers le compartiment 1
25
New cards
Potentiel électrique
Le compartiment 2 étant chargé négativement, on observe la migration électrique de l'ion Na+ du compartiment 1 vers le compartiment 2
26
New cards
Equilibre de Nernst
Equilibre atteint quand le flux lié à la force électrique est égal au flux lié à la diffusion de l'ion
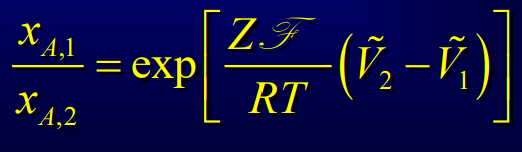
27
New cards
Propriétés colligatives
Il y a moins d'eau dans une solution que dans de l'eau pure
28
New cards
Potentiel chimique de l'eau
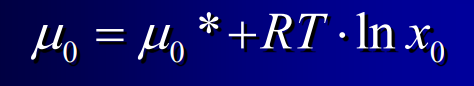
29
New cards
Potentiel chimique du solvant
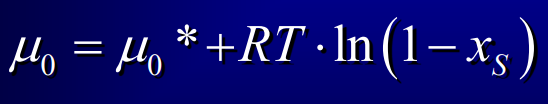
30
New cards
Osmose
Influence du soluté sur la répartition du solvant entre deux phases liquides
31
New cards
Pression osmotique
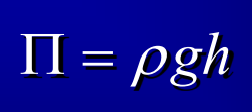
32
New cards
Equation d'osmose

33
New cards
Loi de Van't Hoff
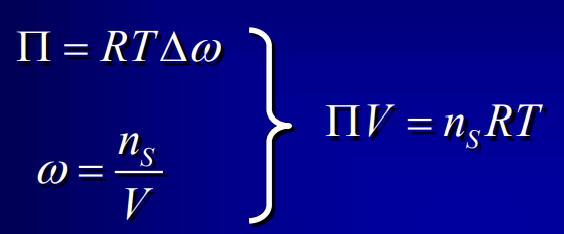
34
New cards
Travail osmotique
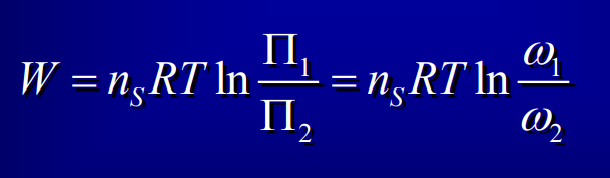
35
New cards
Milieu hypotonique
Entrée d'eau dans les globules rouges jusqu'à les faire exploser : turgescence
36
New cards
Milieu hypertonique
Sortie d'eau des globules rouges : plasmolyse
37
New cards
Solutés isotoniques classiques
Glucosé à 5%
Sérum salé à 9%
Bicarbonates à 14%
Sérum salé à 9%
Bicarbonates à 14%
38
New cards
Loi de Raoult - principe
Traduit l'influence du soluté sur la répartition du solvant entre la phase liquide et la phase vapeur
Evaporation du solvant pur si la pression partielle est plus faible que la pression saturante
Evaporation du solvant pur si la pression partielle est plus faible que la pression saturante
39
New cards
Effet de l'ajout d'un soluté
Diminution de Psat au-dessus de la solution
Augmentation de la température d'ébullition
Diminution de la température de fusion
Augmentation de la température d'ébullition
Diminution de la température de fusion
40
New cards
Constante d'ébulliométrie
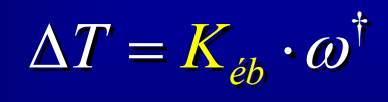
41
New cards
Loi de Raoult

42
New cards
Loi de Henry
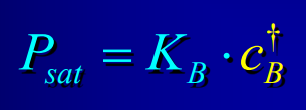
43
New cards
Constantes de l'eau
Masse volumique rho=1000 km/m3
Fusion T=0°C
Ebullition T=100°C
1K=1/273,16 du point triple de l'eau
1 calorie=chaleur spécifique de 1g d'eu
Fusion T=0°C
Ebullition T=100°C
1K=1/273,16 du point triple de l'eau
1 calorie=chaleur spécifique de 1g d'eu
44
New cards
Moment dipolaire de l'eau
Très intense
45
New cards
Constante diélectrique eau
Elevée
Effet d'écran
Excellent solvant pour les ions
Effet d'écran
Excellent solvant pour les ions
46
New cards
Conduction eau
Bon conducteur thermique
faible conduction électrique pour l'eau pure
faible conduction électrique pour l'eau pure
47
New cards
Tension superficielle eau
Elevée
48
New cards
Mobilité eau
Grande, viscosité peu élevée
49
New cards
Expansion eau
L'eau glace prend plus de place que l'eau liquide
50
New cards
Différentes chaleurs de l'eau
Chaleur de fusion très élevée
Chaleur de vaporisation très élevée
Chaleur spécifique élevée
Chaleur de vaporisation très élevée
Chaleur spécifique élevée
51
New cards
Constante de cryométrie