Forensische chemie II
5.0(5)
Card Sorting
1/189
Earn XP
Description and Tags
Forenisch Onderzoek jaar 2 periode 2
Last updated 12:43 PM on 1/31/23
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
190 Terms
1
New cards
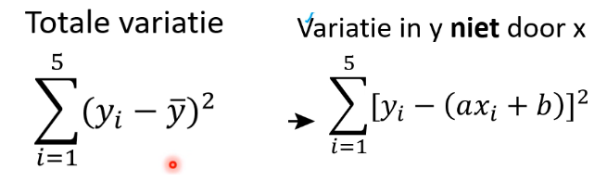
Coefficient of determination/goodness of fit/ r2
Een mate voor hoe goed de kalibratielijn precies door de datapunten loopt. Bij een waarde van 1 gaat het precies door alle datapunten en bij een waarde van 0 totaal niet
2
New cards
Molecuulformules
Opsomming van atomen in een molecuul, gesorteerd op soort en aantal. Bv H2O
3
New cards
Structuurformule
Geeft informatie over de atoomsoort, aantal en positie (eventueel ruimtelijk)
4
New cards
Isomeren
Dezelfde molecuulformule maar een andere structuur. Dit leidt (soms) tot andere eigenschappen
5
New cards
Constitutionele (structurele) isomeren
Andere weergave van het molecuul, maar dezelfde molecuulformule
6
New cards
Functionele groep isomerie/ketenisomerie
2 moleculen hebben dezelfde molecuulformule, maar een andere functionele groep. Soms wordt de molecuulformule op een andere manier geschreven om te verduidelijken welke functionele groepen het molecuul heeft
7
New cards
Organische chemie
Chemie van koolstofhoudende stoffen
8
New cards
Alkanen
Bevatten alleen C en H met enkele bindingen.
* Algemene formule: CnH2n+2 → compleet verzadigd
* Uitgang hoofdketen: -aan
* Uitgang zijketen: -yl
* Laag smelt-/kookpunt, brandbaar en weinig reacties
* Algemene formule: CnH2n+2 → compleet verzadigd
* Uitgang hoofdketen: -aan
* Uitgang zijketen: -yl
* Laag smelt-/kookpunt, brandbaar en weinig reacties
9
New cards
Verbranding
Reactie met zuurstof
10
New cards
Halogenering
Een alkaan reageert met een halogeen (fluor, chloor, broom, jood) waarop het halogeen een plaats inneemt van een H-atoom.
11
New cards
Evenwichtsreactie
Een reactie dat beide kanten op verloopt en aangeduid wordt met ⇄. Op een gegeven moment verlopen beide reacties even snel en verandert de samenstelling van het mengsel niet meer.
12
New cards
Concentratiebreuk
Duidt aan waar het evenwicht ligt. Het wordt aangeduid met de evenwichtsconstante/evenwichtsvoorwaarde (K), dat gelijk staat aan de producten: reagentia, met de molhoeveelheid als macht. Vaste stoffen en vloeistoffen (inclusief H2O) worden hierin NIET meegenomen omdat de molaire massa & dichtheid constant zijn. Gassen en opgeloste stoffen worden WEL meegenomen. De eenheid van K wordt achterwege gelaten.
\-Waarde tussen 10^-3 en 10^3 → evenwicht
\-Waarde kleiner dan 10^-3 → reactie verloopt niet
\-Waarde groter dan 10^3 → reactie is aflopend
\-Waarde tussen 10^-3 en 10^3 → evenwicht
\-Waarde kleiner dan 10^-3 → reactie verloopt niet
\-Waarde groter dan 10^3 → reactie is aflopend
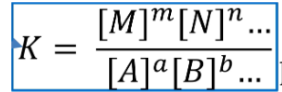
13
New cards
Stappenplan voor het rekenen aan een chemisch evenwicht
1. Reactievergelijking opstellen
2. Concentratiebreuk opstellen
3. Evenwichtsconstante (K) berekenen
14
New cards
Principe van le Chatelier
Wanneer er een verandering van het evenwicht optreedt door bv een verandering in temperatuur, druk, volume of concentratie, zal het evenwicht verschuiven om hiervoor te compenseren
\- Verandering in concentratie: de evenwichtsconstante veranderd NIET. Een andere stof verandert ook in concentratie waardoor de reactie naar een van de kanten tijdelijk sneller of meer verloopt.
\- Verandering in druk: bij een hogere druk zitten de moleculen dichter op elkaar en is de reactie waarbij er minder moleculen wenselijk en verloopt deze sneller/meer. De evenwichtsconstante veranderd hierbij WEL zodat er minder mol gas ontstaat.
\- Verandering in volume: bij een groter volume neemt de druk af, en zal de reactie waarbij er meer mol gas is meer/sneller verlopen.
\- Verandering in temperatuur: bij een hogere temperatuur wordt er warmte toegevoegd en zal de endotherme reactie sneller/meer verlopen.
\
\- Verandering in concentratie: de evenwichtsconstante veranderd NIET. Een andere stof verandert ook in concentratie waardoor de reactie naar een van de kanten tijdelijk sneller of meer verloopt.
\- Verandering in druk: bij een hogere druk zitten de moleculen dichter op elkaar en is de reactie waarbij er minder moleculen wenselijk en verloopt deze sneller/meer. De evenwichtsconstante veranderd hierbij WEL zodat er minder mol gas ontstaat.
\- Verandering in volume: bij een groter volume neemt de druk af, en zal de reactie waarbij er meer mol gas is meer/sneller verlopen.
\- Verandering in temperatuur: bij een hogere temperatuur wordt er warmte toegevoegd en zal de endotherme reactie sneller/meer verlopen.
\
15
New cards
Endotherme reactie
Reactie die warmte gebruikt als grondstof. Het neemt dus warmte op
16
New cards
Exotherme reactie
Reactie waarbij warmte vrijkomt als reactieproduct
17
New cards
Katalysator
Stof die het evenwicht niet verstoort, maar wel zorgt dat deze zich sneller instelt
18
New cards
Zuren
Bevat een H-atoom dat aan een elektronegatief atoom zit. Ze vormen H3O+ in water. Het zijn moleculen met een halogeen + waterstof, moleculen met veel zuurstof of organische zuren
19
New cards
Base
Bevat een atoom met een vrij elektronenpaar dat een H+ kan opnemen. Het vormt OH- in water. Het zijn moleculen met stikstofverbindingen, negatieve ionen of zouten met OH/O.
20
New cards
Zuurrestion/geconjugeerde base
Ion dat wordt gevormd als een zuur in water gaat reageren
21
New cards
Geconjugeerd zuur
Zuur dat wordt gevormd wanneer een base een H+ opneemt
22
New cards
Zuur-base-reacties
Type reacties waarbij er zouten of water (+zouten) gevormd worden. Voor het laatste moet er al OH aanwezig zijn.
23
New cards
Amfoteer
Molecuul dat zowel als zuur als base kan reageren → zoals water
24
New cards
Waterconstante (kw)
Concentratiebreuk van de reactie van water (H2O) met zichzelf. Deze is gelijk aan 10^-14 = \[H3O+\] x \[OH-\]
25
New cards
pH
Maat voor de zuurtegraad, ofterwijl de \[H+\]. Het is te berekenen door: -log \[H+\]. Er geldt ook: \[H+\]= 10^-pH en pH+ pOH= 14.
Afhankelijk van de gegevens moet vaak de \[H+\] nog bepaald worden. Dit wordt gedaan adhv een BOE-tabel en de abc-formule.
Afhankelijk van de gegevens moet vaak de \[H+\] nog bepaald worden. Dit wordt gedaan adhv een BOE-tabel en de abc-formule.
26
New cards
pOH
Maat voor de \[OH-\]. Het is te berekenen door: -log \[OH-\]. Er geldt ook: \[OH-\]= 10^-pOH en pH+ pOH= 14.
27
New cards
Significantie bij pH/pOH berekeningen
Het totale aantal cijfers in \[H+\] of \[OH-\] is de totale hoeveelheid cijfers achter de komma.
28
New cards
Sterke zuren
Zuren die gemakkelijk H+ afgeven. Hierdoor verschuift het evenwicht en ontstaat er een lagere pH. Hoe sterker, hoe zwakker de geconjugeerde base, want als het de H+ opneemt, staat het deze direct weer af. De reactievergelijking is HZ ⇄ Z- + H+.
29
New cards
Zuurconstante (Ka/Kz)
Evenwichtsvoorwaarde van zuren, waarbij geldt dat het gelijk is aan (\[Z-\] x \[H+\]) / \[HZ\]. Bij sterke zuren is het (veel) groter dan 1, omdat \[Z-\] en \[H+\] veel groter is dan \[HZ\]. Bij zwakke zuren is het (veel) kleiner dan 1 omdat ze moeilijker H+ afgeven. Voor basen wordt er gekeken naar het geconjugeerde zuur. Dit wordt weergegeven als BH+ ⇄ B + H+.
30
New cards
Zwakke zuren
Zuren die niet zo makkelijk H+ afgeven. De pH wordt dan hoger.
31
New cards
Polyprotische zuren
Zuren die meer dan 1 H+ kunnen afstaan. Per afgestaan H+ wordt het steeds lastiger en wordt de Ka/Kz steeds (veel) kleiner en de pKa steeds (veel) groter.
32
New cards
pKa
De mate van sterkte van een zuur. Hoe lager, hoe sterker het zuur. Hoe hoger, hoe zwakker. Het staat gelijk aan -log (ka). Als de pKa stijgt, daalt de Ka dus.
33
New cards
Henderson-Hasselbalch formule
Formule die het verband tussen de pH, pKa en de evenwichtsreacties van een zuur/base geeft. Aan de hand hiervan kun je de pH/pKa berekenen.

34
New cards
Buffer
Zorgt voor geen/een klein effect van bijvoorbeeld een pH verandering bij verandering in het systeem. Het bestaat uit een zwak zuur en het zout van de geconjugeerde base in ongeveer gelijke concentraties. De limieten:
\- De pH die het kan hebben is ongeveer gelijk aan de pKa van het zwakke zuur.
\- De concentratie zuur en de concentratie geconjugeerde base moeten ongeveer gelijk zijn.
\- Er kan tot 0,1 keer de concentratie HZ toegevoegd worden aan H3O+ of OH-. Daarbuiten werkt de demping niet goed meer.
\- Er geldt de pKa ± 2 regel: bij een pKa ± 2 pH is alles omgezet naar HZ of Z- en werkt de buffer niet meer. Dit is te berekenen adhv de Henderson-Hasselbalch formule → berekeningen worden adhv deze formule gedaan!
\- De pH die het kan hebben is ongeveer gelijk aan de pKa van het zwakke zuur.
\- De concentratie zuur en de concentratie geconjugeerde base moeten ongeveer gelijk zijn.
\- Er kan tot 0,1 keer de concentratie HZ toegevoegd worden aan H3O+ of OH-. Daarbuiten werkt de demping niet goed meer.
\- Er geldt de pKa ± 2 regel: bij een pKa ± 2 pH is alles omgezet naar HZ of Z- en werkt de buffer niet meer. Dit is te berekenen adhv de Henderson-Hasselbalch formule → berekeningen worden adhv deze formule gedaan!
35
New cards
Titratie
Het druppelsgewijs toevoegen van een base (of zuur) met een bekende concentratie aan een zuur (of base) met een onbekende concentratie, waardoor het geneutraliseerd wordt. Aan de hand van een indicator kan de onbekende concentratie berekend worden.
36
New cards
Indicator
Stof waarvan de kleur afhankelijk is van de pH, vaak bij pH=7. Het wordt gebruikt bij titratie.
37
New cards
Stappenplan voor titratieberekeningen
1. Reactievergelijking opstellen
2. Gegeven: volume van de oplossing toe te voegen base/zuur
3. Berekenen: aantal mol in deze oplossing adhv molariteit
4. Molverhouding bepalen tussen de toe te voegen base/zuur en de onbekende concentratie zuur/base
5. Berekenen: molariteit van de onbekende concentratie adhv het toegevoegde volume. Vaak is deze verdund en moet de formule c1 x V1= c2 x V2 gebruikt worden, of terwijl cm x Vm = cv x Vv
38
New cards
Extractie
Iets (een analyt) van de ene fase in een andere fase brengen.
39
New cards
Vertering
Alle stoffen oplossen in een bepaalde fase
40
New cards
Doel van het scheiden
Zodat er iets gezegd kan worden over bijvoorbeeld bepaalde pieken in een chromatogram, of zodat bepaalde apparaten gebruikt kunnen worden. Het wordt gedaan door het evenwicht van de reactie te verstoren.
41
New cards
Bloed-alcohol-gehaltebepaling
Ethanol is vluchtig en is in gasfase boven het bloed in de vial aanwezig. Het evenwicht (EhOH (aq) ⇄ EtOH (g)) is endotherm en wordt door toevoeging van warmte verstoord. Hierdoor loopt het sneller naar rechts. Vervolgens wordt headspace-GC toegepast.
42
New cards
Lipofiliciteit
Oplosbaarheid in organische oplosmiddelen
43
New cards
Partitiecoëfficiënt (Kow)
De evenwichtsconstante tussen de organische (O) fase en waterige (W) fase. Het is gelijk aan \[A\]O/\[A\]W, of terwijl de hoeveelheid in de organische fase tov de waterige fase.
44
New cards
Op basis waarvan te scheiden is
\- Dampdruk/kookpunt
\- Oplosbaarheid
\- Oplosbaarheid
45
New cards
Apolaire stoffen
Stoffen waarbij de elektronen evenwaardig over het molecuul zijn verdeeld. Ze hebben alleen van der Waalsinteracties.
46
New cards
Polaire stoffen
Stoffen waarbij de elektronen zo verdeeld zijn, dat de negatieve ladingen niet samenvallen met de positieve ladingen. Hierdoor hebben ze dipool-dipool interacties, en zullen ze voornamelijk te vinden zijn in waterige oplossingen.
47
New cards
Ionen
Stoffen met een compleet positieve of negatieve lading. Ze hebben ion-interacties en zullen voornamelijk te vinden zijn in waterige oplossingen.
48
New cards
Extractie met zuur-basen/Vloeistof-vloeistof extractie
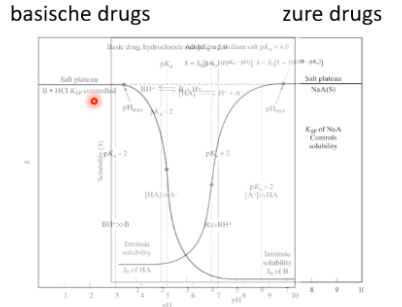
Als een zuur molecuul in een zure omgeving (=lage pH) wordt geplaatst, zal het niet goed H+ gaan afstaan. Dit is omdat er al veel H+ is en het evenwicht ( Z ⇄ H+ + Z-) daardoor naar links verschuift. Het zuur (Z) zal dan goed oplossen in een organische fase. In een basisch milieu zal het juist goed H+ afstaan. Hierdoor ontstaat een zuurrestion (Z-), wat goed oplost in een waterige fase.
Als een basisch molecuul in een zure omgeving wordt geplaatst, zal het H+ opnemen. Hierdoor ontstaat het geladen HB+ ion omdat het evenwicht (HB+ ⇄ B + H+) naar links ligt. Dit lost goed op in een waterige fase. In een basische omgeving zal het juist H+ afstaan, waardoor de base ongeladen is en goed oplost in een organische fase.
Voor de extractie zelf wordt een waterige buffer + een organisch oplosmiddel (bv chloroform) in een scheidtrechter gedaan. Dit wordt goed geschud. De onderste laag wordt afgetapt. Welke drug waarin oplost, is afhankelijk van de pH van de oplossingen en de pKa van het molecuul.
Als een basisch molecuul in een zure omgeving wordt geplaatst, zal het H+ opnemen. Hierdoor ontstaat het geladen HB+ ion omdat het evenwicht (HB+ ⇄ B + H+) naar links ligt. Dit lost goed op in een waterige fase. In een basische omgeving zal het juist H+ afstaan, waardoor de base ongeladen is en goed oplost in een organische fase.
Voor de extractie zelf wordt een waterige buffer + een organisch oplosmiddel (bv chloroform) in een scheidtrechter gedaan. Dit wordt goed geschud. De onderste laag wordt afgetapt. Welke drug waarin oplost, is afhankelijk van de pH van de oplossingen en de pKa van het molecuul.
49
New cards
Zure groepen
Groepen die een H+ kunnen afstaan. Dit zijn de carbonzuren (COOH), hydroxylgroepen (OH) en fenolen (OH vast aan een benzeenring).
50
New cards
Basische groepen
Groepen die een H+ kunnen opnemen. Dit zijn de aminegroepen (R-N-R’). Het N-atoom heeft een vrij elektronenpaar waar een H+ aan kan binden.
51
New cards
Iso elektrisch punt
De positieve lading van de geprotoneerde basische groepen heffen de negatieve lading van het zuurrestion op. Dit kan het geval zijn bij drugs met meerdere ioniseerbare centra, zoals morfine. Dit punt ligt in het dal in het midden van de twee curven bij elkaar opgeteld. Door de opheffende ladingen lost het niet goed op in waterige oplossingen.
52
New cards
Vaste-stof-extracties
Wordt uitgevoerd als de pKa’s van 2 stoffen zo dicht bij elkaar liggen dat er niet goed/geen onderscheid gemaakt kan worden. Er is een stationaire fase (in een kolom), waar de moleculen interactie mee hebben. De type interactie (affiniteit) bepaalt de retentietijd. Deze wordt eerst natgemaakt. Dan stroomt er een mobiele fase doorheen waar het monster in zit. Deze vloeistof wordt erdoorheen gedrukt of met vacuüm aangezogen. De stoffen blijven allemaal in de kolom zitten tot er iets mee gedaan wordt.
53
New cards
Normal phase
De stationaire fase is polair en de mobiele fase apolair
54
New cards
Reversed phase
De stationaire fase is apolair en de mobiele fase polair.
55
New cards
Ion exchange packing
Hierbij zijn er geladen bolletjes als stationaire fase. Als deze negatief zijn blijft alles met een positieve lading langer hangen in de stationaire fase door elektrostatische interactie. Dit is dus anders dan het ‘*like dissolves like’* principe.
56
New cards
geconjugeerde bindingen/geconjugeerd systeem
Afwisseling tussen enkele en dubbele bindingen. Hoe meer er zijn, hoe meer het uitgestraalde licht richting het zichtbare spectrum verschuift en hoe meer kleur het heeft. Dit komt door de ℼ → ℼ\* overgangen bij de absorptie van het licht.
57
New cards
Derivatisering
Het modificeren van een molecuul waardoor de functionele groepen anders/onklaar worden gemaakt. Hierdoor is er bijvoorbeeld minder interactie met andere moleculen waardoor het kookpunt daalt (→ handig voor HS-GC). Ook kan het zorgen voor meer geconjugeerde verbindingen waardoor het met een UV/VIS detector gedetecteerd kan worden. Een stof kan dan aan het originele molecuul binden en als marker figureren.
58
New cards
ABC-technieken
Technieken die gebruikt kunnen worden voor het onderzoek aan verdovende middelen. Het zegt iets over hoe zeker je bent over wat er uit het onderzoek komt. C-technieken bevatten de laagste zekerheid en A-technieken de hoogste.
59
New cards
C-technieken
Technieken die selectief zijn op basis van algemene of klasse-info. Het geeft een indicatie. Voorbeelden zijn kleurtesten, fluorescentiespectrometrie, smeltpuntbepaling of immunoassay.
60
New cards
B-technieken
Technieken die selectief zijn op basis van chemische of fysische eigenschappen. Voorbeelden zijn chromatografie, UV-Vis-spectroscopie of een microkristallijne test.
61
New cards
A-technieken
Technieken die selectief zijn op basis van structurele info. Voorbeelden zijn IR-spectroscopie en massaspectrometrie.
62
New cards
NRM-spectroscopie
Type spectroscopie waarbij er gekeken wordt naar de kernen van atomen. Omdat deze worden beïnvloed door de atomen ernaast, kan er structurele informatie verkregen worden. Het is een A-techniek.
63
New cards
Röntgenkristallografie
A-techniek waarbij er gekeken wordt hoe röntgenstraling verstrooid wordt. Hierdoor is de afstand tussen bepaalde atomen te bepalen. Deze afstand is karakteristiek voor een bepaalde binding. Het geeft dus structurele informatie.
64
New cards
Betrouwbaar onderzoek doen volgens SWGdrug
Er moet 1 van de onderstaande lijnen gevolgd worden:
1. 1x een A-techniek + 1x een andere techniek (A, B of C)
2. 3 technieken met minimaal 2x een B-techniek.
1. 1x een A-techniek + 1x een andere techniek (A, B of C)
2. 3 technieken met minimaal 2x een B-techniek.
65
New cards
Bindende orbitalen
Orbitalen waarbij het het minste energie kost om ze te vormen.
66
New cards
Niet-bindende orbitalen
Orbitalen waarbij het meer energie kost om ze te vormen.
67
New cards
Moleculaire orbitalen
Orbitalen die bepalen welke kleuren we zien met kleurtesten. Er wordt gekeken naar de relatief kleine overgangen tussen π → π\*. De afstand tussen deze overgang hangt af van de hoeveelheid dubbele bindingen en van de functionele groepen met losse elektronenparen (voornamelijk O en N). Het elektronenpaar telt hier als dubbele binding. Het geconjugeerd systeem heeft een grotere invloed dan functionele groepen.
68
New cards
Kleurtesten
Koppelt 2 drugsmoleculen aan elkaar, waardoor een groter geconjugeerd systeem ontstaat. Hierdoor is er een verschuiving van de π → π\* overgangen, waardoor het een andere kleur licht absorbeert. Voorbeelden hiervan zijn de Marquistest en de Liebermanntest.
69
New cards
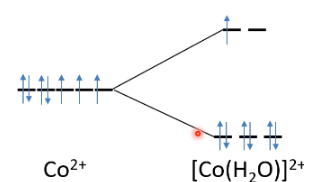
Ligand field theorie
Deze theorie zegt iets over de energieovergangen in d-orbitalen. Elk d-orbitaal heeft 5 mogelijkheden, met elk dezelfde hoeveelheid energie. De elektronen verschuiven dus niet van orbitaal. Bij een geladen atoom, zoals cobalt 2+, wordt deze beïnvloed door de watermoleculen eromheen. Het negatief geladen zuurstofatoom in het watermolecuul zal richting de Co 2+ wijzen. De elektronen van de 2 atomen zitten nu dus dichter bij elkaar, waardoor ze elkaar wegduwen omdat 2 gelijke ladingen elkaar afstoten. Hierdoor worden sommige (plekken in) orbitalen minder gunstig, waardoor de energieniveaus anders worden. Door de nu verschillende niveaus kan een elektron door licht in aangeslagen toestand komen en licht in het zichtbare spectrum uitstralen. Afhankelijk van de moleculen is de opsplitsing en dus de kleur anders. Dit principe wordt toegepast in kleurtesten waarin gebruik wordt gemaakt van metalen.
70
New cards
d-orbitalen
Type orbitaal dat 5 verschillende mogelijkheden heeft.
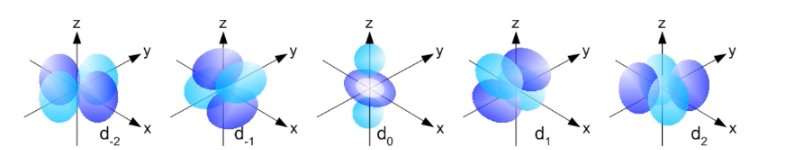
71
New cards
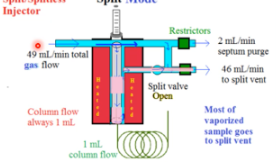
Split injectiemethode
Injectiemethode waarbij een deel van het sample wordt afgesplitst en naar de kolom toe gaat, en het andere gedeelte niet. Doordat de vents openstaan en de stof verdampt, gaat een (groot) gedeelte van de stof weg naar deze split vent. Dit wordt gedaan wanneer het sample een overbelading heeft in de kolom (door een te hoge concentratie).
72
New cards
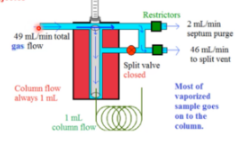
Splitless injectiemethode
Injectiemethode waarbij het volledige sample door de kolom heen wordt gedrukt. Dit komt omdat de vents dichtzitten en er geen circulatie mogelijk is.
73
New cards
Cold on column injectiemethode
Injectiemethode waardoor het hele sample eerst vloeibaar gemaakt wordt door koude lucht, en vervolgens door de kolom gedrukt wordt. Stoffen worden hierdoor niet op kookpunt, maar puur op de affiniteit met de kolom gescheiden. Dit wordt gebruikt voor stoffen die niet thermisch stabiel zijn en snel uit elkaar vallen.
74
New cards
Solid Phase Micro Extractor (SPME)
Methode waarbij er een vezel op de naald zit. Er wordt gebruik gemaakt van de headspace methode omdat er vluchtige stoffen in het mengsel zitten. Moleculen in de gasfase kunnen absorberen op de naald door deze er een tijdje in te laten zitten, waardoor er door het verstoring van het evenwicht meer stoffen in de gasfase kunnen verdampen. Deze blijven ook weer aan de naald adsorberen. Vervolgens gaat het in de GC, waar het weer verwarmd wordt zodat de moleculen loslaten van de naald. Door deze methode wordt het meer geconcentreerd en wordt het detectielimiet verbeterd.
75
New cards
Flame Ionisation Detector (FID)
Detector met daarin een waterstofvlam dat gemaakt is van waterstofgas en schone lucht. Hierdoor verdampt er ook water. Als er koolwaterstoffen uit de kolom van de GC komen, verbranden deze en ontstaat er CO2. Hierdoor ontstaat er een andere soort vlam, en ontstaan er ionen. Deze worden opgevangen met een kathode, waardoor er een stroompje begint te lopen. Dit wordt gedetecteerd.
76
New cards
Selective Ion Monitoring (SIM) mode
Filter techniek van de MS. Een chromatogram bestaat uit diverse pieken op een bepaalde plek. Elke piek is weer opgebouwd uit een compleet massaspectrum (in m/z), met allemaal kleine piekjes die opgeteld die grote piek vormen. Hierbij worden dus ook vervuilingen meegenomen. Een oplossing daarvoor is het kijken naar maar 1 specifieke plek (bij 1 fragment met een bepaald m/z ratio). Het voordeel is dat er een hogere gevoeligheid is door minder ruis. Het nadeel is dat je moet weten welke m/z waarde je moet selecteren. Er is dus kennis over het analyt nodig.
77
New cards
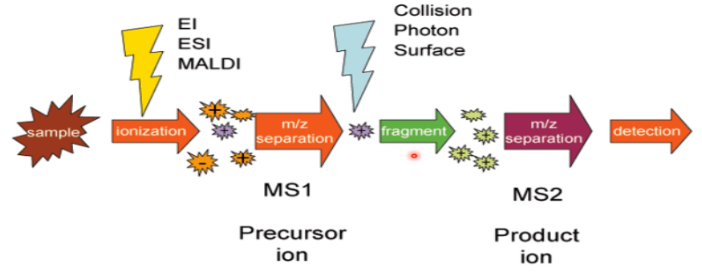
Tandem MS
1 of meerdere MS-en achter elkaar. Hierbij wordt het sample eerst geïoniseerd. 1 fragment wordt geselecteerd, en deze wordt vervolgens nog verder opgebroken. Hierdoor is meer info over het (originele) molecuul te verkrijgen. Er zijn 2 soorten: in ruimte en in tijd.
78
New cards
Tandem MS in ruimte
Hierbij worden de 2 apparaten na elkaar geplaatst. Het sample wordt eerst gefragmenteerd. Er wordt 1 fragment gekozen dat verder opgebroken wordt.
79
New cards
Tandem MS in tijd
Hierbij blijven de fragmenten in 1 ruimte en is er een ion trap met 2 + en 2 - polen die elkaar kunnen afwisselen. De fragmenten van het molecuul zijn + geladen en worden dus aangetrokken door de - en afgestoten door de + ladingen. Voordat ze kunnen ontsnappen worden de ladingen snel omgedraaid waardoor ze ‘vast’ blijven zitten in het midden. Hoe snel de fragmenten kunnen bewegen hangt af van hun massa. Afhankelijk van de tijd tussen het schakelen kunnen bepaalde fragmenten ontsnappen. Op basis daarvan is te selecteren welke je overhoudt. Hier worden weer elektronen op gebombardeerd waardoor dit fragment verder opbreekt.
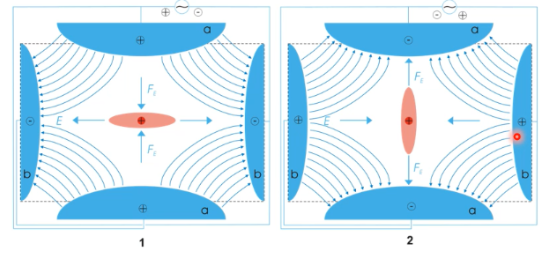
* Voordelen: schonere chromatogrammen met alleen pieken voor componenten met het geselecteerde fragment erin, verhoging van de selectiviteit, mooiere massaspectra en specifieke structuurinfo. Aan de hand hiervan kunnen specifieke componenten in een mengsel (bv drugs in urine) gedetecteerd worden.
* Nadelen: minder signaal door het wegfilteren, complexe apparatuur en er is voorkennis nodig van de materialen/componenten die bekeken worden.
* Voordelen: schonere chromatogrammen met alleen pieken voor componenten met het geselecteerde fragment erin, verhoging van de selectiviteit, mooiere massaspectra en specifieke structuurinfo. Aan de hand hiervan kunnen specifieke componenten in een mengsel (bv drugs in urine) gedetecteerd worden.
* Nadelen: minder signaal door het wegfilteren, complexe apparatuur en er is voorkennis nodig van de materialen/componenten die bekeken worden.
80
New cards
Kwaliteitscontrole
Een sample met een bekende concentratie wordt toegevoegd om te kijken of er geen systematische fout in de kalibratielijn is.
81
New cards
Betrouwbaarheid
Hoe dicht de metingen bij elkaar liggen.
82
New cards
Validiteit
Hoe dicht de (gemiddelde) metingen bij de juiste waarde liggen.
83
New cards
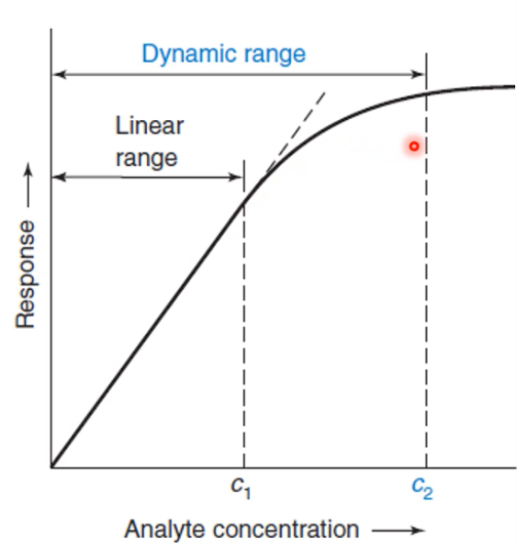
Dynamic range
Gebied van de responsielijn van het apparaat dat te gebruiken is. Dit is niet alleen het lineaire gebied maar ook een stukje van de kromme.
84
New cards
Detectielimiet
Wat nog acceptabel is om te gebruiken. Het is gelijk aan 3 standaarddeviaties (= 99% van de data). Dit is om een vals-positief te voorkomen. / waarde waarbij het nog betrouwbaar is om een stof te kunnen identificeren.
85
New cards
Ruis
Ontstaat door de afwijking in het apparaat. Soms is de meting iets hoger en soms iets lager.
86
New cards
Standaarddeviatie berekenen
1. Gemiddelde berekenen
2. Het gemiddelde aftrekken van elke waarde (=afwijking)
3. Afwijkingen kwadrateren
4. Alle kwadraten optellen
5. De som van de kwadraten delen door n-1
6. Wortel trekken van het antwoord van stap 5
87
New cards
Bovengrens van het detectielimiet
Als het monster op het detectielimiet zit, valt een deel weg en ontstaat er hierdoor een vals-negatieve. Dit is de prijs die je moet betalen om te zorgen dat er minder dan 1% een vals-positief is.
88
New cards
Ondergrens van het detectielimiet
De limiet van het signaal is gelijk aan: signaal van de blanco + 3 x SD. Dan wordt de kalibratielijn (y= ax + b) gebruikt om de concentratie te berekenen. Deze staat gelijk aan: concentratie limiet = (3x SD) / a
89
New cards
Kwantificatielimiet
Het minimale signaal dat nodig is om nog berekeningen te kunnen doen. De piek moet iets groter zijn dan het detectielimiet. Het is gelijk aan: concentratielimiet = (10 x SD) /a.
90
New cards
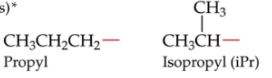
2 soorten van propyl
1. Propyl
2. Isopropyl
91
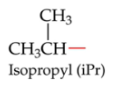
New cards
Isopropyl (iPr)
Zie foto
92
New cards
De 4 soorten butyl
1. Butyl
2. *sec*-Butyl
3. Isobutyl
4. *tert*-Butyl (tBu)
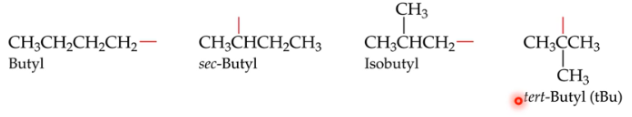
93
New cards
*sec*-Butyl
Zie foto

94
New cards
Isobutyl
Zie foto
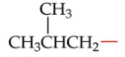
95
New cards
*tert*-Butyl (tBu)
Zie foto
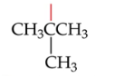
96
New cards
1
Metaan/methyl
97
New cards
2
Ethaan/ethyl
98
New cards
3
Propaan/propyl (evt iso-)
99
New cards
4
Butaan/butyl (evt *sec*-, iso- of *tert*-)/tetra (bij telling)
100
New cards
5
Pentaan