BAZA PYTANIA
1/92
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
93 Terms
czy wzrost ciśnienia wpłynie korzystnie na objętość amoniaku?
tak ponieważ zwiększenie ciśnienia powoduje zmianę ilości moli gazów a amoniak to gaz
jaka grupa charakteryzuje się największym powinowactwem elektronowym?
fluorowce (powinowactwo elektronowe to była energia uwalniana po przyłączeniu elektronów)
metale o wyższym (dodatnim) potencjale są?
mniej chętne do oddania elektronów, słabiej ulegają utlenieniu
jaka jest grupa funkcyjna kwasów tłuszczowych
R-COOH
chlorowanie alkanów zachodzi według mechanizmu?
substytucji rodnikowej
CaCO3→ CaO+CO2 co to za reakcja?
analizy (rozkładu) związek bardziej złożony rozpada się na mniej złożone
czynniki wpływające na szybkość reakcji?
temperatura, środowisko reakcji, dodatek katalizatora, ciśnienie, stężenia reagentów, rodzaj reakcji, rozdrobnienie reagentów
na podstawie czego określana jest moc kwasów?
stałej dysocjacji (jak łatwo dany związek rozłoży się na jony
liczba avogadro?
6,023×10²³
co to zasada według Bronsteda Lowryego?
jest akceptorem jonów H+ (protonów)
kształt orbitali typu p i s jak wygląda?
p= jak symetrycznie obrotowa ósemka, s= jak kula
jeżeli elektrowartościowość jonu miedziowego wynosi +2 oznacza to że?
atom stracił dwa elektrony
liczba stopni swobody dla układu jednoskładnikowego i jednofazowego wynosi?
s=n-f+2 zatem 2
co powstaje po redukcji aldehydów?
alkohole
produktem utlenienia hydroksykwasów
kwas mlekowy, salicylowy, glikolowy, cytrynowy
na czym polega wiązanie jonowe?
łączeniu atomów znacznie różniących się elektroujemnością/ o przeciwnych ładunkach
reakcja substytucji i addycji to inaczej?
wymiany i przyłączania
najprostszy sposób na rozróżnienie związku organicznego od nieorganicznego?
spaleniu próby, związki organiczne zawsze mają węgiel więc w wyniku spalenia albo będzie sadza albo CO2
wymień wiązania wewnątrzcząsteczkowe
jonowe, metaliczne, kowalencyjne
jakie wiązania występują w cząsteczce I2
kowalencyjne niespolaryzownae
Izotop to?
odmienne postacie tego samego pierwiastka różniące się liczbą neutronów (protonów i elektronów mają tyle samo)
przykładami reakcji redoks jest?
redukcja i utlenianie
co to surfaktanty?
związki powierzchniowo czynne, obniżają napięcie powierzchniowe cieczy
reguła van Hoffa mówi że wzrost temperatury zwiększa szybkość reakcji wzrośnie:
dwukrotnie
jak zmienia się rozmiar pierwiastków w tym samym okresie
maleje wraz ze wzrostem ładunku jądra, bo coraz więcej mają protonów i neutronów
Glicerol
Retinal
Glioksal
Metanal
który z nich nie jest aldehydem?
glicerol bo to alkohol
pochodną kwasów ze zmianą w częstości węglowodorowej jest
BEZWODNIK KWASOWY OGÓLNIE fluorowcokwasy, hydroksykwasy, oksykwasy, aminokwasy
ogólny wzór alkanów? alkenów i alkinów?
CnH2n+2, CnH2n, CnH2n-2

procesem odwrotnym do estryfikacji jest?
hydroliza
elektrofil i rodnik co to?
cząsteczka z deficytem elektronów chętnie przyjmująca elektrony, rodnik ma niesparowany elektron o dużej energii więc chętnie szuka drugiego elektronu do obniżenia energii
jak nazwiemy położenie dwóch podstawników połączonych w lokantach 1 i 4 w pierścieniu benzenowym
para
co nam mówi grupa i okres z układu okresowego dla danego pierwiastka
grupa-liczbę elektronów walencyjnych (z ostatniej powłoki) okres- liczbę powłok elektronowych, numer powłoki walencyjnej i wartość głównej liczby kwantowej
liczba atomowa to? liczba masowa to?
liczba mówiąca nam o protonów w jądrze i jeżeli cząsteczka jest obojętna to o ilości elektronów, liczba masowa mówi nam o sumie protonów i neutronów w jądrze
od czego zależy stopień dysocjacji elektrolitycznej?
temperatury, stężenia roztworu , rodzaju elektrolitu, rodzaju rozpuszczalnika
utlenianie i redukcja, na czym polegają?
utlenianie- na oddawaniu elektronów przez atomy a redukcja- na przyjmowaniu elektronó
co to utleniacze i reduktory?
utleniacze to substancje ulegające redukcji przyjmujące elektrony, a reduktory ulegają utlenieniu oddając elektrony
co to odwodornienie i uwodornienie
odwodornienie-odszczepienie atomów wodoru od cząsteczek-utlenienie , a uwodornienie- dołączenie wodorów redukcja
która z powłok nie ma podpoziomu p? L,M,N,K
K bo:

jaki odczynnik pozwoli nam rozróżnić alkohol od fenolu?
wodorotlenek
jakie wiązania występują w cząsteczce tlenu? O2
jedno pojedyńcze sigma i 1 pi przykład:
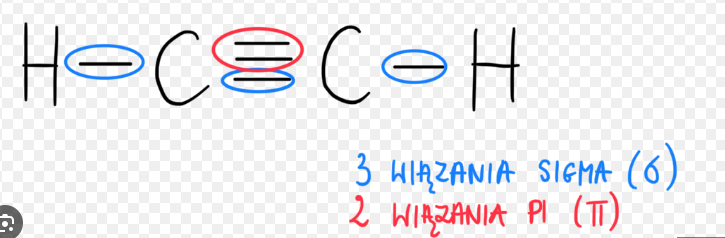
kwas pirogronowy to przedstawiciel?
alfa -oksokwasów
stopień utlenienia węgla w cząsteczce kwasu węglowego wynosi?
H2CO3, więc IV
przykładem dysocjacji elektrolitycznej jest
elektroliza soli (polega na rozpadzie na jony substancji pod wpływem przepływu prądu)
rozpisz konfigurację dla pierwiastka którego Z=20
1s² 2s² 2p^6 3s² 3p^6 4s²
czy reakcja haloformowa służy do wykrywania metyloktonów? np. acetonu?
TAK
w ogniwie elektrolitycznym procesy na elektrodach zachodzą samorzutnie?
nie, potrzebny jest przepływ energii z zewnątrz
mocznik to amid jakiego kwasu?
węglowego
w wyniku której reakcji NIE OTRZYMAMY kwasów karboksylowych: hydrolizy kwasowej estrów, utleniania alkoholi pierwszorzędowych silnym utleniaczem, utleniania aldehydów, hydrolizy zasadowej amidów
w wyniku hydrolizy zasadowej amidów
który z tych pierwiastków nie występuje w cząsteczkach dwuatomowych? azot, wodór, argon, tlen
argon bo jest z gazów szlachetnych a one nie są w cząsteczkach po 2 atomy
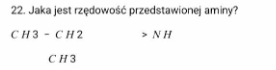
podaj rzędowość tej aminy
2 bo z dwoma węglami się grupa funkcyjna łączy
nukleofil co to
odczynnik chemiczny mogący być dawcą pary elektronowej bo ma nadmiar, chętnie odda elektrony
położenie dwóch podstawników w benzenie w pozycji 1,3 nazywa się?
meta
kwas według Bronsteda-Lowryego
jest donorem protonów (jonów H+)
największą energię jonizacji mają?
gazy szlachetne (energia potrzebna do oderwania elektronu)
pv=nRT co to za równanie i jak się nazywa?
gazu doskonałego, równanie Clapeyrona
w wyniku dehydratacji etanolu otrzymamy?
eten
twórcą teorii dysocjacji elektrolitycznej jest?
Arrhenius
w wyniku całkowitego spalania etenu otrzymamy?
2CO2+2H2O
w wyniku dehydratacji etanolu reakcji przy użyciu stężonego kwasu siarkowego VI powstaje?
alken- eten
nie moge usunac tej fisszki
aldehydy
reakcja substytucji inaczej to? przejście ciała stałęgo w stan gazowy to?
podstawiienia, sublimacja
kolejne orbitale zajmowane są w porządku wzrastającej energii jest to?
zasada rozbudowy powłok
metodą kumenową otrzymamy?
fenol i aceton w wyniku połączenia benzenu propenu
alkany, jak bardzo są reaktywne?
mało

to pierwsze
przykład kryształu molekularnego?
grafit
aktywator co robi?
obniża energię aktywacji przyśpieszając reakcję
po dysocjacji H2PO4 powstanie
2H+ oraz PO4²-
w ogniwie galwanicznym procesy zachodzą?
samoistnie
różnica między szkłem a kryształem
szkło ma nie uporządkowane cząsteczki, powstaje w wyniku ochłodzenia stopionych surowców bez krystalizacji składników, krzyształ to ciało stałe o powtarzających się okresowo ułożeniach atomów i cząsteczek tworząc prawidłową sieć krystaliczną
gazy nie występujące w cząsteczkach dwuatomowych
gazy szlachetne
podaj 2 rodziny związków po których utlenieniu uzyskamy kwasy karboksylowe
aldehydy, alkohole pierwszorzędowe
podaj przykład kryształu jonowego, kowalencyjnego, metalicznego
sól kuchenna, diament, miedź
do czego utleniają się alkohole 3-rzędowe, położenie dwóch podstawników w benzenie 1,2
nie utleniają się, orto
przejście ze stanu gazowego w stały to?
resublimacja
wymień wiązania międzycząsteczkowe
siły Vand der Waalsa, wiązania wodorowe
reguła hunda i zakaz pauliego o czym mówią?
na każdy orbital ma przypadać jak najwięcej niesparowanych elektronów po wysyceniu dopisujemy elektrony o antyrównoległych spinach, zakaz pauliego mówi o tym że w atomie nie mogą występować elektrony nie różniące się ani jedną liczbą kwantową, 2 ELEKTRONY NIE MOGĄ PORUSZAĆ SIĘ POTEJ SAMEJ ORBICIE o tym samym spinie
co robi inhibitor, podaj wzór gliceryny
chamuje reakcje zwiększając energię aktywacji, C3H8O3
cechy gazu doskonałego
nie ma oddziaływań międzycząsteczkowych (działają 3 prawa izobary izotermy i izochory), cząsteczki przemieszaczają się losowo, cząsteczki mają zerową objętość
wzór ogólny ketonów
R-C=O
stopnie utlenienia amoniaku
-III
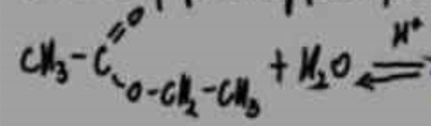
produkty w tej reakcji to?
kwas etanowy+ etanol
określ stopnie utlenienia pierwiastków w kwasie węglowym
H2CO3 H-I C-IV O- -2
estryfikacja na dowolnym przykładzie
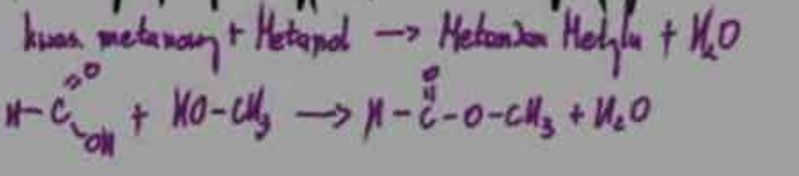
katalizator to?
substancja zwiększająca szybkość reakcji, szybciej osiągnięty zostaje stan równowagi, nie bierze udziału w reakcji samej
wzór ogólny kwasów karboksylowych i aldehydów?
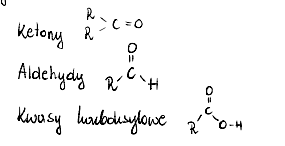
wzór mocznika?
CH4N2O
teoria Lewisa ogólna
atomy dążą do uzupełnienia powłoki walencyjnej lub jej upodobnienia do powłoki najbliższego gazu szlachetnego dublet to gdy mamy 2 e- na ostatniej powłoce
rodzaje wiązań jonowych
heteropolarne, elektrowalencyjne, biegunowe
aminy to pochodne?
amoniaku
wzór ogólny cykloalkanów?
CnH2n
grupa CHO jest grupą funkcyjną?
aldehydów
na czym polega wiązanie atomowe (kowalencyjne) a na czym NIE POLEGA
na uwspólnianiu pary elektronowej, tworzeniu wspólnych par elektronów itp, NIE POLEGA NA ŁĄCZENIU SIĘ ATOMÓW ZNACZNIE RÓŻNIĄCYCH SIĘ elektroujemnością