Micología Parcial 3
1/80
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
81 Terms
¿Qué es una levadura?
Hongo unicelular que se divide asexualmente por gemación o fisión binaria.
¿Qué aplicaciones tiene S. cerevisiae?
Uso tradicional en la fermentación del pan y las bebidas alcohólicas
Aditivo alimentario natural en animales para manipular el tracto gastrointestinal y el ambiente ruminal
Organismo modelo de procesos genéticos fundamentales, estudio de ribosomas y síntesis de proteínas
Modificación genética para la síntesis de proteínas recombinantes
Aplicaciones médicas (probióticos, modelos de enfermedades, fábricas farmacológicas celulares, vacunas, biosensores y productos bioterapéuticos vivos)
Biocombustibles (fermentación para la producción de etanol)
Biorremediación y tratamiento de residuos
Describa el metabolismo de S. cerevisiae
S. cerevisiae tiene un metabolismo flexible. Puede descomponer la glucosa mediante la respiración aeróbica. Sin embargo, en ausencia de oxígeno descompone los azúcares individuales (glucosa, maltosa) en etanol y dióxido de carbono.
¿Qué morfología presenta S. cerevisiae?
Puede existir tanto como organismo unicelular como pseudomicelio. Normalmente se presenta en forma de levaduras, con células ovaladas que se reproducen por gemación bipolar. Sin embargo, en condiciones de estrés (escaso nitrógeno) una cascada de señales de transducción regula la diferenciación de las pseudohifas (células más elongadas con gemación unipolar)
¿Cómo se reproduce S. cerevisiae?
Gemación multilateral, produciendo 1-4 ascosporas elipsoidales de pared lisa
¿Cuáles son los dos mecanismos de reproducción asexual que pueden presentar las levaduras?
Gemación (principal) y fisión binaria
¿Qué es la gemación?
Método de reproducción asexual en el que una pequeña yema crece desde la célula madre hasta alcanzar el tamaño completo. Cuenta con procesos de división nuclear y separación
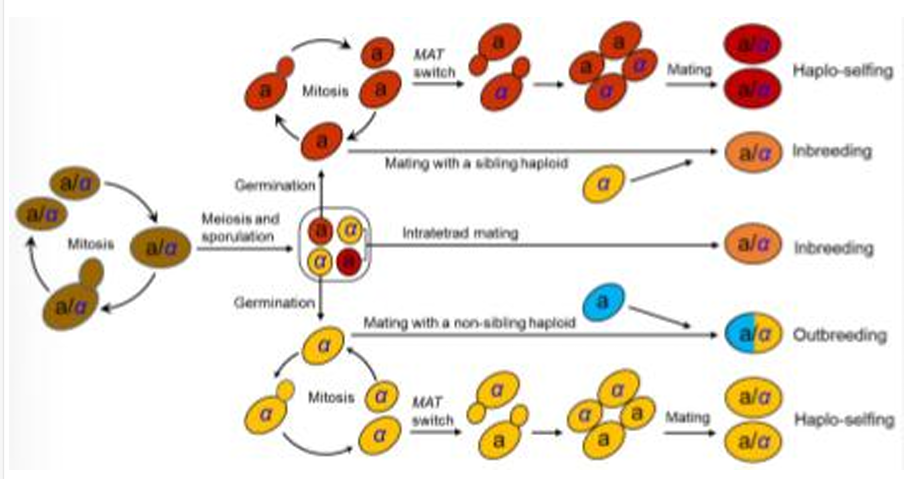
Describa cómo pueden reproducirse las levaduras sexualmente
Las células vegetativas suelen ser diploides y se reproducen asexualmente por gemación. Una célula diploide experimenta meiosis y esporulación debido a la falta de nitrógeno, lo que resulta en la formación de una tétrada con cuatro ascosporas. Estas pueden aparearse dentro de la tétrada para formar una célula diploide o germinar para formar células haploides. Una célula haploide se reproduce por gemación y luego se aparea con otra célula haploide hermana o no hermana con un tipo de apareamiento opuesto para formar una célula diploide. Las células haploides también pueden autofecundarse mediante un proceso conocido como cambio de tipo de apareamiento.
¿Cómo se determina el sexo en levaduras?
Esto está determinado por el locus MAT en el cromosoma CHRII
Explique el cambio de tipo de apareamiento
La endonucleasa Ho corta un sitio específico entre las regiones Y y Z, generando una rotura de la doble cadena. Esto desencadena una conversión génica, utilizando el casete silencioso del tipo de apareamiento opuesto como plantilla.
¿Cuáles son los hábitats adicionales de las levaduras?
Animales
Atmósfera
Entorno construido
¿En qué se basa la identificación clínica de levaduras?
Patrones de fermentación de azúcares
Efecto Pasteur
Describe cómo la presencia de oxígeno inhibe la fermentación.
Efecto Crabtree
Se observa cuando la concentración de glucosa en el medio es mayor al 0.4%. La levadura fermenta el azúcar aunque haya oxígeno. Se debe a una regulación metabólica que inhibe la respiración aerobia y aumenta la fermentación para producir etanol rápidamente. No ocurre en todas las levaduras
¿Qué significa que S. cerevisiae tenga estatus GRAS?
Significa que es “generalmente reconocido como seguro” por la FDA. Esto permite su uso en productos alimenticios sin la necesidad de aprobación previa específica.
¿Por qué S. cerevisiae se utiliza como organismo modelo?
Hay abundante información (genoma completamente secuenciado), lo que lo convierte en un modelo primario para la manipulación científica. Además, su similitud con eucariotas superiores y facilidad de cultivo permite el estudio de diversas aplicaciones biotecnológicas.
¿Cuáles son las aplicaciones de S. cerevisiae en la medicina?
Modelo de enfermedades
Descubrimiento de fármacos
Fábricas farmacológicas celulares
Vacunas
Biosensores
BLPs
¿Cuáles son las aplicaciones de las levaduras en la biotecnología ambiental?
Producción de biocombustibles
Biorremediación
Tratamiento de residuos
Biosensores
¿Cuáles son los pasos en la producción industrial de levadura?
Selección de cepas
Cultivo inicial
Fermentación industrial
Procesamiento y envasado
¿Cuál es el rol de S. cerevisiae en la nutrición animal?
En rumiantes mejora la fermentación ruminal, aumenta la digestibilidad de la fibra, estabiliza el pH ruminal. Esto aumenta la producción de leche y reduce trastornos metabólicos
En aves de corral actúa como prebiótico, mejorando la salud intestinal y fortaleciendo el sistema inmune. Los manano-oligoscáridos de la pared celular pueden bloquear la adhesión de patógenos al epitelio intestinal.
En cerdos, mejora la digestibilidad de nutrientes, reduce la incidencia de diarreas post-destete, promueve el crecimiento y reduce la necesidad de antibióticos promotores del crecimiento.
¿Cuáles son los mecanismos de acción de las levaduras en la nutrición animal?
Modulación microbiana
Efecto barrera
Inmunomodulación
Aporte enzimático
¿Cuáles son los productos comerciales de levadura para nutrición animal?
Levaduras vivas
Mantienen actividad metabólica
Modulan microbiota intestinal y proporcionan enzimas activas
Cultivos de levadura
Células de levadura y su medio de crecimiento
Mayor proporción de células muertas
Aportan nutrientes, enzimas y componentes de la pared celular.
Extractos de pared celular
Ricos en manano-oligosacáridos y B-glucanos
Inmunomoduladores
Absorben micotoxinas
¿Cuáles son los desafíos y limitaciones en la aplicación de levaduras?
Sensibilidad a condiciones extremas (temperatura, concentración de etanol y presencia de inhibidores)
Uso de sustratos (S. cerevisiae no fermenta pentosas)
Consideraciones regulatorias para las cepas modificadas
Micosis
Infección producida por ciertos hongos en alguna parte del organismo.
Clasificación de micosis según el sitio de infección
Superficiales : limitadas al estrato córneo sin inflamación
Cutáneas: afectan la piel, pelo y uñas
Subcutáneas: involucran tejidos subcutáneos tras inoculación traumática
Sistémicas (profundas): afectan órganos internos como pulmones, cerebro y riñones
Clasificación de las micosis según la ruta de adquisición
Exógenos: transmisión aérea, cutánea
Endógenos: colonización por un miembro del a flora normal o reactivación de una infección previa
Clasificación de las micosis según la virulencia
Primarios: pueden establecer infecciones en huéspedes normales
Oportunistas causan enfermedad en individuos con mecanismos de defensa comprometidos
Vías de entrada de hongos patógenos
Tracto respiratorio
Tracto gastrointestinal
Dispositivos intravasculares (catéteres y dispositivos médicos)
Inoculación traumática (heridas)
Micosis superficiales
Definición:
Micosis limitadas al estrato córneo sin inflamación
Ejemplos:
Pitriasis versicolor
Piedra negra
Piedra blanca
Tiña negra
Diagnóstico:
Examen de luz de Wood
Tinción con fluorocromos
Fluoroforo puede emitir fluorescencia al ser activados por la luz ultravioleta (afinidad por la quitina)
Preparación de escamas de piel con KOH o NaOH
Micosis cutáneas
Definición:
Micosis que afectan la piel, pelo y uñas
Ejemplos:
Dermatofitosis
Dermatomicosis
Factores predisponentes
Clima (lugares húmedos y tropicales)
Mala higiene
Hacinamiento
Zapatos cerrados o zapatillas
Ropa sintética
Diabetes
VIH
Micosis subcutáneas
Definición:
Micosis que involucran tejidos subcutáneos tras inoculación traumática. Los hongos introducidos en la dermis o tejido subcutáneo por lesión permanente causan enfermedad.
Características generales
Lesiones granulomatosas que se expanden lentamente desde el punto de implantación.
Distribución
Región tropical y subtropical
Complicaciones
Extensión linfática lenta (excepto esporotricosis)
Rara generalización potencialmente letal
Ejemplos:
Cromoblastomicosis
Micetoma
Esporotricosis
Feohifomicosis
Entomoftoromicosis
Lacaziosis
Micosis sistémicas
Definición:
Micosis que afectan órganos internos
Ejemplos:
Por levaduras (Cándida, Malassezia, Rodotorula, Saccharomyces, Trichosporum)
Por mohos (Aspergillus, mucorales y mohos negros)
Por dimórficos (histoplasmosis, blastomicosis, talaromicosis, emergomicosis)
Micosis exógenas
Definición:
Micosis adquirida por transmisión aérea o cutánea
Micosis endógenas
Definición:
Micosis causada por la colonización de un miembro de la flora normal o reactivación de una infección previa
Micosis primarias
Definición:
Micosis que puede causar infecciones en personas inmunocompetentes
Ejemplos:
Coccidiomicosis
Histoplasmosis
Blastomicosis
Micosis oportunistas
Definición:
Micosis que solo causa enfermedad en pacientes inmunocomprometidos
Ejemplos:
Candidiasis
Aspergilosis
Zigomicosis (mucormicosis)
Criptococosis
Feohifomicosis
Hialohifomicosis
Pitriasis versicolor
Micosis superficial común
Causada por Malassezia furfur
Características y manifestaciones clínicas
Caracterizada por hipopigmentación o hiperpigmentación de la piel del cuello, hombros, pecho y espalda
Máculas o parches de bordes irregulares con descamación fina en piel normal
Lesiones hipocrómicas, amarillo pálido, rosadas o color salmón
Afecta la capa queratínica superficial
Prevalece en zonas de alta humedad y temperatura
Grupos de riesgo: adolescentes y adultos jóvenes
Factores predisponentes y condiciones asociadas: sudoración excesiva, uso de aceites corporales, uso de corticosteroides, inmunosupresión, desnutrición, diabetes, terapia con esteroides
Patogénesis: produce queratinasas, causando disminución del estrato córneo y desescamación. Ocurre en las primeras semanas de vida, con recolonización en adolescencia.
Mecanismo: produce lipasas, que liberan ácido oleico y araquidónico de los lípidos del cebo. Estos inician la reacción inflamatoria en queratinocitos, los cuales producen citosinas proinflamatorias
Piedra negra
Micosis superficial rara
Causada por Piedraia hortae
Características
Pequeños nódulos negros firmes que afectan el tallo del cabello.
Más frecuente en zonas de alta humedad, tropicales y subtropicales
Piedra blanca
Micosis superficial común
Causada por Trichosporon beigelli
Hongos levaduriformes que colonizan el tallo piloso
Caracterizada pro nódulos blancos, friables y beige en los extremos distales de los tallos del pelo
Más frecuente en zonas con alta pluviosidad
El cabello húmedo es un factor predisponente
Tiña negra
Micosis superficial causada por Phaeonnellomyces weneckii
Características
Manchas marrones a negras similares al nitrato de plata en la palma de la mano o en la planta del pie
Máculas hiperpigmentadas, no descamativas
Prevalente en zonas costeras
Incidencia en personas con hiperhidrosis en pies y manos
Clasificación ecológica de los dermatofitos
Antropofílicos
Zoofílicos
Geofílicos
Dermatofitosis
Tipo de micosis cutánea
Epidermophyton
Solo afecta piel y uñas
Colonias aterciopeladas, blanquecino amarillentas
Macroconidios piriformes agrupados en racimos y abundantes clamidosporas
Microsporum
Afecta pelo y piel
Colonias algodonosas, pulverulentas blanco-amarillentas
Macroconidios en forma de croissant y abundantes microconidios
Trichophyton
Afecta pelo, piel y uñas
Colonias algodonosas, aterciopeladas, pulverulentas y blanquecinas
Macroconidios en forma de habano y abundantes microconidios
Tipos de tiña de la cabeza (micosis cutánea)
Ectotrhix: Artroconidios en el exterior del tallo del cabello. Destruye la cutícula del cabello.
Endotrhix: Artroconidios solo dentro del tallo del cabello. Cutícula permanece intacta
Endo-ectotrhix: microsporum presenta filamentos en el interior y esporas en el exterior. Combina características de ambos tipos.
Dermatomicosis
Infecciones cutáneas causadas por otros hongos
Candida es la más común
Puede afectar pliegues cutáneos, espacios interdigitales, uñas y áreas mucosas.
Cromoblastomicosis
Micosis subcutánea
Características
Lesiones verrucosas de la piel en extremidades inferiores
Nódulos o placas verrucosas localizadas en los miembros
Pueden diseminarse por vía linfática o hematógena
Causadas por hongos dematiáceos
Fonsecaea pedrosoi, Fonsecaea compacta, Cladosporium carionii y Phialophora verrucosa
Micetoma
Micosis subcutánea crónica y destructiva
Causada por bacterias u hongos
Características
Infección subcutánea supurativa y granulomatosa que destruye hueso, tendón y músculo esquelético.
Tractos sinusales drenantes con granos pigmentados visibles
Eumicótico o actinomicótico
Alta morbilidad
Aumento del volumen de los tejidos sucbutáneos, provocando deformación de la región
Esporotricosis
Micosis subcutánea causada por Sporotrix scheenckii
Presenta dimorfismo, la forma de levadura es la parasitaria
Características
Infección que se extiende a lo largo de los canales linfáticos cutáneos de la extremidad afectada
Forma linfocutánea, fija, diseminada y extracutánea
Asociado a actividades como jardinería, agricultura y otras recreativas
Patogénesis
Inoculación traumática
Transformación dimórfica
Formación de granuloma
Diseminación linfática
Afectación ganglionar
Medios de transmisión
Inoculación directa por material vegetal contaminado
Zoonótica (gatos)
Contacto con tierra contaminada
Grupos de riesgo
Jardineros, agricultores y floricultores
Veterinarios
Mineros y trabajadores forestales
Propietarios de gatos en zonas endémicas
Entomoftoromicosis
Micosis subcutánea por Entomophtorales
Mucormicosis subcutánea
No reportan alteraciones inmunológicas
Climas ecuatoriales, tropicales o semiáridos
Rinosporidiosis
Micosis submucosa y subcutánea granulomatosa crónica
Causada por Rinosporidium seeber
Caracterizada por la formación de masas verrucosas o vegetantes, altamente vascularizados
Lacaziosis
Micosis subcutánea
Causada por Lacazia loboi
Caracterizada por lesiones nodulares queloideas en cualquier parte del cuerpo
Restringida en zonas de la selva amazónica
Dimorfismo
Conversión morfológica y fisiológica de ciertos hongos de un fenotipo a otro cuando cambian de ambiente.
Por lo general la forma saprofítica los hongos crecen como estructuras filamentosas (hifas) que producen conidios. Al ingresar al huésped, entran a la forma parasitaria que se manifiesta como levaduras o esférulas.
Candida albicans es distinta pues el organismo se transforma de levaduras en gemación (blastoconidias) a estructuras filamentosas conocidas por tubos germinales que pueden desarrollarse posteriormente como pseudohifas e hifas.
Dimorfismo en C. albicans
Blastoconidia
Forma de levadura con gemación
Típica en condiciones normales de crecimiento
Tubo germinal
Estructura filamentosa inicial que se desarrolla a partir de la blastoconidia en respuesta a condiciones específicas del huésped
Pseudohifa
Cadena de células de levadura elongadas que permanecen unidas
Estructuras similares a hifas pero con constricciones
Hifas verdaderas
Estructuras filamentosas continuas sin constricciones
Forma más agresiva
Coccidiomicosis
Micosis primaria
Causada por Cocidioides immitis
Artroconidios inhalados se convierten en esférulas en el pulmón
Puede diseminarse al cerebro, huesos y otros sitios
Meningitis
Histoplasmosis
Micosis primaria
Causada por Histoplasma capsulatum
Caracterizada por el crecimiento intracelular en macrófagos y reacción granulomatosa
Puede reactivarse y diseminarse a otros tejidos
Blastomicosis
Micosis primaria (infección pulmonar)
Causada por la inhalación de Blastomyces dermatitidis
Caracterizada por reacción granulomatosa con marcada fibrosis
Neumonía crónica con posible diseminación a piel, huesos y próstata
Candidiasis
Infección fúngica oportunista más común
Principalmente causada por Candida albicans
Puede ser superficial o profunda
Factores de riesgo
Antibióticos de amplio espectro
Quimioterapia citotóxica
Corticosteroides
Catéteres vasculares
Aspergilosis
Micosis oportunista
Afecta principalmente pulmones y senos paranasales
Posible diseminación a cerebro, riñones, hígado, corazón y huesos
La principal vía de entrada es el tracto respiratorio, aunque lesiones cutáneas también pueden introducir el microorganismo
Factores de riesgo
Defectos cuantitativos y funcionales en neutrófilos circulantes
Neutropenia por quimioterapia citotóxica
Corticosteroides sistémicos.
Zigomicosis
Micosis oportunista
Infección sinopulmonar invasiva por Rhizopus, Rhizomucor, Absidia y Mucor
La rinocerebral es una forma mortal que ocurre en diabéticos con cetoacidosis
La neutropenia y los corticosteroides son otros factores de riesgo
Fuerte propensión a invadir vasos sanguíneos, causando trombosis e infartos
Criptococosis
Micosis oportunista
Causa neumonía y meningitis
Relacionada al SIDA
Feohifomicosis
Infecciones por hongos dematiáceos oportunistas
Son hongos oportunistas, casi todos los casos ocurren en pacientes inmunocomprometidos
Ciertas especies causan abcesos cerebrales
Síndromes clínicos
Sinusitis invasora, necrosis ósea, nódulos subcutáneos, queratitis, masas pulmonares, artritis micótica, etc.
Medidas para el control y tratamiento de las micosis
Control ambiental
Diagnóstico precoz
Prevención
Terapia antifúngica (mejorar eficacia y reducir la toxicidad)
Describa el problema de las enfermedades desatendidas
Impacto en salud: baja mortalidad pero alta morbilidad (discapacidad permanente)
Consecuencias socioeconómicas: alto impacto social y económico en poblaciones vulnerables
Investigación limitada: escasa inversión en diagnóstico, tratamiento y prevención
¿Cuál es el problema con las micosis oportunistas?
Aumento de la población en riesgo
Poca capacidad de diagnóstico
Resistencia antimicrobiana
Cambios en los ecosistemas
Aumento en los brotes
Resistencia antifúngica a azoles, polinos y equinoadiles
Infecciones invasivas
Desafíos de identificación
Persistencia en dispositivos médios y piel humana
Mencione los factores de riesgo para micosis oportunistas
Sida
Trasplantes
Desnutrición
Hospitalización prolongada
Antibióticos de amplio espectro
Antifúngico
Sustancia capaz de producir alteraciones en la estructura de una célula fúngica, inhibiendo desarrollo y alterando su viabilidad o capacidad de supervivencia.
Tipos de antifúngicos según método de aplicación
Sistémicos
Tópicos
Clasificación de los antifúngicos por estructura química
Polienos
Azoles
Alilaminas
Clasificación de los antifúngicos por sitio de acción
Membrana celular
Pared fúngica
ADN-ARN
Mecanismo de acción de polienos
Se unen al ergosterol, formando canales que aumentan la permeabilidad de la membrana, provocando la pérdida de componentes celulares y la muerte fúngica
Mecanismo de acción de los azoles
Inhiben el citocromo P-450 fúngico, bloqueando la conversión de lanosterol a ergosterol, componente esencial de la membrana
Mecanismo de acción de las quinocandinas
Inhiben la enzima B-1, 3-D-glucano sintasa, impidiendo la formación de glucanos en la pared celular y provocando desequilibrio osmótico.
Mecanismo de acción de la flucitosina
Transportada al interior de la célula fúngica por la citosina permeasa. Dentro del citoplasma, la enzima citosina desaminasa (ausente en humanos) convierte la flucitosina en un compuesto activo. El 5-FI es fosforilado e incorporado al ARN, alterando la síntesis proteica e inhibiendo la trimidilato sintetasa, bloqueando la síntesis de ADN y la división celular.
¿Cuáles son los problemas asociados a los antifúngicos?
Limitado espectro de acción
Actividad restringida contra determinadas especies. Dificulta su tratamiento empírico sin identificación del patógeno
Acción fungistática vs. fungicida
Algunos antifúngicos solo inhiben el crecimiento sin eliminar el hongo, requiriendo un sistema inmune competente para erradicar la infección
Toxicidad y efectos adversos
Similitud entre célula fúngicas y humanas limita la selectividad de los fármacos, provocando efectos secundarios como nefrotoxicidad
Altos costos y resistencia
Desafíos en el desarrollo de antifúngicos
Similitud bioquímica
Células fúngicas y humanas comparten vías metabólicas y estructuras celulares.
Dificulta el desarrollo de compuestos con toxicidad selectiva sin dañar al hospedero
Heterogeneidad fúngica
Enorme diversidad morfológica y fisiológica
Mecanismos de virulencia, estructuras celulares y susceptibilidad a fármacos varían entre especies o cepas
Limitaciones farmacológicas
Difícil desarrollar antifúngicos con adecuada biodisponibilidad oral, buena penetración en tejidos y fluidos corporales, así como mínimas interacciones medicamentosas
Resistencia adaptativa
Tipos de resistencia a antifúngicos
Intrínseca o innata
Primaria
Secundaria o adquirida
Resistencia intrínseca o innata
Característica natural presente en todas las cepas de una especie fúngica determinada
Las hace resistentes a un antifúngico específico sin exposición previa
Resistencia primaria
Aparición espontánea de cepas resistentes en especies normalmente sensibles sin contacto previo al antifúngico
Causado por mutaciones aleatorias en genes relevantes, adaptaciones a condiciones ambientales y presión selectiva por exposición ambiental a compuestos similares
Resistencia secundaria o adquirida
Se desarrolla después de la exposición a los antifúngicos, mediante alteraciones genotípicas o fenotípicas
Causas frecuentes
Uso prolongado de antifúngicos en tratamientos
Terapia antifúngica a dosis subterapéuticas
Profilaxis en pacientes de alto riesgo
Mecanismos de resistencia microbiológica
Alteraciones del transporte
Reducción en la entrada el fármaco al interior de la célula (barreras de permeabilidad)
Expulsión activa del compuesto mediante bombas de flujo
Alteraciones de la diana
Cambios en la interacción fármaco-diana por mutaciones o aumento del número de copias de la diana, reduciendo la efectividad del fármaco sin afectar la función celular
Activación de vías de respuesta a estrés
Hsp90 → chaperonas moleculares
Facilitan la adaptación al estrés causado por antifúngicos, permitiendo la supervivencia celular
Plasticidad genómica
Aneuploidía (cambios en el número de cromosomas)
Duplicación de genes o cromosomas completos
Permiten adaptaciones más rápidas frente a presiones selectivas
Estructuras metabólicas complejas
Biopelículas
Resistencia clínica
Crecimiento o falta de inhibición de un microorganismo en el foco de infección, a pesar de existir concentraciones terapéuticas del fármaco.
No siempre se correlaciona con los resultados de susceptibilidad in vitro.
El estado inmunológico, factores farmacológicos y factores microbiológicos afectan la respuesta clínica
¿Qué se puede hacer para combatir la problemática de la resistencia a antifúngicos?
Diagnóstico precoz
Investigar moléculas específicas de hongos sin homólogos humanos que puedan actuar como dianas terapéuticas
Terapias combiadas (sinergias antifúngicas con diferentes mecanismos)
Vigilancia