B.1.2 Proteínas
1/14
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
15 Terms
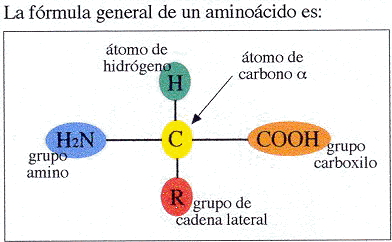
Estructura de un amino ácido
Los aminoácidos son los monómeros de las proteínas. Tienen la siguiente estructura.
Carbono en el centro.
Hidrógeno arriba.
R abajo.
Grupo amino (NH2) a la izquierda.
Grupo ácido (COOH) a la derecha.
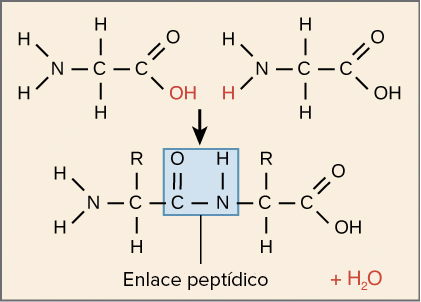
Reacción de condensación en amino ácidos
Los amino ácidos se unirán mediante el enlace peptídico por reacciones de condensación.
Amino ácidos esenciales
Son aquellos amino ácidos que suelen estar en animales, y que el organismo no es capaz de sintetizar. Estos vienen directamente de la dieta. 9/20 amino ácidos son esenciales. Son extremadamente importantes.
Amino ácidos no esenciales
Son aquellos amino ácidos que sintetiza solo el organismo. Sin embargo, solo hay dos amino ácidos que pueden sintetizarse solos, ya que el resto se sintetizan a base de los amino ácidos esenciales. 11/ 20 son no esenciales. Son importantes pero no tanto.
Variedad de posibles cadenas peptídicas
Hay una variedad infinita de proteínas, dado que solo con el cambio de orden de un amino ácido, la proteína cambia en estructura y por tanto, en función.
Efecto del pH y temperatura en proteínas.
Las proteínas tienen funciones determinadas debido a su conformación tridimensional. El pH y la temperatura si cambian, hace que cambie totalmente la forma de las proteínas y por tanto, su función.
Desnaturalización
Cambio de pH o temperatura, lo que cambia la forma y totalmente la función de la proteína.
Por ejemplo: El Huevo: Cuando le aplicamos calor cambia el color y la función.
Diversidad de grupos R
El grupo R, hace referencia a lo que cambia en cada amino ácido. Dependiendo del radical, el cual puede ser hidrofóbico o hidrofílico, dentro del que puede ser polar o con carga, el amino ácido y por tanto la proteína cambian de forma, y por tanto, de función.
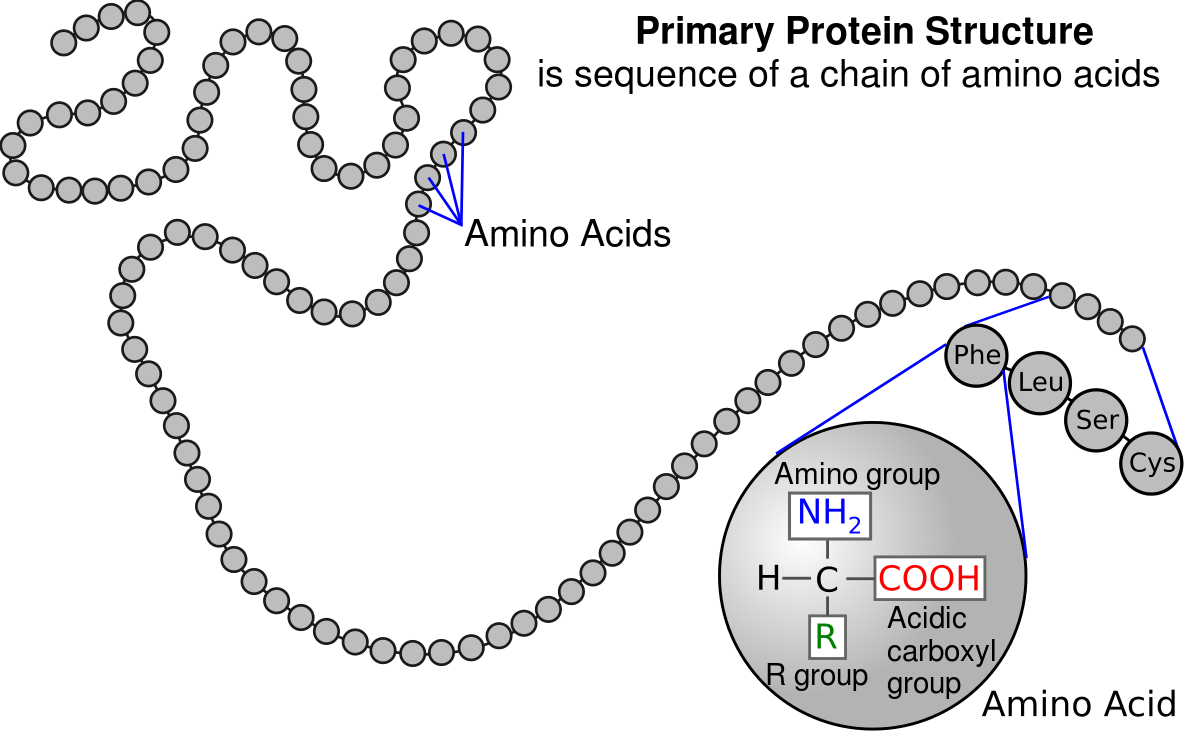
Estructura Primaria
Una cadena lineal de amino ácidos unidos mediante enlaces peptídicos por reacciones de condensación.
El carbono α de cada amino ácido tiene dos enlaces capaces de rotar en todas las direcciones, cambiando la conformación de la proteína. Asimismo, dependiendo de el grupo R, cambiará la conformación.
Estructura Secundaria
Esta estructura coge estabilidad dado que se forman puentes de hidrógeno, aunque no muy fuertes, entre los hidrógenos de N-H y los oxígenos de C=O. Esta estructura puede presentarse de 2 formas: α-Hélice y Lamina B.
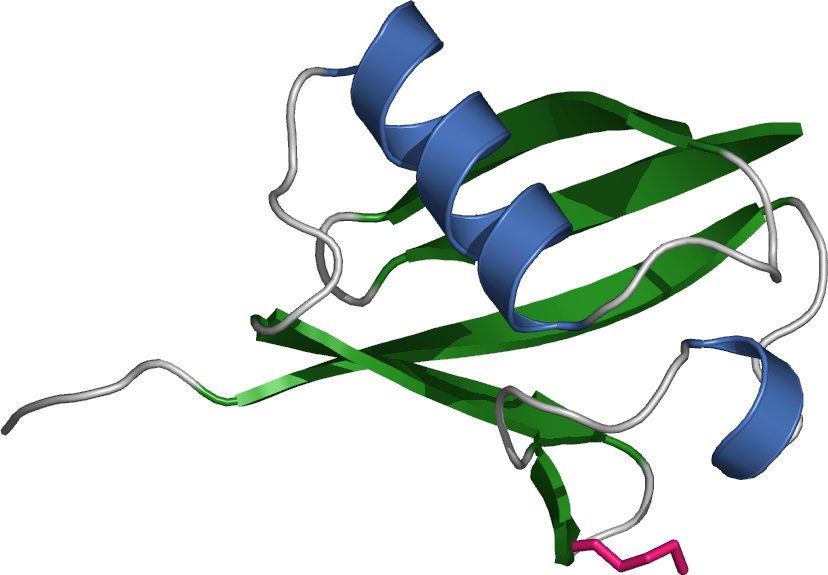
α-Hélice
Los puentes crean una forma de hélice.
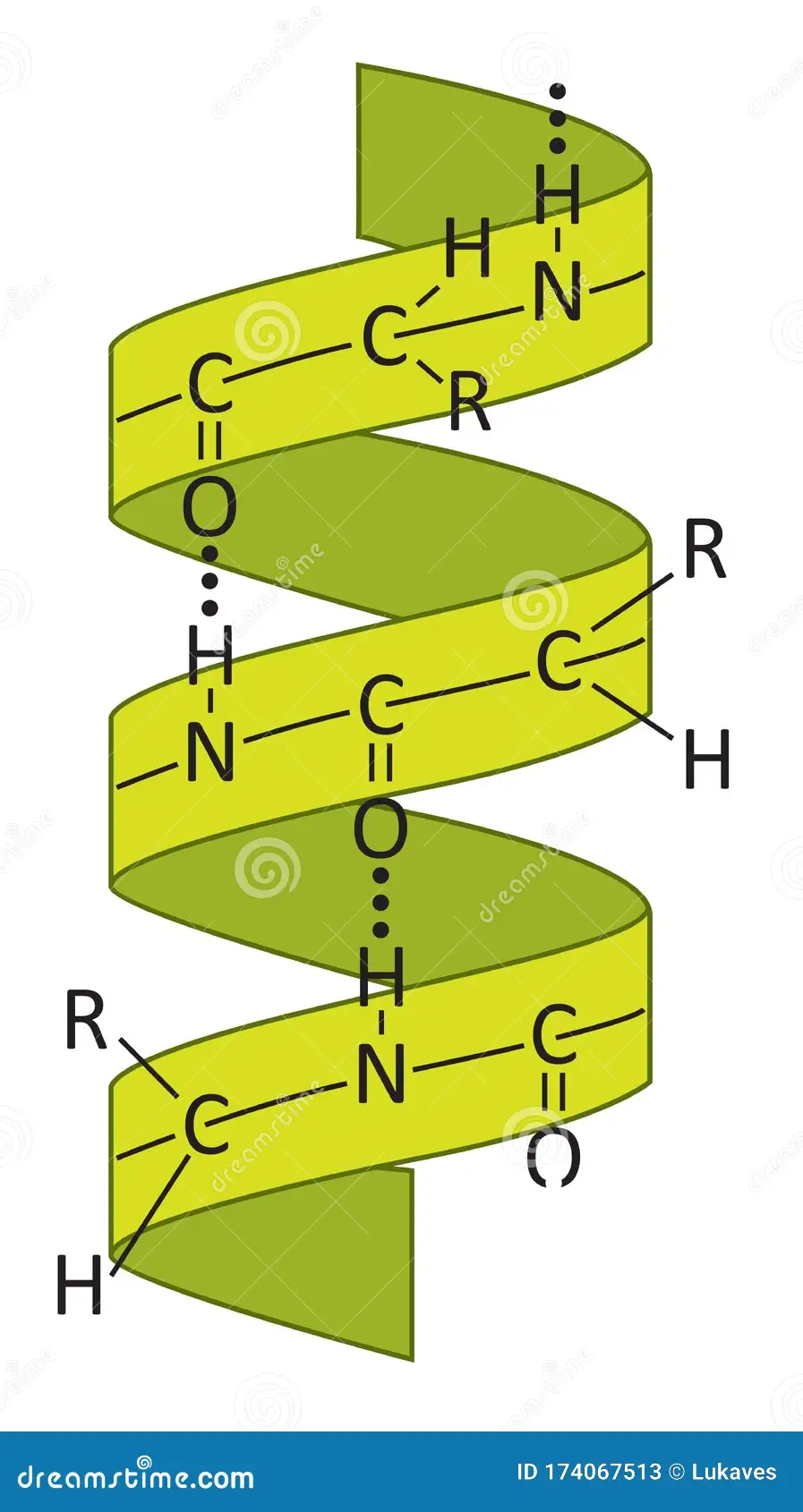
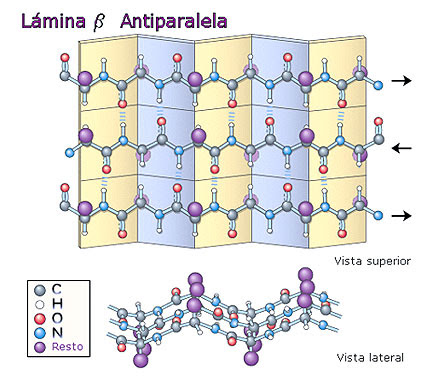
Lámina B
Se van formando puentes de hidrogeno de forma antiparalela, lo que forman capas apiladas.
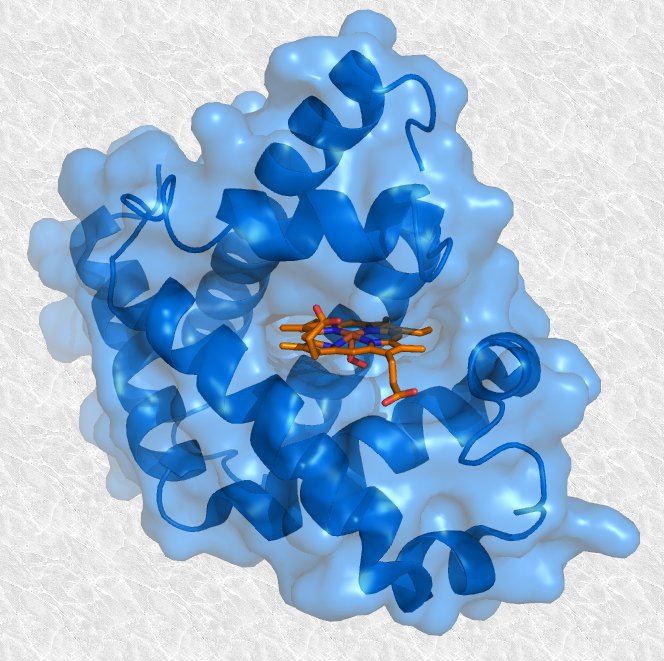
Estructura Terciaria
Se forma cuando se pliega toda la cadena peptídica formando una estructura tridimensional. Esta estructura depende de:
Las interacciones iónicas entre grupos R (con diferentes cargas).
Enlaces de hidrógeno entre Rs polares (PDH).
Interacciones entre enlaces disulfuro (S-S).
Interacciones Hidrofóbica.
Estructura Cuaternaria
Esta fase es opcional, y solo ocurre en algunas proteínas. Una proteína cuaternaria va a estar formadas por varias subunidades peptídicas con estructura terciaria. Hay 2 tipos:
No conjugadas: Solo con subunidades peptídicas.
Ejemplo: Insulina: 2 subunidades
Ejemplo: Colágeno: 3 subunidades.
Conjugadas: Subunidades polipeptídicas + subunidades no polipeptídicas.
Ejemplo: Hemoglobina → 4 subunidades polipeptídicas cada una unida a un grupo hemo.
Relación entre Forma y Función.
Hay dos tipos:
Globulares: Función: Fisiológica
Estructura Cuaternaria y Terciaria.
Alfa hélices + Lamina B
Interna hidrofóbica, externa hidrofílica.
Esférica
Ejemplo: Insulina.
Fibrosas: Función: Estructural
Estructura Cuaternaria.
No tienen alfa hélices.
Fibras unidas por puentes de hidrógeno.
Cuerda extensible.
Ejemplo: Colágeno.