Bio Kap. 16 (Schmerz)
1/58
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
59 Terms
Was ist Schmerz? Zu welcher Sinnesmodalität gehört es? Was sind deren zentrale Merkmale? Wie wird es von Nozizeption unterschieden? Ist es ein universelles Phänomen?
a. Definition laut Internationaler Gesellschaft zum Studium des Schmerzes (sinngemäß):
Schmerz = unangenehmes Sinnes- und Gefühlserlebnis, das mit tatsächlicher oder potenzieller Gewebsschädigung verbunden ist oder so beschrieben wird.
b. Schmerz gehört zur Sensorik, unterscheidet sich aber von anderen Sinnesmodalitäten wie Sehen oder Hören durch seine unmittelbar negative affektive Qualität.
Während andere Sinneseindrücke erst durch persönliche Erfahrung emotional eingefärbt werden, ist Schmerz von Beginn an negativ emotional aufgeladen.
c. Vier zentrale Merkmale von Schmerz
Sinnesempfindung: Schmerz ist quantifizierbar hinsichtlich Intensität, Dauer, Ort.
Schutzfunktion: Schmerz signalisiert drohende oder bestehende Gewebsschädigung oder Überbeanspruchung.
Negative Affektivität: Schmerz ist immer negativ emotional getönt – im Gegensatz zu anderen Sinnesmodalitäten.
Unabhängigkeit von Reizquelle: Schmerz kann ohne adäquate Reizung von Schmerzrezeptoren auftreten – z. B. bei Phantomschmerz.
d. Abgrenzung: Schmerz vs. Nozizeption
Nozizeption: Physiologischer Prozess der Reizaufnahme und -weiterleitung von noxischen Reizen (gewebeschädigend oder potenziell gewebeschädigend) – ohne notwendiges Bewusstsein.
Schmerz: Subjektive Erlebensqualität, die bewusst wahrgenommen wird.
Beispiele zur Unterscheidung:
Fluchtreflexe (z. B. Zurückziehen bei Hitze), Schmerzreaktionen im Schlaf oder unter Anästhesie: zeigen Nozizeption ohne Schmerzempfinden.
Bei Querschnittslähmung können Reflexe ausgelöst werden, ohne bewusste Schmerzwahrnehmung (z. B. Bein zieht sich zurück).
e. Nozizeption im Tierreich
Nozizeption kommt in allen Tieren mit Nervensystem vor – auch bei einfachen Arten (z. B. Wirbellosen).
Diese zeigen Schutzreflexe, obwohl sie wahrscheinlich kein Schmerzbewusstsein haben – typisch für niedere Spezies.
Ist Schmerz ein häufiges Erlebnis?
Schmerz als eigenständiges Thema
Chronischer Schmerz ist ein zentrales medizinisches Problem, das rein körperlich orientierte Therapien oft nicht erfolgreich behandeln können.
Psychologische Faktoren wie Verhalten, Einstellungen und Erwartungen spielen eine entscheidende Rolle.
Schmerz ist daher ein zentrales Thema der Gesundheitspsychologie und Verhaltensmedizin.
Grundkenntnisse über Schmerzentstehung und -behandlung sind für Psychologen unerlässlich.
Verbindung zwischen Körper und Psyche
Schmerz zeigt besonders deutlich, wie eng körperliche und psychische Prozesse miteinander verflochten sind.
Er kann das gesamte Bewusstsein dominieren, psychische Zustände beeinflussen (z. B. Depression, Suizidgedanken) und das Verhalten steuern.
Es ist ein Teil des Bewusstseins, und beeinflusst diesen auch.
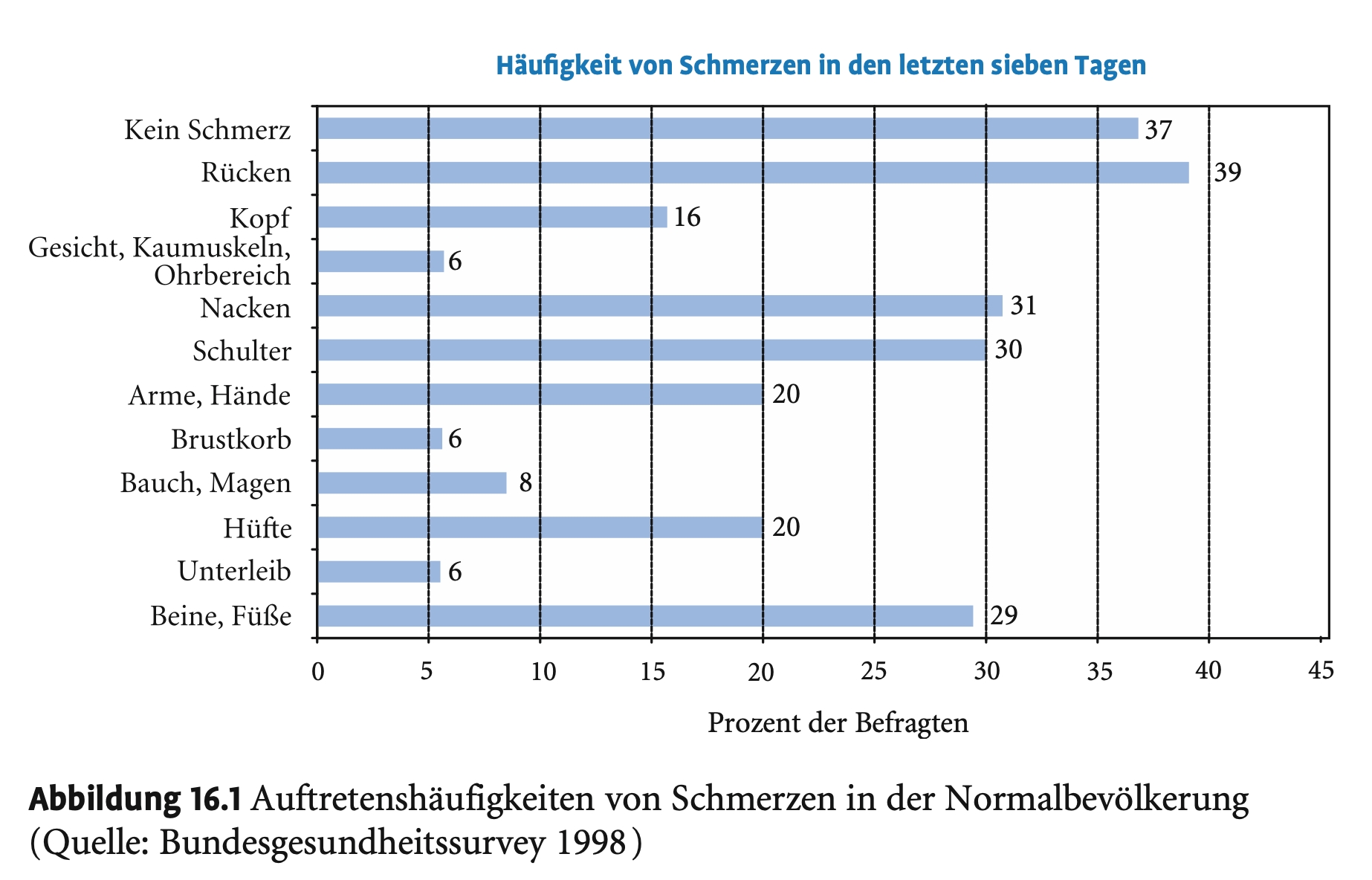
Schmerz als häufiges Erlebnis
Laut Abbildung 16.1 gaben nur 37 % der Befragten an, in den letzten 7 Tagen schmerzfrei gewesen zu sein – Schmerz ist für viele ein alltägliches Erlebnis.
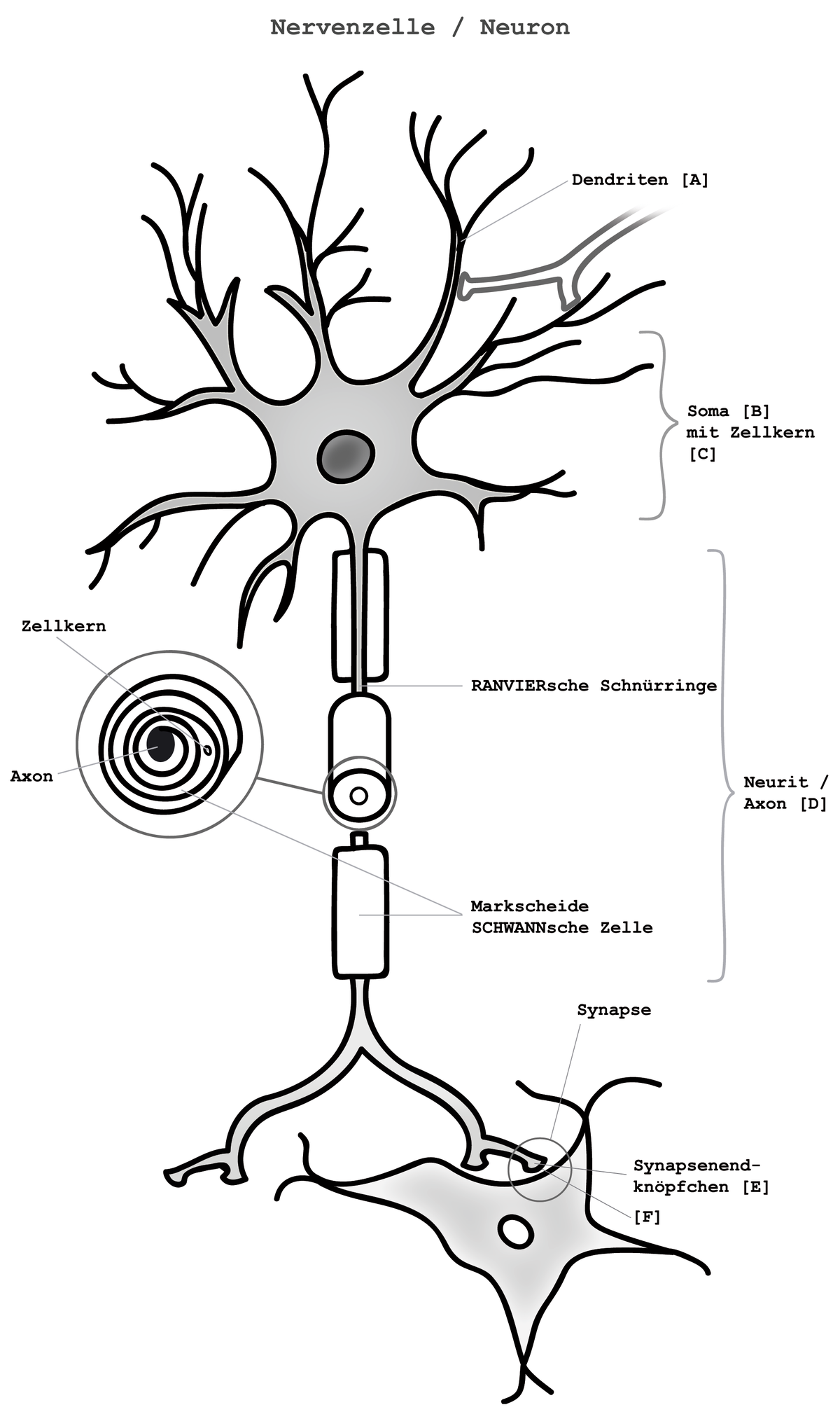
Wie sieht die allgemeine Struktur des nozizeptiven Systems aus?
Allgemeine Struktur und funktionelle Einbettung
Das nozizeptive System (auch nozifensives System) ist funktionell eng mit dem somatosensiblen System verwandt:
Afferente Fasern beider Systeme verlaufen in unmittelbarer Nähe zueinander.
Die Umschaltprozesse auf Rückenmarksebene sind strukturell vergleichbar.
Die Projektionsgebiete im Gehirn (subkortikal und kortikal) überlappen sich teilweise, insbesondere im somatosensorischen Kortex.
Was sind Nozizeptoren und wo befinden sie sich?
Nozizeptoren – Primäre Sinneszellen für Schmerz
Nozizeptoren sind spezialisierte Nervenzell-Endigungen zur Detektion noxischer Reize (mechanisch, thermisch, chemisch).
Sie kommen überall im Körper vor, mit Ausnahme des zentralen Nervensystems (ZNS).
Die meisten Nozizeptoren sind freie Nervenendigungen, die sich mikroskopisch als verzweigte neuronale Fortsätze darstellen.
Lokalisation
Besonders dicht vorhanden in:
Haut, Muskeln, Gelenken, inneren Organen.
Diese Verteilung erklärt, warum in diesen Bereichen Schmerz besonders sensibel wahrgenommen wird.
Wie geschieht die Transduktion im nozizeptiven System?
Transduktion: Umwandlung in elektrische Signale
Die Reizumwandlung (Transduktion) erfolgt über spezialisierte Ionenkanäle in der Zellmembran der Nozizeptoren:
Reizspezifische Kanäle öffnen sich bei Einwirkung eines noxischen Reizes.
Einstrom von Kationen (Na⁺, Ca²⁺) → Depolarisation der Membran → Aktionspotenzial.
Beispielhafte Rezeptoren:
Säuresensitiver Kanal: Reagiert auf Abfall des pH-Werts (z. B. bei Gewebsschädigung).
Thermorezeptoren:
Aktivierung ab ca. 45 °C.
Einer dieser Rezeptoren reagiert auch auf Capsaicin (in scharfen Speisen), was erklärt, warum Schärfe ein Schmerzempfinden ist, nicht Geschmack.
Was sind verschiedene Arten von Nozizeptoren?
Arten von Nozizeptoren
Mechanonozizeptoren
Reagieren auf hohe mechanische Reize (z. B. Gewebsdeformation).
Niedrige Reize ignorieren sie oder lösen nur minimale Reaktion aus.
Mechanische Verletzungen führen zur Freisetzung von Kalium- (K⁺) und Wasserstoffionen (H⁺) aus beschädigten Zellen, die chemisch auf Nozizeptoren wirken.
Thermonozizeptoren
Aktivierungsschwelle liegt bei ca. 45 °C.
Erst bei Überschreiten dieser Schwelle wird bewusster Schmerz ausgelöst.
Chemosensitive Nozizeptoren
Reagieren auf:
Bradykinin (stärkster Schmerzvermittler)
K⁺, Acetylcholin, Histamin, Prostaglandine, Serotonin, H⁺
Substanzen wirken:
Direkt auf Rezeptoren
Oder indirekt über Reaktionsketten (z. B. Gewebereaktionen in der Nähe des Nozizeptors).
Es gibt verschiedene Typen von chemosensiblen Nozizeptoren mit unterschiedlicher Empfindlichkeit für die jeweiligen Substanzen.
Wie geschieht die Schmerzmodulation im nozizeptiven System?
Entzündungsprozesse und Schmerzmodulation
a. Hyperalgesie
Entzündungen setzen Entzündungsmediatoren frei:
Prostaglandine, Histamin, Substanz P
Folge: Sensibilisierung der Nozizeptoren
→ Gesteigerte Empfindlichkeit für Berührungen und andere Reize
→ Hyperalgesie = übersteigerte Schmerzreaktion im betroffenen und angrenzenden Gewebe
b. Schmerzhemmung durch Opioidrezeptoren
Im Verlauf von Entzündungen: Vermehrte Bildung von Opioidrezeptoren in den Zellkörpern der Nozizeptoren
Transport zu den peripheren Endigungen
Dort Integration in Membran → direkte Wirkung von körpereigenen oder externen Opioiden
Ergebnis: Periphere Schmerzhemmung bereits auf Ebene der Rezeptoren
Was ist Hyperalgesie?
Hyperalgesie = übersteigerte Schmerzreaktion im betroffenen und angrenzenden Gewebe
Wie modal sind die meisten Nozizeptoren?
Modalität der Nozizeptoren
Unimodale Nozizeptoren:
Reagieren ausschließlich auf eine Reizart (z. B. Hitze oder mechanisch)
Polymodale Nozizeptoren:
Reagieren auf zwei oder drei Reizarten (z. B. mechanisch, thermisch, chemisch)
Kommen häufig in Haut, Muskeln, Gelenken vor
Was für eine neuronale Struktur weisen Nozizeptoren auf?
Neuronale Struktur: Pseudounipolare Nervenzellen
Nozizeptoren sind meist pseudounipolar:
Dendrit und Axon gehen gemeinsam vom Zellkörper ab
Aufspaltung in zwei Fortsätze nach kurzer Strecke
Soma wird beim Erregungsfluss elektrisch umgangen
Der Dendrit leitet aktiv Erregung → wird auch als „dendritisches Axon“ bezeichnet
Was ist ein dendritisches Axon?
A „dendritisches Axon“ ist ein peripherer Fortsatz pseudounipolarer Neuronen (z. B. Nozizeptoren), der:
morphologisch ein Dendrit ist (endet in der Peripherie),
aber funktional wie ein Axon wirkt, da er aktiv Aktionspotenziale leitet,
und somit den Soma elektrisch umgeht.
Fazit: Ein „dendritisches Axon“ ist ein dendritischer Fortsatz, der sich wie ein Axon verhält – typisch für sensorische Neurone wie Nozizeptoren.
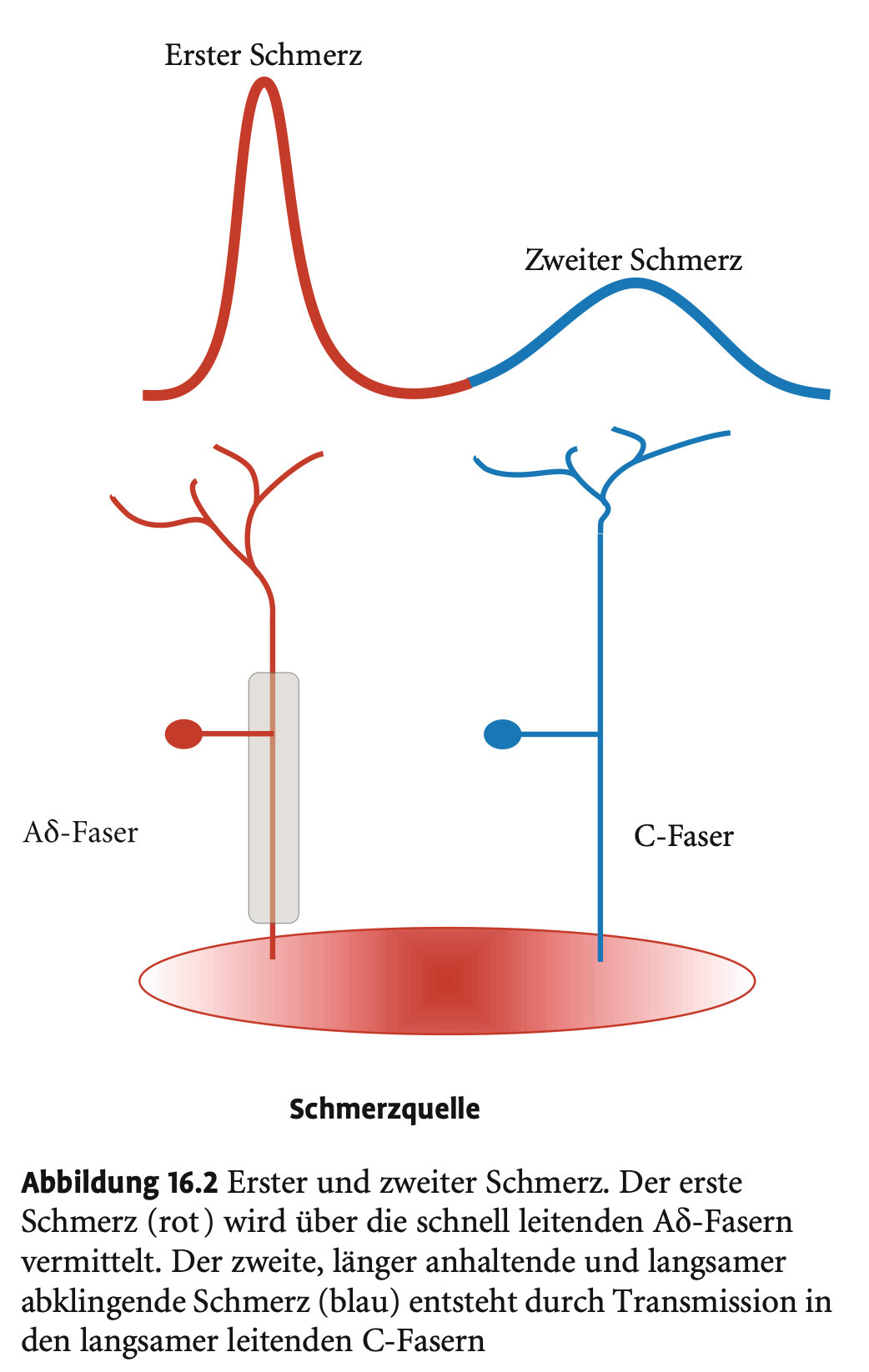
Was für Fasern werden im nozizeptiven System verwendet? Wieso?
Erregungsleitung
Ad-Fasern (schneller, myelinisiert)
Leitungsgeschwindigkeit: bis zu 20 m/s
Vermitteln den ersten Schmerz:
Scharf, kurz, gut lokalisierbar
Wichtig für Schutzreflexe (z. B. Zurückziehen bei Stich)
C-Fasern (langsam, unmyelinisiert)
Leitungsgeschwindigkeit: bis zu 5 m/s
Vermitteln den zweiten Schmerz:
Dumpf, brennend, länger anhaltend
Besonders dicht in Haut, Hornhaut, Zahnwurzel
Anatomischer Exkurs:
Warum langsame Fasern?
Raumersparnis: Dünne Fasern dominieren → das Bündel bleibt kompakt
Trotz hoher Anzahl an Nozizeptoren wird das Nervengewebe nicht zu voluminös
Sind Nozizeptoren nur afferent?
Efferente Funktionen von Nozizeptoren
Nozizeptoren sind nicht nur afferent (reizaufnehmend), sondern auch efferent aktiv:
Bei elektrischer Stimulation (z. B. im Spinalganglion):
Freisetzung vasoaktiver Substanzen (z. B. Histamin) aus den Endigungen
Folge:
Gefäßerweiterung (Vasodilatation)
Erhöhte Gefäßpermeabilität im versorgten Organbereich
Diese peripheren Effekte entstehen durch zentrifugal (vom ZNS weg) geleitete Aktionspotenziale
Beschreibe die Rolle von Gliazellen im Nozizeptiven System.
Gliazellen und ihre Rolle in der Schmerzverarbeitung
Gliazellen registrieren neuronale Aktivität über Rezeptoren für Transmitter wie Glutamat.
Durch diese Reaktion erkennen sie neuronale Signale und schütten:
Wachstumsfaktoren oder Neurotransmitter aus → steigert Sensitivität von Schmerzfasern.
Zytokine → lösen Entzündungen aus → macht Gewebe überempfindlich, schützt vor weiteren Schäden.
Auch im Rückenmark werden bei starken Schmerzreizen Zytokine von Gliazellen ausgeschüttet → steigert Erregbarkeit nozizeptiver Neurone → Schmerz bleibt bestehen, auch wenn der Auslöser vorbei ist.
Beschreibe die ersten zwei Verschaltungen in der Schmerzbahn.
Schmerzbahn (zentrale Verarbeitung)
1. Neuron (Nozizeptor): Zellkörper im Spinalganglion, Neurotransmitter: Glutamat & Substanz P (nur bei stärkeren Schmerzen aktiv).
2. Neuron: Zellkörper im Hinterhorn des Rückenmarks:
Strangzellen (Projektionsneurone): kreuzen direkt → ziehen kontralateral über das anterolaterale System aufwärts.
Interneurone: bleiben auf Rückenmarksebene → Reflexsteuerung & Angriffspunkt für hemmende Bahnen.
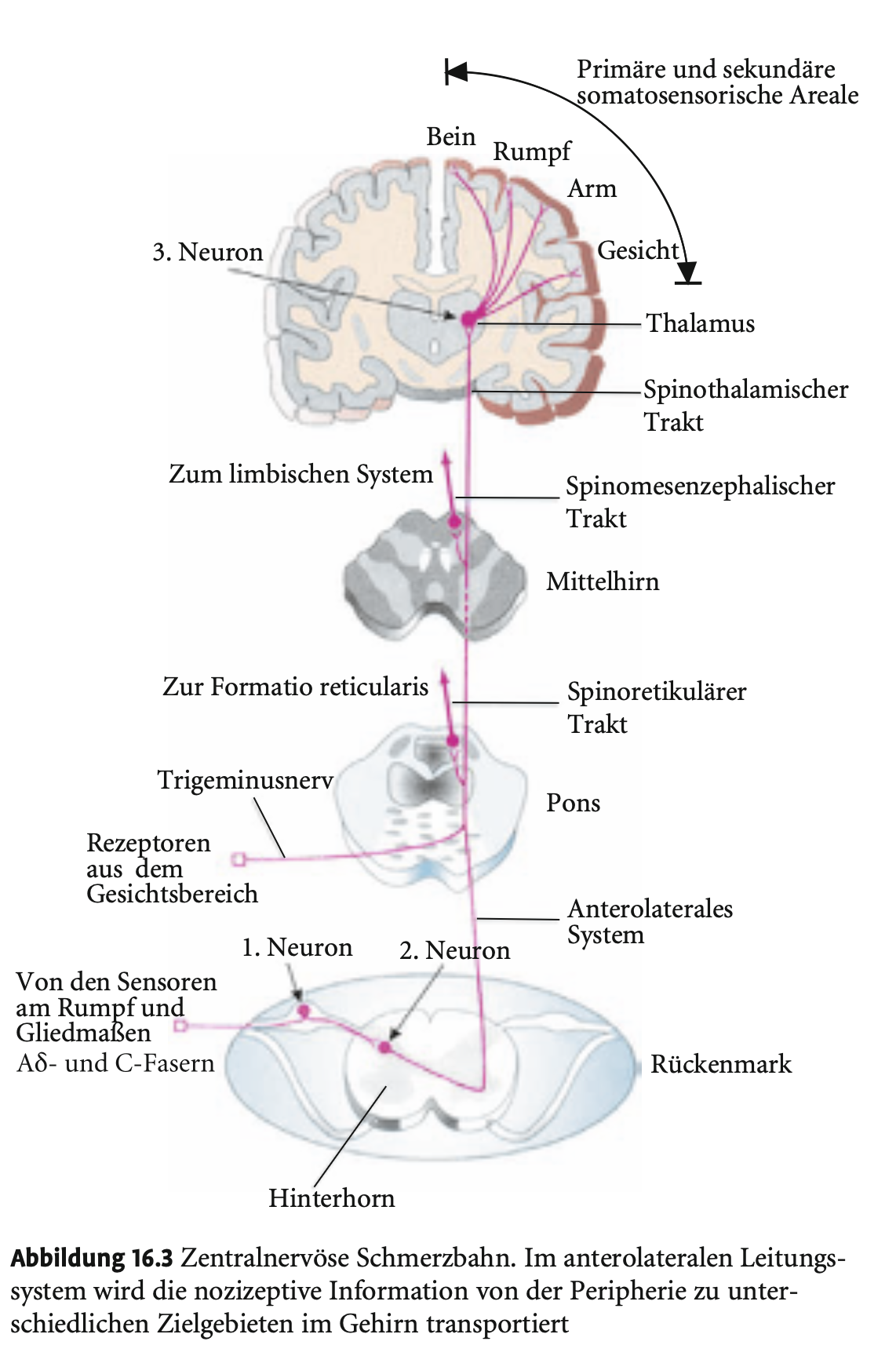
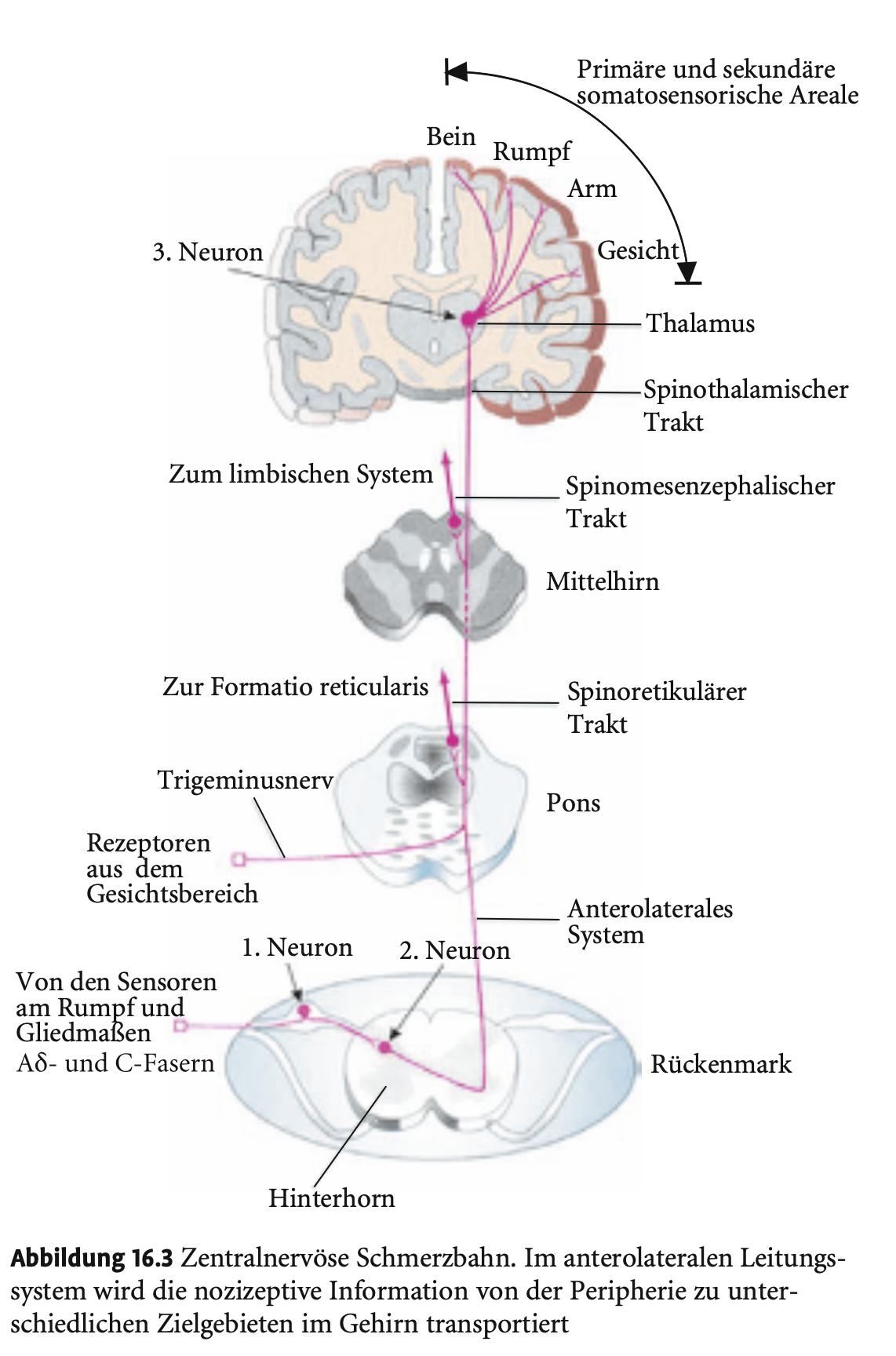
Beschreibe die aufsteigende Schmerzbahnen des nozizeptiven Systems (sowie diejenige des Gesichts- und Halfbereichs).
Aufsteigende Schmerzbahnen
Spinoretikulärer Trakt: zur Formatio reticularis → löst globale kortikale Aktivierung aus (bei starken/ungewohnten Schmerzen).
Spinomesenzephaler Trakt: zum Tectum & periaquäduktalen Grau → wichtig für absteigende Schmerzhemmung.
Spinothalamischer Trakt: stärkste Bahn → leitet Reize zu Thalamuskernen (VPL, MD).
Gesichts-/Halsbereich:
1. Neuron: Ganglion trigeminale
2. Neuron: im Trigeminuskern (Pons)
3. Neuron: im Thalamus, Formatio reticularis, Colliculi superiores/inferiores
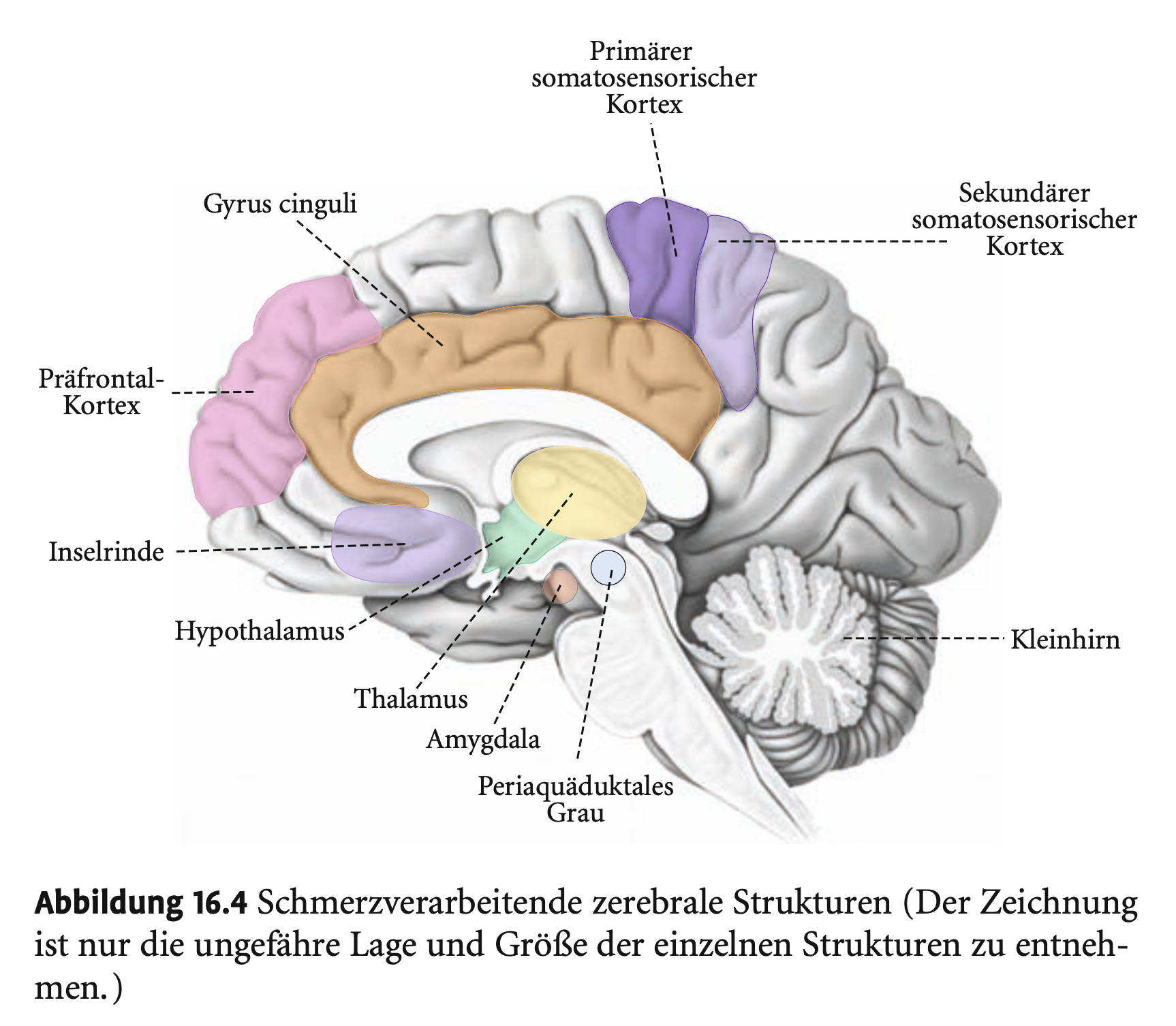
Welche Regionen sind an der Schmerzverarbeitung beteiligt? Was sind die Hauptareale?
Kortikale Schmerzverarbeitung
Früher unterschätzt, heute klar: Kortex spielt zentrale Rolle.
Hauptareale:
SI & SII: Ort, Dauer, Intensität des Schmerzes, evtl. auch affektive Aspekte.
Inselrinde: viszeraler Schmerz & Schmerzgedächtnis.
Anteriorer Gyrus cinguli (AGC): affektiv-motivationale Dimension (z. B. Unlust, Angst), eng vernetzt mit dem limbischen System.
Zerebrales Netzwerk der Schmerzverarbeitung:
SI, SII
AGC
Inselrinde
DLPFC
Thalamus
Kleinhirn
Hypothalamus
Amygdala
Periaquäduktales Grau
Alle Areale interagieren – die spezifischen Funktionen sind noch nicht vollständig verstanden.
Was ist die dissoziierte Empfindungslähmung?
Störungsbild: Dissoziierte Empfindungslähmung
Ursache: Unterschiedliche Kreuzung der Bahnen:
Mechanosensible Bahnen (Berührung, Vibration): laufen ipsilateral (ungekreuzt).
Schmerzbahnen (Nozizeption): verlaufen kontralateral (gekreuzt).
Folge bei einseitiger Rückenmarksläsion:
Verlust von Berührungs-/Vibrationssinn auf derselben Körperseite.
Verlust der Schmerzwahrnehmung auf der Gegenseite (jeweils unterhalb der Läsion).
Diagnostisch relevant, da das Muster spezifisch auf eine seitenlokalisierte Rückenmarksverletzung hinweist.
Was sind verschiedene Mechanismen der Schmerzhemmung?
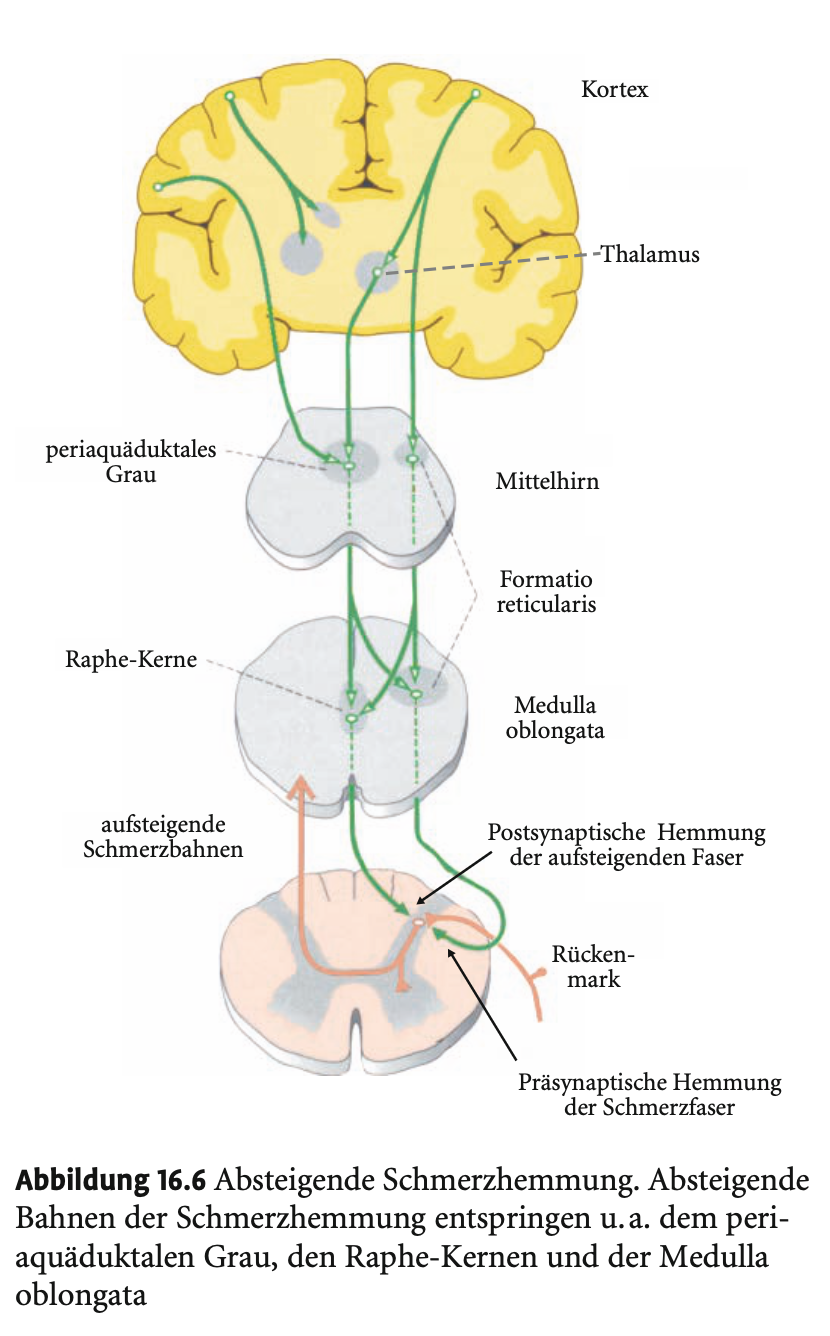
Gate-Control Theorie (auf Rückenmarks- und absteigender Ebene)
Endogene Schmerzhemmung (inkl. wichtige Transmitter, Modulatoren & Neuropeptide, und serotenerge & noradrenerge Bahnen)
Zerebrale Mechanismen (noch wenig erforscht)
Beschreibe die Mechanismen der Gate-Control Theorie.
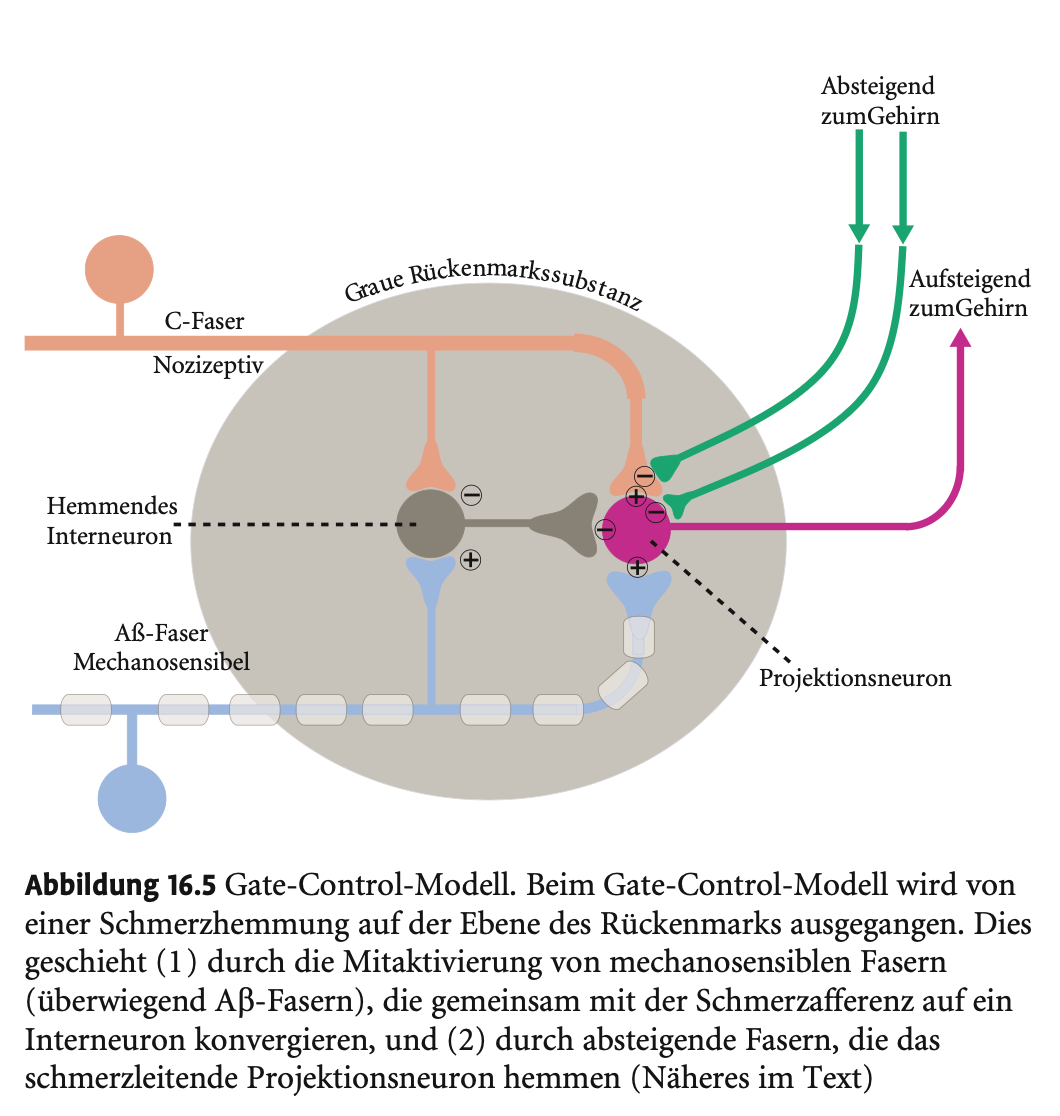
Gate-Control-Theorie (Melzack & Wall, 1965)
Grundidee: Schmerz ist kein rein afferenter Reiz, sondern kann im Rückenmark moduliert werden.
Mechanismus 1: Rückenmarksschaltkreis
In der Substantia gelatinosa treffen:
Nozizeptive C-Fasern (Schmerz)
Mechanosensible Aβ-Fasern (Berührung)
auf dasselbe Projektionsneuron.
Ein hemmendes Interneuron ist normalerweise aktiv und bremst das Projektionsneuron.
C-Fasern hemmen das Interneuron → Schmerz wird weitergeleitet.
Aβ-Fasern erregen das Interneuron → Schmerzhemmung.
Effekt: Mechanische Reizung (z. B. Reiben nach Verletzung) reduziert Schmerzempfinden – nennt sich Gegenirritation.
Mechanismus 2: Absteigendes Hemmsystem
Ausgangspunkte: periaquäduktales Grau, Raphe-Kerne.
Ziel: C-Fasern und Projektionsneurone in der Substantia gelatinosa.
Top-down-Signale aus dem Gehirn hemmen Schmerzleitung rückwirkend über kortikale Bahnen.
Was ist Gegenirritation?
Gegenirritation ist ein Verfahren zur Schmerzhemmung, bei dem gezielt nicht-schmerzhafte Reize eingesetzt werden, um schmerzhafte Reize zu unterdrücken. Es basiert auf dem Prinzip der Gate-Control-Theorie.
Kernprinzip:
Schnell leitende Aβ-Fasern (z. B. durch Berührung, Vibration, Kälte) werden stimuliert.
Diese hemmen auf Rückenmarksebene die langsamen Aδ- und C-Fasern, die Schmerz weiterleiten.
Ergebnis: Schmerz wird blockiert oder abgeschwächt, weil das “Tor” im Rückenmark für Schmerzimpulse geschlossen bleibt.
Beispiele für Gegenirritation:
Reiben nach einem Schlag (“über Schmerz drüberreiben”)
Wärmepflaster
TENS (transkutane elektrische Nervenstimulation)
Akupunktur, Elektroakupunktur
Ziel: Schmerzhemmung durch einen konkurrierenden, nicht-schmerzhaften Reiz.
Beschreibe die Mechanismen der endogenen Schmerzhemmung (des Opiodsystems)
Endogene Schmerzhemmung (Opioidsystem)
Hemmende Neuronen benutzen endogene Opioide:
β-Endorphin
Methionin- und Leucin-Enkephalin
Dynorphine
Bildungsorte: v. a. Hypothalamus, Hypophyse, Nebennierenmark.
Wirkung: Binden an Opioidrezeptoren → hemmen Neurotransmitterfreisetzung (v.a. Glutamat, Substanz P).
Sitz der hemmenden Neuronen:
Rückenmark
Periaquäduktales Grau
Nucleus raphe magnus
Locus subcoeruleus
→ Über diese Bahnen wird der Schmerz direkt oder über Interneurone gehemmt.
Transmitter: v. a. Serotonin und Noradrenalin, die Opioidfreisetzung anregen → präsynaptische Hemmung.
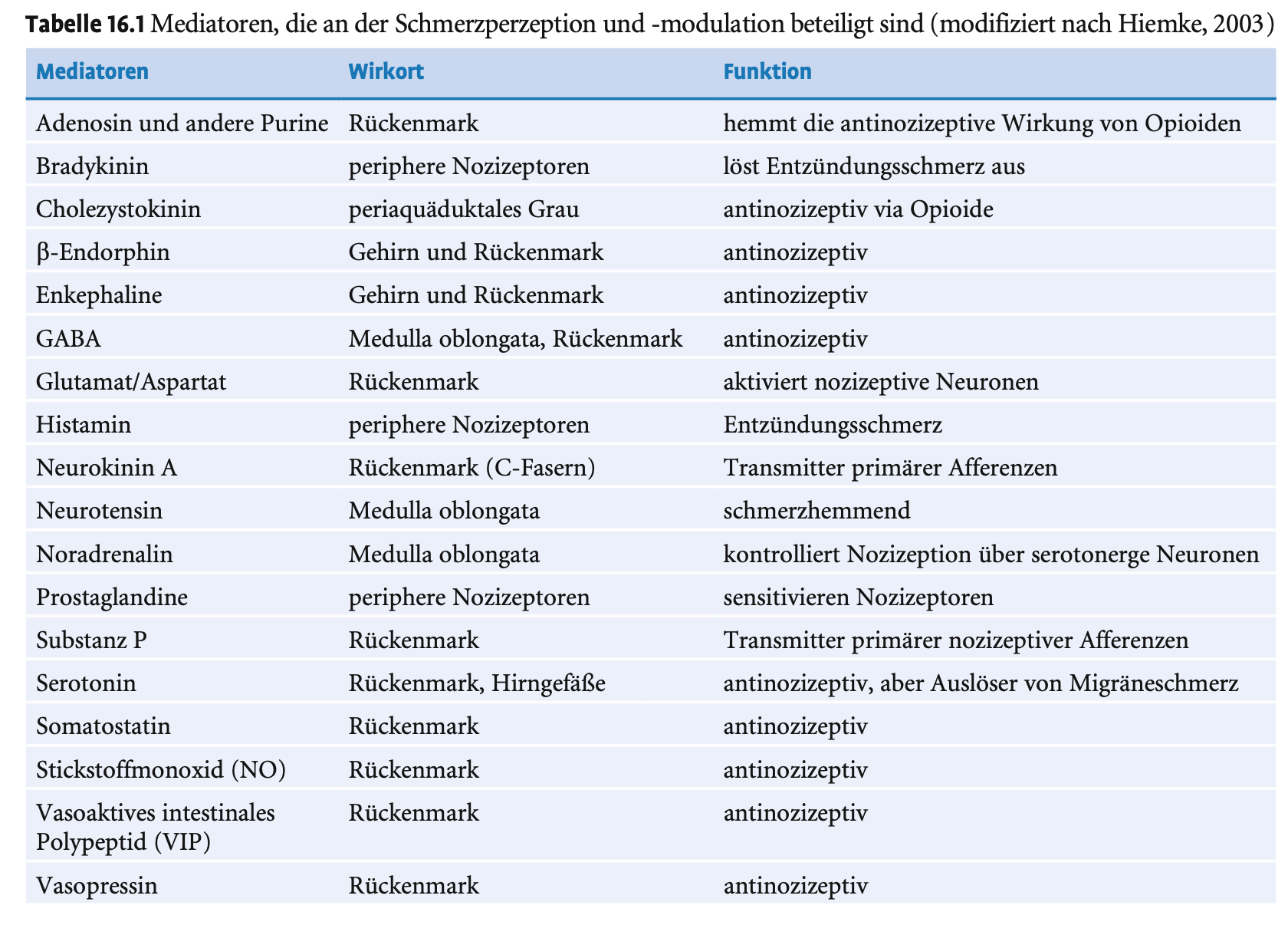
Beschreibe die wichtige Mediatoren im Schmerzsystem.
Wichtige Transmitter und Modulatoren im nozizeptiven System
Schmerzfördernd:
Glutamat (Haupttransmitter an 1. Synapse)
Substanz P
Neurokinin A
Aspartat
Schmerzhemmend:
GABA
Glycin
Serotonin
Noradrenalin
Neuropeptid Y
Endogene Opioide
Wichtig: Die Wirkung eines Stoffes ist ortsabhängig: z. B. kann Serotonin je nach Wirkort hemmend oder fördernd wirken.
Serotonerge und Noradrenerge Bahnen
Serotonin: aus Raphe-Kernen.
Noradrenalin: aus dem Locus coeruleus.
Beide sind Teil des absteigenden Schmerzhemmungssystems auf Rückenmarksebene.
Neuropeptide im Schmerzsystem
Exzitatorisch (schmerzfördernd):
→ Tachykinine, v.a. Substanz PInhibitorisch (schmerzhemmend):
→ Endogene Opioide (Enkephaline, Dynorphine, β-Endorphin)
Was ist die experimentelle Schmerzforschung? Was für Methoden werden angewendet?
Experimentelle Schmerzforschung
Ziel und Bedeutung
Zweck: Verständnis der biologischen und psychologischen Prozesse der Schmerzverarbeitung + Entwicklung und Prüfung von Therapieverfahren.
Zwei Hauptbereiche:
Schmerzinduktionstechniken
Messung des Schmerzerlebens (neurobiologisch, subjektiv, behaviorale Ebene)
Schmerzinduktion:
Mechanische Reizung (inkl. Ischämieschmerz)
Elektrische Reizung (inkl. Zahnpulpareizung)
Thermische Reizung (Cold-Pressure-Test, Hitzereize, Strahlungswärme/Laserlicht)
Chemische Reizung
Beschreibe die mechanische Reizung der experimentellen Schmerzforschung.
Mechanische Reizung
Klassisches Verfahren seit über 100 Jahren.
Technik: Definierter Druck auf eine kleine Hautfläche mittels Stiften/Nadeln mit genau vermessener Kontaktfläche.
Ziel: Bestimmung der Druckschwelle, bei der Schmerz erstmals wahrgenommen wird.
Häufige Körperstellen: Unterarm, Hand, Gesicht.
Ischämieschmerz (Sonderform):
Blutdruckmanschette blockiert Blutfluss → Proband öffnet/schließt Hand rhythmisch.
Führt zu dumpfem, tiefem Schmerz durch Sauerstoffmangel → chemische Reizstoffe.
Ursprünglich mechanisch, wird oft auch als chemisch induzierter Schmerz klassifiziert (aufgrund des mangelnden Sauerstoffes im Zellinneren).
Beschreibe die elektrische Reizung der experimentellen Schmerzforschung.
Elektrische Reizung
Seit Mitte des 19. Jahrhunderts bekannt und verbreitet.
Technik: Haut wird über zwei Metallelektroden gereizt mit Impulsen steigender Stromstärke.
Schwellenwert: Schmerz wird registriert, sobald subjektiv wahrgenommen.
Zahnpulpareizung (spezielle Variante):
Vorteile:
Selektive Reizung von Ad- und C-Fasern, keine Propriozeption.
Stabilere elektrische Eigenschaften als Haut.
Nachteile:
Belastend für Proband:innen.
Hautreizung unnatürlich: Kribbeln tritt auf unterhalb der Schmerzschwelle, wird als aversivempfunden.
Nicht-spezifische Erregung von Nervenfasern ohne typische nozizeptive Reizverarbeitung.
Beschreibe die thermische Reizung der experimentellen Schmerzforschung.
Thermische Reizung
Kältereize (Cold-Pressure-Test):
Unterarm in Eiswasser (0–4 °C).
Gewebeschonend, erzeugt natürlichen Schmerz.
Wird auch als Stresstest verwendet.
Hitzereize:
Technik: Hand berührt erhitzten Metallkörper oder Thermode (kleiner Hohlkörper mit heißer Flüssigkeit).
Thermode bietet präzise Temperaturkontrolle, wird am Körper befestigt.
Angaben des Probanden: Wann Reiz als warm, unangenehm, schmerzhaft oder unerträglich wahrgenommen wird.
Strahlungswärme / Laserlicht:
Langwellige elektromagnetische Strahlung erzeugt Hitzeschmerz.
Laser erlaubt exakte Kontrolle von Ort und Zeit des Reizes.
Beschreibe die chemische Reizung der experimentellen Schmerzforschung.
Chemische Reizung
Selten verwendet (schwer kontrollierbar, hohe Belastung).
Verabreichung von reizenden oder entzündungsfördernden Substanzen:
Histamin, Capsaicin (z. B. auf die Haut oder subkutan).
Wirkung: Starker Schmerzreiz, aber ethisch und methodisch problematisch.
Was ist Ischämieschmerz?
Ischämieschmerz (Sonderform):
Blutdruckmanschette blockiert Blutfluss → Proband öffnet/schließt Hand rhythmisch.
Führt zu dumpfem, tiefem Schmerz durch Sauerstoffmangel → chemische Reizstoffe.
Ursprünglich mechanisch, wird oft auch als chemisch induzierter Schmerz klassifiziert (aufgrund des mangelnden Sauerstoffes im Zellinneren).
Was ist die Zahnpulpareizung?
Zahnpulpareizung (spezielle Variante):
Vorteile:
Selektive Reizung von Ad- und C-Fasern, keine Propriozeption.
Stabilere elektrische Eigenschaften als Haut.
Nachteile:
Belastend für Proband:innen.
Hautreizung unnatürlich: Kribbeln tritt auf unterhalb der Schmerzschwelle, wird als aversivempfunden.
Nicht-spezifische Erregung von Nervenfasern ohne typische nozizeptive Reizverarbeitung.
Was ist die Algesimetrie? Wie wird diese durchgeführt?
Algesimetrie ist die Messung der Schmerzempfindlichkeit – also ein Verfahren zur quantitativen Erfassung von Schmerzreaktionen.
Schmerzschwellenbestimmung (Grenzmethode, Konstanzmethode, Schmerztoleranzschwelle)
Intermodal Intensitätsvergleich
Kategorisierungsverfahren
Klinische Algesimetrie (Schmerzfragebögen, Schmerztagebücher/-kalendar, inkl. intermodale Verfahren)
Psychophysiologische Algesimetrie (Hirnelektrische Reaktionen, vegetative Reaktionen, muskularer Bereich)
Beschreibe die Schmerzschwellenbestimmung.
Schmerzschwellenbestimmung
a) Grenzmethode
Reizintensität wird schrittweise erhöht, bis Schmerz angegeben wird.
Danach wird die Reizintensität abgesenkt, bis der Schmerz verschwindet.
Die Schmerzschwelle wird als Mittelwert beider Grenzpunkte berechnet, da beide oft nicht gleich sind.
b) Konstanzmethode
Reize mit konstanter Intensität werden wiederholt dargeboten.
Schmerzschwelle = Intensität, bei der 50 % der Reize als schmerzhaft empfunden werden.
Weitere Messgrößen
Schmerztoleranzschwelle: Maximal ertragbare Reizintensität.
Beeinflussende Faktoren: Tageszeit, Stimmung, körperlicher Zustand, Medikamente.
Beschreibe den intermodalen Intesitätsvergleich.
Intermodaler Intensitätsvergleich (Intermodalitätsvergleich)
Schmerzintensität wird mit einer anderen Sinnesmodalität verglichen.
Beispiel: Lautstärke eines Tons wird vom Probanden an das Schmerzempfinden angepasst.
Oder: Druckkraft auf ein Handdynamometer spiegelt empfundene Schmerzstärke wider.
Vorteil: Nichtsprachliches Maß der Schmerzintensität.
Beschreibe die Kategorisierungsverfahren.
Kategorisierungsverfahren
Schmerz wird in verbalen Kategorien eingestuft („kaum schmerzhaft“, „sehr schmerzhaft“ etc.).
Alternativ: Numerische Skalen (z. B. 0–10).
Besonders verbreitet: Visuelle Analogskala (VAS):
Linie (meist 10 cm) mit Endpunkten „kein Schmerz“ bis „unerträglicher Schmerz“.
Patient markiert subjektive Schmerzintensität.
Beschreibe die klinische Algesimetrie.
Klinische Algesimetrie
Ziel: Erfassung chronischer oder pathologischer Schmerzformen (auch ohne organische Ursache).
a) Schmerzfragebögen
Beispiel: McGill Pain Questionnaire.
Erfassen sensorische, affektive und kognitive Schmerzkomponenten.
Hauptziel: Schmerzverlauf über die Zeit bewerten, Therapieerfolg nachvollziehen.
Wichtiges Gütekriterium: Sensitivität für Veränderungen.
b) Schmerztagebücher/-kalender
Patienten dokumentieren regelmäßig (z. B. täglich) ihre Schmerzintensität.
Eingabe meist per VAS oder numerische Skala.
c) Ergänzend: Einsatz intermodaler Verfahren mit akustischen Vergleichsreizen.
Beschreibe die psychophysiologische Algesimetrie.
Psychophysiologische Algesimetrie
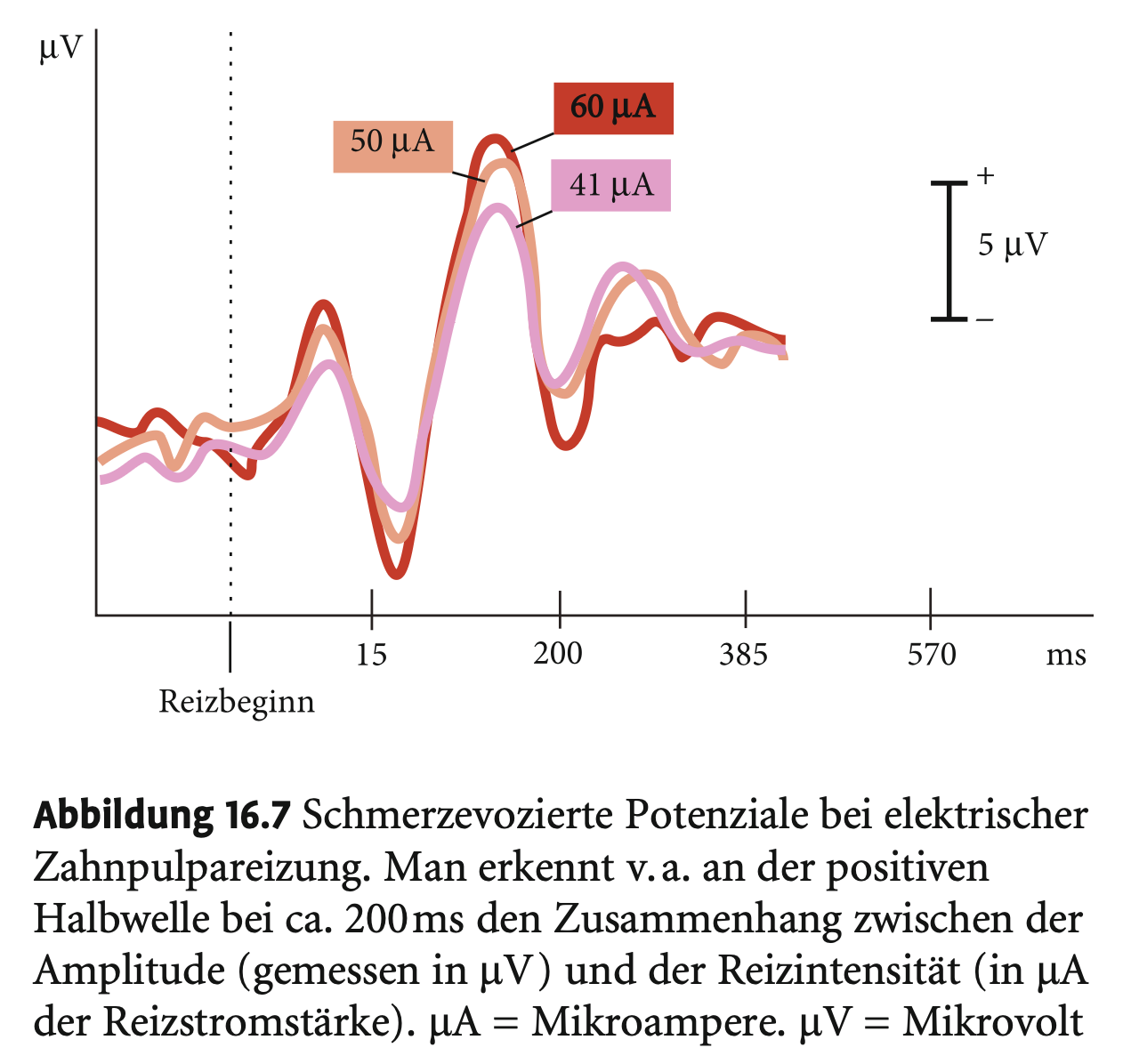
a) Hirnelektrische Reaktionen (EEG)
Schmerzevozierte Potenziale (100–300 ms nach Reiz).
Typisch: biphasische Wellenform mit positiver Halbwelle (korreliert positiv mit Schmerzintensität und negativ mit Schmerzmittel).
Amplitude sinkt bei Schmerzmittelgabe, steigt bei stärkerem Schmerz.
Nützlich in Forschung, aber weniger brauchbar für chronischen Schmerz.
b) Vegetative Reaktionen
Typische Stress-/Schmerzantworten:
Erhöhte Herzfrequenz
Anstieg Blutdruck
Pupillenerweiterung
Vasokonstriktion (v. a. Haut)
Erhöhte Hautleitfähigkeit (Schweiß)
Sie sind jedoch unspezifisch und treten auch bei Stress auf.
c) Muskularer Bereich
Nozifensive Reflexe (Schutzbewegung vom Schmerzreiz weg)
Besonders in der Tierforschung verbreitet.
Muskeltonus-Erhöhung in:
Armen, Stirn, Nacken, Rücken.
Kann selbst zu Schmerzsyndromen führen, v. a. bei muskelbedingtem Schmerz.
Auch nicht-schmerzhafte, aber belastende Reize können diese Muskelspannungen auslösen.
Wie unterscheidet man Schmerzformen?
Allgemeines
Schmerz tritt in vielfältigen Formen auf – bei akuten und chronischen Zuständen.
Unterscheidung erfolgt anhand:
Empfindungsqualitäten (z. B. stechend, brennend)
neurophysiologischer Ursache (z. B. Läsionen, Funktionsstörungen)
Tabelle 16.2 enthält die zugehörige Fachterminologie.

Was sind besondere Schmerzformen?
Chronischer Schmerz
Projizierter Schmerz
Übertragener Schmerz (viszerokutaner Reflex)
Phantomschmerz
Was ist chronischer Schmerz? Was sind deren Folgen? Besondere Terminologie bezüglich dem? Deren Häufigkeit und Kosten?
Chronischer Schmerz
Definition
Chronischer Schmerz verliert seine Warnfunktion und wird selbst zur Krankheit.
Der Schmerz dominiert das Denken und Verhalten des Patienten.
Folge: soziale Isolation, psychische Belastungen, Verschlimmerung der Symptomatik.
Schmerzkarriere
Langjährige, erfolglose Therapieversuche führen zur Chronifizierung.
Der Patient durchläuft eine „Karriere“ von Ärzten, Diagnosen und Behandlungen ohne dauerhafte Besserung.
Häufigkeit und Kosten
Am häufigsten kommen Rücken-, Kopf- und Gesichts-, sowie Gelenkeschmerzen vor.
Etwa 5–7 % der deutschen Bevölkerung betroffen (Daten aus den 1980er-Jahren).
Kosten: 5–10 Milliarden € jährlich.
Problem: Akuter und chronischer Schmerz werden oft nicht unterschieden, was zu überflüssigen Diagnosen führt.
Was ist ein Schmerzgedächtnis? Was sind deren Mechanismen?
Schmerzgedächtnis
Definition
Unbehandelte starke Schmerzen können langfristige Spuren im Nervensystem hinterlassen.
Folgen:
Hyperalgesie (übersteigerte Schmerzreaktion)
Allodynie (Schmerz durch eigentlich nicht-schmerzhafte Reize)
Spontanschmerz (ohne äußeren Reiz)
Neurophysiologische Basis
Langzeitpotenzierung (LTP) im Rückenmark am zweiten Neuron der Schmerzbahn:
Ausgelöst durch intensive Glutamatvermittelung zwischen Nozizeptorfaser und Rückenmarksneuron.
Aktivierung von Transkriptionsfaktoren → struktureller Umbau der subsynaptischen Membran.
Resultat: langanhaltende Sensibilisierung für Schmerzreize.
Weitere Mechanismen
Absteigende Schmerzhemmung gestört bei Entzündungen:
GABA- und Glycin-vermittelte Hemmung durch Interneurone im Rückenmark kann ausfallen.
Folge: Verlust zentraler Schmerzmodulation, verstärkt Chronifizierung.
Was ist projizierter Schmerz?
Projizierter Schmerz
Definition: Schmerz wird im peripheren Versorgungsgebiet einer gereizten nozizeptiven Faser empfunden, obwohl die Reizung zentral (z. B. am Rückenmark) erfolgt.
Mechanismus: Das ZNS kann nicht erkennen, wo entlang der Faser die Erregung entsteht → „Rückwärtsprojektion“ in das Ursprungsgebiet.
Beispiel: Bandscheibenvorfall → Reizung einer Faser im Sakralmark → Schmerzempfindung am Unterschenkel, Fuß oder Zeh.
Was ist übertragener Schmerz?
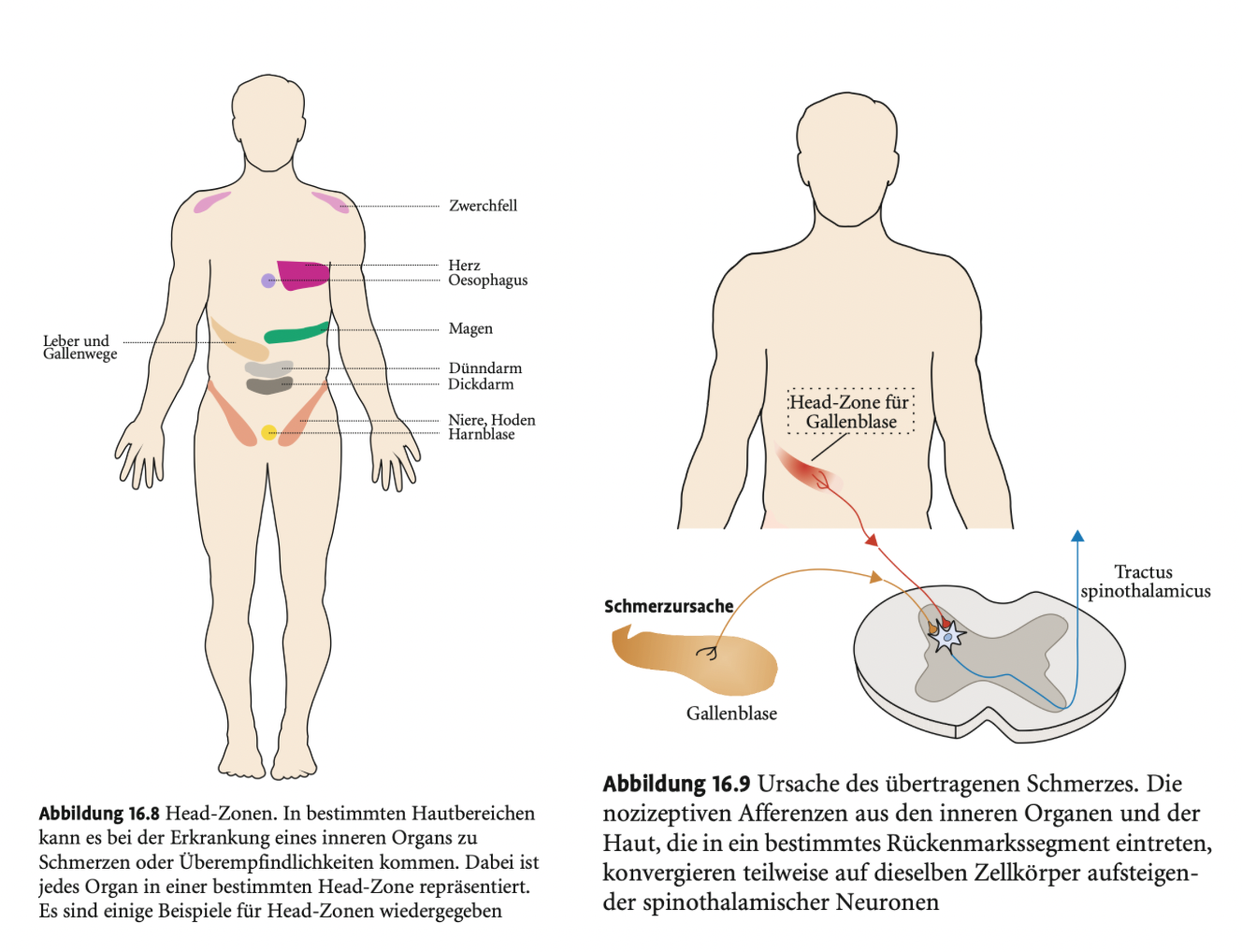
Übertragener Schmerz (Viszerokutaner Reflex)
Definition: Schmerz aus inneren Organen (Viszera) wird an der Körperoberfläche empfunden.
Typische Projektion: Schmerz außerhalb des betroffenen Organs – häufig in bestimmten Hautarealen (→ Head-Zonen).
Beispiel: Angina pectoris → Schmerz im Brustkorb, Druck- oder Engegefühl.
Neurophysiologischer Hintergrund: Konvergenz nozizeptiver Afferenzen aus Haut und Organen auf dieselben Rückenmarksneurone (Interneurone oder spinothalamische Neurone).
Folge: Das ZNS kann die Schmerzquelle nicht eindeutig zuordnen, es entsteht eine Wahrnehmungstäuschung.
Klinische Relevanz: Kenntnis der Head-Zonen ist diagnostisch wichtig für die Identifikation internistischer Erkrankungen.
Was ist Phantomschmerz?
Phantomschmerz
Definition: Schmerzempfindung aus amputierten Gliedmaßen oder entfallenen Körperteilen – obwohl diese nicht mehr existieren.
Gehört zur Gruppe der Deafferenzierungsschmerzen (Zerstörung afferenter Bahnen).
Mögliche Ursachen:
Spontanaktivität zentraler Neurone:
Nach einer Durchtrennung werden zentrale Neurone durch Irritation erregt.
Erhöhte Entladungsrate hält auch ohne Reizeinwirkung an.
Beweis: Lokalanästhesie während Amputation kann Phantomschmerz deutlich reduzieren.
Kortikale Reorganisation:
Verlorene Körperregionen hinterlassen „freie“ Areale im somatosensorischen Kortex.
Diese werden durch benachbarte Körperregionen mitbesetzt („kortikale Überwucherung“).
Je stärker diese funktionelle Umverteilung, desto höher die Phantomschmerzhäufigkeit (nachweisbar über bildgebende Verfahren).
Was sind verschiedene Schmerztherapien?
Medikamentöse Schmerztherapie
Nervenblockade und Lokalanästhesie
Gegenstimulationsverfahren
Biofeedback
Neurochirurgische Therapie
Was sind die zwei Hauptgruppen von Analgetika?
Medikamentöse Schmerztherapie: Zwei Hauptgruppen von Analgetika
Opioidanalgetika
Nichtopioidanalgetika
Was sind Opiodanalgetika? Was für Opiate unterscheiden wir? Was genau ist deren Wirkung, und wo? Wie können sie angewendet werden? Werden sie wirklich in der Medizin genutzt?
a) Substanzklassen
Opiate: z. B. Morphin, Opiumalkaloide, Methadon (synthetisch)
Endogene Opioide: β-Endorphin, Enkephaline, Dynorphine
b) Rezeptorbindung
Wirkung über Opioidrezeptoren auf Neuronen im nozizeptiven System:
μ-Rezeptor (μ1, μ2): Hauptziel von Morphin und β-Endorphin; wirkt v. a. supraspinal
κ-Rezeptor: Ziel von Dynorphin; wirkt v. a. spinal, auch bei Atemdepression/Sedation
δ-Rezeptor: Affinität zu Leu-Enkephalin und β-Endorphin
c) Synaptische Wirkung
Postsynaptische Hyperpolarisation → vermindert Aktionspotenziale
Präsynaptische Hemmung → reduzierte Transmitterfreisetzung (z. B. Glutamat)
d) Zentrale Wirkorte mit hoher Rezeptordichte
Substantia gelatinosa (Rückenmark)
Periaquäduktales Grau
Raphe-Kerne
Thalamuskerne
Limbisches System
Hypothalamus
e) Applikationsformen
Oral, subkutan, intravenös
Direkt in den Rückenmarkskanal (z. B. per Dauerkatheter)
Transdermale Pflaster (konstante, niedrig dosierte Abgabe)
f) Weitere Wirkungen
ZNS: Atemdepression, Hustendämpfung, Miosis
Praxisproblem: Opioide werden noch immer zu selten eingesetzt, trotz klarer Wirksamkeit bei chronischen Schmerzen.
Was sind Nichtopioidanageltika? Wo wirken sie genau, und wie? haben sie Nebenwirkungen? Beispiel?
Nichtopioidanalgetika
a) Eigenschaften
Meist auch antipyretisch (fiebersenkend)
Chemisch verwandte Substanzen
Zentrale Wirkung gering, Hauptwirkung peripher
b) Wirkmechanismus
Hemmung der Prostaglandinsynthese, wodurch:
Nozizeptorenschwelle erhöht wird
Freisetzung von Substanz P reduziert wird (auch zentral)
Prostaglandine fördern Schmerz durch:
Senkung der Reizschwelle
Beteiligung an entzündlichen Prozessen
c) Nebenwirkungen
Prostaglandinsynthese wird systemisch gehemmt → Nebenwirkungen, besonders im Magen-Darm-Trakt (z. B. Schleimhautschäden)
d) Wichtigstes Medikament
Acetylsalicylsäure (ASS) – bekanntester Vertreter: Aspirin
Wie und wo genau wirken Lokalanästhetika? Wann wird dies angewendet, und mit welchem Ziel?
Nervenblockade und Lokalanästhesie
Wirkprinzip der Lokalanästhetika
Reversible Blockade von Aktionspotenzialen in Nervenfasern.
Wirkung gezielt auf schmerzleitende Fasern → Schmerzausschaltung ohne Bewusstseinsverlust.
Typische Wirkstoffe: Kokain, Prokain, Lidocain.
Blockiert wird die periphere Schmerzleitung, entweder:
Am Nervenende (z. B. in der Haut)
Am Nervenstamm (z. B. vor Eintritt ins Rückenmark)
Indikationen für Nervenblockaden
Neuralgien der Spinalnerven
Postoperative Schmerzbehandlung
Narben- oder Herpesschmerzen
Therapeutisches Ziel
Durchbrechen des Teufelskreises aus gesteigerter Nozizeptoraktivität und überhöhter sympathischer Rückkopplung.
Pathophysiologischer Hintergrund
Übermäßige Aktivierung von Nozizeptoren kann zu einer Verkettung mit sympathischen Neuronen führen.
Dies resultiert in:
Starker vasokonstriktiver Aktivität in der Peripherie
Gefäßschmerzen und weiterer Nozizeptorüberaktivierung
Wirkmechanismus der Schmerzunterbrechung
Lokalanästhetikum → Hemmt periphere Schmerzweiterleitung
→ Dämpft Sympathikusaktivität
→ Reduziert vasogene Schmerzen
→ Normalisiert Nozizeptoraktivität
Was sind Gegenstimulationsverfahren? Deren Variationen?
Gegenstimulationsverfahren
Grundprinzip
Beruht auf der Gate-Control-Theorie:
Aktivität schnell leitender Aβ-Fasern hemmt die Weiterleitung von Schmerzsignalen (Ad- und C-Fasern) im Rückenmark.Ziel: Nicht-schmerzhafte Reize aktivieren hemmende Interneurone → Schmerzsignal wird geblockt.
Transkutane elektrische Nervenstimulation (TENS)
Akupunktur
Was ist TENS? Deren Funktionsweise? Anwendungsmöglichkeiten? Wirksamkeit?
Transkutane elektrische Nervenstimulation (TENS)
Funktionsweise
Elektrische Stimulation der Haut über Elektroden.
Reizt Aβ-Fasern → hemmt Aktivität der schmerzleitenden Fasern im Rückenmark.
Anwendung: Gerät mit variabler Frequenz (1–200 Hz), Stromstärke und Impulsmuster; Elektroden werden an Schmerzstelle oder spinalnah platziert.
Neurochemische Wirkmechanismen
Niederfrequente TENS (1–4 Hz):
Freisetzung endogener Opioide (v.a. Enkephaline)
Wirkt langanhaltend, aber häufiger lokale Hautreizungen
Hochfrequente TENS (80–100 Hz):
Schnell wirksam, aber kürzere Wirkung.
Mögliche Hemmung durch synaptische Depression
Einsatzbereich und Wirksamkeit
Vielfältig einsetzbar bei chronischen und akuten Schmerzen.
Nebenwirkungsarm (gelegentlich Hautreaktionen).
Kann Schmerzmittelverbrauch um ~50 % senken.
Wirksamkeit bei ca. 70–80 % der Patienten, Versagen evtl. durch Serotoninmangel oder gestörtes Opioidsystem.
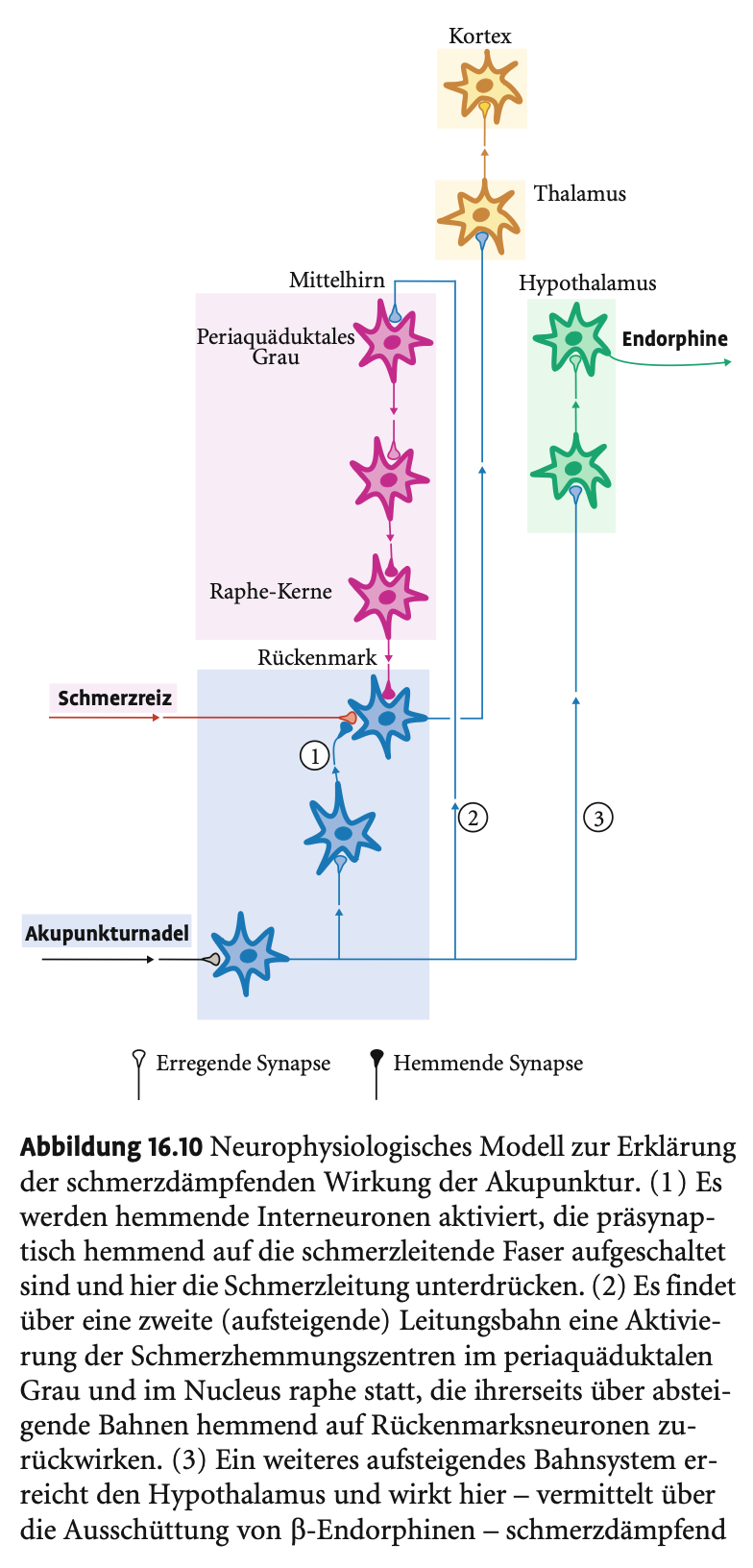
Was ist Akupunktur? Deren Funktionsweise? Anwendungsmöglichkeiten? Wirksamkeit?
Akupunktur
Theoretische Grundlage
Basierend auf der Vorstellung, dass Organe über die Körperoberfläche beeinflusst werden können.
Klassisch aus der chinesischen Medizin, mittlerweile auch im Westen anerkannt, v.a. bei chronischen Schmerzen.
Wirkmechanismen
Nervale & hormonelle Effekte:
Endorphin- und Serotoninausschüttung; blockierbar durch Naloxon und PCPA → bestätigt neurochemische Beteiligung.
Tierstudien: ATP → Adenosin → Bindung an A1-Rezeptor → Analgesie (Beweis durch pharmakologische Blockade/Verstärkung).
Erfordert intakte Nervenleitbahnen: Keine Wirkung bei Querschnittslähmung oder Lokalanästhesie unterhalb der Punktionsstelle.
Weitere physiologische Wirkungen
Aktiviert vermutlich auch vegetatives Nervensystem und Immunsystem → Anwendung bei funktionellen und psychosomatischen Beschwerden.
Akupunktur bei Kopfschmerzen
Einsatz bei Migräne & Spannungskopfschmerzen:
Wirkt akut und kann langfristige Besserung bringen.
Studien: >50 % profitieren, v. a. durch Schmerzlinderung und Medikamentenreduktion.
Bei vielen Patienten anhaltende Effekte über 6–18 Monate beobachtet.
Was ist Biofeedback? Wann wird es angewendet? Was ist deren Funktionsweise?
Grundprinzip
Biofeedback bedeutet: Rückmeldung biologischer Prozesse an den Patienten, sodass dieser lernt, willentlich Einfluss auf diese zu nehmen.
Ziel: Selbstkontrolle über physiologische Vorgänge (z. B. Muskeltonus, Herzfrequenz, Gefäßtonus, EEG-Aktivität).
Besteht aus 3 Hauptkomponenten:
Organismus als Signalquelle (z. B. Hauttemperatur)
Messsystem, das die biologische Aktivität aufzeichnet
Signalgeber (visuell, akustisch), der dem Patienten Veränderungen rückmeldet
Indikationen
Chronische Schmerzen (z. B. Rücken, Migräne, Spannungskopfschmerz)
Vegetative Beschwerden (Herzrate, Blutdruck)
Muskuläre Störungen (z. B. bei Kiefergelenksschmerzen)
Psychosomatische Beschwerden (z. B. bei Angststörungen)
Wirkmechanismen
Direkte Wirkung: Regulation des Zielparameters (z. B. Muskeltonus).
Indirekte Wirkung:
Verbesserung der Körperwahrnehmung
Förderung der Selbstwirksamkeit: Patient erlebt, dass er seinen Körper beeinflussen kann.
Erhöht Konkordanz zwischen Empfinden und biologischer Aktivität
Trägt zur Differenzierung von körperlichen und psychischen Schmerzursachen bei
Kombinationstherapie
Biofeedback wird meist mit verhaltenstherapeutischen Maßnahmen kombiniert.
Besonders sinnvoll bei Patienten, denen Zusammenhänge zwischen Psyche und Körper nicht bewusst sind.
Biofeedback bei spezifischen Schmerzsyndromen
Chronische Rückenschmerzen
Spannungskopfschmerz
Migräne

Beschreibe die Anwendung von Biofeedback an chronischen Rückenschmerzen.
Chronische Rückenschmerzen
Häufigstes Schmerzsyndrom (20–30 % Prävalenz)
Oft muskulär mitbedingt: chronische Verspannungen, Fehlhaltungen
Zwei Hauptziele:
Korrektur unphysiologischer Bewegungen (selten)
Muskelrelaxation bei chronischem Tonusanstieg (häufig)
Psychische Belastung → Muskelverspannung → Schmerz
Biofeedback: Patient lernt gezielt, Rückenmuskulatur zu entspannen
Effekte
Veränderung des Muskeltonus
Aktive Rollenübernahme des Patienten
Reduktion des Schmerzerlebens und Verbesserung des Selbstkontrollgefühls
Beschreibe die Anwendung von Biofeedback an Spannungskiofschmerz.
Spannungskopfschmerz
Häufige Form chronischer Kopfschmerzen (8–11 % Prävalenz)
Charakter: symmetrisch, dumpf, variabel in Intensität
Ursache oft: erhöhter Muskeltonus im Gesichts-, Nacken-, Kieferbereich
Diagnostik über Elektromyogramm (EMG)
Muskelrelaxationsbiofeedback
Ziel: Reduktion der Muskelspannung
Typische Zielmuskeln:
Musculus frontalis (Stirn)
Musculus trapezius (Nacken)
Musculus masseter (Kiefer)
Patient verändert durch Selbstinstruktionen das Feedbacksignal in Richtung geringerer Muskelspannung
Wirksamkeit
Bei ~50 % der Patienten: ≥ 50 % Schmerzlinderung
Effektstärke vergleichbar mit medikamentöser Therapie
Beschreibe die Anwendung von Biofeedback an Migränen.
Migräne
10 % der Bevölkerung betroffen
Schmerz: einseitig, pulsierend, anfallsartig (4–72h), häufig mit Übelkeit/Erbrechen
Ursache: Überaktivität im Trigeminussystem → Gefäßerweiterung → Freisetzung von Neuropeptiden (z. B. Substanz P) → neurogene Entzündung
Vasomotorisches Biofeedback
Ziel: Gefäßverengung der Schläfenarterie
Messung über photoelektrischen Sensor
Effekt generalisiert vermutlich auf intrakranielle Gefäße
Effekte
Reduktion von Häufigkeit, Dauer, Schmerzstärke
Weniger Medikamentengebrauch
Effektiv bei Kombination mit anderen Verfahren wie Entspannungstraining, Verhaltenstherapie
Was ist die neurochirurgische Therapie, und was sind deren Hauptverfahren?
Neurochirurgische Therapie
Allgemeines
Ziel: Linderung (nicht Heilung) chronischer, therapierefraktärer Schmerzen.
Anwendung: v. a. palliativ, z. B. bei Tumorschmerzen.
Grundproblem: Nur selten wird die Schmerzursache beseitigt (z. B. bei Nervenkompression), meist nur das Symptom.
Drei neurochirurgische Hauptverfahren
Läsionsverfahren (z.B. anterolaterale Chordotomie)
Thermokoagulation
Neurostimulation
Was sind Läsionsverfahren?
Läsionsverfahren (z. B. anterolaterale Chordotomie)
Technik: Durchtrennung schmerzleitender Bahnen im Rückenmark (v. a. Tractus spinothalamicus im Vorderseitenstrang).
Funktion dieser Bahn: Leitung von Druck, Berührung, Schmerz, Temperatur aus dem Hinterhorn.
Erfolgsquote:
Einseitig: 70–90 % initiale Schmerzreduktion
Beidseitig: 40–78 %
Anwendung: Vor allem bei tumorbedingten Schmerzen bei geringer Lebenserwartung.
Nebenwirkungen: Störungen in Motorik, Sexualfunktion, Blasenfunktion → reduzierte Lebensqualität.
Problem: Schmerzrezidive möglich, Effekt kann mit der Zeit nachlassen.
Was ist Thermokoagulation?
Thermokoagulation
Technik: Erhitzung auf ca. 72 °C schädigt gezielt äußere Fasern eines Nervs (v. a. nozizeptive und sensible).
Vorteil: Motorische Fasern bleiben erhalten, da diese tiefer liegen.
Nebenwirkungen:
Sensibilitätsstörungen möglich, oft reversibel
Rückkehr des Schmerzes durch Wiederaussprossung beschädigter Fasern
Einsatzgebiet: Periphere Nerven, gezielte Schmerzblockade
Was ist Neurostimulation?
Neurostimulation
Hintergrund: Komplette Nervendurchtrennung kann zu Deafferenzierungsschmerz führen (ähnlich Phantomschmerz), da das Gehirn die fehlenden Eingangssignale durch Schmerz ersetzt.
Ziel: Erhalt der Nervenfunktion, aber Störung der Schmerzleitung
Methode:
Elektrische Reizung des betroffenen Nervs ersetzt Schmerz durch angenehmes Kribbeln
Indikation: Besonders nach Bandscheibenschäden
Vorgehen:
Probestimulation für einige Tage
Bei Erfolg: Implantation eines Impulsgebers (z. B. unter der Bauchhaut), der die Elektrode im Rücken ansteuert
Patient kann Intensität selbst regeln
Ausweitung: Auch zerebrale Neurostimulation (v. a. im Thalamus und Mittelhirn) wird experimentell genutzt.