Enzimologija
1/146
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
147 Terms
Koji faktori određuju smjer i intenzitet hemijske reakcije?
Entalpija H
Entropija S
Slobodna energija G
Šta je entalpija?
Entalpija je veličina koja pokazuje sadržaj toplote reaktanata i proizvoda reakcije. Promjena entalpije ukazuje na to hoće li biti reakcija spontana ili ne, tj. je li se energija oslobađa ili troši.
Spontana i egzotermna ∆H<0
Nije spontana i endotermna ∆H>0
Prvi zakon termodinamike.
Ukupna energija univerzuma je konstantna te se energija ne može stvoriti niti uništiti, ona samo može prelaziti iz jednog oblika u drugi.
Šta je entropija?
Entropija je mjera neuređenosti sistema i također određuje hoće li reakcija biti spontana ili ne.
Veća entropija znači i veću neuređenost sistema ∆S>0
Manja entropija ∆S<0 sistem je uređen.
Kako glasi drugi zakon termodinamike?
Svi fizički i hemijski procesi teže da se odvijaju u smjeru koji vodi maksimalnom povećanju entropije, odnosno neuređenosti sistema. Kada se dosegne maksimum, uspostavlja se ravnoteža i promjene u sistemu prestaju.
Šta je slobodna energija?
Slobodna energija je onaj dio ukupne energije učesnika reakcije koji može da se prevede u druge oblike energije.
Egzotermna, spontana reakcija ∆G<0.
Endotermna reakcija ∆G>0.
Reakcija u ravnoteži ∆G=0
Osobine bioloških katalizatora.
Velika efikasnost u ubrzavanju reakcija, ne mijenjaju se tokom reakcije, visoka specifično djelovanja, snižavaju energiju aktivacije i ne utiču na položaj hemijske ravnoteže.
Razlike između katalizatora i enzima.
Biološkog su porijekla
Svi su proteinske građe
Moraju se konstantnom sintezom nadomještati u organizmu
Vrlo su specifični po tome što djeluju na jedan ili najviše na neke strukturno slične srodne supstrate
Koji je uslov da hemijska reakcija bude moguća?
∆G<0
Podjela enzima prema složenosti građe.
Prosti - monomerni i oligomerni
Metaloproteini - sadrže jon metala
Složene proteinske - sadrže prostetičnu grupu
Tipovi specifičnosti prema supstratu.
Apsolutna
Grupna
Stereohemijska
Koja su dva modela za vezanje supstrata?
model ključ-brava
model indukovanog prilagođavanja
Model indukovanog prilagađavanja.
Dolazi do prilagođavanja trodimenzionalne strukture tj. konformacije enzima, tako da su aktivne grupe dovedene u adekvatnu poziciju za katalizu.
Koraci u enzimskoj katalizi.
E + S ←→ ES
ES ←→ EP
EP ←→ E + P
Kako enzimi inače dobijaju imena?
Po supstratu, reakciji, supstartu i reakciji i neinformativni nazivi.
Rodovi enzima.
Oksidoreduktaze
Transferaze
Hidrolaze
Liaze
Izomeraze
Ligaze
Koji faktori utječu na enzimsku katalizu.
koncentracija supstrata
koncentracija enzima
temperatura
pH
aktivatori
inhibitori
koenzimi…
Kako brzina hemijske reakcije ovisi o koncentraciji enzima?
Sa porastom koncentracije enzima raste brzina hemijske reakcije. Što je više enzima, to je više aktivnih centara i češći su sudari sa molekulama supstrata. Međutim, u kasnijim gazama reakcija, ograničavajući faktor postaje zapravo konc. supstrata, jer ne mogu svi enzimi zasićeni supstratom.
Kako brzina reakcije ovisi o koncentraciji supstrata?
S povećanjem koncentracije supstrata raste i brzina hemijske reakcije, međutim i ovdje u kasnijim fazama reakcije ograničavajući faktor se mijenja. Determinirajući faktor onda postaje konc. enzima sa slobodnim aktivnim centrima. Ako nema slobodnih enzima, reakcija se ne odvija.
Šta je denaturacija?
Gubitak biološke funkcije koji je baziran na promjeni trodimenzionalne strukture enzima.
Kako pH utječe na brzinu reakcije?
pH koji je van granica optimuma:
Protoniranje i deprotoniranje enzima dovodi do narušavanja veza i 2D i 3D strukture enzima. Znači da raskida veze između naelektrisanih AK i denaturiše proteine.
Michaelis-Mentenova konstanta.
Michaelis-Mentenova konstanta predstavlja mjeru za određivanje afiniteta enzima prema supstratu (Km). Definira se kao koncentracija supstrata kod koje je brzina reakcije jednaka polovici maksimalne brzine, a ovisi o supstratu i uvjetima u kojima se odvija reakcija.
Kada je ostvarena najveća brzina reakcije?
Kada su sve molekule enzima u obliku ES kompleksa.
vm= k2 [Eo]
Konstante brzine reakcije.
k1 - konstanta brzine reakcije nastajanja ES kompleksa
k-1 - konstanta brzine povratne reakcije nastajanja ES kompleksa
k2 - konstanta brzine reakcije nastajanja produkta
k-2 - konstanta brzine povratne reakcije nastajanja produkta
Šta je obrtni broj enzima?
Obrtni broj enzima je broj molekula supstrata koju je enzim pretvorio u produkt kad je enzim potpuno zasićen supstratom.
Koji su efektori u enzimskoj katalizi?
aktivatori - ubrzavaju dejstvo enzima
inhibitori - usporavaju ili potpuno koče katalizu
Podjela inhibitora.
ireverzibilni - kovalentno/čvrsto se vežu za enzima i sporo disociraju
reverzibilni - vežu se nekovalentno, malim afinitetom za enzim i brzo disocira sa njega
a) kompetitivni - strukturni sličan supstratu, pa se sa njim natječe ta aktivno mjesto; povećavaju Km tj. smanjuju afinitet za supstrat
b) nekompetitivni - ne vežu se za aktivno mjesto i djeluju tako što smanjuju vmax.
c) akompetitivni
d) kombinirani
Kako funkcioniše biokataliza?
Ubrzanje reakcije za 106 do 1012 puta posljedica je smanjenja energetskih barijera, tj. energije potrebne za interakciju pojedinih atoma i hemijskih skupina.
Građa enzima.
Apoenzim (proteinska komponenta) + kofaktor (neproteinska komponenta) = holoenzim
Dvije klase proteina prema strukturi.
Vlaknasti ili fibrilarni koji su nerastvorljivi u vodi i razblaženim rastvorima soli. To su npr proteini dlake, kože, noktiju, ligamenata i tetiva. Enzimi ne spadaju u ovaj tip proteina.
Globularni proteini imaju građu klupka i najveći dio proteina ima ovakvu strukturu. Rastvorljivi su u tjelesnim tečnostima. Nerastvorljivi su tzv. Dezmozimi, koji su vezani za strukturne elemente ćelija ili organela i mogu se rastvoriti dejstvom soli, deterdženata ili površinski aktivnih supstanci, kako bi se odvojili od strukture za koju su vezani.
Osnovni nivoi strukture enzima.
Primarna - redoslijed AK u peptidnom lancu
Sekundarna - konformacija polipeptidnih lanaca - izdužena ili helikoidna
Suprasekundarna - veći broj sekundarnih struktura, tj. alfa-heliksa i beta-nabranih ploča
Tercijarna - način na koji se peptidni lanac presavija i uklupča, odnosno trodimenzionalna struktura enzima kao proteina
Kvaterna - prostorna organizacija više peptidnih lanaca u enzimu
Enzimi prema složenosti građe.
Monomerni enzimi - sastoje se iz jedne globule i nemaju kvaternu strukturu - himotripsin, tripsin, pepsin
Oligomerni - sastoje se iz više globula/subjedinica i imaju kvaternu strukturu - pri čemu mogu biti homogeni i heterogeni oligomerni enzimi (subjedinice su mu proteomeri)
Razlika između subjedinice i domene.
Subjedinice predstavljaju različite polipeptidne lance dok se domeni nalaze u okviru jednog polipeptidnog lanca.
Enzimi katalizuju samo jednu od velikog broja mogućih reakcija. Kako se naziva to svojstvo?
Specifično dejstvo enzima.
Osnovne vrste specifičnosti prema supstratu
Apsolutna - enzimi su strogo specifični i djeluju samo na jedan supstrat
Relativna supstratna specifičnost - grupna + vezna specifičnost - djeluju na određene tipove supstrata
Široka supstratna specifičnost - enzimi su specifični za više srodnih supstrata
+++ stereospecifičnost
4 osnovne vrste specifičnosti
Apsolutna
Grupna
Stereohemijska
Specifičnost prema pojedinim vrstama reakcija
Kako utječe temperatura na brzinu reakcije?
S porastom temperature se povećava kinetička energija čestica i povećava se broj sudara među njima. Do određene granice raste brzina reakcije, nakon čega je moguće preći u zonu inhibicije i nepovratnog gubitka katalitičke aktivnosti usljed koagulacije.
Šta je aktivno mjesto enzima?
Aktivno mjesto je utor, džep ili udubljenje u unutrašnjosti ili na površini enzima koje služi za prihvat supstrata i kofaktora. To je mjesto na kojem se odvija kataliza posredovana enzimom. Aktivno mjesto je hidrofobno.
Aminokiseline aktivnog mjesta.
Katalitičke AK - kataliziraju hemijske reakcije; pretvaranje ES u EP
Kontaktne AK - učvršćuju supstrate i kofaktore; stvaranje ES kompleksa
Preostale AK koje okružuju katalitičke i kontaktne AK
Enzimi koji su manji od svog supstrata?
Amilaze, DNA polimeraze, proteaze.
Brzina hemijske reakcije.
Promjena koncentracije supstrata ili produkta u jedinici vremena (1mol/Ls)
Katal
Aktivnost enzima usred koje se 1 mol supstrata katalizira u 1 sekundi. 1 kat = 1 mol/s
Unit
Aktivnost enzima usred koje se 1 mikromol supstrata katalizira u 1 minuti. 1 U = 1 mikromol/min
Utjecaj visokih temperatura na aktivnost enzima.
Aktivnost enzima kod povećanja temperature postepeno raste do određene granice preko koje se IREVERZIBILNO gasi enzimska aktivnost.
Utjecaj niskih temperatura na enzimsku aktivnost.
Aktivnost enzima na niskim temperaturama postepeno opada, što je reverzibilan proces.
Šta sve može biti aktivator enzima?
Mali ioni (hlor, kobalt, magenzij) ili male molekule (glutation) koji pojačavaju aktivnost enzima.
Šta sve može biti inhibitor?
Mali ioni - cijanid, olovo, živa
Male molekule
Alosterička regulacija enzimske aktivnosti.
Alosterička aktivacija - aktivator se veže na svoje regulacijsko/alosteričko mjesto, udaljeno od aktivnog mjesta, pri čemu indukuje promjenu konformacije enzima i povećava njegovu interakciju sa supstratom; bez aktivatora je slabo djelotvoran
Alosterička inhibicija - inhibitor se veže na svoje alosteričko mjesto pri čemu enzim ostaje nefleksibilan ili poprima neadekvatnu konformaciju za reakciju sa supstratom; inače je u odsustvu inhibitora djelotvoran.
Osobine senzora metabolizma.
To su alosterični enzimi koji pored aktivnog mjesta imaju bar još jedno alosteričko mjesto za vezanje efektora
Regulišu protok metabolita u metaboličkim putevima
Ne podliježu MM kinetici i imaju višestruka aktivna mjesta
Regulacijski alosterički modulatori mogu stimulirati ili inhibirati enzimsku aktivnost.
Inhibicije enzimske aktivnost
Inhibitorom - reverzibilna - kompetitivna, nekompetitivna i akompetitivna
Inhibitorom - ireverzibilna - inhibitor se kovalentno veže za površinu enzima
Toplinska inhibicija
Ireverzibilna inhibicija sredstvima za taloženje enzima
Kakav može biti kompetitivni inhibitor?
Parcijalni antagonist - inhibitor izaziva istu katalitičku reakcije kao supstrat ali manjeg intenziteta
Neutralni antagonist - inhibitor ostaje vezan uz enzim bez katalitičkog djelovanja
Inverzni antagonist - inhibitor izaziva katalitičko djelovanje s negativnim posljedicama za organizam, suprotno supstratu.
Nekompetitivni inhibitor
Inhibitor se veže za neko mjesto blizu AM i uzrokuje promjene u konformaciji enzima; može E vezati S, ali nema razgradnje EP.
Akompetitivni inhibitor.
Inhibitor se veže za ES i onemogućuje disocijaciju EP
Lijekovi kao inhibitori
ACE-inhibitor - ACE - hipertenzija
Aspirin - ciklooksigenaza protiv inflamacije
Lovastatin - HMG-CoA reduktazu - hipolipemik
Penicilin - transpeptidaza - bakterije
Metotreksat - dihidrofolat reduktaza - leukemija
Šta je kofaktor?
Neproteinska komponenta enzima.
Koja je razlika između koenzima i prostetične grupe?
Koenzim je disocijabilan i uglavnom organske prirode. Prostetična grupa je nedisocijabilni kofaktor, tj. Ireverzibilno se veže za enzim.
Šta su metaloenzimi?
Enzimi kod kojih su metalni ioni čvrsto vezani za enzim.
Metal-aktivirani enzimi
Enzimi kod kojih je metal labavo vezan za enzim.
Razlika u metaboličkoj ulozi koenzima i prostetičkih grupa.
Koenzim može da učestvuje u reakcijama svih enzima određenog ćelijskog prostora koji su za njega specifični. Prostetična grupa isključivo djeluje samo u jednoj reakciji specifičnoj za taj enzim.
Kofaktori prema hemijskoj strukturi mogu biti:
Anorganski - metalni ioni i Fe-S grozdovi
Organski - prostetične grupe i koenzimi
Primjeri metaloenzima
Zn - karboanhidraza, alkohol dehidogenaza i karboksipeptidaza
Fe - citohromi
Cu - citohrom oksidaza
Mg - heksokinaza
Mn - SOD
Se - glutation peroksidaza
Ni - ureaza
Koja je osnovna razlika između koenzima i prostetičkih grupa?
Razlikuju se primarno u stepenu aftiniteta prema enzimima. Koenzimi se lahko, a prostetične grupe teško odvajaju od proteinskog dijela.
Podjela koenzima prema vrsti enzima u čiji sastav ulaze:
Koenzimi oksidoreduktaza
Koenzimi transferaza
Koenzimi liaza, izomeraza i ligaza.
Koji su najznačajniji koenzimi oksidoreduktaza?
Nikotinamidski nukleotidi
Flavinski nukleotidi
Ubikinoni
Liponska kiselina
Citohromi/hem-proteini
Ne-hem proteini
Građa piridin nukleotida.
Baza, šećer i fosforna kiselina, a baza je nikotinamid (derivat piridina)
Najbitniji piridin nukleotidi su:
Nikotinamid adenin-dinukleotid i
Nikotinamid adenin-dinukleotid fosfat
Mogu u mnogim reakcijama kataliziranim OR, dolazi do redukcije koenzima, pa za njega kažemo da je i kosupstrat.
Kojom reakcijom nastaje NADP+?
Fosforilacija NAD pomoću ATP-a katalizirana NAD+ kinazom.
Warburgov optički test.
Promjenom aromatske strukture nikotinamida mijenja se i apsorpcija svjetlosti u UV dijelu spektra. Pored apsorpcionog maksimuma na 260 nm koji imaju oksidacione forme NAD+ i NADP+ javlja se poslije redukcije još jedan maksimum na 340 nm.
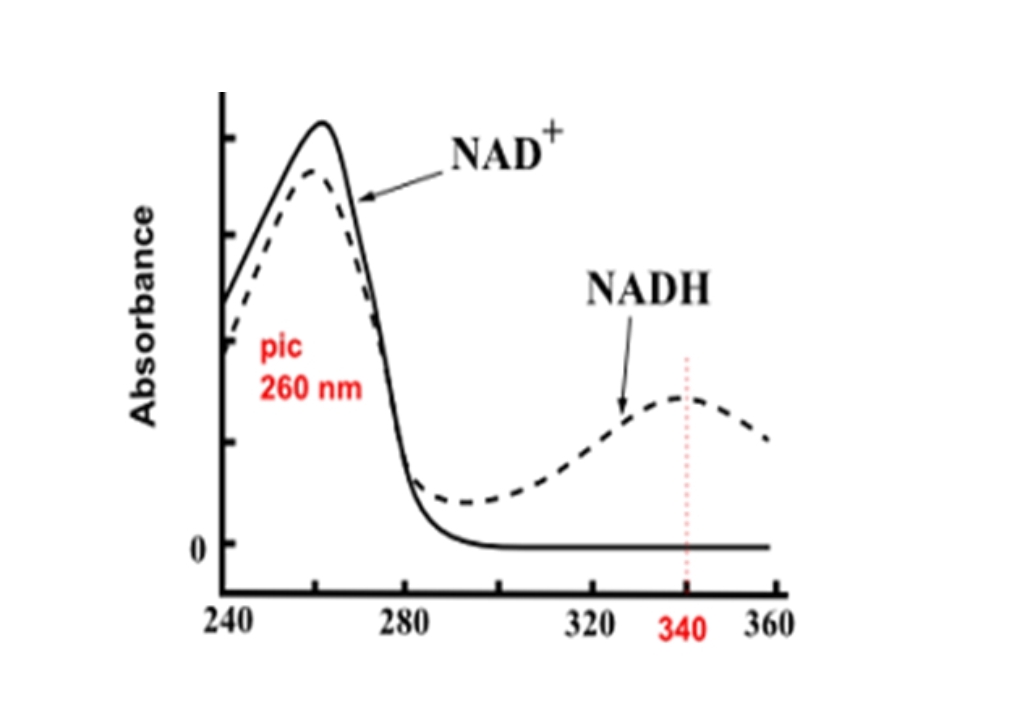
Funkcija nikotinamidskih nukleotida.
NAD+/NADH i NADP+/NADPH prenose vodik odnosno elektrone i protone pri oksidacijama supstrata sa dehidrogenazama.
Koje je reaktivno mjesto u NAD+ i NADP+?
Reaktivno mjesto je nikotinamidski prsten, vitamin PP, niacin.
Građa flavinskih nukleotida.
Flavinski nukleotidi su derivati vitamina B2 tj. riboflavina.
FMN - flavin + ribitol + fosfat
FAD - dva nukleotida = riboflavin-fosfat + adenozin-monofosfat
Reakcija nastanka FAD iz riboflavina.
Riboflavin → FMN → FAD
Enzim - riboflavin kinaza
Enzim - FAD pirofosforilaza
Šta su ubikinon i plastokinoni? Gdje ih najviše ima?
Ubikinon i plastokinon su benzokinonski derivati koji u bočnom lancu sadrže nekoliko izoprenskih jedinica. Najviše ih ima u hloroplastima i u respiratornom lancu.
Koji ubikinon može inicirati i modulirati ćelijske energetske procese?
CoQ10
Razlika između ubikinona i plastokinona?
Po strukturi su slični ubikinonu ali se od njega razlikuju po tome što umjesto metoksi grupe sadrže metil grupu u aromatičnom prstenu.
Šta je liponska kiselina?
Liponska kiselina je koenzim koji sadrži disulfidnu grupu koja može primati elektrone. Ima ulogu u reakcijama u kojima se prenose vodik i acil-grupe. Sastavni je dio dihidrolipoil-transferaza i dehidrogenaza. Redukcijom gradi dihidroliponsku kiselinu.
Šta su citohromi? Navesti podjelu citohroma.
Citohromi su hem proteini koji služe kao redoks katalizatori u respiraciji i konverziji energije. Nalaze se u mitohondrijama - a, a3, b, c i c1. Prema položaju maksimuma apsorpcije svjetlosti u redukovanom stanju (Fe2+) razlikuju se 4 grupe: a, b, c i d. Ista podjela i prema strukturi bočnih lanaca.
Uloga citohroma.
Uloga citohroma u biohemijskim procesima je značajna i višestruka. Sastavni su dio respiratornog lanca, učestvuju pri enzimskim reakcijama hidroksiliranja, posreduju kod fiksacije N2 u bakterijama itd.
Ne-hem proteini.
Posebna grupa redoks jedinjenja koja sadrže FeS centre i prenose elektrone.
Šta su feredoksini? Podjela Fd.
Feredoksini su prosti FeS proteini. Za proteinski dio se FeS vežu preko cisteina. Imaju ulogu u prenosu elektrona u hloroplastima, fiksaciji azota, sintezu ketokiselina i sl.
Bakterijski rubredoksin - 1
Biljni, bakterijski i životinjski Fd - 2
Nefotosintetički bakterijski - 4
Bakterijski - 8
Koji je najvažniji koenzim transferaza i koje su njegove osobine?
Koenzim A - derivat pantotenske kiseline ili vitamina B5. Aktivira acilne ostatke tako što veže karboksilne (masne) kiseline preko SH funkcionalne skupine.
Najvažnije reakcije CoA.
Oksidativna dekarboksilacija piruvata (I faza proizvodnje energije u mitohondrijama)
Oksidativna dekarboksilacija α – ketoglutarata (IV faza Krebsovog ciklusa)
Aktivacija masnih kiselina
Sinteza acetil – CoA oksidacijom masnih kiselina (IV faza β-oksidacije)
Katabolizam acetata (iz etilnog alkohola) u hepatocitima
ATP i UTP kao koenzimi.
ATP prenosi fosfatnu skupinu sa jednog na drugi supstrat, a sama nastaje u reakciji koju katalizira adenilat-kinaza. Hidrolizom nastaje AMP.
UTP i UDP su koenzimi biosintetskih reakcija šećera. UTP je koenzim enzima glukozo-1-fosfat-uridintransferaze u biosintezi saharoze.
Pirodoksal-fosfat PLP je derivat kojeg vitamina i koenzim kojih enzima?
Derivat je vit. B6 i koenzim je aminotrasnferaza - nastaju Schiffove baze i karboksilaza.
Tiamin-pirofosfat i njegovi enzimi.
Derivat je vitamina B1. Ulazi u građu piruvat-DH, alfa-ketoglutarat-DH i transketolaza.
6 glavnih rodova enzima
EC 1 oksidoreduktaze - kataliziraju oksidacije i redukacije
EC 2 transferaze - kataliziraju prenos funckionalnih skupina s jedne na drugu molekulu
EC 3 hidrolaze - kataliziraju hidrolitičko kidanje C-C, C-O i C-N veza uz sudjelovanje molekula vode
EC 4 liaza - kataliziraju kidanje C-C, C-O i C-N veza, ali procesima oksidacije, eliminacijom atoma i stvaranjem dvostrukih veza ili prstenova
EC 5 izomeraze - kataliziraju geometrijske ili strukturne promjene unutar molekule, tj. Stvaranje izomera
EC 6 ligaza - kataliziraju spajanje dvije molekule stvaranjem C-C, C-O i C-N veza, uz potrošnju ATP-a
Šta su liaze?
Liaze su enzimi koji odvajaju molekulske grupe od supstrata (nehidrolitički) pri čemu preostaje dvostruka veza.
Šta su ligaze?
Ligaze su enzimi koji katalizuju sjedinjavanje dva molekula, ako se proces snadbjeva energijom pirofosfatne veze A/GTP-a
Šta označava prva cifra u enzimskom broju EC?
Prva cifra pokazuje kojem rodu enzim pripada.
Šta označava druga cifra u enzimskom broju?
Druga cifra označava klasu enzima.
Šta označava druga cifra EC broja kod oksidoredukaza?
Kod oksidoreduktaza je podjela izvršena prema funkcionalnoj grupi u donoru koja podliježe oksidaciji. Br. 1 - alkoholna grupa; 2 - aldehidna ili ketonska: 3 - CH-CH grupu i sl.
Šta označava druga cifra EC broja kod hidrolaza?
Kod hidrolaza se ovom cifrom označava tip hemijske veze koja podliježe hidrolizi.
Šta označava druga cifra EC broja kod liaza?
Druga cifra kod liaza predstavlja tip veze koji se prekida između uklonjene grupe i ostatka.
Šta označava druga cifra EC broja kod izomeraza?
Ova cifra karakterizuje tip izomeracije.
Šta označava druga cifra EC broja kod ligaza?
Kod ligaza ovim brojem je numerisan tip novonastale veze.
Šta označava treća cifra u EC broju enzima?
Treća cifra označava potklasu enzima.
Šta označava treća cifra EC broja kod oksidoredukaza?
Kod oksidoredukaza se njome označava tip akceptora koji sudjeluje u reakciji: 1 - NAD+ ili NADP+, 2 - citohrom, 3 - O2
Šta označava četvrta cifra EC broja enzima?
Četvrta cifra je individualni/serijski broj u njegovoj potklasi
Kako se zove i koju reakciju katalizira enzim EC 1.1.1.1?
Enzim je alkohol: NAD+ oksidoreduktaza (alkohol dehidrogenaza) i katalizuje sljedeću reakciju:
Alkohol + NAD+ = aldehid/keton + NADH
Kako se zove i koju reakciju katalizira enzim EC 1.1.1.27?
Enzim se zove L-laktat: NAD+ oksidoreduktaza (laktat-dehidrogenaza)
L-laktat + NAD+ → piruvat + NADH