Chapitre 1 : Spinal Cord Injuries
1/81
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
82 Terms
A. Définition
Qu’est-ce qu’une lésion de la moelle épinière ?
Atteinte traumatique ou non traumatique de la moelle épinière, structure protégée par la colonne vertébrale.
Causes traumatiques ?
Accident de la route, chute, accident de chantier…
Causes non traumatiques ?
Tumeur, infection, ischémie.
De quoi dépendent les conséquences ?
Niveau de la lésion et caractère complet ou incomplet.
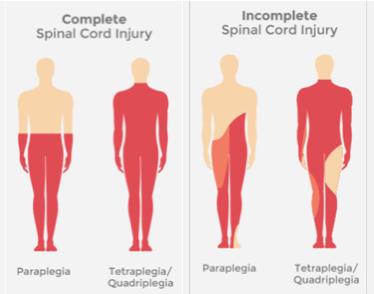
Lésion cervicale → conséquence ?
Tétraplégie.
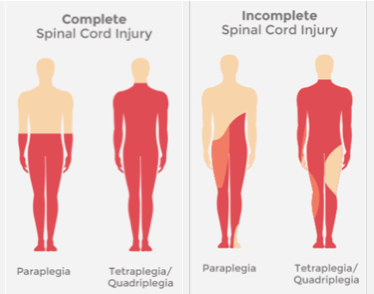
Lésion thoracique ou inférieure → conséquence ?
Paraplégie.
Nombre de nouveaux cas annuels dans le monde ?
250 000 à 500 000.
B. Régéneration : différence entre SNC et SNP
Régénération : différences SNP vs SNC
Système | Caractéristiques | Capacité de régénération |
|---|---|---|
SNP | Richement vascularisé → arrivée rapide des macrophages et cellules de Schwann. | Bonne régénération des neurones et axones. |
SNC | Isolé par barrière hémato-encéphalique → peu de cellules immunitaires. | Régénération limitée, lente et incomplète. |
Rôle des cellules de Schwann ?
Éliminent les débris et sécrètent des cytokines pro-réparatrices.
Rôle de la barrière hémato-encéphalique ?
Freine l’entrée des cellules immunitaires → limite la réparation.
Conséquences globales d’une SCI ?
Douleurs
Troubles moteurs
Troubles respiratoires
Troubles autonomes
Troubles sensitifs
Détresse psychologique
Perte d’autonomie
Fardeau social
Comment évalue-t-on la gravité ?
Par le questionnaire ASIA (classification selon le niveau de la lésion).
Evolution des lésions médullaires
Lésion primaire
Quelles sont les causes initiales d’une lésion primaire ?
Ischémie, hémorragie, afflux inflammatoire.
Conséquence vasculaire ?
Perturbation vasculaire, gonflement, compression médullaire
Cellules touchées ?
Neurones et oligodendrocytes → mort cellulaire.
Conséquence fonctionnelle ?
Interruption des voies ascendantes et descendantes (axones endommagés).
Lésion secondaire
Neurotransmetteur impliqué dans la cascade exotoxique de la lésion secondaire ?
Glutamate (libération excessive).
Étapes de la cascade exotoxique ?
Hyperactivation des récepteurs au glutamate
Dérégulation du calcium intracellulaire
Hyperexcitabilité neuronale
Dysfonction neuronale
Stress oxydatif
Neuroinflammation
Que provoque l’inflammation locale ?
Œdème médullaire
Cavité cystique secondaire
Cellules impliquées ?
Leucocytes, macrophages, astrocytes, microglies.
Réactions gliales ?
Astrogliosis et microgliosis → cicatrice gliale.
Rôles des macrophages et microglies ?
Phagocytose des débris et libération de médiateurs inflammatoires.
Principaux médiateurs inflammatoires ?
Prostaglandines
Cytokines (IL-1β, TNF-α)
Chémokines
Conséquence sur la myéline ?
Apoptose des oligodendrocytes → démyélinisation.
Effet sur la matrice extracellulaire ?
Remodelage → freine la repousse axonale.
Conséquence à long terme
Quelles sont les conséquences tissulaires à long terme d’une lésion médullaire ?
Formation d’une cicatrice fibro-adhésive dense.
Blocage de la régénération axonale.
Que font les astrocytes après la lésion ?
S’activent et :
Entrent en contact avec les fibroblastes et les regroupent au centre de la lésion.
Forment une paroi dense autour du site lésé.
Produisent et déposent des molécules inhibitrices : CSPG (Chondroitin Sulfate Proteoglycans).
Quelle est la conséquence de ces CSPG ?
Formation d’une barrière physique et chimique empêchant la repousse axonale.
Différence entre inflammation PNS et CNS ?
PNS : inflammation = bénéfique → favorise la réparation.
CNS : inflammation = délétère → aggrave les dommages.
Neuroprotection
Objectif de la neuroprotection ?
Préserver les tissus neuronaux durant la phase secondaire pour limiter les pertes
Première mesure clinique ?
Immobilisation du patient → éviter d’aggraver la lésion.
Médicaments utilisés et leurs rôles ?
Érythropoïétine (EPO) → limite la mort cellulaire.
Magnésium, riluzole → réduisent l’excitotoxicité.
Anti-inflammatoires, cyclosporine → modulent la réponse immunitaire.
Objectif de la chirurgie ?
Stabiliser la moelle :
Remplacement de fragments osseux.
Réalignement de la moelle épinière.
Pourquoi maintenir la respiration ?
Pour éviter l’hypoxie secondaire et préserver la fonction neuronale.
But des soins continus ?
Prévenir les complications secondaires.
Exemples de complications à prévenir ?
Contractures musculaires.
Troubles intestinaux et vésicaux.
Infections respiratoires.
Caillots sanguins.
Que comprend la réhabilitation ?
Soins physiques, respiratoires et psychologiques pour restaurer autonomie et qualité de vie.
Risque d’une immunosuppression excessive ?
Empêche l’action bénéfique des macrophages → freine la réparation.
Efficacité clinique des stratégies testées ?
Peu d’efficacité durable à ce jour.
Règles des 7
a. Reduction of Damage (Phase 1)
Que signifie la réduction du dommage dans la phase 1 ?
Préservation relative du tissu neural pendant la lésion secondaire.
Limiter l’expansion de la lésion (ex. éviter qu’une paraplégie devienne tétraplégie).
Moyens de réduction de la mort cellulaire ?
Cytokines pro-survie.
Facteurs de croissance.
Moyens de réduction de l’excitotoxicité ?
Modulateurs des canaux ioniques.
Modulateurs des récepteurs du glutamate.
Moyens de modulation de l’inflammation ?
Stéroïdes, AINS, autres.
⚠ Ne pas supprimer totalement l’inflammation → nécessaire à la réparation.
Autre objectif de la phase 1 ?
Stopper l’œdème médullaire.
b. Remplacement (phase2)
Objectif de la phase de remplacement ?
Développement de thérapie cellulaire pour remplacer les cellules perdues.
Types de cellules utilisées ?
Mesenchymal Stem Cells (essais cliniques humains).
Neural Precursor Cells.
Induced Pluripotent Stem Cells (à partir de fibroblastes).
Schwann Cells.
Olfactory Ensheating Cells.
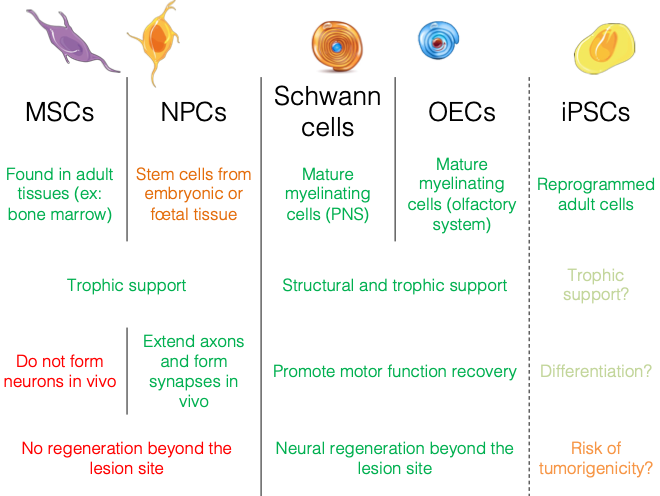
c. Resupply (Phase 2)
Objectif du réapprovisionnement ?
Fournir aux neurones endommagés des molécules favorisant survie et régénération.
Principales molécules utilisées ?
Neurotrophines → régulent survie, développement et fonction des neurones (SNC & SNP).
BDNF, NT-3, NT-4,
On peut aussi réapprovisionner avec des FGF ou GDNF
Voies de signalisation principales activées par les neurotrophines ?
MAPK.
PI3K-Akt.
Modes d’administration des neurotrophines ?
Perfusion directe.
Biomatériaux / nanotransporteurs.
Greffe cellulaire.
Vecteurs viraux.
Problèmes actuels du resupply ?
Faible stabilité.
Lésion au site de perfusion.
Diffusion limitée.
Incapacité à traverser la BBB.
Complexité de la signalisation et effets secondaires.
d. Regeneration (Phase 2)
Objectif de la régénération ?
Exploiter les mécanismes intrinsèques des neurones du SNC pour améliorer leur régénération.
Capacité de régénération des neurones ?
Possible dans un environnement propre mais pas dans la lésion.
Stimulation des programme de régénération (modulation pharmacologique ou manipulation génétique)
Modulation du cytosquelette cellulaire
Exemple expérimental ?
Transplantation d’un nerf fémoral à proximité d’une région centrale chez un rat → régénération axonale dépendant de l’environnement.
Nécessité pour améliorer la régénération ?
Identifier les acteurs clés de la repousse neuronale.
e. Remyelination (Phase 2)
Pourquoi la remyélinisation est-elle importante ?
Protège les axones d’une dégénérescence supplémentaire.
Améliore la vitesse de conduction des signaux.
Moyens de remyélinisation ?
Transplantation de cellules différenciables en oligodendrocytes :
Cellules de Schwann
Olfactory Ensheating Cells (OEC)
Neural Precursor Cells (NPC)
Recrutement de cellules précurseurs oligodendrocytaires endogènes (OPC)
Favoriser différenciation vers cellules myélinisantes matures.
f. Removal (Phase 3)
Que signifie “removal” ?
Élimination des facteurs inhibiteurs (cicatrice gliale)→ nettoyage de la zone lésée.
CSPG, rôle et élimination ?
Protéoglycanes de chondroïtine sulfate, contribuent à la cicatrice gliale, barrières à la repousse axonale.
CSPG = noyau protéique avec une chaine latérale de chondroïtine sulfate.
Principales cellules exprimant les CSPG : astrocytes.
Dégradation possible par ChABC.
Autres composants à éliminer ?
Composant de la MEC et débris de myéline → inhibent la régénération axonale.
Techniques : anticorps neutralisants (ex. anti-NogoA).
g. Rehabilitation (Phase 3)
Objectif de la rééducation ?
Stimuler l’activité neuronale et le système locomoteur sous le site de la lésion.
Méthodes principales ?
Entraînement moteur : course, exercices physiques.
Stimulation électrique : activateurs neuronaux implantés ou externes.
Effets observés ?
Élagage et affinement des circuits moteurs.
Stimulation de la production locale de neurotrophines.
Modulation des systèmes de neurotransmetteurs.
Amélioration de la ramification et des réseaux de relais neuronaux.
Exemple expérimental ?
Tests sur rongeurs en Suisse : exercice physique et stimulation neuronale → amélioration de la plasticité.
Conclusion des 7R combinées ?
“COMBINING FOR THE BETTER” → combinaison des phases pour maximiser récupération fonctionnelle.