Coenzymes Cartes | Quizlet
1/60
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
61 Terms
Phosphate pyridoxal
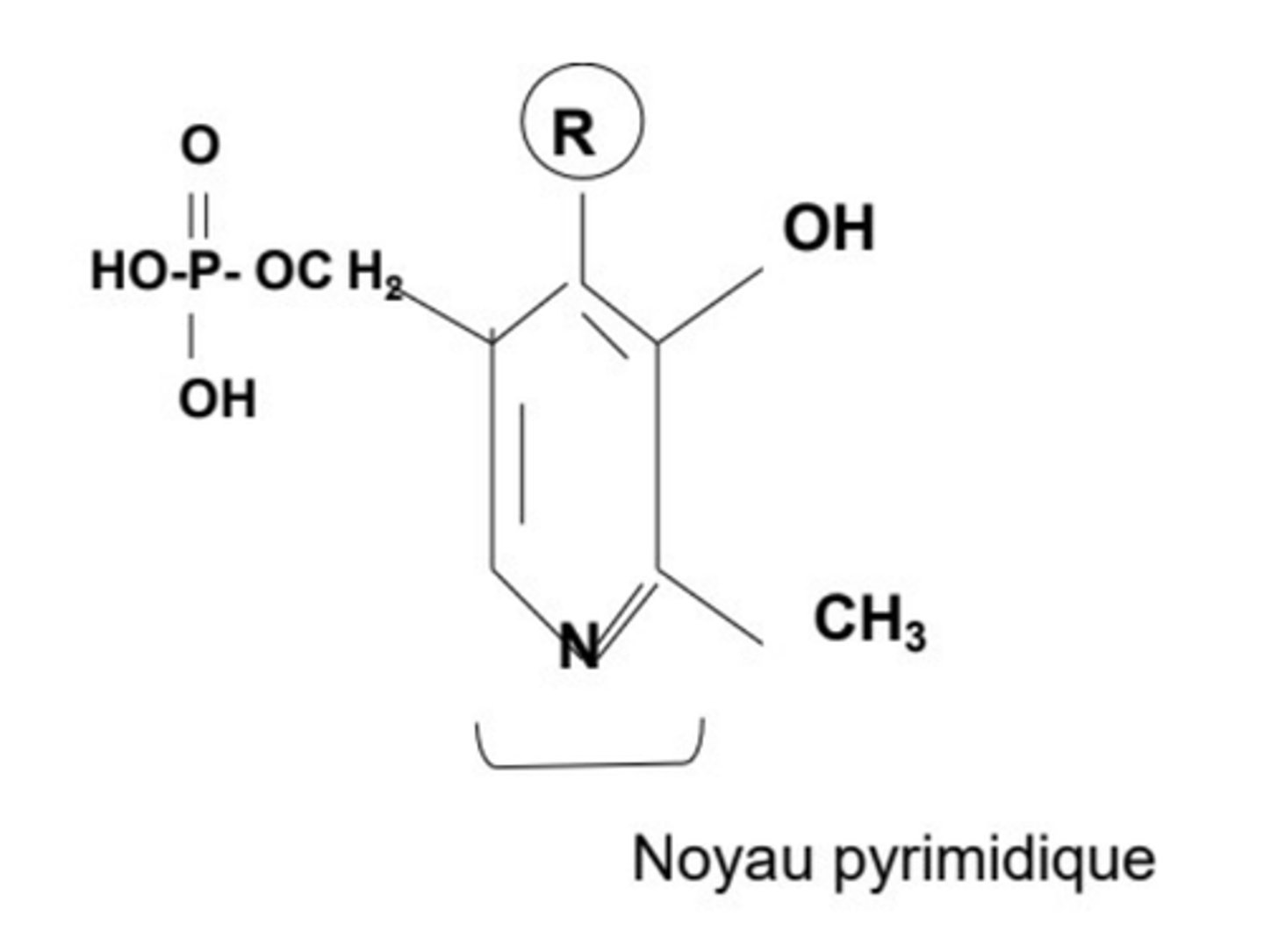
Quels types de réactions impliquent le phosphate de pyridoxal dans le métabolisme des acides aminés ?
Décarboxylation, transamination et départ de radicaux via la formation d'une base de Schiff.
Thiamine pyrophosphate (TPP)
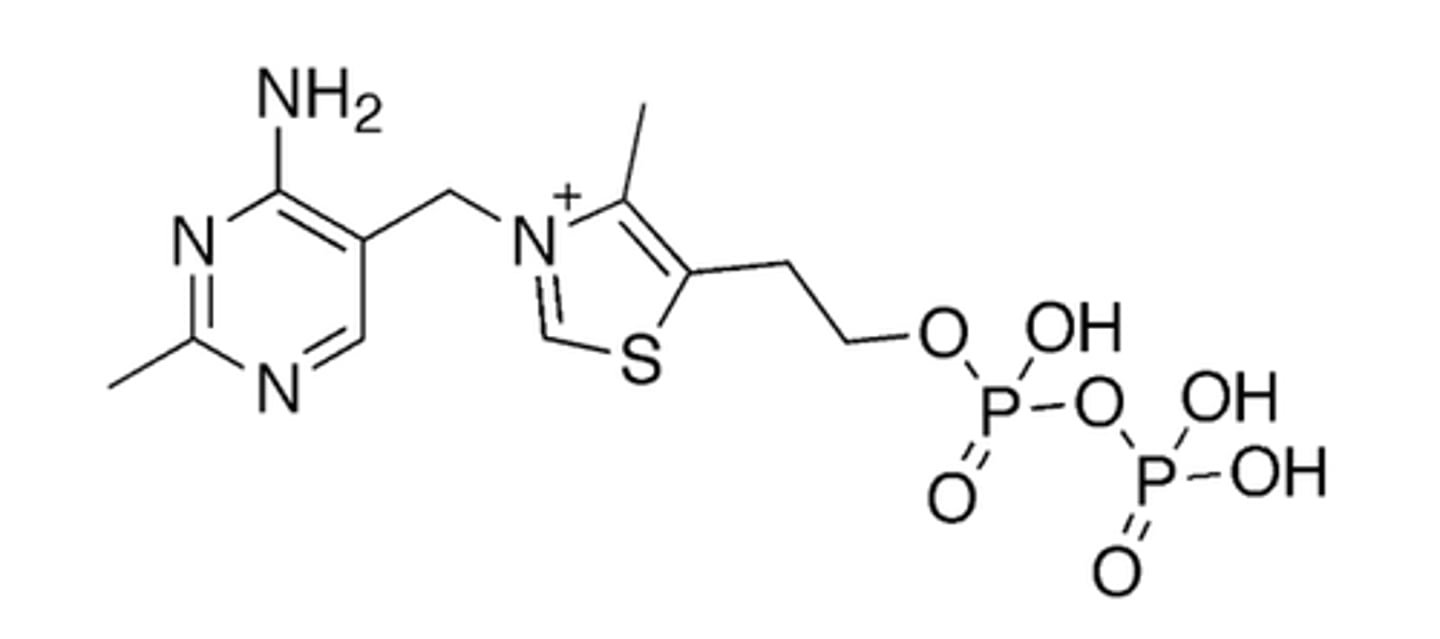
Quels sont les rôles métaboliques principaux de la thiamine pyrophosphate (TPP) ?
Décarboxylases (liant la glycolyse au cycle de Krebs) et des transcétolases.
Quelles sont les fonctions de la transcétolase ?
Transfert d'un groupement dicarboné, voie des pentoses phosphate, et produit NADPH+H+ (biosynthèse du cholestérol et des acides gras)
Quelle maladie résulte d'une carence en vitamine B1 ?
Le béribéri, caractérisé par des polynévrites et des atrophies musculaires.
Coenzyme A (CoA)
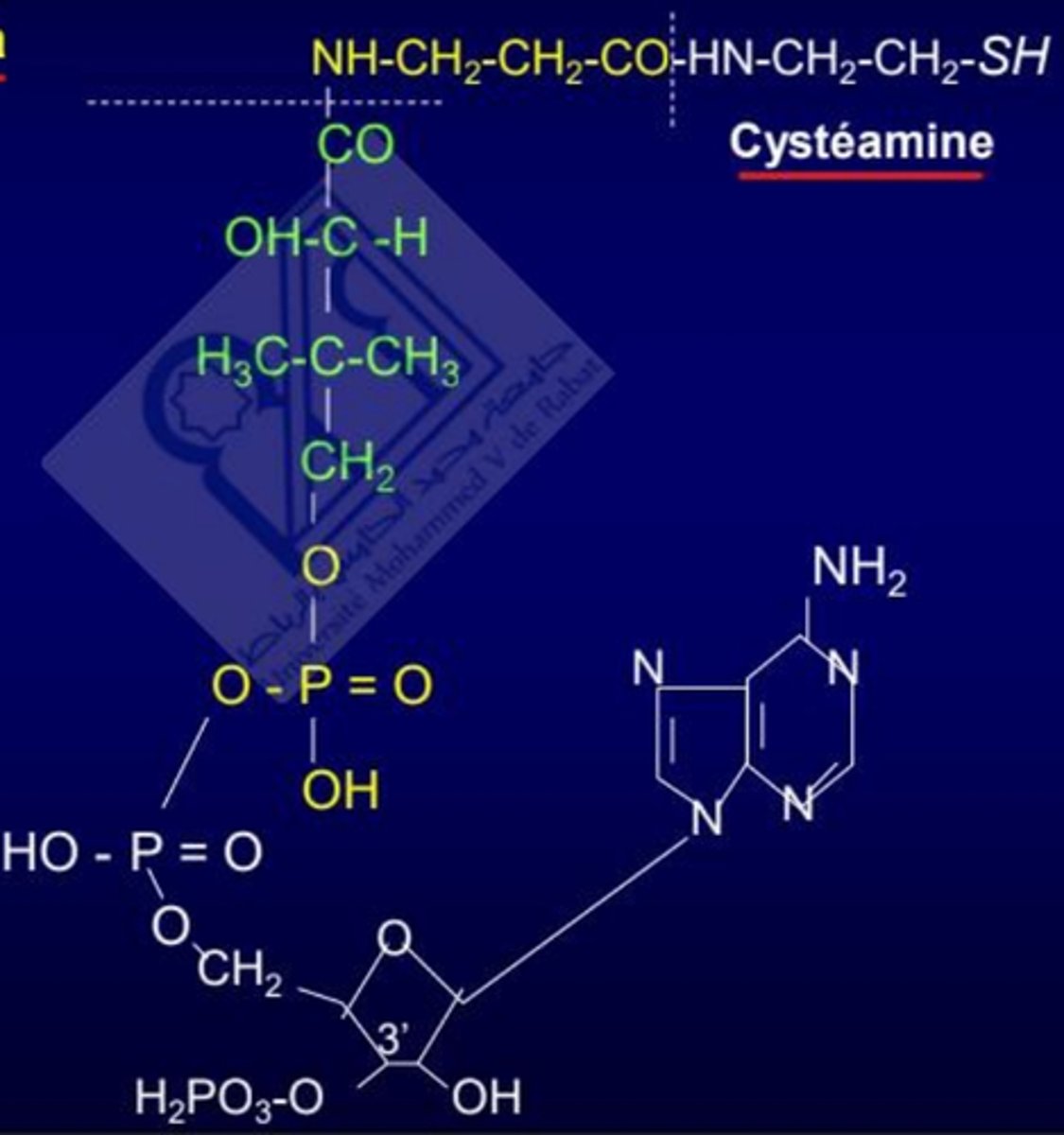
Quels sont les rôles principaux de la Coenzyme A ?
Métabolisme AG, AA, et du cholestérol
L'acide tétrahydrofolique (THF)?
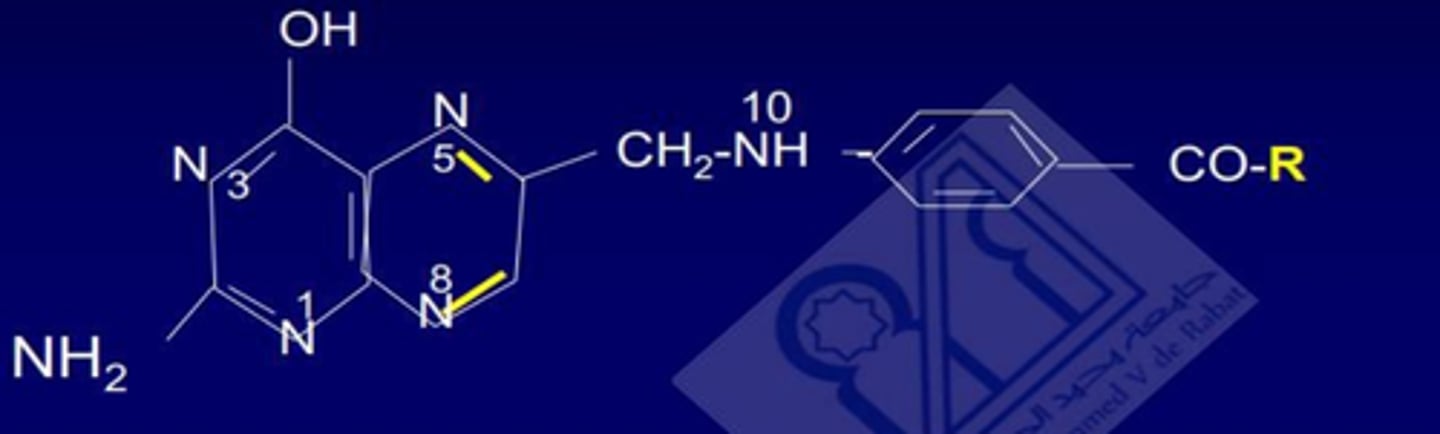
Quels sont les rôles principaux du THF ?
Synthèse des bases nucléiques (purines et pyrimidines), de la méthionine, de l'histidine, sérine et à partie de cette dernière la glycine.
Décrivez le processus de transformation de l'acide folique en THF.
contenue dans les végétaux est absorbé sous forme de polyglutamates, hydrolysé en acide monoglutamate, réduit et transformé en THF.
Quelles sont les conséquences d'une carence en acide folique et B12 ?
anémie macrocytaire.
Quels types de réactions la vitamine B12 catalyse-t-elle ?
Isomérisation par méthyl malonyl coA mutase , trans-méthylation, et réduction d'un groupement hydroxyméthyl en CH3.
Donnez un exemple de réaction impliquant la vitamine B12.
Homocystéine en Méthionine, uracile en thymine, noradrenaline en adrenaline, serine en glycocolle
Quelles sont les sources alimentaires principales de la vitamine B12 ?
Les protéines animales
Vitamine B12
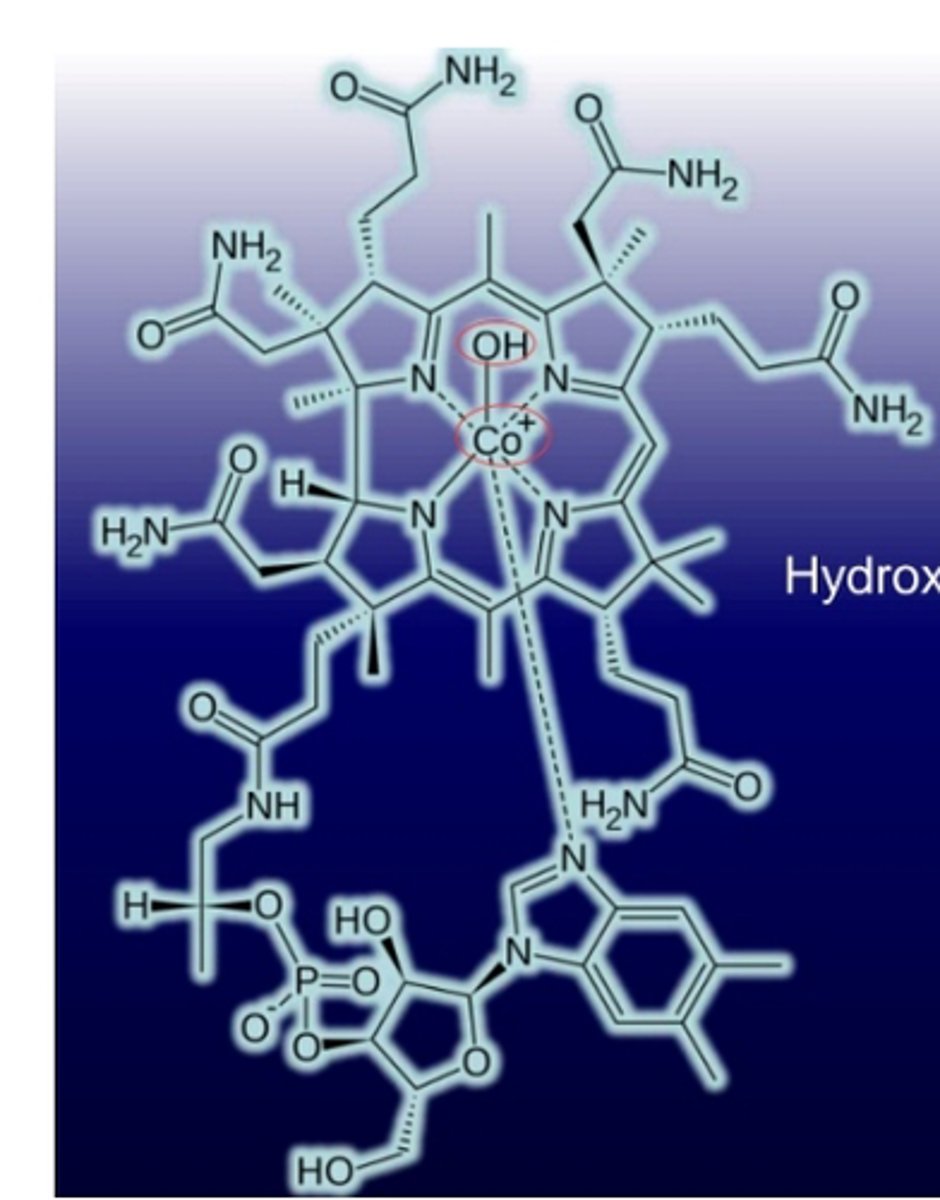
La biotine (vitamine H)
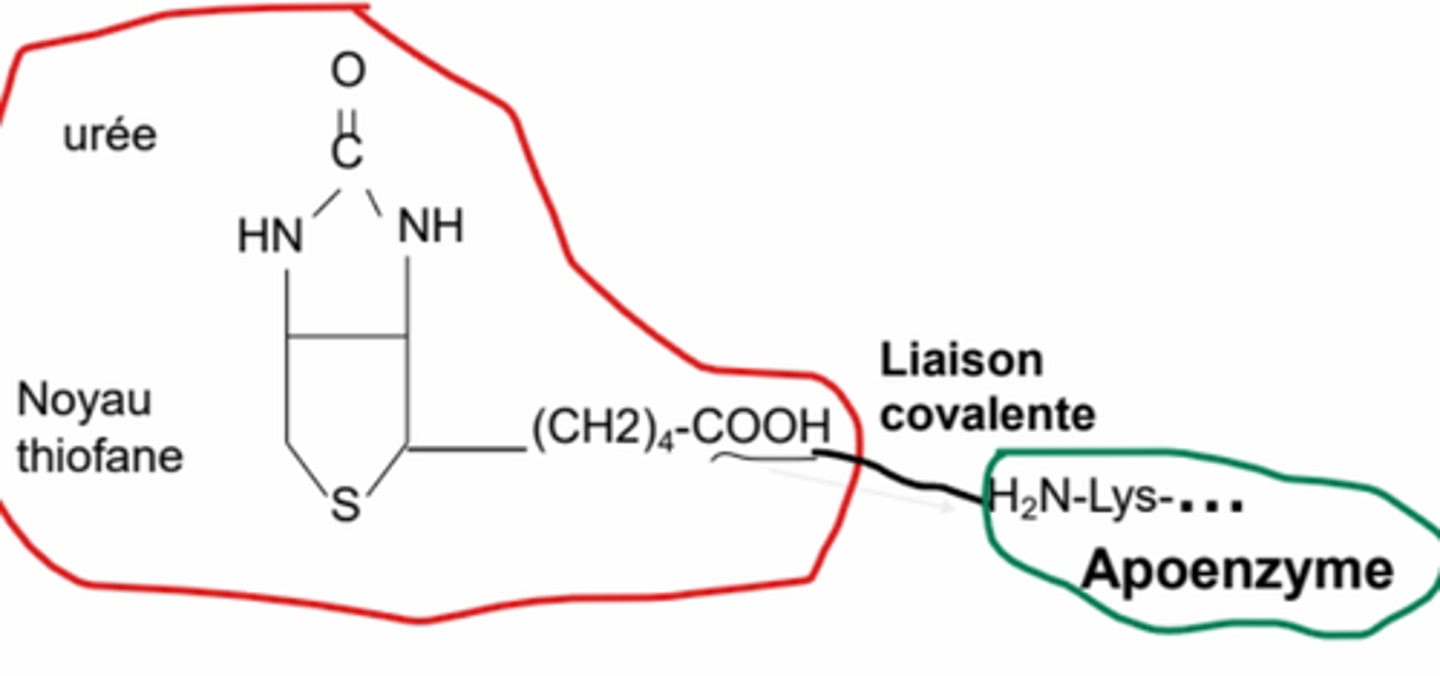
Quelles sont les réactions catalysées par la biotine ?
La transformation du propionyl-CoA en méthyl malonyl-CoA et de l'acétyl-CoA en malonyl-CoA.
Quels sont les rôles métaboliques de la biotine ?
Métabolisme AG, des glucides et des AA, ainsi que dans la biosynthèse des vitamines B9 et B12.
Quels sont les effets d'une carence en biotine ?
Une carence peut provoquer une chute des cheveux et une fragilité des ongles.
Quels sont les rôles des nucléosides di et triphosphates dans le métabolisme ?
Ils transfèrent des radicaux phosphates et servent de coenzymes pour les ligases et les transférases.
NAD+
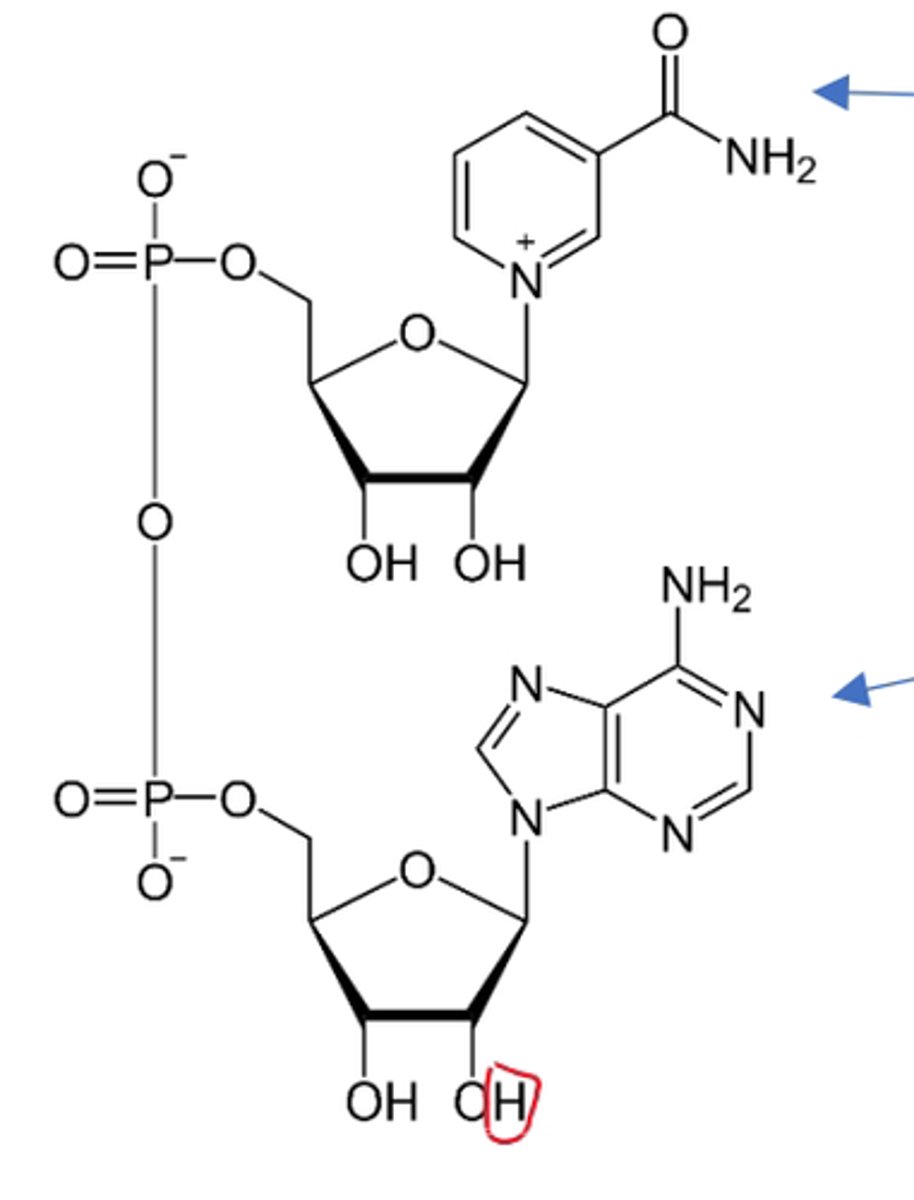
Quels sont les rôles biologiques du NADH, H+ ?
est réoxydé dans le cytoplasme par la mitochondrie via des transporteurs d'électrons et de protons (systèmes navette).
Dans quelles voies métaboliques le NADP+ intervient-il principalement ?
Voie des pentoses phosphate, où il est utilisé dans les deux premières réactions catalysées par la glucose-6-phosphate déshydrogénase et la 6-phosphogluconate déshydrogénase, ainsi que dans la synthèse des AG, du cholestérol et des hormones stéroïdes.
Quels sont les symptômes d'une avitaminose en vitamine PP ?
La pellagre, avec des signes digestifs, neuropsychiques, et cutanéo-muqueux.
Comment le NADH, H+ est-il utilisé pour doser le lactate ?
À 340 nm, une augmentation d'absorption due au NADH, H+ est proportionnelle à la quantité de lactate produite. La réaction utilise LDH et NAD+ pour laisser le lactate comme facteur limitant.
Décrivez le mode d'action des coenzymes nicotiniques.
Échange d'électrons et de protons (H+) au niveau du noyau pyridinique, agissant comme co-substrat.
Quels sont les deux modes principaux de biosynthèse des coenzymes nicotiniques ?
1/3 provient de l'apport alimentaire en nicotinamide (vitamine PP) et 2/3 de la flore intestinale. Une voie secondaire synthétise les coenzymes à partir du tryptophane.
De quoi dérivent les coenzymes flaviniques ?
Elles dérivent de la riboflavine (vitamine B2)
Quelle est l'association principale des coenzymes flaviniques avec les enzymes ?
Elles sont associées aux oxydoréductases et interviennent dans des réactions à deux substrats.
Dans quel complexe les coenzymes flaviniques jouent-elles un rôle important ?
Dans le complexe II de la chaîne respiratoire mitochondriale, notamment via les flavoprotéines comme la glycérol-3-phosphate déshydrogénase, l'acyl-CoA déshydrogénase et la succinate déshydrogénase.
structure de l'acide lipoïque ?
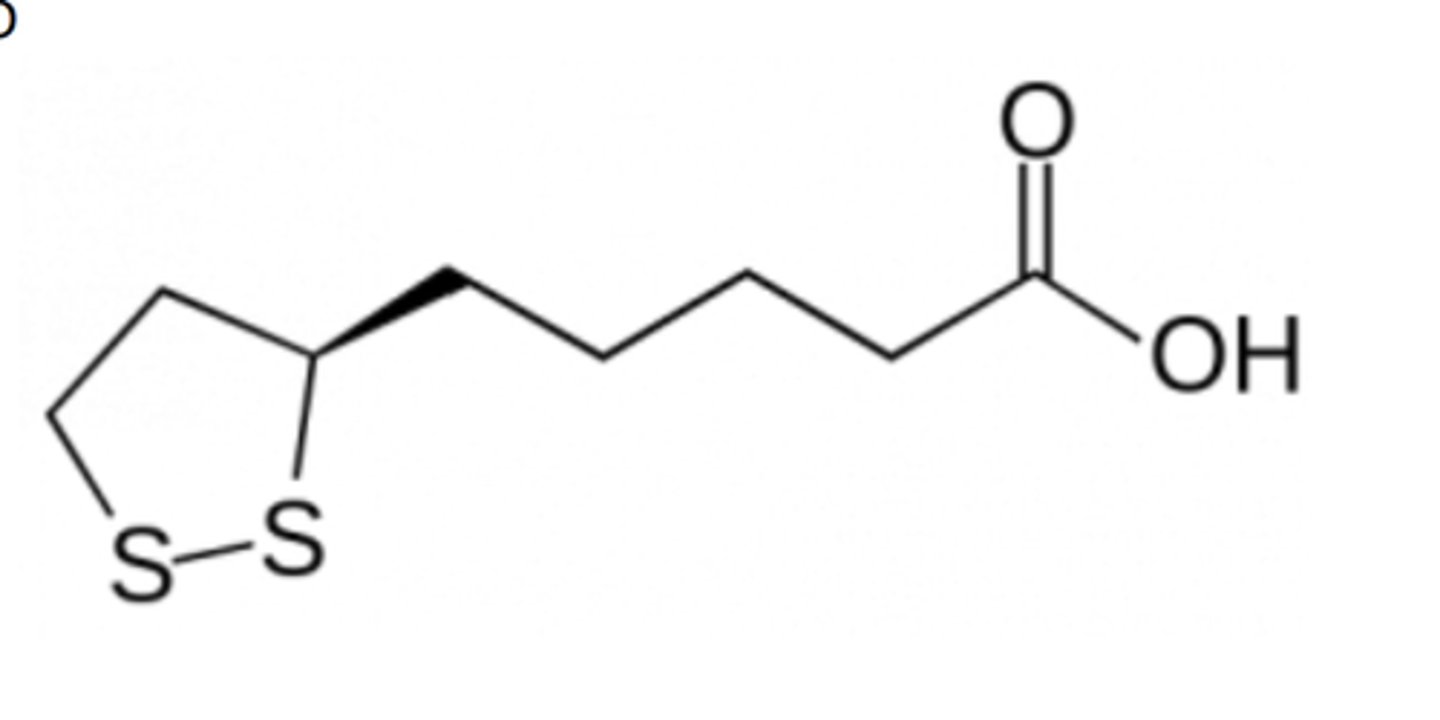
Donnez un exemple d'utilisation de l'acide lipoïque dans un système enzymatique.
La décarboxylation oxydative du pyruvate en acétyl-CoA via la pyruvate déshydrogénase.
Quels coenzymes sont impliqués dans le système de décarboxylation oxydative avec l'acide lipoïque ?
TPP, acide lipoïque (L), CoA-SH, FAD, et NAD.
Comment l'acide lipoïque est-il régénéré dans les réactions de décarboxylation oxydative ?
Par l'intervention du FAD et du NAD.
Nucléosides di et triphosphates ?
Ne dérivent pas de vitamines + cosubstrat
Riboflavine
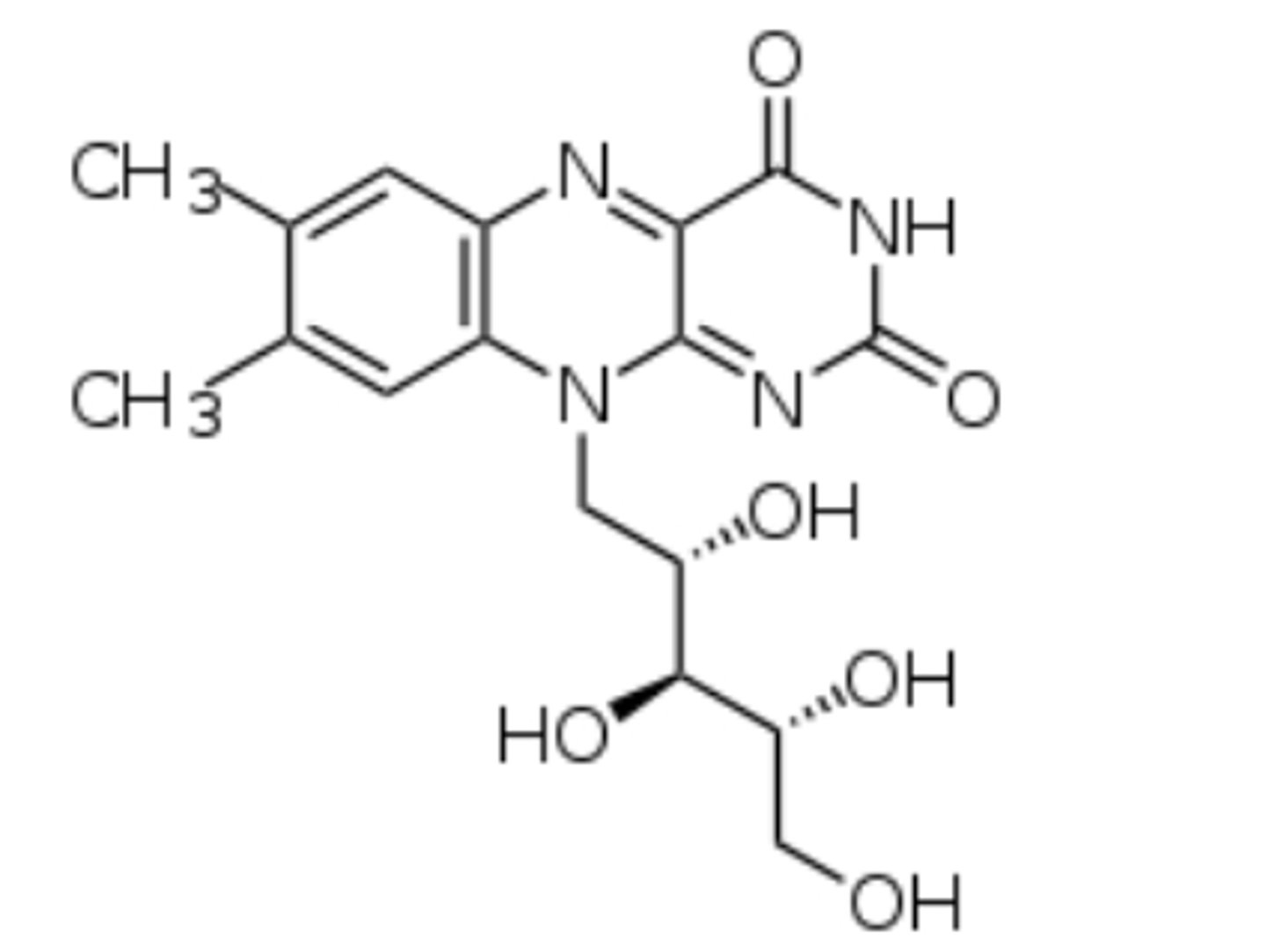
FMN
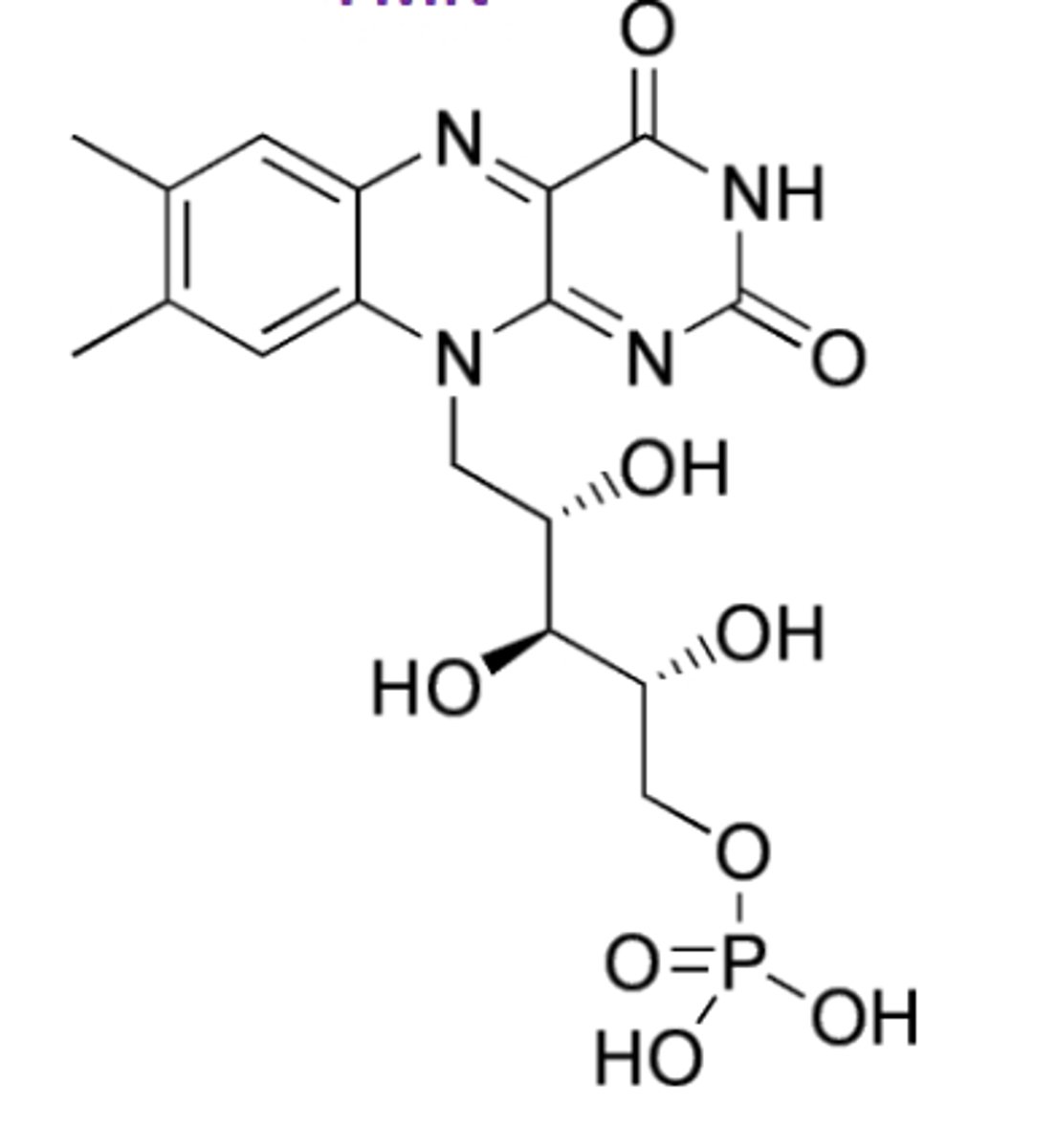
FAD
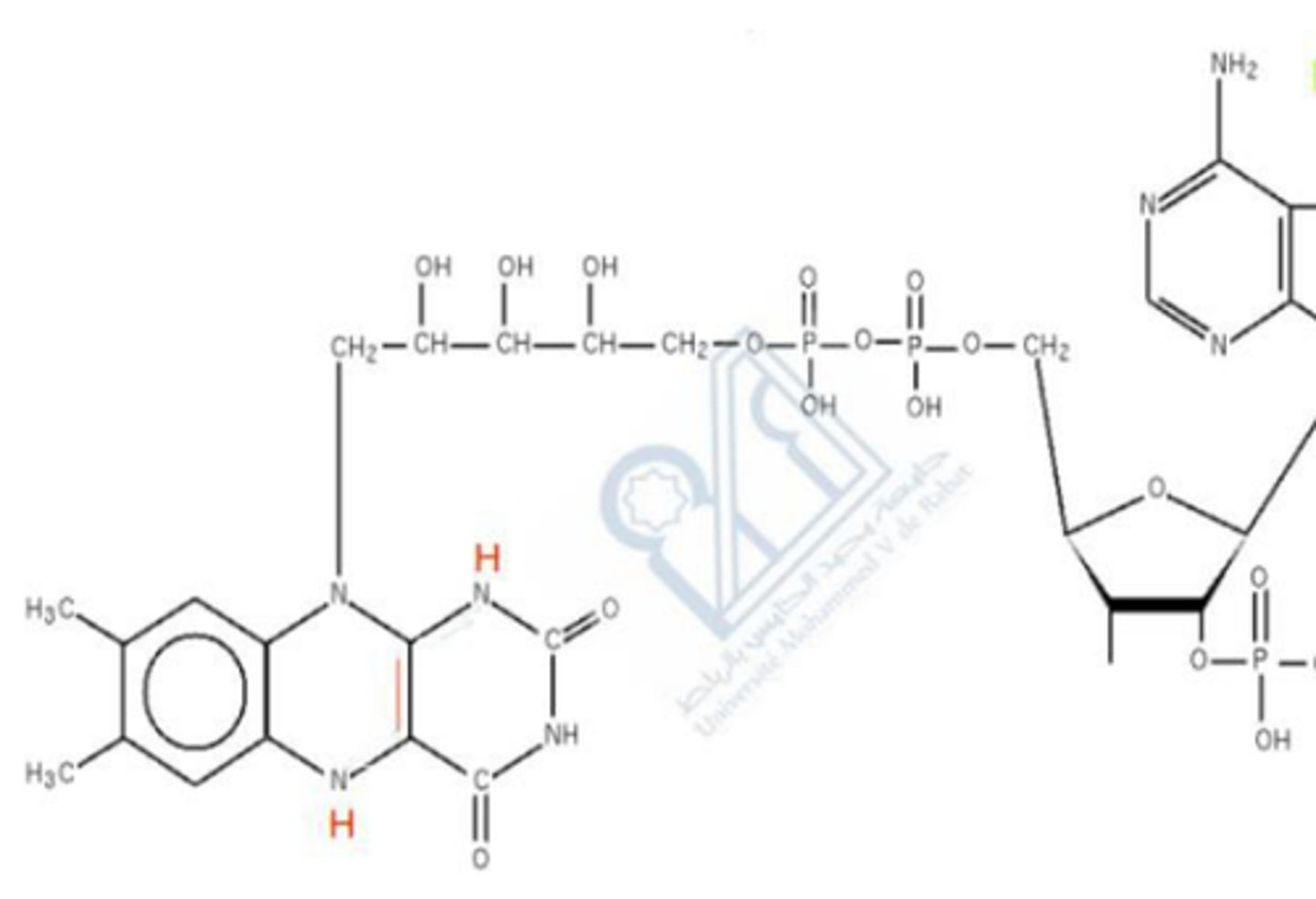
Phosphate pyridoxal
vitamine B6 hydrosoluble
Phosphate pyridoxal
Groupement prosthétique
Thiamine pyrophosphate
vitamine B1, hydrosoluble
Thiamine pyrophosphate
Groupement prosthétique
De quoi est dérivé le CoA?
L'acide pantothénique (vitamine B5), formé d'acide pantoïque et d'alanine.
CoA
Co-substrat
Tetrahydryfolate THF
L'acide folique vitamine B9
Réactions de THF
intervient dans le transfert et interconversion de groupements monocarbonés
Pourquoi la bitaline B12 est essentielle?
Elle est indispensable à la synthèse des globules rouges, à la croissance, et à la division cellulaire.
Biotine
Groupement prosthétique
Réactions de la biotine
agissant avec les carboxylases, activée par ATP
De quoi dérivent NAD et NADH,H+
Vitamine PP (Vitamine B3 ou Niacine)
NAD
Co-substrat
Acide lipoïque
Groupement prosthétique
Réactions de l'acide lipoïque
décarboxylation oxydative, avec des cycles d'ouverture et de fermeture impliquant des ponts disulfure (S-S).
Coenzymes flaviniques
Groupement prosthétique
NAD+
Il est utilisé dans de nombreuses réactions du métabolisme intermédiaire
Exemple de réaction de CoA
Activation du groument acyl (par suppression d'OH de COOH)
Ubiquinone
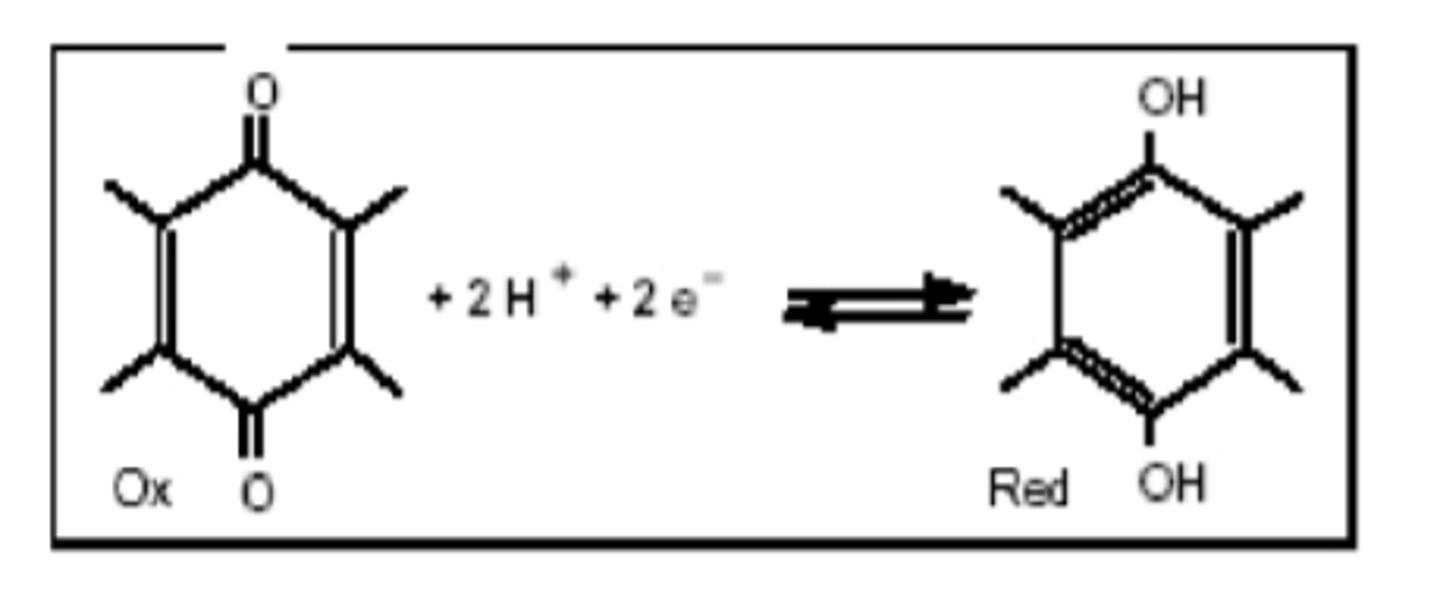
Ubiquinone
N'a pas d'origine vitaminique
cytochrome
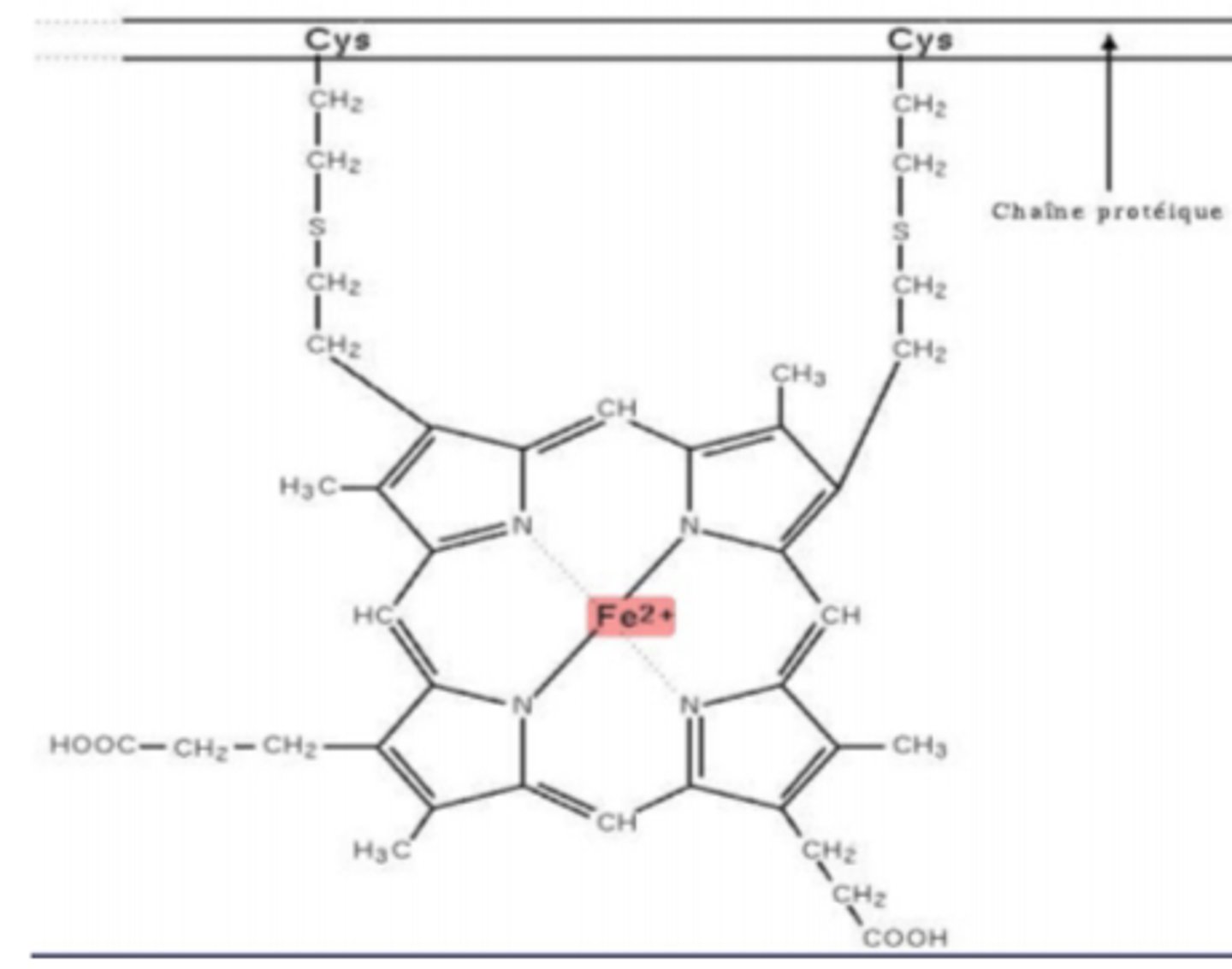
cytochrome
chromoprotéine, mb interne des mitochondrie, prend les e- des coenzymes réduits