CM2 : Les dispersions
1/38
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
39 Terms
Dispersion c’est quoi ?
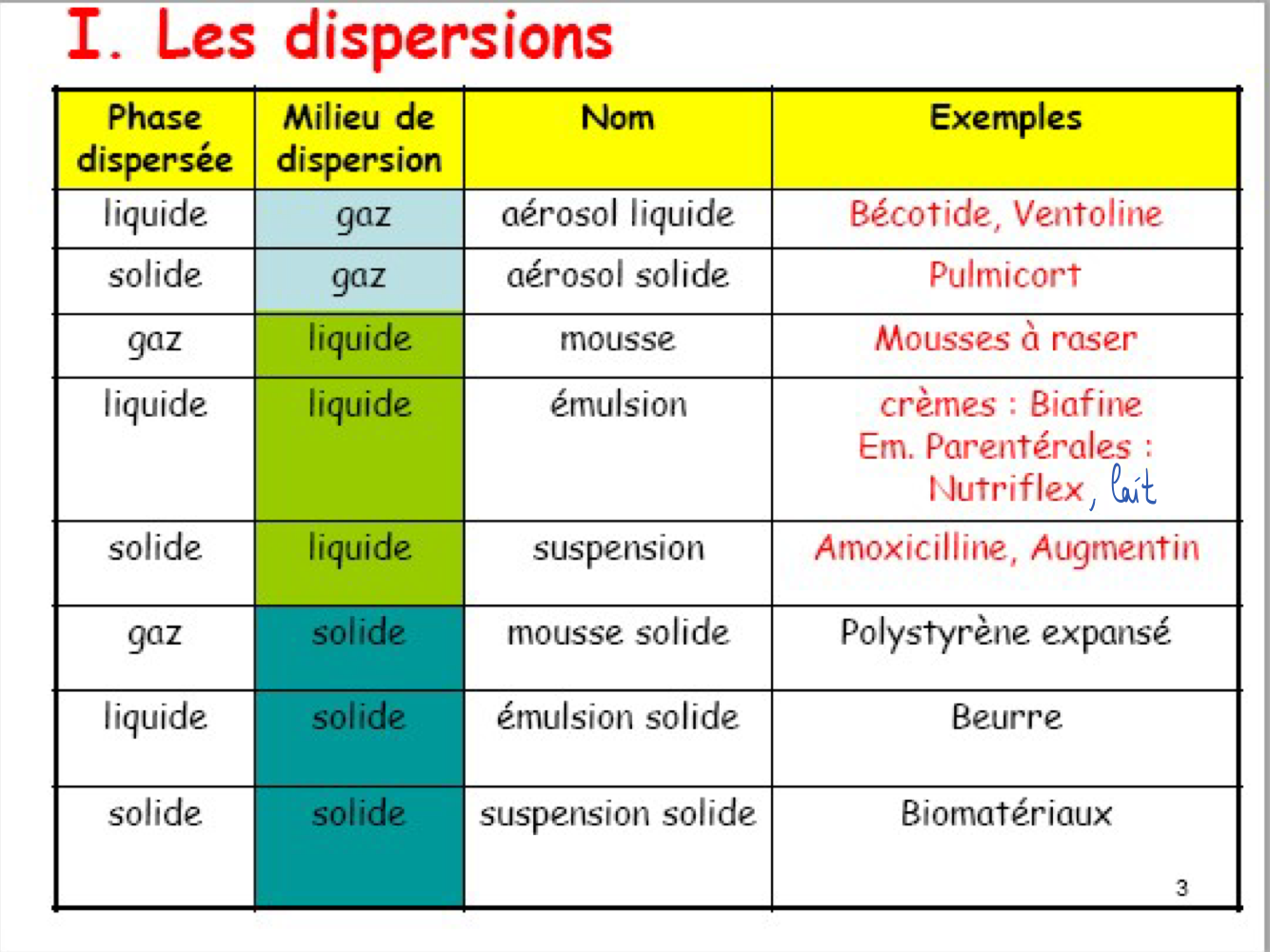
Dispersion : Coexistence de 2 phases non miscibles (particulièrement instables)
Types de dispersions ?
Émulsion
Suspension
Émulsion c’est quoi ?
Emulsion : gouttelettes de liquide dispersées dans un autre liquide non miscible
→ Peut être E/H ou H/L ou W/O (hydrophile dans lipophile) OU H/E ou L/H ou O/W (lipophile dans hydrophile)
Suspension c’est quoi ?
Suspension : particules (solides) dispersées dans un liquide (non-solvant)
Autre type de dispersions
Caractéristiques des dispersions ?
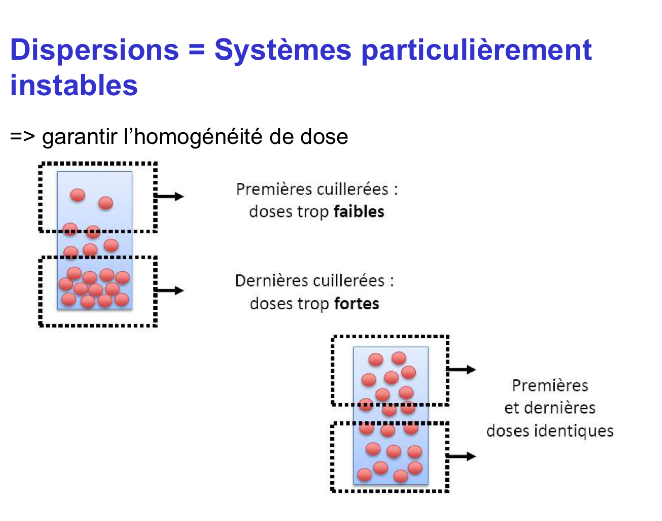
Les dispersions sont des systèmes particulièrement instables
→ Il faut garantir l’homogénéité de dose.
Si on n’agite pas la suspension avant administration, les particules sédimentées se retrouvent dans le fond. On se retrouve avec pour les premières cuillérées, des doses trop faibles et pour les dernières cuillérées des doses trop fortes.
En revanche, si on réhomogénise en agitant avant emploi, les premières et dernières doses seront identiques
Instabilité des suspensions ?
Sédimentation / Crémage
Floculation
Mûrissement d’Ostwald
Instabilité des émulsions ?
Sédimentation / crémage
Floculation
Coalescence
Inversion de phase
Formulation des dispersions ?
Formulation : toujours au moins 3 constituants de base :
Phase dispersée
Phase dispersante
Agent stabilisant
Instabilité des différents types de dispersions (récap) ?

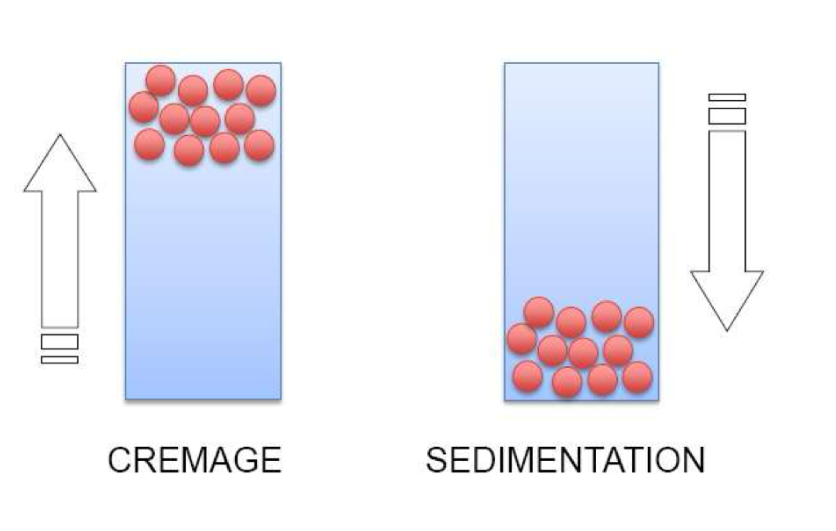
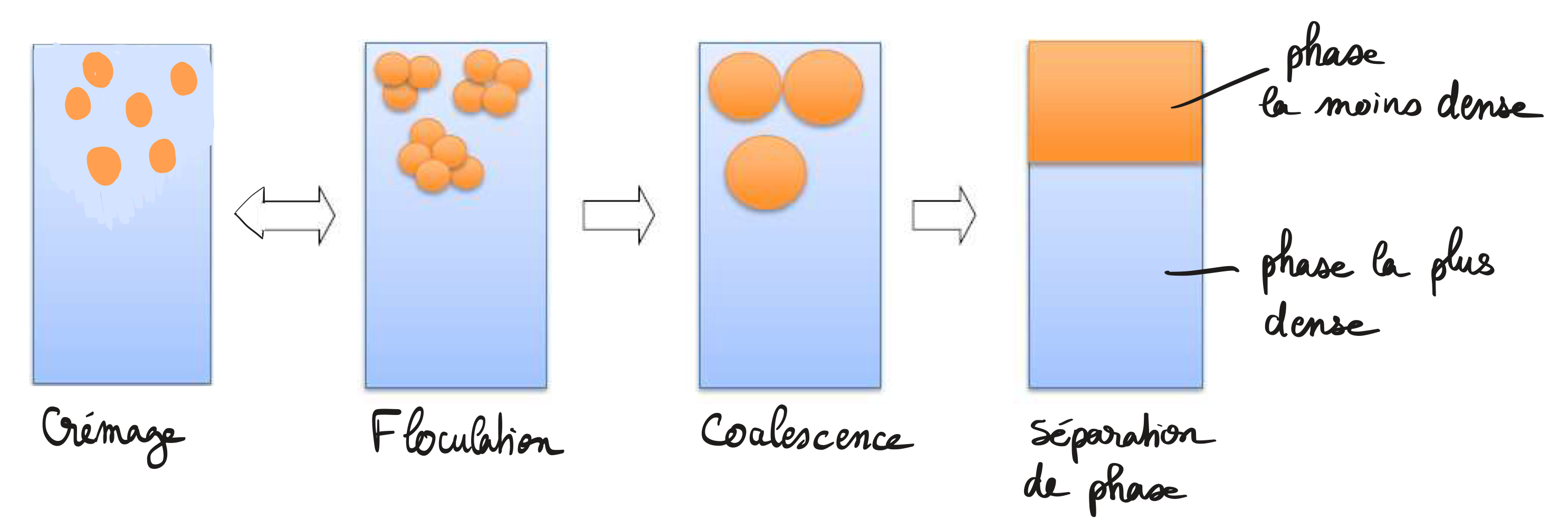
Crémage / sédimentation ?
Le crémage et la sédimentation correspondent à une séparation progressive des phases. La phase dispersive va soit remonter vers le haut parce qu’elle est moins dense (= crémage) soit va sédimenter vers le bas (= sédimentation)
Concernent toutes les formes dispersées
Sont réversibles par agitation
Quels sont les facteurs influant le crémage et la sédimentation ?
Le crémage et la sédimentation sont influés par la loi de STOKES.
Formule :
V = vitesse de sédimentation ou de crémage → Plus la vitesse est haute, plus la vitesse de crémage ou de sédimentation sera élevée. Cette vitesse dépend de plusieurs facteurs :
r = rayon des particules dispersées
Différence entre la masse volumique de la phase dispersée ρ et la masse volumique de la phase dispersante ρ1
De la viscosité de la phase disperSANTE η
De l’accélération de la pesanteur g

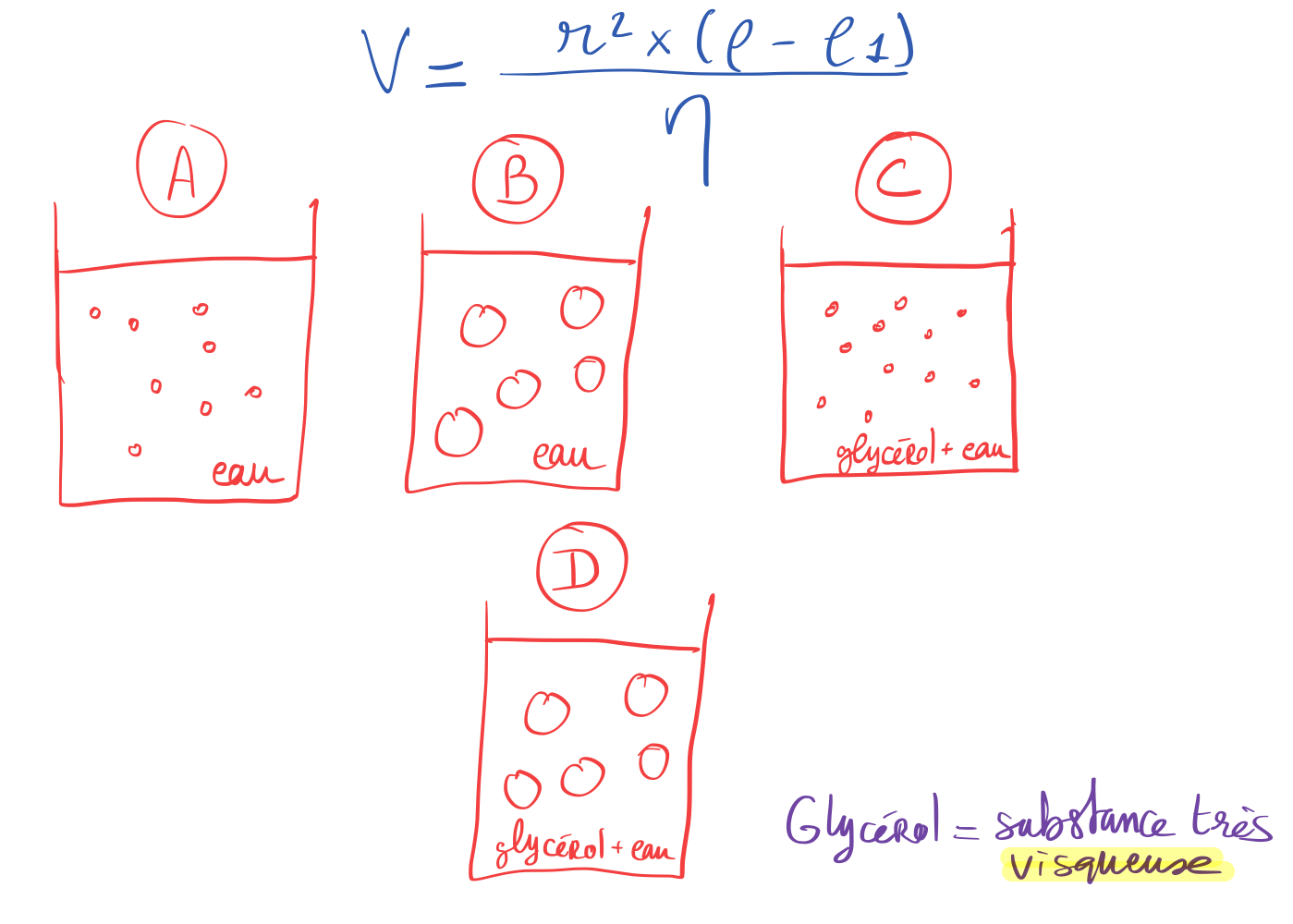
Exemple : ici quelle est la forme la plus stable (classement) ?
Compte tenu de la formule de la loi de STOKES (il faut que la vitesse V soit faible) :
C (particules petites + viscosité importante) > D (particules grandes + viscosité importante) > A (particules petites + viscosité faible) > B (particules grandes + viscosité faible)
Entre la A et D, c’est compliqué de dire laquelle est la plus stable sans valeur
Compte tenu de ce qu’on sait sur crémage et sédimentation, quelle formulation pour les suspensions ?
Si on veut une suspension plus stable, il y a 3 stratégies :
Diminution de r = taille des éléments dispersés
Diminution de (d1 - d2) = densités aussi proches que possible
Augmentation de η , viscosité de la phase dispersante → Ajout d’agents viscosifiants
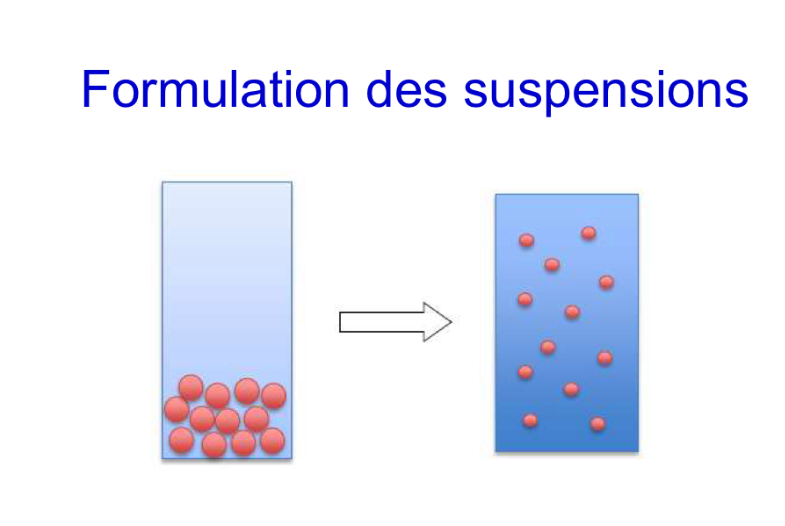
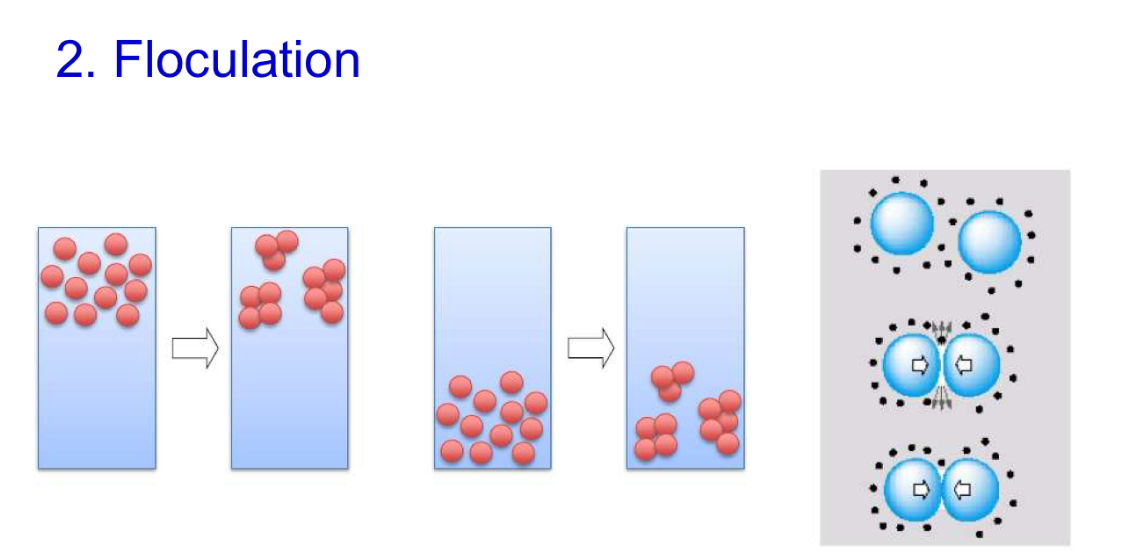
Floculation ?
Floculation = apparition d’INTERACTIONS entre les éléments dispersés préalablement rassemblés par la sédimentation (ou crémage)
Concerne TOUTES les formes dispersées
Est REVERSIBLE par agitation
Murissement d’Ostwald ?
Mûrissement d’Ostwald = Croissance des cristaux en suspension
Concerne SEULEMENT les suspensions
Est IRRÉVERSIBLE
Explication du mûrissement d’Ostwald ?
Explication : Dans la suspension, on des particules solides de taille hétérogène : certaines particules sont petites, d’autres plus grosses. En raison d’un choc cinétique, d’un changement physico-chimique : un changement de pH ou une hausse de température, les particules les plus petites vont pouvoir se dissoudre dans la phase dispersante ce qui n’était pas le cas avant. Les bouts dissous sont attirés par les grosses particules et vont s’y coller → grosses particules deviennent encore plus grosses → problème de biodisponibilité car les gros cristaux se dissolvent plus lentement dans le milieu gastrique pour la forme orale et très dangereux pour la forme IV (peut boucher des veines…)
Conséquences du mûrissement d’Ostwald ?
Conséquences du mûrissement d’Ostwald :
Risque de sédimentation, de floculation accrus
Modification de la cinétique de dissolution (modification de la mise à disposition)
Rejet du lot : hors spécifications requises
Comment lutter contre le mûrissement d’Ostwald ?
Réduire et homogénéiser la taille des globules
Ajouter des agents de surface réduisant l’Energie de surface
Réduire amplitudes thermiques (éviter les changements de température pendant le stockage, les étapes de fabrication : stérilisation…) car risque de murissement pendant la conservation
Coalescence ?
Coalescence = FUSION des éléments floculés → Conduit à l’étape ultime : la séparation de phase
ne concerne donc que les phases dispersées FLUIDES (émulsions, mousses...)
Est IRRÉVERSIBLE
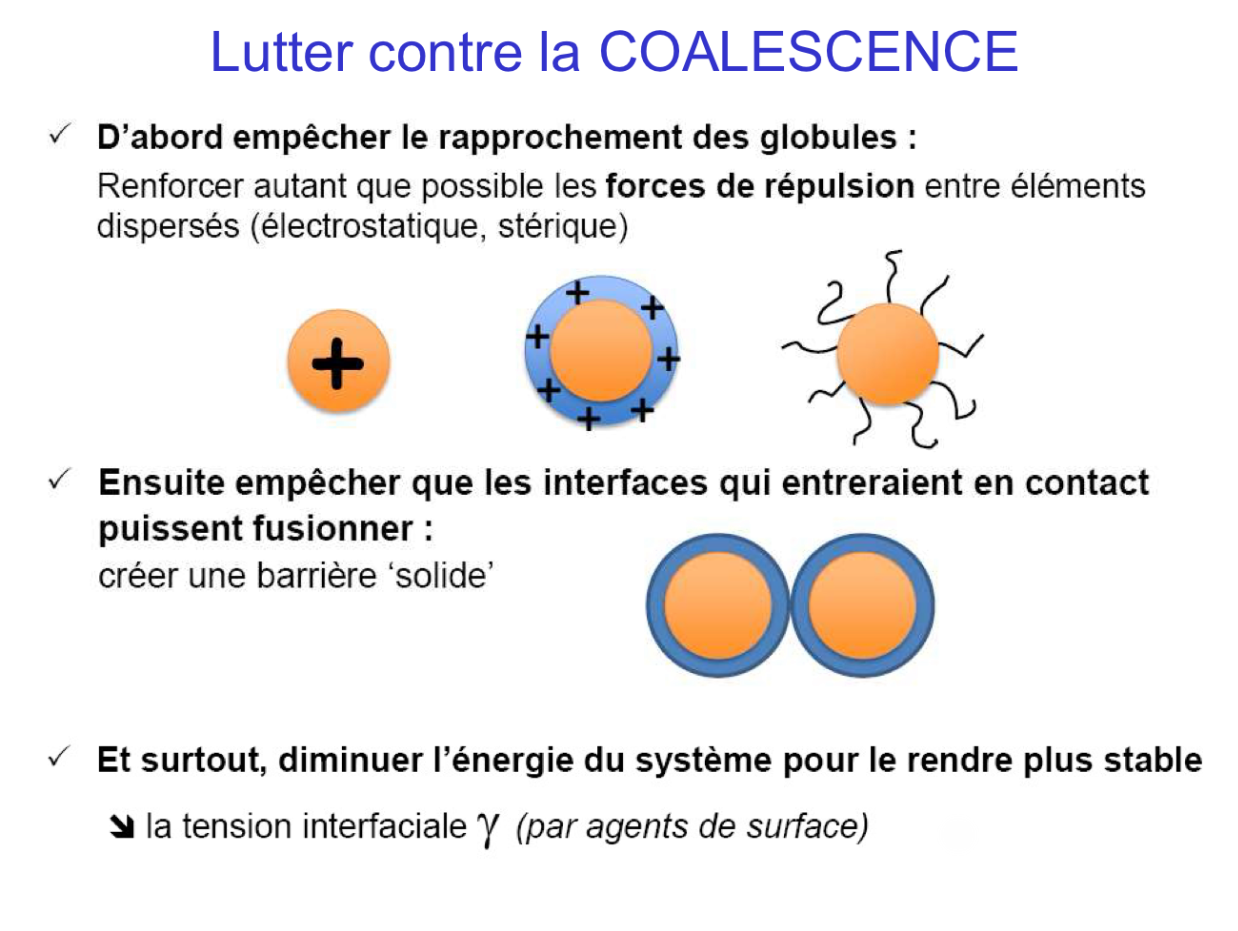
Comment lutter contre la coalescence ?
D'abord empêcher le rapprochement des globules :
Renforcer autant que possible les forces de répulsion entre éléments dispersés (électrostatique (on rajoute des électrolytes), stérique (comme des polymères hydrosolubles qui vont se mettre autour des globules)
Ensuite empêcher que les interfaces qui entreraient en contact puissent fusionner : Créer une barrière « solide »
Et surtout, diminuer l'énergie du système pour le rendre plus stable
Diminuer la tension interfaciale γ (par agents de surface)
Tension interfaciale γ ?
Augmentation de γ avec :
Chaleur
Dégradation chimique : modification pH, interactions excipients
TEMPS → conditions de conservation + durée limite
Diminution de γ avec :
Agents de surface (tensioactifs)

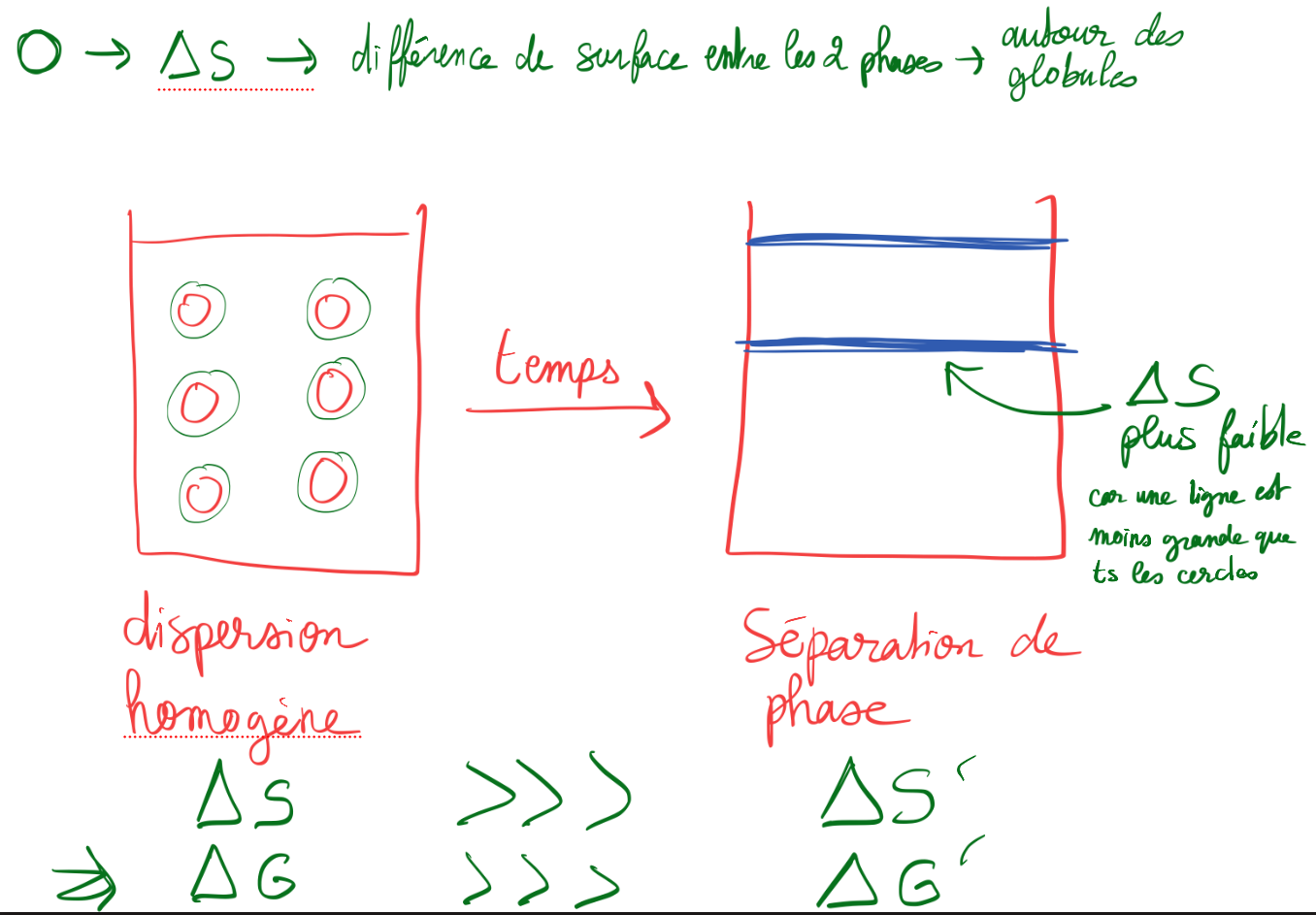
Explication schématique de la coalescence + intérêt d’un tensioactif ?
Si on ajoute des agents de surface comme les micelles, les tensioactifs se mettent autour de chaque globule et réduisent l’énergie du système
Tension interfaciale de l’eau = 50 mN/mètre
Tension interfaciale + tensioactif = 20 mN/mètre → énergie plus faible → plus stable → favorable → donc on reste plus longtemps dans la forme normale
* Tension interfaciale = tension à l’interface entre la phase dispersée et la phase dispersante
Inversion de phase ?
Inversion de phase : la phase dispersée, très abondante, devient la phase dispersante (>75%, voire 90%)
La phase dispersée devient en fait encore plus abondante que ce qu’elle était déjà parce qu’il y a par exemple une évaporation de notre phase aqueuse
Arrive très rarement (souvent dû à un choc brutal de température ou de cinétique)
Ne concerne que les phases dispersées FLUIDES (émulsions, mousses...)
Est IRREVERSIBLE
Résumé : Stratégie de formulation des suspensions ?

Résumé : Stratégie de formulation des émulsions ?

Types d’agents épaississants ?
Agents épaississants hydrophiles
Agents épaississants lipophiles
Agents épaississants hydrophiles ?
Les agents épaississants hydrophiles sont utilisés pour épaissir les phases aqueuses des émulsions L / H et des suspensions :
dérivés cellulosiques : méthylcellulose,carboxyméthylcellulose sodique
PEG
protéines
polyosides
Carbopols
Agents épaississants lipophiles ?
Les agents épaississants lipophiles sont utilisés pour épaissir les phases huileuses des émulsions H / L et des suspensions
Silicones
Cires
Agents de surface : autres noms ?
Dénominations générales de même signification : agent de surface, surfactif, tensio-actif → = agent qui va diminuer la tension de surface entre les deux phases : phase dispersée et dispersante
Propriétés particulières qui différencient les différents agents de surface ?
Propriétés particulières qui les différencient : émulsionnants, détergents, mouillants, solubilisants, antimoussants,… → Ce sont des agents de surface qui ont une propriété en plus dans la formulation que seulement être un agent de surface
Classement des agents de surface ?
Les agents de surface sont classés en :
Anioniques
Cationiques
Amphotères (anioniques et cationiques)
Non ioniques
Polymères
Règles générales d’association des agents de surface ?
Anioniques n’agissent qu’en milieu alcalin
Cationiques n’agissent qu’en milieu acide
Anioniques et cationiques incompatibles
Non ioniques compatibles avec tous les émulsionnants, avec tous les autres types d’agents de surface
Savons alcalins sensibles aux sels dissous (calcium)
Propriétés particulières des agents de surface ?
Anioniques les plus irritants
Cationiques antiseptiques (crèmes cutanées)
Non ioniques les plus employés, ce sont les moins irritants et les plus polyvalents
Agents de surface qui ont le meilleur impact environnemental → ceux qui ont une liaison ester biodégradable
Comment choisit-on un agent de surface ?
On choisit un agent de surface en fonction de notre phase dispersante. Si notre phase dispersante est huileuse, on va choisir un agent de surface huileux aussi et inversement → Notion de HLB
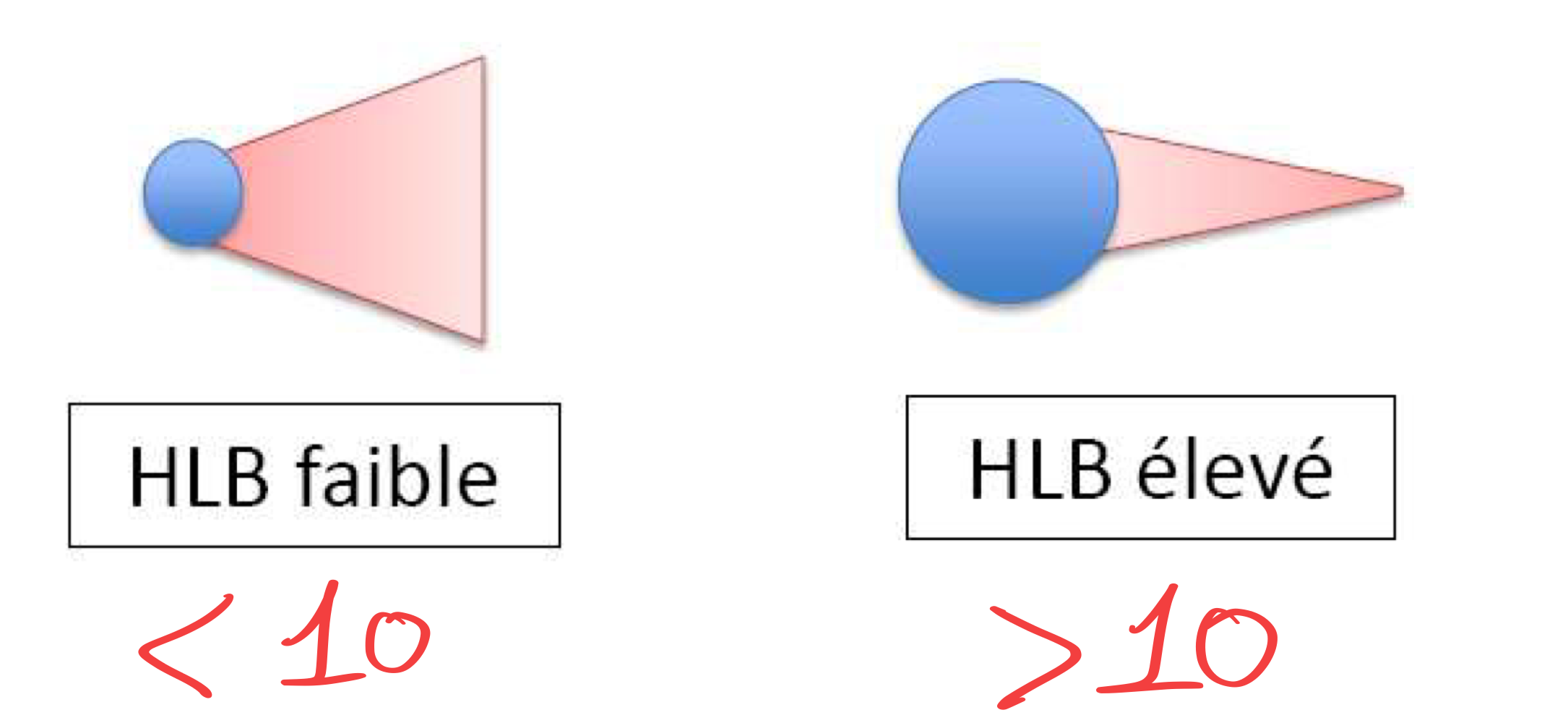
Notion de HLB ?
HLB : Hydrophile Lipophile Balance
→ HLB représente la tendance hydrophile ou lipophile d’un agent de surface. Plus le HLB est haut, plus le tensioactifs a des propriétés hydrophiles.
Echelle de 1 à 40 illustrant le « poids » du groupement hydrophile
Equilibré si = 10
Formules HLB ?


Exo : cas clinique ?
