Chimie organique
5.0(1)
5.0(1)
Card Sorting
1/36
Earn XP
Description and Tags
Study Analytics
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
37 Terms
1
New cards
Pourquoi le C est à l’origine d’un si grand nombre de composés (>106) ?
1. Formation de chaînes de longueur quelconque (le seul capable avec le soufre et le silicium).
2. Formation d’une liaison stable avec l’hydrogène (qui surtout n’est pas décomposée par l’eau).
3. Capacité de former des liaisons avec un grand nombre d’autres éléments. De plus peu de préférence pour un certain élément (contrairement au silicium qui a une préférence pour l’oxygène).
4. Formation de liaisons multiples avec un atome identique et avec d’autres
éléments (le seul capable avec l’azote et l’oxygène)
2. Formation d’une liaison stable avec l’hydrogène (qui surtout n’est pas décomposée par l’eau).
3. Capacité de former des liaisons avec un grand nombre d’autres éléments. De plus peu de préférence pour un certain élément (contrairement au silicium qui a une préférence pour l’oxygène).
4. Formation de liaisons multiples avec un atome identique et avec d’autres
éléments (le seul capable avec l’azote et l’oxygène)
2
New cards
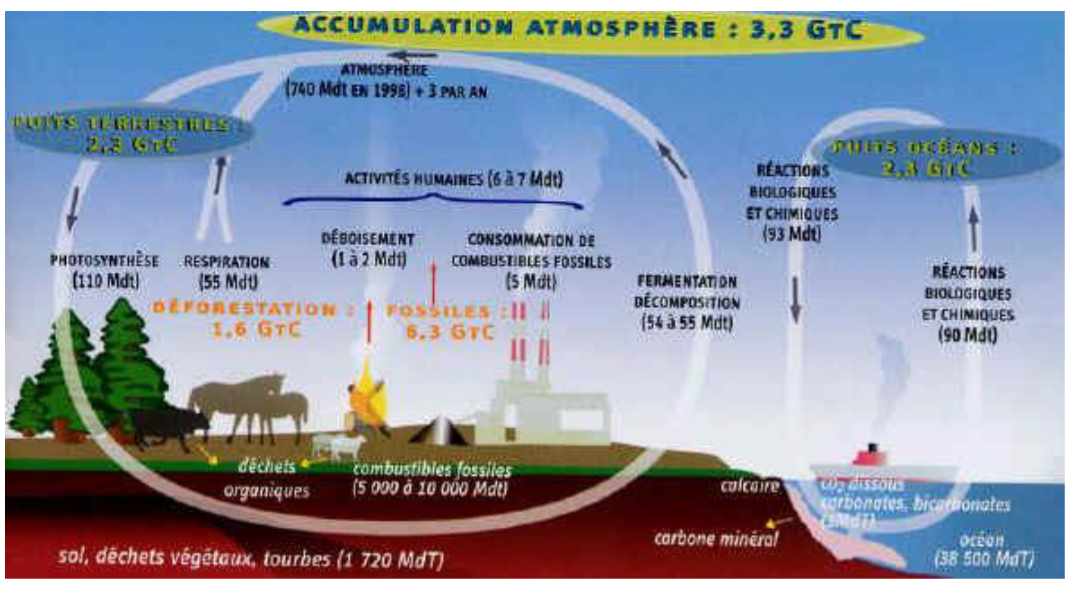
4 processus importants du cycle du carbone
1) Respiration
2) Combustion
3) Photosynthèse
4) Décomposition -> Pétrole !!!!
2) Combustion
3) Photosynthèse
4) Décomposition -> Pétrole !!!!
3
New cards
C'est quoi le pétrole ? Formation?
1. Combustible fossile composé d'hydrocarbures et d'origine animale ou végétale (on le trouve dans les offshores)
2. haute pression, température élevée, (anaérobie: peu d'oxygène)
2. haute pression, température élevée, (anaérobie: peu d'oxygène)
4
New cards
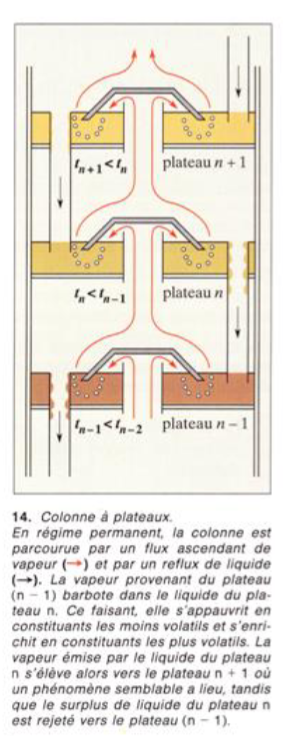
Principe d'une tour de distillation
3. séparer un mélange ( pétrole brut) en jouant sur les températures -> "plateau"
5
New cards
4. Quels sont les problèmes de combustion d’hydrocarbures ?
5. Connaissez-vous de nouveaux carburants qui remplacent ou pourraient remplacer la benzine ?
5. Connaissez-vous de nouveaux carburants qui remplacent ou pourraient remplacer la benzine ?
4. pollution, accumulation de CO2 ("gaz à effet de serre"), pluie acide
5. Hydrogène, électrique, Biogaz, Solaire
5. Hydrogène, électrique, Biogaz, Solaire
6
New cards
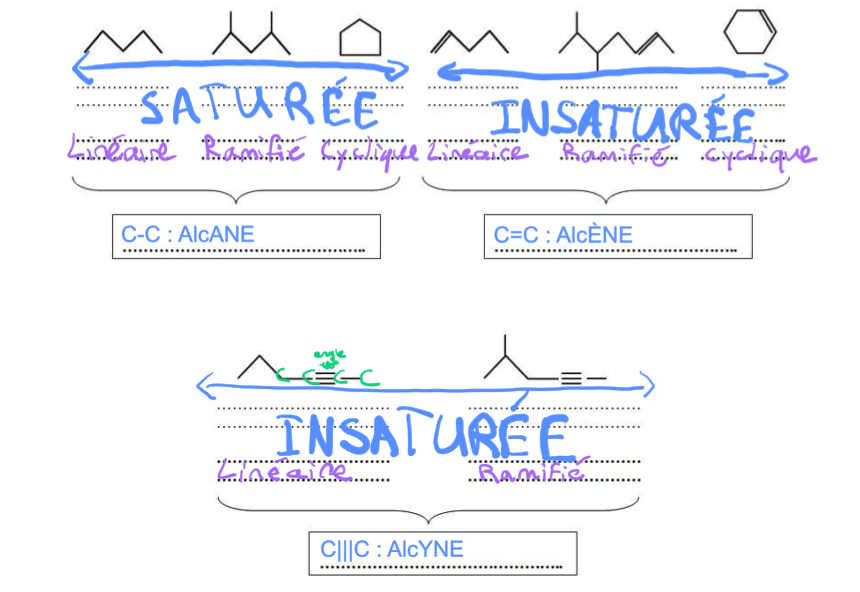
Hydrocarbures
Les hydrocarbures sont des molécules ne comprenant que des atomes de carbone (C) et d’hydrogène (H). Ils possèdent en conséquence une formule brute de type :
CnHm, où n et m sont deux entiers naturels
saturés: ALCANE: linéaire, ramifié, cyclique
insaturés: ALCÈNE: linéaire, ramifié, cyclique; ALCYNE: linéaire, ramifié
CnHm, où n et m sont deux entiers naturels
saturés: ALCANE: linéaire, ramifié, cyclique
insaturés: ALCÈNE: linéaire, ramifié, cyclique; ALCYNE: linéaire, ramifié
7
New cards
Isomères
Les molécules de même formule brute mais dont les formules de structure sont différentes s’appellent isomères.
8
New cards
Fomule 3D
9
New cards
Formule développée / de Lewis
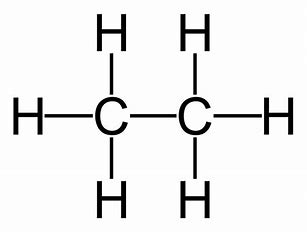
10
New cards
Formule semi-développée
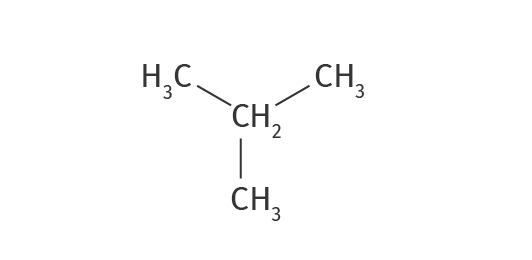
11
New cards
Formule schématique / zig zag
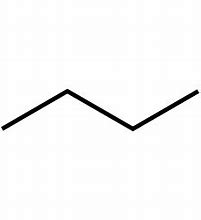
12
New cards
Règles pour déterminer la formule brute d'un hydrocarbure
1) Compter le nbr de C -> utiliser la formule CnH2n+2 (n=nbr de Carbone)
2) Compter le nbr de C=C -> par C=C, -2H à la formule générale
3) Compter le nbr de C|||C -> par C|||C, -4H à la formule générale
4) Compter le nbr de cycle -> par cycle, -2H à la formule générale
2) Compter le nbr de C=C -> par C=C, -2H à la formule générale
3) Compter le nbr de C|||C -> par C|||C, -4H à la formule générale
4) Compter le nbr de cycle -> par cycle, -2H à la formule générale
13
New cards
NOMENCLATURE
MÉTHode Étonnante Pour Bien pigé !
C1 méth-
C2 éth-
C3 prop-
C4 but-
C5 pent-
C6 hex-
C7 hept-
C8 oct-
C9 non-
C10 déc-
C11 undéc-
C12 dodéc-
C13 tridéc-
C14 tetradéc-
C15 pentadéc-
C20 iecos-
C21 heneicos-
C22 docos-
C23 tricos-
C30 triacont-
C35 petatiacont-
C40 tétracont-
C1 méth-
C2 éth-
C3 prop-
C4 but-
C5 pent-
C6 hex-
C7 hept-
C8 oct-
C9 non-
C10 déc-
C11 undéc-
C12 dodéc-
C13 tridéc-
C14 tetradéc-
C15 pentadéc-
C20 iecos-
C21 heneicos-
C22 docos-
C23 tricos-
C30 triacont-
C35 petatiacont-
C40 tétracont-
14
New cards
Règles pour la nomenclature
1) Chercher la chaîne la plus longue -> chaîne principale ! 7C -> heptane (nom principal)
2) la nom principal est précédé par celui des ramifications et dans l'ordre alphabétique !
éthyl- méthyl
3) il faut indiquer les nombre de ramifications en fonction de la longueurs de celle-ci
2x éthyl 3x méthyl diéthyl - triméthyl (4x = tetra)
4) il faut indiquer la position exacte de toutes les ramifications ! (numéroter les C de la chaîne principale)
4,4 diéthyl-3,3,5 triméthylheptane (C14H30)
ATTENTION! la somme des ramifications de position la plus petite possible (non pas 4,4 diéthyl-3,5,5 triméthylheptane)
2) la nom principal est précédé par celui des ramifications et dans l'ordre alphabétique !
éthyl- méthyl
3) il faut indiquer les nombre de ramifications en fonction de la longueurs de celle-ci
2x éthyl 3x méthyl diéthyl - triméthyl (4x = tetra)
4) il faut indiquer la position exacte de toutes les ramifications ! (numéroter les C de la chaîne principale)
4,4 diéthyl-3,3,5 triméthylheptane (C14H30)
ATTENTION! la somme des ramifications de position la plus petite possible (non pas 4,4 diéthyl-3,5,5 triméthylheptane)
15
New cards
Pour les alcanes cycliques
Les règles de nomenclatures sont les mêmes que pour les composés non-cycliques, la seule différence est que le préfixe "cyclo" est rajouté dans le nom.
16
New cards
Les Alcanes:
sont caractérisés par une grande inertie chimique à température ambiante. Cependant, à des températures plus élevées ou sous l’action de la lumière, deux types de réactions sont possibles: Combustion et Halogénation
17
New cards
Combustion
combustion complète: Réactif + O2 --> CO2 + H2O => si pas indiqué alors c'est ça combustion incomplète: Réactif + O2(peu) --> (CO2) + H2O + CO->dangereux *
*Produire de l'énergie !! -> produit plus stable ! (moins d'énergie (réaction d'oxydoréduction)
Formule générale de combustion des alcanes
CnHn+2 + 3n+1/2 O2 --> nCO2 + (n + 1)H2O
*Produire de l'énergie !! -> produit plus stable ! (moins d'énergie (réaction d'oxydoréduction)
Formule générale de combustion des alcanes
CnHn+2 + 3n+1/2 O2 --> nCO2 + (n + 1)H2O
18
New cards
Halogénation
Réaction de substitution -> alcane
"remplacer" un H de l'alcane par un halogène
"remplacer" un H de l'alcane par un halogène
19
New cards
les Alcènes
-terminaison en ÈNE dans le nom
-> ! indiquer la POSITION de la C=C
-indiquer le nbr de C=C (di, tri, tétra, …)
-la C=C doit toujours faire partie de la chaîne la plus longue
-> ! indiquer la POSITION de la C=C
-indiquer le nbr de C=C (di, tri, tétra, …)
-la C=C doit toujours faire partie de la chaîne la plus longue
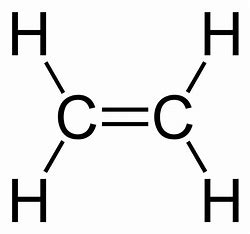
20
New cards
les Alcènes:
21
New cards
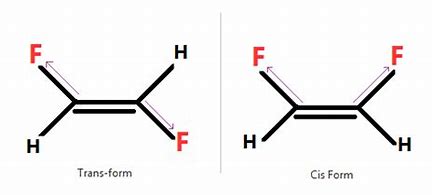
Géometrie:
la double liaison C = C ainsi que les deux simples liaisons aboutissent à chaque carbone sont dans un même plan.
la double liaison C = C ainsi que les deux simples liaisons aboutissent à chaque carbone sont dans un même plan.
Contrairement aux simples liaisons C – C qui possèdent une possibilité de rotation, les doubles liaisons C = C sont rigides de sorte que des stréréoisomères (isomères dans l’espace) sont possibles.
cis/zusammen: du même côté
trans/entgegen: de côté différents
cis/zusammen: du même côté
trans/entgegen: de côté différents
22
New cards
groupements alkyles
vinyl (groupement): CH = CH2
allyl (ramification): CH2 - CH =CH2
allyl (ramification): CH2 - CH =CH2
23
New cards
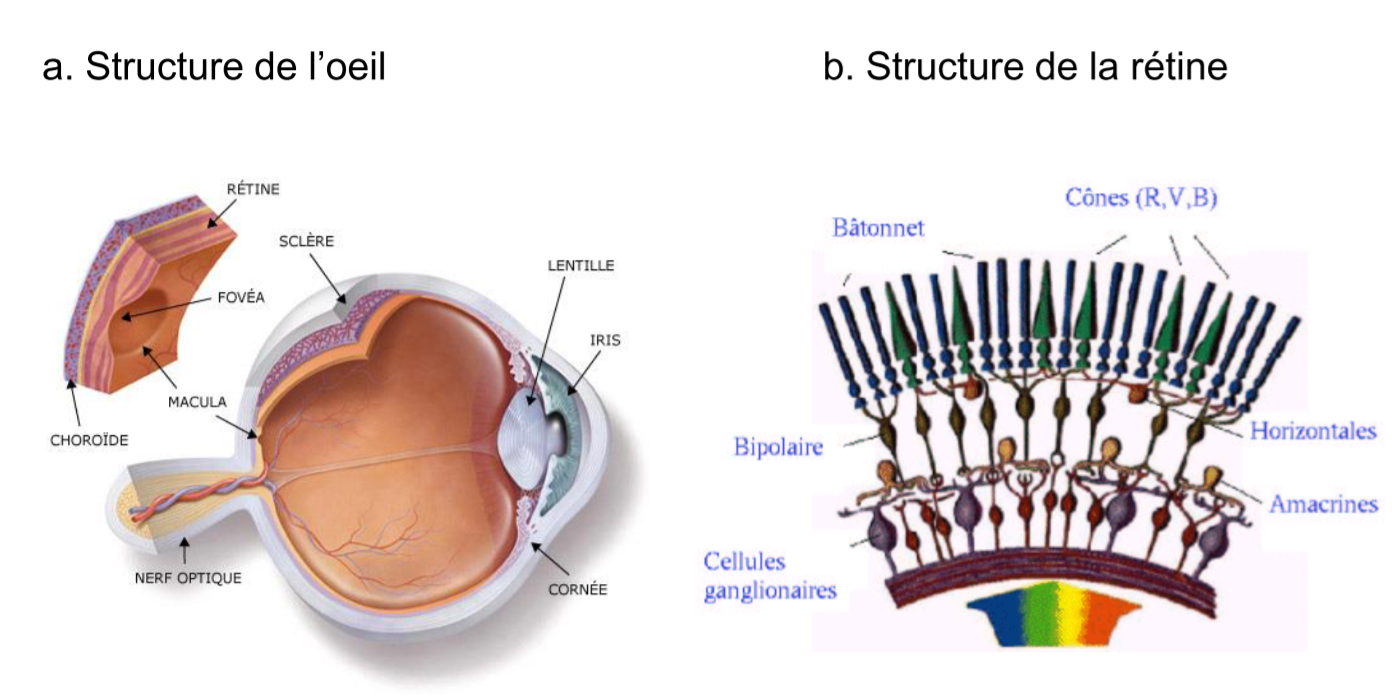
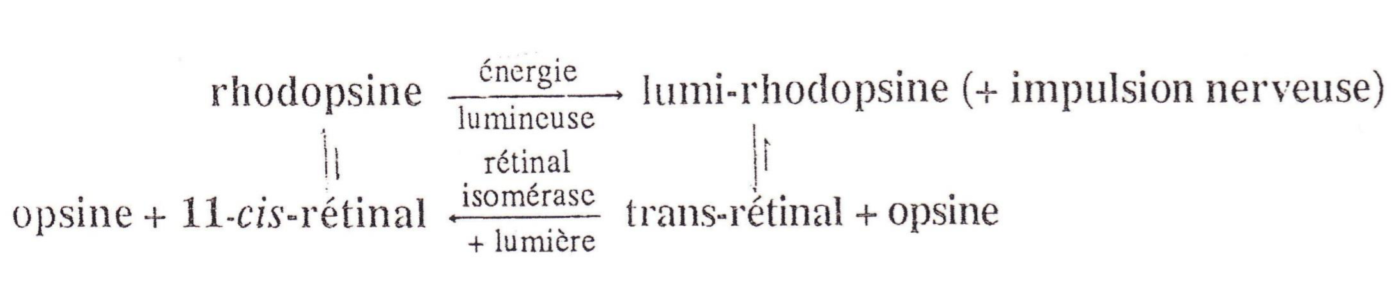
Expliquer la chimie de la vision
L’isomérie cis-trans est importante dans certains processus biologiques, par exemple dans celui de la vision. Les cellules en bâtonnet de la rétine renferment un pigment rouge, sensible à la lumière, appelé rhodopsine. C’est le complexe d’une
protéine, appelée opsine, avec le 11-cis rétinal.
Quand de la lumière visible d’énergie appropriée est absorbée par la rhodopsine, le cis-rétinal est converti en l’isomère trans. Comme le montrent les structures, les formes de l’un et de l’autre sont très différentes. Le complexe trans-rétinal avec l’opsine (appelé lumi-rhodopsine) est moins stable que le complexe cis correspondant et se dissocie en opsine et en trans-rétinal. Ce changement de géométrie déclenche aussi une réponse dans les cellules nerveuses en bâtonnet, qui est transmise au cerveau ; c’est la vision.
S’il en était ainsi, on ne devrait voir que pendant quelques instants, car tout le 11-cisrétinal présent dans les cellules en bâtonnet serait rapidement épuisé. Mais il existe un enzyme, la rétinal isomérase qui, en présence de lumière, retransforme le trans-rétinal en l’isomère cis, permettant ainsi la fermeture du cycle.
Pour la vision il est important d’ingérer de la vitamine A, car elle a presque la structure du rétinal. De ce fait la vitamine A que nous ingérons est transformée (oxydation) par une enzyme en rétinal.
protéine, appelée opsine, avec le 11-cis rétinal.
Quand de la lumière visible d’énergie appropriée est absorbée par la rhodopsine, le cis-rétinal est converti en l’isomère trans. Comme le montrent les structures, les formes de l’un et de l’autre sont très différentes. Le complexe trans-rétinal avec l’opsine (appelé lumi-rhodopsine) est moins stable que le complexe cis correspondant et se dissocie en opsine et en trans-rétinal. Ce changement de géométrie déclenche aussi une réponse dans les cellules nerveuses en bâtonnet, qui est transmise au cerveau ; c’est la vision.
S’il en était ainsi, on ne devrait voir que pendant quelques instants, car tout le 11-cisrétinal présent dans les cellules en bâtonnet serait rapidement épuisé. Mais il existe un enzyme, la rétinal isomérase qui, en présence de lumière, retransforme le trans-rétinal en l’isomère cis, permettant ainsi la fermeture du cycle.
Pour la vision il est important d’ingérer de la vitamine A, car elle a presque la structure du rétinal. De ce fait la vitamine A que nous ingérons est transformée (oxydation) par une enzyme en rétinal.
24
New cards
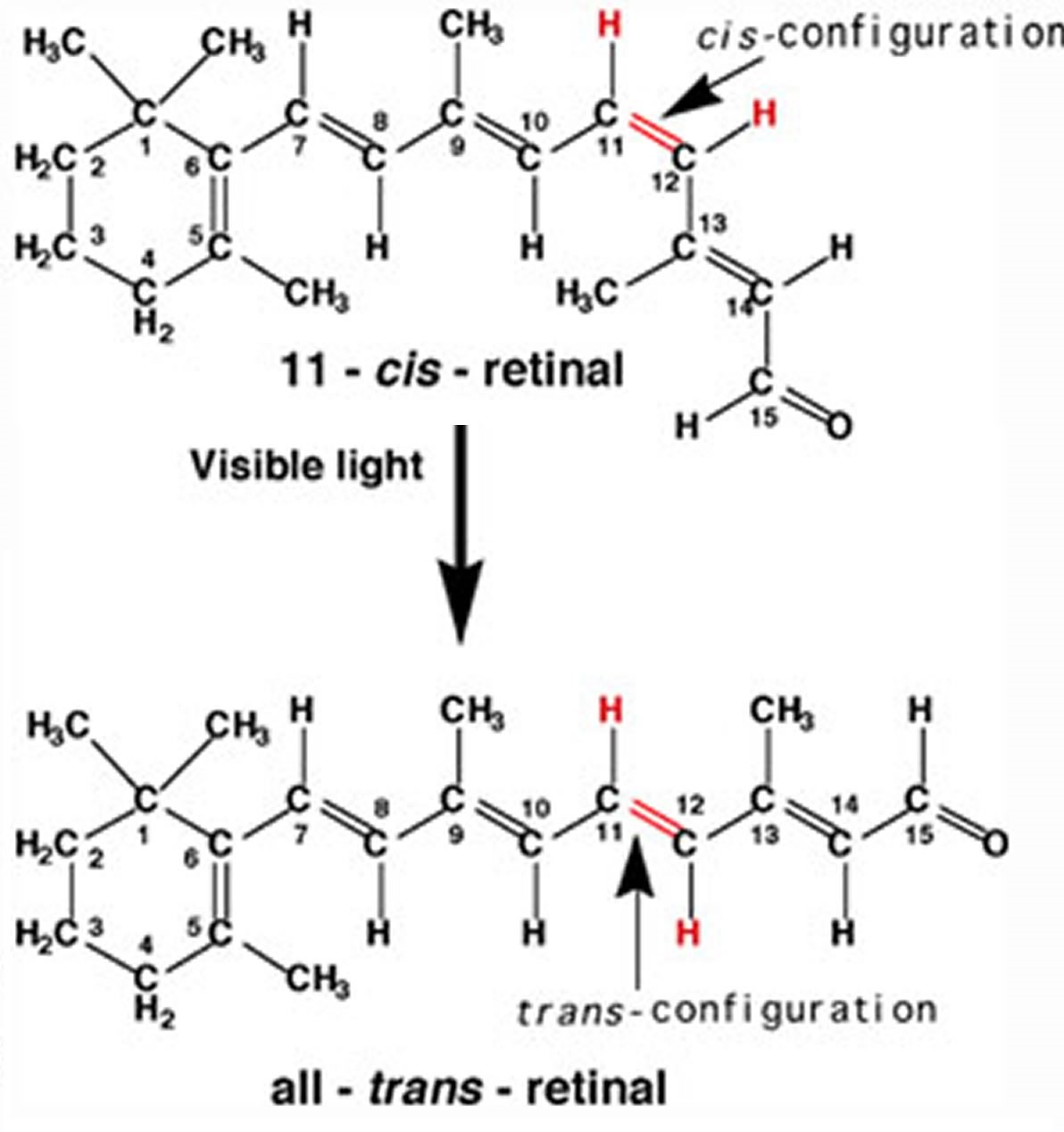
Structure de l'oeil
25
New cards
Mécanisme chimique de la vision
26
New cards
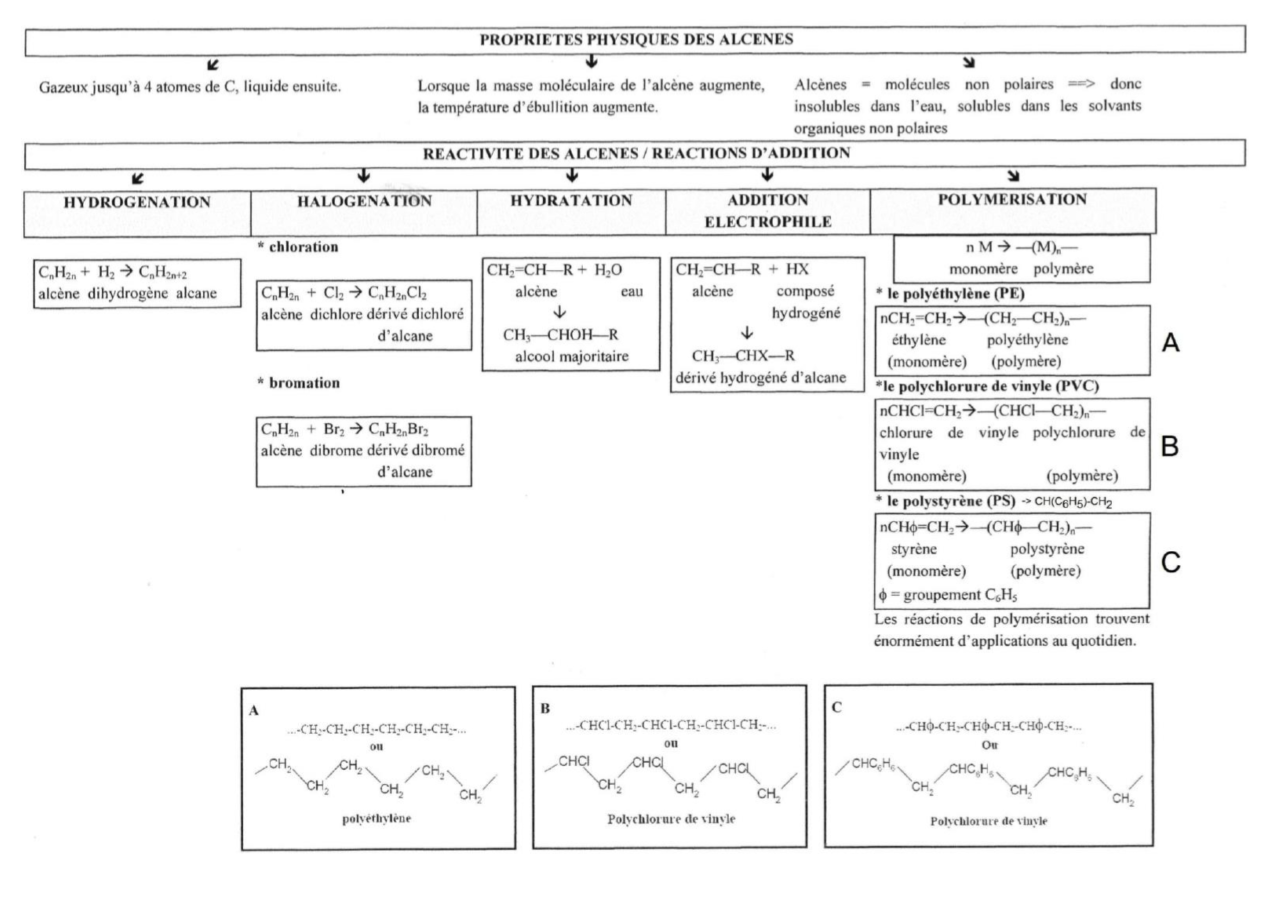
Réactivité des alcènes
réactions d'additions:
avec des halogènes => halogénation
avec des acides => addition électrophile
avec de l'eau => hydratation
avec de l'hydrogène => hydrogénation
réactions de polymérisations:
La polymérisation est une réaction d’autoaddition. Les molécules d’un alcène peuvent s’accrocher l’une avec l’autre pour donner des macromolécules (polymère).
avec des halogènes => halogénation
avec des acides => addition électrophile
avec de l'eau => hydratation
avec de l'hydrogène => hydrogénation
réactions de polymérisations:
La polymérisation est une réaction d’autoaddition. Les molécules d’un alcène peuvent s’accrocher l’une avec l’autre pour donner des macromolécules (polymère).
27
New cards
Halogénation: alcènes
Différences entre l'halogénation d'un alcane et d'un alcène:
1) alcane: création de 2 produits
alcène: création de 1 produit
2) alcane: substitution (radicalaire)
alcène: addition (électrophile)
3) alcane: amorce (énergie pour lancer la réaction) (énergie ->lumière)
alcène: pas d'amorce -> énergie ? --> C=C (double liaison)
1) alcane: création de 2 produits
alcène: création de 1 produit
2) alcane: substitution (radicalaire)
alcène: addition (électrophile)
3) alcane: amorce (énergie pour lancer la réaction) (énergie ->lumière)
alcène: pas d'amorce -> énergie ? --> C=C (double liaison)
28
New cards
Addition électrophile
une liaison pi est supprimée par la création de 2 liaisons simples covalentes
29
New cards
Hydratation
+ H2O
30
New cards
Hydrogénation
+ H2
Ex: transformation des graisses insaturées en graisses saturés
Ex: transformation des graisses insaturées en graisses saturés
31
New cards
Polymère
Les molécules d’un alcène peuvent s’accrocher l’une avec l’autre pour donner des macromolécules.
32
New cards
Propriétés des polymères
▪ Thermoplastiques: malléables quand ils sont chauffés
▪ Thermodurcissables: durcissent sous l'action de la chaleur
▪ Élastomères: déformables de manière réversible
▪ Thermodurcissables: durcissent sous l'action de la chaleur
▪ Élastomères: déformables de manière réversible
33
New cards
Types de polymères
d'addition:
doivent avoir au moins 1 C=C
condensation:
création d'une molécule d'H2O
fait intervenir les fonctions chimiques. Elles réagissent entre elles.
doivent avoir au moins 1 C=C
condensation:
création d'une molécule d'H2O
fait intervenir les fonctions chimiques. Elles réagissent entre elles.
34
New cards
les Alcynes
- terminaison en -YNE
-> ! indiquer la POSITION de la C|||C
-indiquer le nbr de C|||C (di, tri, tétra, …)
-la C|||C doit toujours faire partie de la chaîne la plus longue
S’il y a des liaisons doubles et des liaisons triples dans la même molécule, on favorise l’ordre alphabétique. Exemple : le hept-4-ène-2-yne
-> ! indiquer la POSITION de la C|||C
-indiquer le nbr de C|||C (di, tri, tétra, …)
-la C|||C doit toujours faire partie de la chaîne la plus longue
S’il y a des liaisons doubles et des liaisons triples dans la même molécule, on favorise l’ordre alphabétique. Exemple : le hept-4-ène-2-yne
35
New cards
Réactivité des alcynes
réactions d'additions:
avec des halogènes => halogénation
avec de l'eau => hydratation
avec de l'hydrogène => hydrogénation
réaction d'autoaddition => polymérisation
avec des halogènes => halogénation
avec de l'eau => hydratation
avec de l'hydrogène => hydrogénation
réaction d'autoaddition => polymérisation
36
New cards
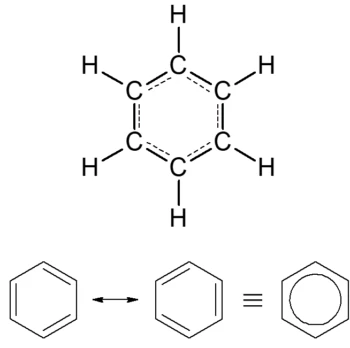
les Aromatiques
-Molécules possédant au moins un cycle de 6 atomes de carbone liés alternativement par des liaisons simples et doubles. A l'origine le terme aromatique désignait une famille de substances possédant une odeur caractéristique, souvent agréable.
-Molécule TRÈS stable
-les aromatiques réagissent comme les alcanes (mêmes si C=C)
-les e- du cycle se délocalisent tout le temps -> Mésomère
-Molécule TRÈS stable
-les aromatiques réagissent comme les alcanes (mêmes si C=C)
-les e- du cycle se délocalisent tout le temps -> Mésomère
37
New cards
Réactivité des aromatiques
réaction de substitution:
Présence de doubles liaisons
->La délocalisation constante des électrons (la résonance) stabilise le(s) cycle(s).
-> -> Les aromatiques se comporte pour cette raison comme les alcanes.
-> -> -> Réactions de substitution.
halogénation
Présence de doubles liaisons
->La délocalisation constante des électrons (la résonance) stabilise le(s) cycle(s).
-> -> Les aromatiques se comporte pour cette raison comme les alcanes.
-> -> -> Réactions de substitution.
halogénation