scheikunde materie
1/55
Earn XP
Description and Tags
deel I ATS
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
56 Terms
leg het ammoniakproductieproces uit
N2 + 3H2 ←> 2NH3
N2 wordt uit de lucht gehaald via cryogene destillatie door de T te doen dalen
H2 wordt via steam reforming gewonnen:
CH4 + H20 → CO + 3H2 (syngas)
of via water gas shift:
CO + H20 → CO2 + H2 (H2 afzonderen door methanol te borrelen, waarbij CO2 achterblijft en H2 ontsnapt)
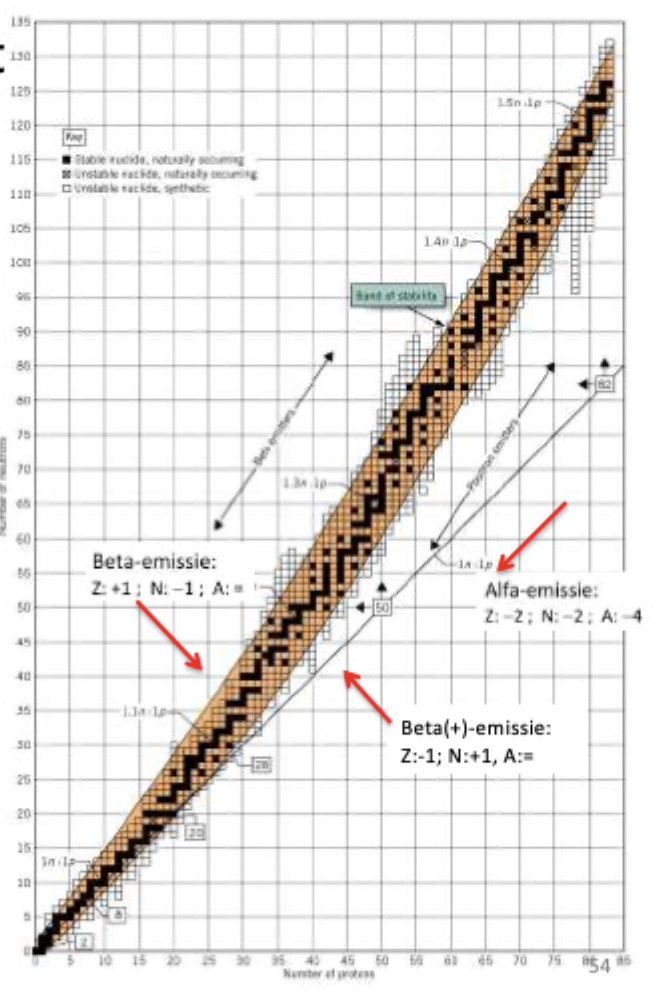
verband tussen het aantal protonen en neutronen
elektrostatische kracht zorgt ervoor dat deeltjes elkaar afstoten. de kracht die dit tegenwerkt is de sterke kernkracht die enkel op korte afstanden werkzaam is. De neutronen zijn een bufferdeeltje die de elektrostatische kracht tegenwerken omdat de protonen elkaar niet heel dicht kunnen benaderen en omdat de sterke kernkracht de deeltjes samenhoudt. bij grotere atomen is de afstoting groter dan de aantrekking waardoor er meer neutronen moeten zijn om dit te compenseren.
hoe bekomt een atoom een hogere stabiliteit
als gevolg van het verschil tussen sterke kernkracht en elektrostatische repulsie tussen protonen is dat de kern onstabiel kan zijn. om een lager energie niveau en dus hogere stabiliteit te bekomen zullen zulke kernen kleine kernfragmenten of hoog-energetische elektromagnetische straling emitteren. de isotopen die dit doen zijn radionucliden.
vervalt niet noodzakelijk direct naar een stabiel isotoop.
alfa straling
emissie van een He kern. M = 4 Z = 2
beta straling
beta -: proton → elektron + pro
beta +: proton → neutron + positron
gamma straling
hoog energetische elektromagnetische straling:
radio -micro - IR- licht - UV-x-gamma
hoe werkt een massaspectrometer
te analyseren stof wordt opgewarmd en hierdoor in dampvorm gebracht. en wordt dan beschoten met elektronen (gesplitst in ionen) warbij er positief geladen ionen ontstaan. deze ionen versnellen in het elektrisch veld dat energie geeft aan de ionen via Ekinetisch omdat de isotopen verschillende massa’s hebben zullen ze in het magnetisch veld meer of minder afbuigen afhankelijk van hun snelheid . dit kan nadien op een detectieplaat onderzocht worden om de geonormale samenstelling te vinden.
waarom is de massa van een atoom /= de massa van het aantal kerndeeltjes + elektronen?
door het massadefect-principe. de verdwenen massa is omgezet in een hoeveelheid warmte-energie (delta E = delta m * c²). om de kern op te breken in zijn protonen en neutronen is energie nodig die equivalent is aan zijn bindingsenergie. deze bindingsenergie is een maat voor de stabiliteit van de kern.
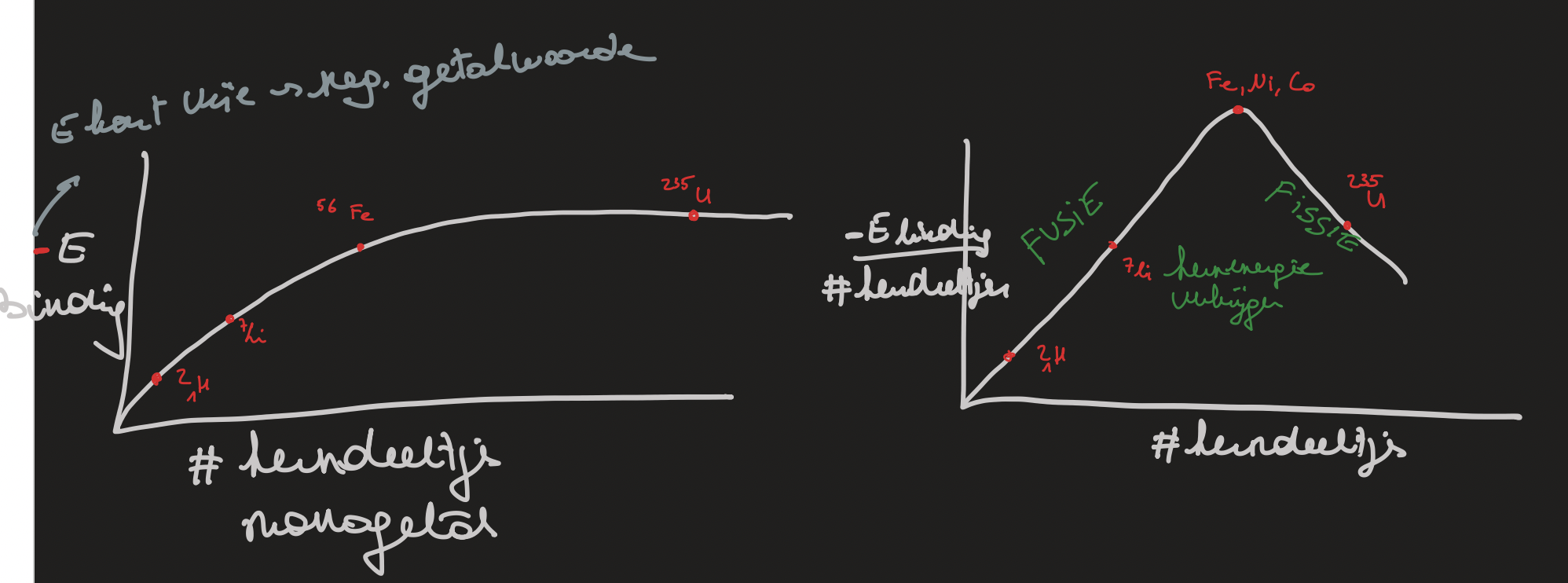
teken de grafieken voor het verband tussen bindingsenergie en massagetal
grafieken
kernsplijting
uranium-235 beschieten met een neutron wat uranium-236 dat splijt in krypton en barium en 3 neutronen. deze neutronen zorgen voor een kettingreactie.
hoe werkt een kerncentrale + gevaar
in kerncentrales worden neutronen opgenomen door regelstaven om de reactie te regelen + concentratie uranium-235 is niet groot genoeg. het probleem is dan echter dat de vrijgegeven warmte afgevoerd moet worden in koelwater, anders smelt de reactor waardoor water splitst in H2 en O2 en de recombinatiereactie een explosie kan inhiberen. + afvalstoffen zijn gevaarlijk.
het warme water wisselt warmte uit met een secundaire waterloop (stoom) dat een turbine kan aandrijven. dit water wordt weer gecondenseerd.
SMR
small modular reactor, kleinere kerncentrales, modulair betekent dat ze op een gestandaardiseerde manier gebouwd en geassembleerd worden.
kernfusie
2 lichtere kernen fuseren leidt tot een verhoging van de bindingsenergie en een afgifte van energie. grootste uitdaging is om de kernen dicht genoeg bij elkaar te krijgen voor de sterke kernkracht te doen werken → hoge kinetische energie en genoeg kernen nodig om botsingen mogelijk te maken. de temperatuur wordt behaald door elektrische stroom door het gas te sturen of de gaskernen te bestralen met microgolven. door die temperatuur ontstaat een plasma (elektronen en kern vrij rondzweven) en de druk wordt verhoogd om botsingen te inhiberen. dit gebeurd in een tokamak reactor, de plasma is beheert door magnetische velden zodat het niet de wand raakt.
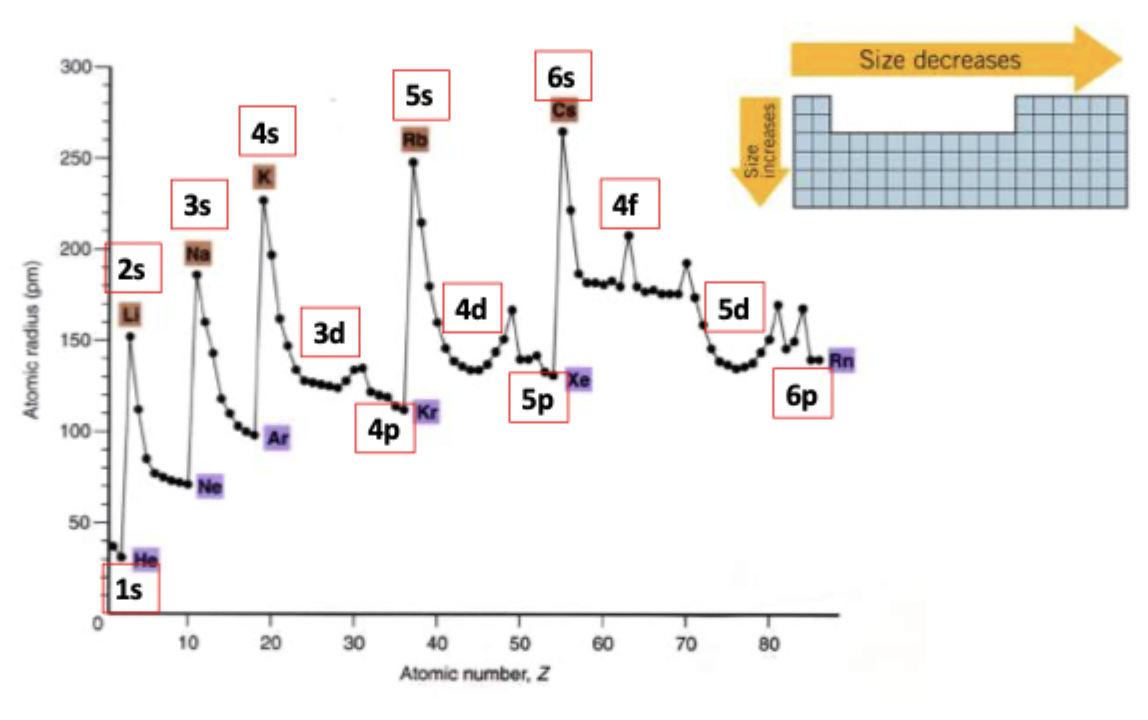
wat is de reden achter de stagnatie in de d subschil?
de d-elektronen zorgen ervoor dat de kern harder ‘zuigt’ aan de valentie elektronen waardoor de atomen kleiner worden
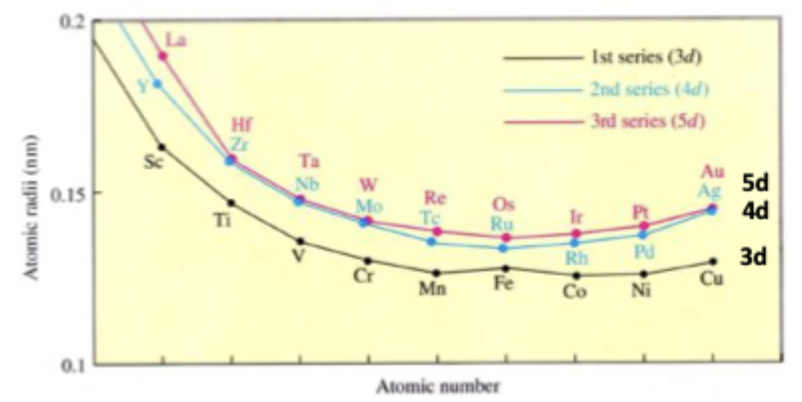
lathanidencontractie
door de 14 extra protonen van de lathaniden(4f) is de contractie zo groot dat de verwachtte extra afstand tenietgedaan is.
ionisatie energie
energie die nodig is voor het onttrekken van een elektron ter vorming van een kation.
grotere straal zorgt voor een kleinere IE,
grotere atoomlading zorgt voor grotere IE
element met 1 elektron (na valentie schil) is makkelijk te onttrekken doordat de valentie-schil het elektron goed afschermt.
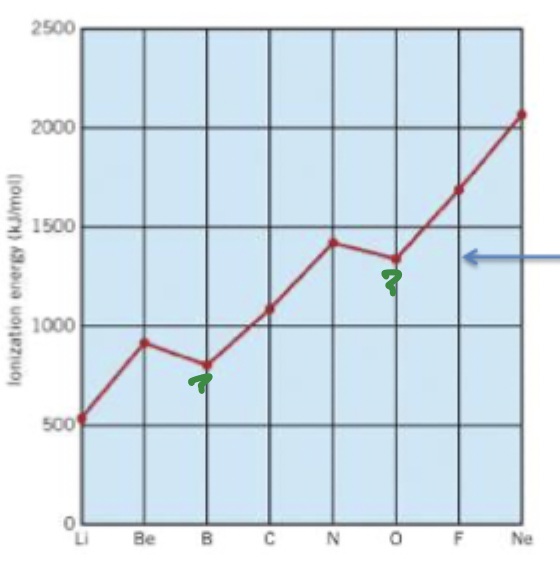
onregelmatigheden in ionisatienergie
halve of kleine edelgasconfiguratie is ook vrij stabiel. tussen Be en B is er een daling van IE. dit is door een verandering in schil. bij B wordt het elektron verwijderd uit de 2p subschil, dit is hier het enige elektron. je houdt een gevulde 2s subschil over, die stabieler is dan de oorspronkelijke en minder energie vergt om te bereiken
bij N en O: bij O als je een elektron onttrekt heb je een halve edelgas config → stabiel, weinig IE nodig.
affiniteitsenergie
energie die vrijkom if nodig is voor de vorming van negatieve ionen door toevoegen van een elektron
IE EN AE en atoomstraal verandering doorheen PSE
EN EA en IE stijgen van links → rechts en dalen van boven → onder
atoomstraal is het tegengestelde
grafiek bindingsenergie ifv de afstand tussen atomen
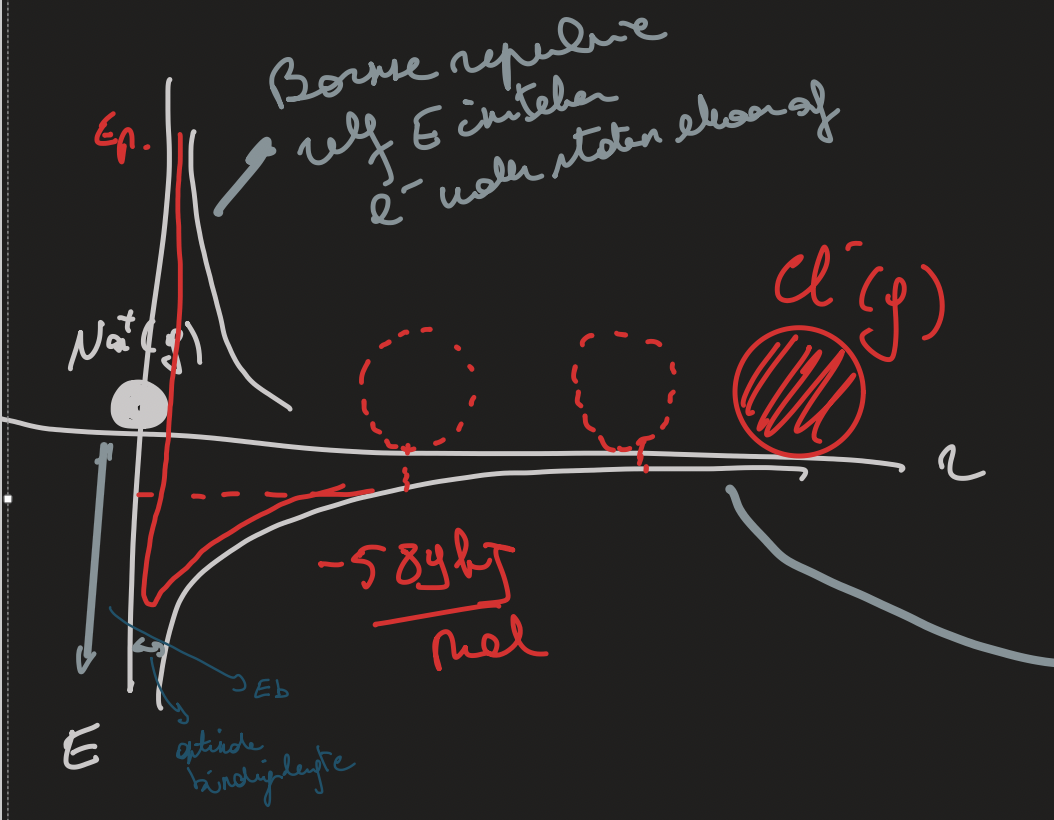
bornse repulsie
als atomen dichter bij elkaar willen komen dan de optimale bindingslengte zal deze repulsie dit tegenwerken. op deze afstand kom de bindingsenergie (coulombenergie) vrij die ervoor zorgt dat Na en Cl bijvoorbeeld binden met elkaar
wat bepaalt de grootte van de roosterenergie
straal van het ion: kleinere ionen hebben grotere roostzerenergieen omdat de coulombkracht groter is
lading van het ion:
Ca2+ heeft een grotere boosterenergie dan Na+
eigenschappen ionische binding
enkel sterke ion-ion interacties
vorming ionische kristallen
zeer stabiel
hoog kook en smeltpunt
relatief hard
goed oplosbaar in water
in gesmolten toestand gesplitst in ionen
eigenschappen covalente binding
sterke intramoleculaire krachten en zwakke interdeelkrachten
laag smelt en kookpunt
vaste toestand: moleculaire kristallen
minder goed oplosbaar in water
minder hard dan ionische bindingen
waarom hebben sommige atomen meer dan 8 valentie elektronen
geexpandeerde valentie schil, vanaf de derde periode is de d-subschil die ervoor zorgt dat bindende elektronen ook hier een plaats vinden, dit zal dikwijls de FL verminderen.
eigenschappen metallische verbinding
verbinding met als bouwstenen metaalkristallen met mobiele elektronen (metalen kleine EN) in een rooster van kationen.
stabiel met variërend kook en smeltpunt
hoge geleiding
kneed en smeedbaar
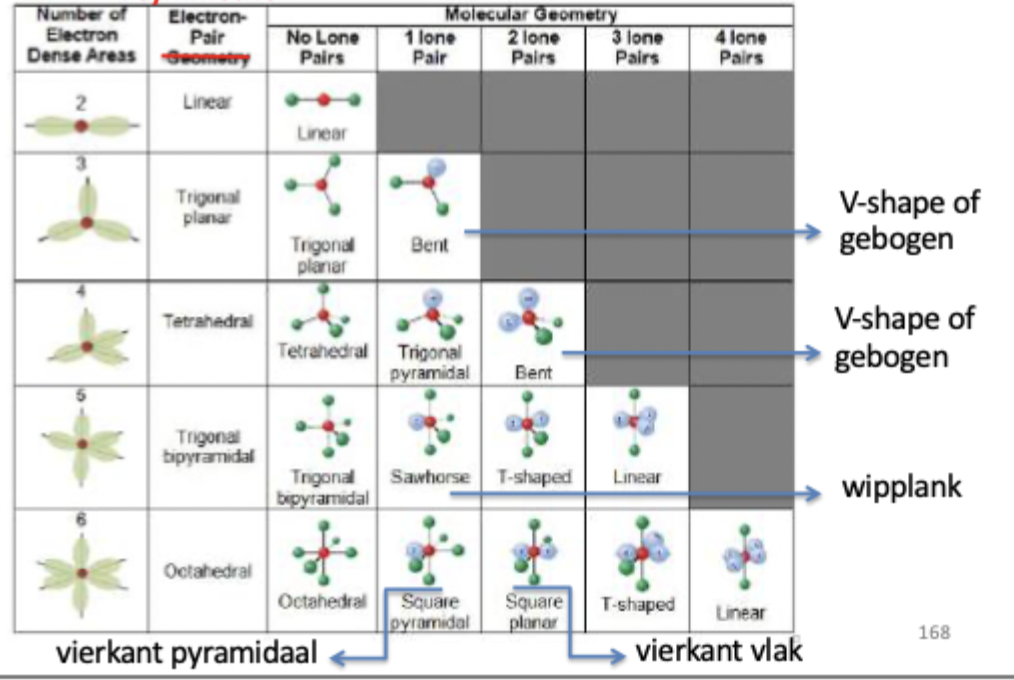
SG met bijhorende symmetrie en bindingshoeken
2 = 180° = lineair
3 = 120° = driehoekig vlak
4 = 109° = tetraedisch
5 = 120° en 90° = trigonaal bipiramidaal
6 = 90° = octaeder
symmetrie en geometrie
rangschikking VDW krachten
ion-dipool
H-brug
dipool-dipool
ion-geinduceerd dipool
dipool-geinduceerd dipool
LD
interdeelkrachten
elektrostatisch van aard (VDW)
polariseerbaarheid van een molecule
hoe makkelijk kan de elektronenwolk verstoord worden (hoe groter de molecule, hoe groter de polariseerbaarheid, hoe meer dispersiekrachten dus meer interacties)
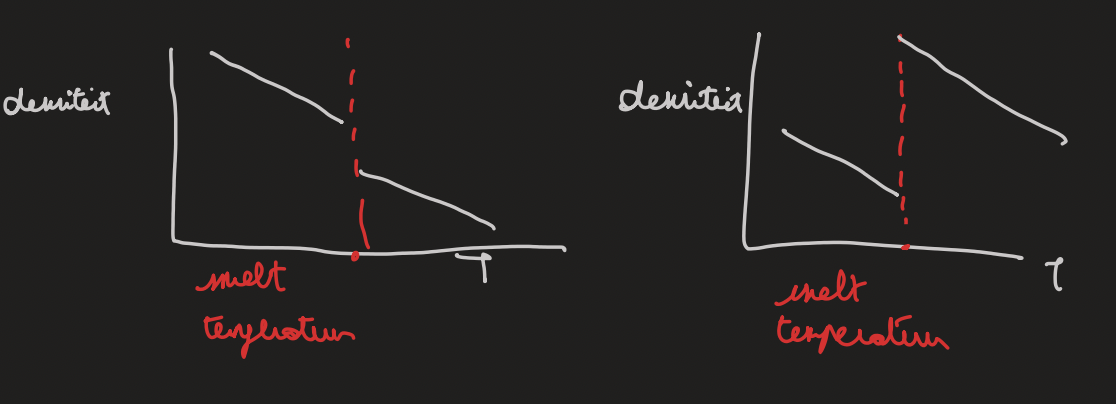
water uitzondering + toepassing + grafiek densiteit
in de bloemsector worden de bloemen in de winter gesprayd met water en deze druppels bevriezen en geven warmte af
bij lagere temp zullen de H-bruggen vergrendelen in een hexagonale pakking → ijs met veel gaten (densiteit daalt) waardoor vissen in de winter kunnen overleven (ijs drijft op water)
kookpunt en interdeelkrachten
hoe groter de interdeelkrachten in de vloeistof, hoe hoger het kookpunt (binnen periode bij apolaire molecules zal kookpunt stijgen door LDS en polariseerbaarheid)
Hbruggen zorgen ook voor een hoger kookpunt
oplosbaarheid
maximale concentratie van een opgeloste stof bij (dynamisch) evenwicht
balans roosterenergie en hydratatienergie (oplossingswarmte)
grootte hydratieenergie
afhankelijk van grootte van het kation en grootte van de lading
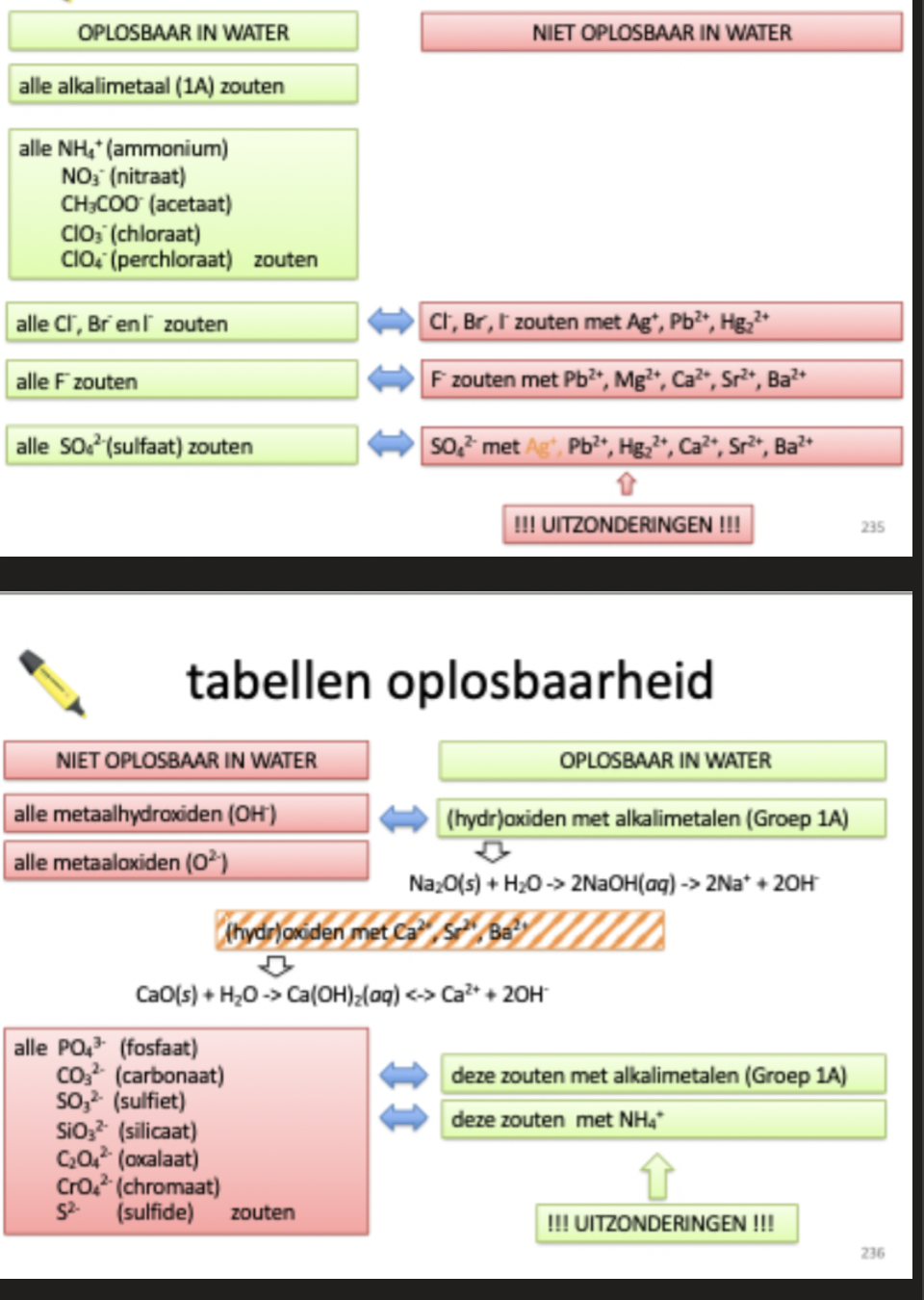
tabel van oplosbaarheid
oppervlaktespanning
elk molecule is onderworpen aan aantrekkingskrachten van de molecule in zijn nabijheid. de moleculen aan de rand hebben enkel moleculen niet zoals de rest waarbij de aantrekkingskrachten elkaar opheffen en zullen dus naar de vloeistof ‘gezogen’ worden, hierdoor gedraagt de rand zich als een dunnen zwakke film
oppervlaktespanning is de energie die nodig is om het oppervlak te vergroten
bevochtiging
intermolecular attracties tussen vloeistof en oppervlak ongeveer even groot zijn als de attractie binnen de vloeistof. dit gebeurd wanneer water een proper glasoppervlak raakt, het water vormt H bruggen met de zuurstof op het glas, gecoat glas heeft apolaire vetten waardoor geen bevochtiging optreedt
hydrofobiciteit kwantificeren
via de contacthoekmeting, als de hoek tussen materiaal en druppel kleiner is dan 90° is het hydrofiel.
werking van zeep
hydrofobe staart die goed oplost in olie en een kleine hydrofiele (polaire) kop die H bruggen zal aangaan. ze verlagen de oppervlaktespanning omdat ze zich aan de olie-water interfase rangschikken. zo wordt de vetfase makkelijker opgebroken in een emulsie met veel micellen → bolvormige structuren (hydrofobe staarten richten zich naar binnen, met het olie in contact en hydrofiele koppen naar buiten, met het water in contact). dit wegspoelen.
visocsiteit
weerstand van een vloeistof tegen stromen, gevolgd van VDW krachten tussen moleculen (interne wrijving) en door moleculaire vorm en grootte → denk aan alkaanreeks en vloeibaarheid bij kamertemperatuur.
kritisch punt + toepassing
geen onderscheid meer tussen damp en vloeistof op de dampspanningskromme. net voor kritisch punt heb je vloeistof en damp interfase, als we de vloeistof verwarmen zal er meer vloeistof verdampen → meer moleculen per dampvolume (densiteit stijgt) en de vloeistof zal uitzetten → vloeistof zal mer volume innemen (densiteit daalt). densiteit van vloeistof en damp komen dichter tot er geen scheidingslijn meer is. → hogere T dan kritisch punt is superkritisch fluïdum.
superkritisch CO2 (verhit en gecomprimeerd) zodat de densiteit die van een vloeistof is met gaseigenschappen. door lage viscositeit gaat de CO2 makkelijk in de bonen op cafeïne op te lossen, na enkele uren wordt de druk gereduceerd en CO2 ontsnapt en temp stijgt om overblijvende CO2 te verdampen.
Principe van Avogadro ampere
bij gelijke T en P bevatten gelijke volumes van willekeurige gassen hetzelfde aantal deeltjes N
mol% = vol%
ideaal gas
gas dat onder alle omstandigheden voldoet aan pv = nrt
effusie en diffusie (wet van graham)
diffusie is de menging van 2 of meer gassen tgv de beweging van de gasmoleculen
effusie is het uitstromen van een gas doorheen kleine openingen
wet van graham zegt dat de effusiesnelheid van A/B = molaire massa van B/A
verschil ideaal en reëel gas
ideaal gas heeft geen interdeelkrachten en geen eigenvolume en Z=1
toepassing wet van Graham
verrijken van uranium:
uranium omgezet in UF6 (volatiel bij vrij lage temp). de UF6 damp diffundeert door poreuze membranen waarbij de lichtere verbindingen sneller diffunderen dan de zwaardere, via de wet van Graham bepaal je het verschil in effusiesnelheid. door dit proces te herhalen kun je je uranium aanrijken in de gewenste samenstelling.
wet van raoult
vluchtigheid is de grootte van de partieeldruk met een bepaalde bolfractie bij een bepaalde temperatuur
bij zuivere stoffen is dit gelijk aan de dampspanning
bij mengsels is dit gelijk aan de dampspanning*molfractie
colligatieve eigenschappen
eigenschapen van mengsels met de grootte van het effect enkel bepaald door de aard vh oplosmiddel en door de concentratie opgeloste stoffen en onafhankelijk van de aard van opgeloste stoffen
isotherme dampspanningsverlaging
isobare kookpuntsverhoging
isobare vriespuntsverlaging
osmotische druk
isotherme dampspanningsverlaging
Bij het oplossen van een niet-vluchtige stoffen in een vloeistof (vluchtig solvent) daalt de dampspanning van de vloeistof bij constante temperatuur. Dit komt doordat minder vloeistofmoleculen kunnen verdampen, aangezien ze deels vervangen zijn aan het oppervlak.
de dampfase bestaat dan uit zuiver solvent in evenwicht met de vloeibare oplossing. het oplosmiddel is niet aanwezig als zuivere stof in de vloeibare oplossing, maar verdund door de opgeloste stoffen. de partieeldruk (gelijk aan de totale druk) van het solvent is dus gedaald volgens raoult
isobare kookpuntsverhoging
Bij het oplossen van een niet-vluchtige stoffen in een vloeistof (vluchtig solvent), stijgt het kookpunt bij constante druk. Dit komt doordat de dampspanning daalt (isotherme dampspanningsverlaging)en de vloeistof pas kookt als haar dampspanning gelijk wordt aan de omgevingsdruk. Er is dus meer energie nodig om het kookpunt te bereiken. De kookpuntsverhoging is evenredig met de concentratie opgeloste deeltjes.
deltaT = ebullioscopische cte * sum(molaliteit)
isobare vriespuntsverlaging
Bij het oplossen van een niet-vluchtige stoffen in een vloeistof (vluchtig solvent)verlaagt het vriespunt. De aanwezigheid van deze deeltjes verstoort de kristalvorming van het oplosmiddel (verdunning van het oplosmiddel), waardoor bevriezing pas bij een lagere temperatuur optreedt. De verlaging is afhankelijk van het aantal opgeloste deeltjes. Dit verschijnsel verklaart o.a. het strooien van zout op ijs.
deltaT = -vancryoscopische cte * sum(molaliteit)
osmotische druk
Osmotische druk is de druk die nodig is om de netto osmose van oplosmiddel door een semipermeabel membraan te stoppen. Ze ontstaat door het verschil in concentratie van opgeloste stoffen tussen twee oplossingen. Hoe meer deeltjes in oplossing, hoe groter de osmotische druk.
van’t hoff factor
De van’t Hoff-factor geeft aan hoeveel deeltjes een opgeloste stof produceert in oplossing, vergeleken met het aantal opgeloste formules. Hoe groter i, hoe sterker het effect op colligatieve eigenschappen zoals vriespuntsverlaging, kookpuntsverhoging of osmotische druk. 1 mol NaCl dissocieert in 2mol (Na en Cl)
osmose + toepassing
Osmose is het proces waarbij een oplosmiddel (meestal water) spontaan door een semipermeabel membraan stroomt, van een gebied met lage concentratie opgeloste stoffen naar een gebied met hoge concentratie opgeloste stoffen.
Dit gebeurt om het concentratieverschil aan opgeloste deeltjes aan beide zijden van het membraan te verkleinen. Het membraan laat alleen het oplosmiddel door, niet de opgeloste stoffen (zoals zout of suiker).
ontzouten van water mbv omgekeerde osmose:
druk uitoefenen om de stroming van water om te keren, met als resultaat zuiver water dat geëxtraheerd zal worden van de oplossing zoals uit zeewater bijvoorbeeld.
vluchtigheid van een molecule
Welke heeft de hoogste molfractie in de dampfase? → Die is vluchtiger
Welke heeft de laagste kooktemperatuur? → Die is vluchtiger
Welke heeft de zwakste interacties? → Die is vluchtiger
Vertakte moleculen zijn compacter → minder contactoppervlak → zwakkere krachten. → vluchtiger