PHOSPHORYLATION OXYDATIVE
1/82
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
83 Terms
Quelle est l’unique source d’NRJ animale ?
l’oxydation des substrats carbonés
qu’est-ce qu’un zymogène ?
=précurseur d’une enzyme →enzyme non fonctionnelle
interet : l’orga synthétise ce qu’il va activer l'e zymogène
→stockage d’une enzyme inactive
qu’est-ce qu’un gpt prosthétique ,
composant non-aminé qui fait partie de la structure des protéines conjuguées
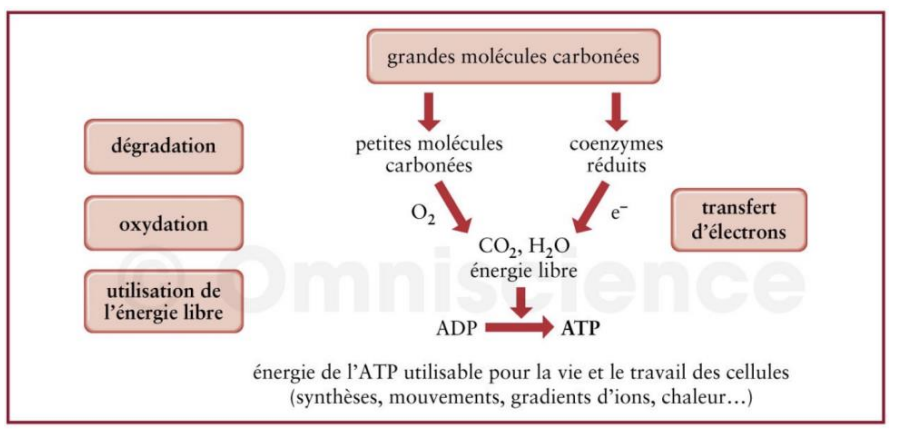
qu’est qui se passe au cours de la glycolyse, de l’oxydation des AG, et le CDK ?
la réduction de coenzymes (NAD, FAD) qui seront réoxydés au cours de la respiration mitochondriale →fournit une NRJ importante
la respiration est une chaîne d’oxydation…
exergonique
→donne de l’NRJ à l’environnement
→spontanée
qu’implique le transfert d’électrons ?
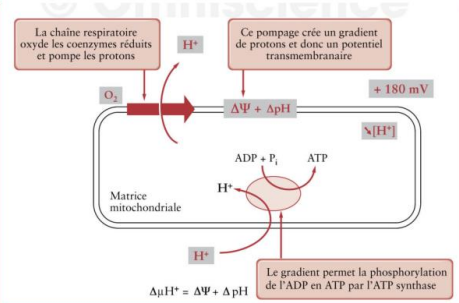
ça permet la mise en place d’un gradient de proton entre la matrice mitochondriale et l’EIM
que permet ce gradient électrochimique ?
permet la libération d’énergie nécessaire à la production d’ATP à partir d’ADP par l’ATP synthase
(l’ATP synthase ne tourne plus si il ya la meme conc des deux cotés de la mb)
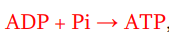
quelles sont les étapes de la phosphorylation oxydative ?
réaction d’oxydation qui permet le transfert d’électron (réaction d’oxydo red)
formation et maintien d’un gradient de proton
se termine par l’utilisation d’oxygène moléculaire
Oxydation : on utilise des électrons provenant du NADH et du FADH₂
Phosphorylation : on fabrique de l’ATP (ADP + Pi → ATP)
quelle est la réaction d’oxydo reduction finale et fondamentale ?
l’oxydation de l’hydrogène (ou réduction de l’oxygène)
quelle est la production d’eau liée à cette oxydoreduction
300mL/jour
dans cette réaction qui est l’oxydant et qui est réducteur ?
oxydant = oxygène (=capte les électrons)
réducteur = hydrogène (=cède des électrons)
quelle est l’équation exergonique ?
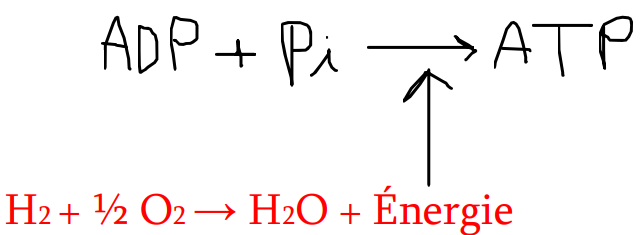
qu’où proviennent les hydrogènes de la réaction exergonique ?
du catabolisme des substrats carbonés ( oxydation des glucides des AG AA CDK) qui permettent de former des CoE nucléotidiques NADH,H+ et FADH2 = substrats de la chaîne respiratoire
comment se fait l’oxydation des CoE nucléotidiques réduits ? qui est l’oxydant et qui est le reducteur ?
bien se souvenir de (ox + ne- → red)
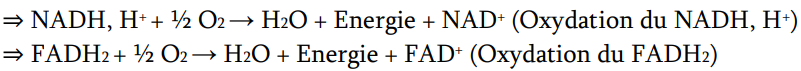
quelles sont les principales origines des CoE ?
oxydation AG →N et F
décarbo du pyruvate en actéyl coa →N
4 réactions d’oxydation/DSH du CDK →6N et 2F
iso →alpha céto
alpha céto→sucinyl coa
succinate →fumarate
malate →oxalo
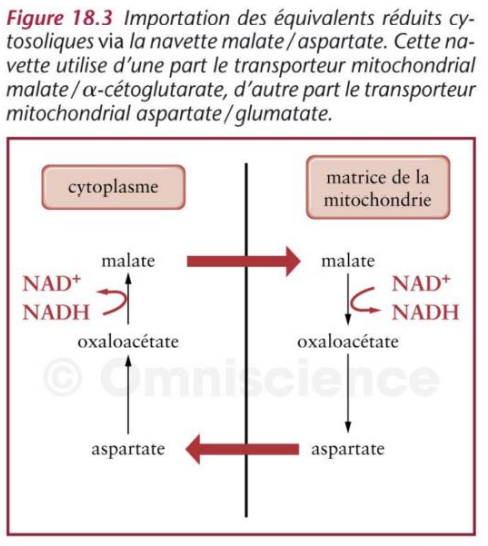
cytoplasmique (N seulement) : système navette Asp-Malate, qui permet son transport dans la mitochondrie. vient de la glycolyse
quel est le rôle des CoE ?
ces sont des réducteurs(=capable d’accepter des e-) fortement électronégatifs, qui sont les substrats de la chaîne respiratoireà laquelle ils cèdent des e-
le NADH,H+ est le coe de quel complexe ?et le FADH2 ?
NADH,H+→CoE mobile du complexe 1 d’oxydoreduction (cofacteur libre)
FADH2 →groupement prosthétique substrat du complet 2 d’oxydoreduction
(il est un grpmt prosthétique car solidement lié à une enzyme et ne peut pas se dissocier facilement, =molécule non protéique)
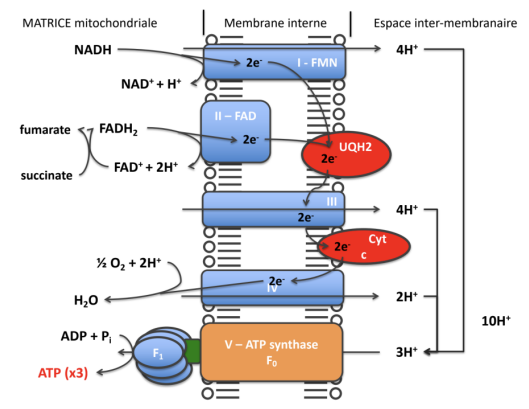
A quoi participent tous les constituants de la chaine respiratoire de la MI ?
La chaîne de transfert des e- et des H+ jusqu’à l’oxygène moléculaire par RedOx
La production d’eau
La synthèse d’ATP par l’ATP synthase
Formation d’un gradient de protons entre l’espace intermembranaire et la matrice mitochondriale, source d’énergie
pourquoi est-ce qu’on dit que c’est un mécanisme chimio-osmotique ?
parce qu’il combine réactions chimiques (RedOx) et la formation de gradients osmotiques (charge, pH) du fait des protons.
quelle est la différence entre gradient osmotique et gradient de protons
gradient osmotique =diff de concentration en soluté de part et d’autre de la mb→mvt de l’eau=osmose
gradient de protons = diff de concentration d’H+ et de potentiel électrique
que fait la réaction exergonique ?
Production et transfert de protons et d’électrons pour la réduction de l’O2 en H2O
Gradient osmotique de protons : énergie nécessaire à la synthèse de l’ATP
combien de composants sont fixes et combien sont mobiles ?
4 composants sont fixes, ancrés dans la MI mitochondriale : complexes d’oxydo-réduction (I à IV) dont 3 (I, III, IV) sont des pompes à protons qui permettent le transfert des protons de la matrice vers l’espace intermembranaire à chaque réaction d’oxydation. Attention : complexe 2 n’est pas une pompe à protons
2 composants sont mobiles : coenzyme Q et cytochrome c → transportent les électrons entre les complexes d’oxydoréduction donneurs et accepteurs.
qu’est ce que le coenzyme nucléotidique ?
FMN(Flavine Mononucléotide) solidement lié au complexe 1
réduit par le NADH (→NADH → NAD⁺ + FMNH₂)chat gpt
FAD(Flavine Adénine Dinucléotide) lié au complexe 2
=>ce sont les 1ers R d’e- dans leur complexe respectif
qu’est-ce que le centre fer/soufre ?
(OxRed)
ce centre est présent dans les complexes 1, 2 et 3 et dans le cytochrome c : permettent le transfert d’e-
il alterne entre Fe²⁺ (réduit) et Fe³⁺ (oxydé)
quand est-ce qu’on établit un gradient électrochimique ?
c’est l’entrée des ions dans l’espace intermembranaire mitochondriale qui permet la formation de ce gradient de protons. (=/ sortie d’H+)
comment évolue l’électronégativité et l’exegonisme au cours de la chaine respiratoire ?
il y a diminution de l’électronégativité et diminution de l’exergonisme.
=>suite de réactions exergoniques allant du couple redox le plus électronégatif (NAD/NADH) jusqu’au moins électronégatif (O2/H2O)
à quoi appartient le complexe 2 ?
au CDK avec la succinate déshydrogénase =enzyme du CDK
qu’est-ce que l’enthalpie ?
Enthalpie (H) = Énergie interne + travail de pression-volume
Enthalpie = chaleur à pression constante
La connaissance de la variation de l’enthalpie libre au cours d’une réaction permet la prédiction de la spontanéité de la réaction.
qu’est-ce qu’une réaction isoergonique
aura une variation d’enthalpie libre nulle
Une réaction standard implique le fait que les concentrations soient fixées
q
quelle est la particularité du complexe II
il ne fait pas intervenir une pompe à protons
que permet la réoxydation du NADH, H+
la synthèse de 3 ATP
=>NADH,H+ peut céder ses e- donc il est bien le réducteur qui va subir une oxydation
quelle est la seule réaction irréversible de la chaîne respiratoire
la reduction de l’O2
qui a le potentiel de réduction le plus grand entre le NADH,H+ et l’O2 ?
Le potentiel de réduction standard du NADH + H+ est inférieur à celui de l’oxygène car l’oxygène est le plus oxydé
Le complexe II permet l’oxydation ou la réduction du FADH2
l’oxydation car FADH2 est un réducteur
FADH2→FAD+2e−+2H+
=>FAD n’a pas les e-
quelle est la réaction du complexe 1 ?
NADH DSH ou NADH-ubiquinone oxydoréductase
quele est le gmt prosthétique lié au complexe 1
FMN =CoE qui est fixe du coup
qu’est-ce uqi se passe ?
NADH → NAD+ + H+ + e- :
réduction du FMN qui pourra réduire le CoE Q par sa réoxydation
combien de protons sont transloquer par le C1 ?
4H+
comment s’apelle l’inhibiteur ?
: roténone → composé de pesticides qui pourrait avoir une neurotoxicité (Parkinson)
quelle est la réaction du c2
succinate DSH ou succinate-ubiquinone oxydoréductase
quel est le CoE lié au c2
FAD (lié) =gmt prosthétique
qu’est-ce qu’il se apsse comme réact chimique
succinate + FAD → fumarate + FADH2 (Krebs)
puis réduction du CoE Q par réoxydation du FADH2
quel est l’inhibiteur du complexe 2
malonate (analogue du succinate) → poison très dangereux, soluble
quel est le premier composant mobile qui intervient ? il se déplace de où à où
CoE Q ou ubiquinone
Lipide diffusible mobile qui se déplace du complexe donneur (I ou II) à l’accepteur (III)
quelle est sa forme réduite et sa forme oxudée ?
réduite : ubiquinol (UH2) ou CoE Q réduite (CoQH2) (OH)
Oxydée : ubiquinone (U) ou CoE Q (CoQ) (CO)
comment s’appelle le complexe 3 ?
cytochrome bc1 ou ubiquinol-cytochrome c oxydoréductase
qu’est-ce qui se passe dans le complexe 3 ?
Transfert d’e- du CoQH2 vers le cytochrome c oxydé → réduction
combien de protons sont transloqués ?
4H+
comment s’appelle l’inhibiteur du complexe 3 ?
antimycine A, poison produit par des bactéries de genre Streptomyces
quel est le deuxième composé mobile et où se trouve il ?
Cytochrome c
Protéine légèrement hydrosoluble mais qui reste associée à la membrane
il transfert des e- de qui à qui ?
➢ Transfert d’e- du 3 (donneur) au 4 (accepteur).
comment s’appelle le complexe 4 ?
cytochrome aa3 ou cytochrome c oxydase
qu’est- ce uqi se passe dans le complexe 4 ++++
Transfert d’e à O2 qui produit de l’eau métabolite : consomme 95% de l’O2 pour produire 300 mL d’eau par jour.
combien de protons sont transloqués ?
2H+c
comment s’appelle son inhibiteur ?
CN- (cyanide), N3 - (azide), CO (monoxyde de carbone) : poisons connus
dans quel sens se fait L’ordre d’intervention des systèmes RedOx?
dans le sens de l’accroissement du potentiel redox (E0’)
du NAD/ NADH (couple le plus réducteur) → O2 / H2O (couple le plus oxydant)
La réduction de la valeur l’énergie libre
(attention, ici on parle bien de couple redox, et non pas d’acide/base donc ce n’est pas compatible avec cette façon de penser →H2O/H0-)
comment évolue l’énergie libre au fil des réaction ?
elle diminue car c’est un systèmes donneurs d’e- et de H+ selon une succession de réactions exergoniques
donc qu’est ce qui se passe à la dernière réction ? +++
à la dernière étape, il n’y a plus d’énergie libre, donc la réduction de l’hydrogène en eau est irréversible
on commence les réaction à un potentiel de reduction de combien et combien pour la fin et quelle est la variation au final ?
début : -0,32V (le plus reducteur)
fin : +0,81 V (le plus oxydant)
deltaE =1,14V
par quoi sont transférés les e- jusqu’à l’oxygène moléculaire ? quel gradient est imposé ?
Les e sont transférés via le CoQ et les cytochromes jusqu’à l’oxygène moléculaire. Le trajet du transfert est imposé par le gradient du potentiel RedOx
quel est le ddp (→ Gradient de protons électrochimique)?
ddp=180 mV
schéma bilan
Maintenant on parle de la phosphorylation de l’ADP
pourquoi l’O2 a un contrôle positif sur la respiration par l’ADP ?
car L’addition d’ADP à des mitochondries stimule la consommation d’O2
qu’estc-e qui se passe s’il y a l’action de l’oligomycine (inhibiteur de l’ATP synthase)
abolit l’effet de l’ADP sur la chaîne respiratoire. C’est donc la phosphorylation de l’ADP en ATP (indirectement l’ADP) qui stimule la respiration mitochondriale. Il y a un couplage entre respiration mitochondriale et phosphorylation de l’ATP. L’un ne se fait pas sans l’autre
quelle est l’’action du DNP (2-4 dinitrophénol)
abolit la phosphorylation de l’ADP, c’est un agent de découplage des transports, il est présent sur la membrane interne aux protons, ce qui permet la disparition du gradient de protons → La formation et le maintien du gradient de protons est indispensable à la phosphorylation
pourquoi La phosphorylation de l’ADP en ATP est dite oxydative
car elle est couplée à la respiration mitochondriale exergonique.
ΔpH c’est quoi
Gradient de concentration de protons
ΔΨm c’est quoi et il est de combien ?
=Différence de potentiel électrique
= + 180 mV
qu’est-ce que ΔµH+ et quelle est son équation?
ΔµH+ = ΔpH + ΔΨm
=force proton motrice utilisée par l’ATP synthase.
bilan
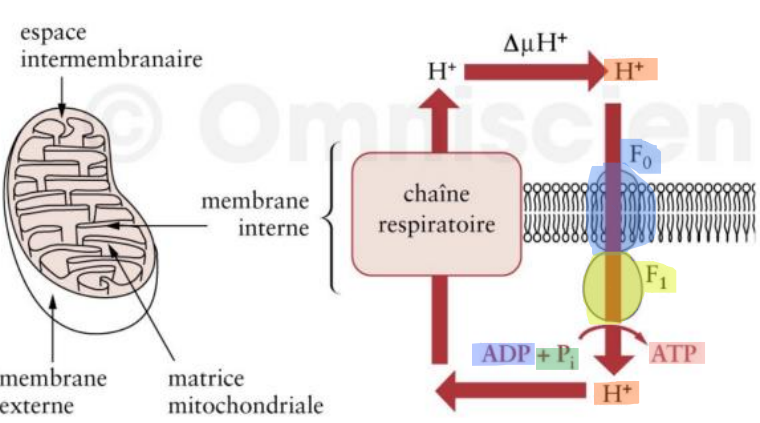
décrire le complexe enzymatique volumineux (MI) en deux parties
F0 : partie membranaire globulaire multimérique avec canal à H+ qui permet le retour des protons dans la matrice.
F1 : protubérance multimérique dans la matrice qui est attachée à F0, elle contient 3 sites de fixation de l’ADP, elle porte l’activité enzymatique de phosphorylation.
bilan de ce qui est nécessaire
Le retour de 3 protons est nécessaire pour synthétiser 1 molécule d’ATP, c’est pour ça qu’à partir du NADH, H+ (10 H+ transférés dans l’EIM) on peut produire 3 molécules d’ATP
et 2 à partir du FADH2 (6H+ transloqués)
La synthèse de l’ATP est une réaction … exer/ender ?
ENDERgonique
quand est-ce que L’ADP ne pourra alors pas être phosphorylé par l’ATP synthase ?
Quand la cellule n’utilise pas l’ATP, cet ATP n’est pas hydrolysé donc il y a peu d’ADP dans la mitochondrie.
l’ATP synthase qui elle-même ne pourra pas résorber le gradient de proton
→ Effet feed-back qui va ralentir la chaîne respiratoire et la réoxydation des coenzymes nucléotidiques
quand est-ce qu’on a la turbine à protons marche à plein régime?
À l’inverse, si l’ATP est utilisée par la cellule, grande quantité d’ADP qui est réutilisée de manière efficace par l’ATP synthase pour resynthétiser l’ATP, la turbine à protons marche à plein régime, on a une résorption du gradient de protons et la chaîne respiratoire est extrêmement active.
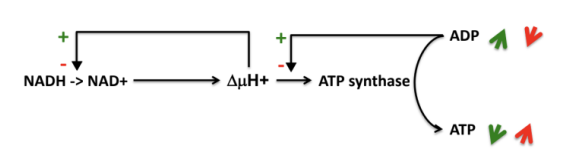
Si excès d’ATP ?
activité ATPase de l’ATP synthase pour hydrolyser l’excès d’ATP
+++
en pathologie si on a une production excessive d’énergie ça induit quoi ?
→ production excessive de radicaux libres = toxicité mitochondriale, peuvent endommager les lipides, les protéines et les acides nucléiques.
il ya deux classes de maladies, quelle est la première ?
Causes connues : maladies mitochondriales
Troubles de la chaîne respiratoire
Altérations de gènes mitochondriaux ou nucléaires qui codent pour les constituants de la chaîne respiratoire
Cela donne lieu à des maladies polymorphes, très grande variabilité d’expression et de manifestations cliniques (atteintes ophtalmiques, musculaires, cardiaques…) en fonction des gènes endommagés
Maladies héréditaires
et la deuxième ?
Corrélation avec dysfonctionnement énergétique :
Diabète de type II (insulino-résistant)
Alzheimer (accumulation de peptides β amyloïde)
Parkinson
Majorité de cancers (souvent dues à une activation d’oncogènes)
Mais on ne sait pas si ce dysfonctionnement est une cause ou une conséquence (cancer : plutôt une conséquence)
bilan