organische chemie hoofdstuk 5
1/83
Earn XP
Description and Tags
Alkenen-alkynen naamgeving en reactiviteit
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
84 Terms
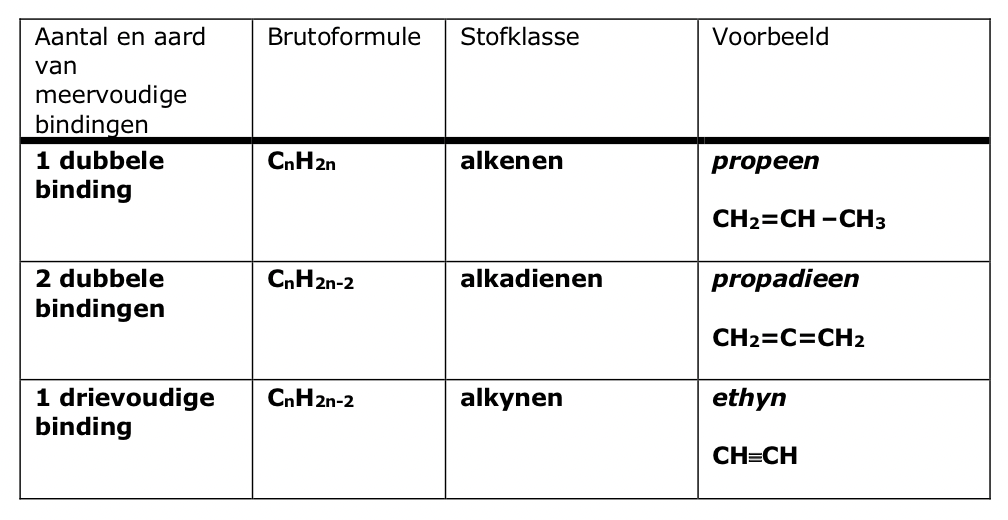
wat betekent onverzadigd en wat is het gevolg ervan
uit wat is de naam van deze verbinding afgeleid
Onverzadigd wil zeggen dat een aantal C-atomen slechts twee of drie bindingspartners heeft. Dit heeft dubbele of drievoudige bindingen tussen C-atomen voor gevolg.
De naam van deze verbindingen is altijd afgeleid van het alkaan met hetzelfde aantal C-atomen.
Waarom kunnen verzadigde stoffen met slechts één C-atoom (zoals methaan) geen dubbele of drievoudige bindingen bevatten?
Omdat een dubbele of drievoudige binding altijd gevormd wordt tussen twee C-atomen. Methaan bevat maar één C-atoom, dus er is geen tweede C-atoom om zo’n meervoudige binding mee te vormen. Daardoor kan methaan geen onverzadigde variant hebben.
Wat zegt het aantal bindingspartners van een C-atoom over de verzadiging van een organische stof?
In een verzadigde verbinding heeft elk C-atoom vier bindingspartners (enkelvoudige bindingen). Als een C-atoom slechts twee of drie bindingspartners heeft, betekent dit dat het C-atoom betrokken is bij een dubbele of drievoudige binding → de stof is dan onverzadigd.
Welke soorten bindingen komen voor bij onverzadigde organische stoffen, en tussen welke atomen?
Bij onverzadigde stoffen komen dubbele bindingen (C=C) en drievoudige bindingen (C≡C) voor, en deze bindingen ontstaan tussen koolstofatomen (C-atomen).
Geef een voorbeeld van een onverzadigde verbinding en toon hoe de naam afgeleid is van het overeenkomstige alkaan.
Bijvoorbeeld: etheen (C₂H₄) is een onverzadigde verbinding met een dubbele binding. De naam is afgeleid van ethaan (C₂H₆), het overeenkomstige alkaan met twee koolstofatomen. De "-aan" uitgang verandert in "-een" om de dubbele binding aan te duiden.
Wat is de rol van de meervoudige binding in de chemische reactiviteit van een onverzadigde stof?
De meervoudige binding (dubbel of drievoudig) is een reactief centrum in een molecuul. Deze bindingen bevatten elektronen die makkelijker kunnen deelnemen aan chemische reacties dan enkelvoudige bindingen, waardoor onverzadigde stoffen reactiever zijn dan verzadigde stoffen.
Waarom zegt men dat een meervoudige binding tussen C-atomen 'vanzelfsprekend' niet mogelijk is bij methaan?
Omdat methaan slechts één C-atoom bevat, is het chemisch onmogelijk om een meervoudige binding te vormen tussen twee C-atomen — er is immers geen tweede C-atoom aanwezig. Daarom spreekt men van een ‘vanzelfsprekendheid’ op basis van de molecuulstructuur.
op welke manier wordt een dubbele of drievoudige binding aangegeven in de naamgeving
Wat is polyetheen en hoe wordt het gevormd uit etheen?
Polyetheen is een polymeer, een lange keten van herhaalde eenheden, gevormd uit het monomeer etheen (C₂H₄). Door een polymerisatiereactie verbinden vele etheenmoleculen zich via additie tot een keten, waarbij de dubbele binding wordt verbroken en nieuwe enkelvoudige C–C-bindingen ontstaan.
Welke toepassingen heeft polyetheen in het dagelijks leven?
Polyetheen wordt gebruikt in het huishouden als dekfolie, plastic zakjes, flessen, en verpakkingsmateriaal, omwille van zijn lichte gewicht, flexibiliteit en chemische bestendigheid.
Welke chemische eigenschap van etheen maakt het geschikt als grondstof voor polymerisatie?
De aanwezigheid van een reactieve dubbele binding (C=C) in etheen maakt het geschikt voor additiepolymerisatie. Deze binding kan makkelijk openbreken en reageren met andere etheenmoleculen, waardoor een lange keten ontstaat.
Wat is de rol van etheen in planten?
Etheen is een plantenhormoon dat verschillende stofwisselingsprocessen reguleert. Het stimuleert o.a. de rijping van vruchten, de veroudering van bladeren en de bladval. In vruchten activeert het enzymen die verantwoordelijk zijn voor veranderingen in kleur, geur, smaak en zachtheid.
Hoe beïnvloeden importeurs de rijping van fruit met etheengas?
Importeurs laten fruit vaak onrijp oogsten en vervoeren om bederf tijdens transport te vermijden. Bij aankomst wordt het fruit blootgesteld aan etheengas, wat de natuurlijke rijpingsprocessen versnelt. Hierdoor rijpt het fruit op het juiste moment voor verkoop en consumptie.
Waarom is het economisch voordelig om fruit onrijp te importeren en pas later te laten rijpen?
Onrijp fruit is steviger en bederft minder snel, wat transport en opslag vergemakkelijkt. Door het rijpingsproces pas bij aankomst te starten, kunnen importeurs de houdbaarheid verlengen en de rijping afstemmen op de marktvraag, wat economische verliezen door bedorven fruit voorkomt.
Leg uit waarom etheen een voorbeeld is van een organische stof met zowel industriële als biologische functie.
Etheen is een klein organisch molecuul met een dubbele binding dat wordt gebruikt in de chemische industrie als grondstof voor de productie van kunststoffen (polyetheen), maar het speelt ook een rol in de natuur als plantenhormoondat biologische processen zoals vruchtvorming en rijping beïnvloedt. Het is dus een zeldzaam voorbeeld van een molecule met dubbele functionele waarde.
Wat is het verschil tussen het gebruik van etheen in polymerisatie en in rijping van fruit?
Bij polymerisatie ondergaat etheen een chemische reactie waarbij moleculen samensmelten tot een polymeer (polyetheen), terwijl bij rijping van fruit etheen functioneert als een signaalmolecuul (hormoon) dat biologische processen activeert, zonder dat het zelf structureel verandert.
Waarom is etheen in staat om effect te hebben op fruit, ondanks zijn eenvoudige structuur?
Etheen is een gasvormig, klein molecuul dat gemakkelijk door plantencellen wordt opgenomen. Ondanks zijn eenvoudige structuur kan het specifiek binden aan receptoren in plantencellen, waardoor een reeks signaalroutes en genexpressie geactiveerd worden die leiden tot vruchtontwikkeling en rijping.
Wat zou het gevolg zijn van etheengebrek in een plant?
Bij gebrek aan etheen zouden vruchten trager of niet rijpen, bladeren minder snel verouderen, en bepaalde stressreacties (zoals bladval of wondsluiting) kunnen trager verlopen. Dit toont aan dat etheen essentieel is voor de regulatie van ontwikkeling en afrijping in planten.
Waarom is extra informatie in de naamgeving van meervoudige bindingen noodzakelijk?
Zonder extra informatie (zoals een positietelwoord) zou de naam van een verbinding niet éénduidig zijn. Aangezien de meervoudige binding op verschillende plaatsen in de koolstofketen kan zitten, is het belangrijk om precies aan te geven waar die binding zich bevindt. Zo vermijd je verwarring tussen verschillende structuren die anders dezelfde naam zouden kunnen krijgen.
Wat is een positietelwoord en wat geeft het aan bij een meervoudige binding?
Een positietelwoord is een cijfer in de systematische naam dat de plaats van een dubbele of drievoudige bindingaanduidt in de koolstofketen. Het cijfer geeft het laagste genummerde koolstofatoom aan dat betrokken is bij de meervoudige binding.
Bijv. in but-2-een zit de dubbele binding tussen C2 en C3.
Vanaf hoeveel C-atomen is een positietelwoord verplicht bij één meervoudige binding, en waarom?
Vanaf vier C-atomen is een positietelwoord verplicht. Dat komt omdat vanaf die lengte de meervoudige binding op verschillende plaatsen in de keten kan voorkomen, wat structuuranaloge isomeren oplevert. Voor ketens met minder dan 4 C-atomen (zoals etheen of propeen) is de plaats van de binding vanzelfsprekend.
Vergelijk dit principe met dat van zijketens. Waarom wordt er een analogie gemaakt in het tekstfragment?
Bij zijketens wordt ook een positietelwoord gebruikt om de plaats aan te duiden (bijv. 2-methylbutaan). De analogie toont aan dat zowel zijgroepen als meervoudige bindingen invloed hebben op de structuur van het molecuul, en dus een precieze plaatsaanduiding vereisen om dubbelzinnigheid in de naamgeving te vermijden.
Waarom is het belangrijk dat de naam van een organische verbinding éénduidig is?
In de chemie moet elke naam exact één specifieke structuur voorstellen. Dit is essentieel voor correcte communicatie, synthese, analyse, en toepassingen. Zonder éénduidigheid kunnen misverstanden ontstaan die leiden tot foute experimenten, vergissingen in medicatie of foutieve industriële toepassingen.
Geef een voorbeeld van een situatie waarbij geen positietelwoord nodig is voor een dubbele binding.
Bij etheen (C₂H₄) en propeen (C₃H₆) is een positietelwoord overbodig omdat de dubbele binding maar op één plaats mogelijk is. De structuur ligt dus vast en er is geen verwarring mogelijk.
Wat is het gevolg voor de naamgeving als je het positietelwoord bij grotere verbindingen weglaat?
Als je het positietelwoord weglaat bij verbindingen met ≥4 C-atomen, kan men niet bepalen waar de meervoudige binding ligt. Hierdoor ontstaat ambigue naamgeving, wat leidt tot onduidelijke communicatie of verkeerde structuurinterpretatie.
Hoe bepaal je het correcte positietelwoord bij meervoudige bindingen?
Je nummer de koolstofketen vanaf het uiteinde dat het dichtst bij de meervoudige binding ligt. De laagste mogelijke locant (positie) wordt gebruikt in de naam. Bijv.: in pent-2-een zit de dubbele binding tussen C2 en C3, wat de laagste nummering oplevert t.o.v. pent-3-een.
Wat is het verschil in naamgevingsregels tussen een meervoudige binding en een functionele groep (zoals OH)?
Voor zowel meervoudige bindingen als functionele groepen zijn positietelwoorden verplicht vanaf ambiguïteit. Echter, functionele groepen (zoals -OH) krijgen prioriteit bij het nummeren van de keten. Bij dubbele bindingen wordt alleen rekening gehouden met de positie van de binding zelf. De prioriteitsvolgorde van functionele groepen speelt dus geen rol bij dubbele bindingen zonder andere groepen.
Leg uit hoe dit principe kadert binnen de IUPAC-naamgeving.
De IUPAC-naamgeving streeft naar logica, éénduidigheid en universele toepasbaarheid. Door het gebruik van positietelwoorden bij meervoudige bindingen wordt voldaan aan het principe van structurele precisie. Elke naam moet eenduidig een specifieke structuur opleveren, wat essentieel is voor internationale communicatie in de chemie.
Wat is de basisregel bij het kiezen van de hoofdketen in de naamgeving van onverzadigde koolwaterstoffen zoals alkenen?
Je kiest de langste koolstofketen. Als er meerdere langste ketens zijn, kies je de keten die de meervoudige binding (dubbele of drievoudige) bevat.
Waarom moet je bij naamgeving van een alkeen, als er meerdere even lange koolstofketens zijn, de keten kiezen die de dubbele binding bevat?
Omdat de dubbele binding prioriteit heeft in de IUPAC-naamgeving. Ze bepaalt het type verbinding (bv. alkeen i.p.v. alkaan), en moet dus in de hoofdketen zitten zodat haar positie correct kan worden aangeduid in de naam.
Gegeven een molecule met meerdere mogelijke hoofdketens van gelijke lengte, waarvan slechts één de dubbele binding bevat. Welke keten kies je volgens de IUPAC-regels en waarom?
Volgens de IUPAC-regels kies je de keten die de dubbele binding bevat, zelfs als een andere keten even lang is. Dit zorgt voor een correcte en éénduidige naam waarin de dubbele binding duidelijk gelokaliseerd is.
Wat bepaalt of de dubbele binding in de hoofdketen of in een zijketen zit?
Als de dubbele binding in de langste koolstofketen opgenomen kan worden, moet ze in de hoofdketen zitten. Alleen als de langste keten niet de dubbele binding bevat, wordt deze als deel van een zijketen benoemd.
Welke uitgang gebruik je voor de stamnaam als er een dubbele binding in de hoofdketen zit?
De uitgang wordt “-een” (zoals in pent-1-een) als er een dubbele binding in de hoofdketen zit. Deze geeft aan dat het om een alkeen gaat.
Hoe geef je de plaats van de dubbele binding weer volgens IUPAC?
Je gebruikt een positietelwoord: het nummer van het laagste genummerde C-atoom dat betrokken is bij de dubbele binding. Je telt dus vanaf de kant die de kleinst mogelijke plaats voor de dubbele binding oplevert.
Bijv.:
3-methylpent-1-een → dubbele binding tussen C1 en C2
Niet “pent-4-een”, want dan is de plaats niet zo klein mogelijk.
Wat gebeurt er als twee meervoudige bindingen even ver van de ketenuiteinden liggen?
Dan begin je te nummeren vanaf het uiteinde dat het dichtst bij een substituent (bv. een zijgroep) ligt. Dit is de tweede prioriteitsregel bij het nummeren.
Wat zijn -ylideen en -ylidyn, en wanneer gebruik je ze?
Deze benamingen worden gebruikt voor zijketens die zelf een meervoudige binding bevatten:
-ylideen: voor zijgroepen met een dubbele binding
-ylidyn: voor zijgroepen met een drievoudige binding
Bijvoorbeeld:
4-ethylideenheptaan → zijgroep met dubbele binding
4-ethynylheptaan → zijgroep met drievoudige binding
Waarom is 3-propyleen-1-een foutief volgens IUPAC?
Omdat de naam impliceert dat de dubbele binding zich in een zijgroep bevindt, terwijl er een langere keten mogelijk is waarin de dubbele binding opgenomen kan worden. Volgens IUPAC-regels moet je dan de dubbele binding in de hoofdketen opnemen. De correcte naam zou dus een langere stam bevatten, bv. 4-ethylideenheptaan.
Wat is het verschil tussen -enyl en -ylideen?
Beide verwijzen naar een zijgroep met een dubbele binding, maar:
-enyl gebruik je als de zijketen met dubbele binding gebonden is via een enkelvoudige binding aan de hoofdketen.
-ylideen gebruik je als de dubbele binding direct verbonden is aan de hoofdketen (dus de dubbele binding zit op het verbindende C-atoom).
Waarom moet je soms de zijketen benoemen met een prefix als -enyl of -ynyl?
Wanneer de langste keten geen dubbele of drievoudige binding bevat, maar de zijketen wel, dan benoem je die zijketen apart. Je gebruikt dan het juiste prefix om aan te geven welk type meervoudige binding de zijketen bevat.
Wat is de correcte naam van een verbinding met 7 C-atomen in de hoofdketen en een etheen-zijketen aan C4?
4-ethylideenheptaan, want:
De hoofdketen bevat 7 C-atomen (heptaan).
De zijketen met dubbele binding is een ethylideen-groep aan C4.
Waarom heeft de dubbele binding altijd voorrang bij het kiezen van de hoofdketen, ook als die keten korter is dan een andere mogelijke keten zonder dubbele binding?
Omdat de IUPAC-regels voorschrijven dat meervoudige bindingen voorrang krijgen op lengte, tenzij er een langere keten is waarin de binding wel past. Dit is om de chemische eigenschappen (zoals reactiviteit) correct te weerspiegelen in de naamgeving.
wanner spreekt men van aromatische verbindingen
Komen er afwisselend enkelvoudige en dubbele bindingen voor tussen de ringvormig gebonden C-atomen, spreekt men van aromatische verbindingen
benoem me de 3 brutoformule met hun algemene benaming van het type ‘onverzadigde koolwaterstof’
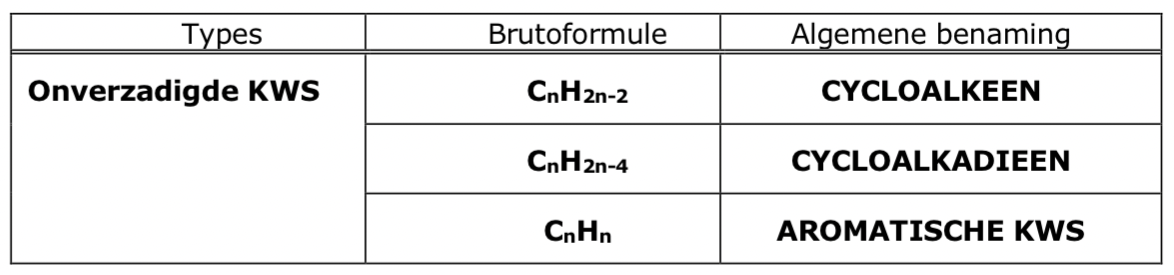
wat is de naamgeving van Cyclische onverzadigde koolwaterstoffen
cyclo + stamnaam bepaald door aantal C-atomen + uitgang -(DI)EEN
Wat zijn de fysische eigenschappen van ethyn zoals vermeld in de tekst?
Ethyn is een kleurloos gas dat onoplosbaar is in water. Onder druk kan het worden gecondenseerd tot vloeistof, maar in die toestand is het explosief.
Waarom moet men bij het transport van ethyn extra voorzorgsmaatregelen nemen?
Omdat ethyn in vloeibare toestand explosief is, en ook ontplofbare mengsels met lucht kan vormen. Daarom moeten bij transport speciale drukcilinders, ventilatie en ontstekingsbeveiliging worden gebruikt.
Wat maakt ethyn bruikbaar als brandstof bij lassen?
De verbranding van ethyn is zeer exotherm: er komt veel warmte vrij. Die hoge temperatuur is voldoende om metalen te doen smelten, wat ideaal is voor toepassingen zoals autogeen lassen.
Waarom is het dragen van een beschermbril noodzakelijk bij het lassen met ethyn?
De vlam van ethyn is intens lichtgevend, wat kan leiden tot oogschade of verblinding. Daarom moeten lassers een donkere, beschermende bril dragen om hun ogen te beschermen tegen het intense licht en straling.
Wat betekent ‘de verbranding is zeer exotherm’ en wat is het energetisch gevolg?
‘Exotherm’ betekent dat er warmte vrijkomt bij een chemische reactie. In dit geval levert de verbranding van ethyn 2600 kJ energie per reactie (voor 2 mol C₂H₂), wat zeer veel is en verklaart waarom de vlam zo heet is.
Geef de gebalanceerde reactievergelijking voor de verbranding van ethyn.
2 C₂H₂ (gas) + 5 O₂ (gas) → 4 CO₂ (gas) + 2 H₂O (gas) + 2600 kJ
Hoeveel mol CO₂ en H₂O ontstaan bij volledige verbranding van 2 mol ethyn?
Volgens de reactievergelijking ontstaan:
4 mol CO₂
2 mol H₂O
per 2 mol ethyn.
Welk gevaar is er verbonden aan mengsels van ethyn en lucht?
Dergelijke mengsels zijn explosief. Ethyn vormt met lucht een brandbaar mengsel dat bij een ontsteking kan ontploffen, zelfs bij relatief lage concentraties.
Waarom wordt ethyn soms ook ‘acetyleen’ genoemd?
‘Acetyleen’ is de triviale (oude) naam voor ethyn. In IUPAC-naamgeving wordt de correcte naam ethyn gebruikt, omdat het een alkyne is met een drievoudige binding tussen twee C-atomen.
Welke binding zit er in ethyn en wat is het effect ervan op reactiviteit?
Ethyn bevat een drievoudige binding (C≡C) tussen de twee koolstofatomen. Deze binding is energierijk en maakt het molecuul erg reactief, vooral bij verbranding of additiereacties.
Wat is de industriële toepassing van etheen zoals vermeld in de tekst?
Etheen wordt gebruikt als grondstof voor de productie van polyetheen, een kunststof die o.a. wordt gebruikt als dekfolie en verpakkingsmateriaal in het huishouden.
Wat is polyetheen en hoe wordt het gevormd uit etheen?
Polyetheen is een polymeer die ontstaat door polymerisatie van etheenmoleculen. Tijdens dit proces breekt de dubbele binding van etheen open en verbinden de moleculen zich tot een lange keten.
Welke rol speelt etheen in de natuur?
Etheen fungeert als een hormoon in planten. Het stimuleert stofwisselingsprocessen die leiden tot het rijpen van vruchten.
Wat is het effect van etheen op vruchten?
De aanwezigheid van etheen activeert het rijpingsproces. Dit houdt onder meer in: zachter worden van het vruchtvlees, kleurverandering, geurontwikkeling en afbraak van zuren en zetmelen.
Waarom voeren importeurs vaak onrijp fruit in?
Onrijp fruit is steviger en bederft minder snel tijdens het transport. Hierdoor kan het over langere afstanden vervoerd worden zonder kwaliteitsverlies.
Hoe zorgen importeurs ervoor dat fruit bij aankomst rijp is voor verkoop?
Ze stellen het fruit bij aankomst bloot aan etheengas, dat het natuurlijke rijpingsproces versnelt. Zo rijpt het fruit op het juiste moment, net voor verkoop.
Waarom is etheen een voorbeeld van een molecule met zowel een industriële als biologische rol?
Etheen wordt industrieel gebruikt als bouwsteen voor kunststof (polyetheen), maar heeft ook een biologische functie als plantenhormoon. Hierdoor speelt het een rol in zowel de chemische industrie als de levenswetenschappen.
Waarom is etheen geschikt als plantenhormoon, ondanks zijn eenvoudige structuur?
Etheen is een klein, gasvormig molecuul dat zich gemakkelijk door plantencellen kan verplaatsen. Het kan zich binden aan specifieke ethyleenreceptoren, die vervolgens genexpressie en enzymactiviteit reguleren die betrokken zijn bij rijping.
Wat is een voordeel voor de handel van het gebruik van etheen bij fruitrijping?
Het gebruik van etheen laat toe om fruit te oogsten en vervoeren vóór het rijp is, en het pas rijp te maken bij aankomst. Dit verlengt de houdbaarheid en vermindert voedselverlies tijdens transport.
Hoe draagt de verbranding of polymerisatie van etheen bij tot zijn toepassingen?
Bij polymerisatie wordt de dubbele binding van etheen benut om lange ketens te vormen (zoals polyetheen). Dit materiaal is licht, sterk en veelzijdig, waardoor het veel gebruikt wordt in verpakkingen, plastic zakken, folie, enz.
Wat maakt alkenen en alkynen reactiever dan alkanen?
De aanwezigheid van een π-binding (pi-binding) maakt alkenen en alkynen reactiever. Deze binding vereist minder energie om te breken dan een σ-binding (sigma-binding), waardoor het molecuul gemakkelijker reageert.
Wat is heterolytische splitsing?
Bij heterolytische splitsing worden beide elektronen van een gebroken binding aan één atoom overgedragen, wat resulteert in de vorming van een kation en een anion. Dit komt vaak voor bij polair gebonden atomen met een verschil in elektronegativiteit.
Wat is een ionaire reactie?
Een ionaire reactie is een organische reactie waarbij ionen ontstaan als tussentoestand. Ze vinden plaats via een polair reactiemechanisme, vaak via elektrofiele additie.
Hoe vindt elektrofiele additie plaats bij een dubbele binding?
Een elektrofiel deeltje valt aan op de elektronenrijke dubbele binding. De dubbele binding breekt, en het eerste elektrofiel bindt aan het C-atoom met de meeste waterstofatomen. Daarna wordt een nucleofiel toegevoegd aan het carbokation dat ontstaat.
Wat betekent “ladingsverschuiving” bij een reactiepijl?
De gebogen pijl toont van waar de elektronen vertrekken naar waar ze naartoe gaan: van het atoom met de hoogste elektronenrijkdom (δ⁻) naar het atoom met de elektronenbehoefte (δ⁺).
Hoe herken je het elektrofiel en nucleofiel in een reactie?
Het elektrofiel is het deeltje met een positieve (deel)lading of een elektronenpaaracceptor.
Het nucleofiel is het deeltje met een negatieve (deel)lading of een vrij elektronenpaar (donor).
Wat is het verschil tussen substraat en reagens?
Het substraat is het molecuul dat verandert tijdens de reactie (bv. een alkeen).
Het reagens is het deeltje dat wordt toegevoegd (bv. HBr, HCl, Br₂…).
Wat zijn de twee soorten organische reacties volgens de aard van het reagens?
Elektrofiele reacties: reagens is elektrofiel (positief of elektronarm).
Nucleofiele reacties: reagens is nucleofiel (negatief of elektronrijk).
Wat is het positief inductief effect (+I-effect)?
Een substituent duwt elektronen naar het C-atoom waarmee het gebonden is, waardoor dit C-atoom positief geladen wordt. Daardoor stabiliseert het een negatieve lading elders in het molecuul.
Wat zegt de regel van Markovnikov?
Bij additie van H-X aan een alkeen wordt het H-atoom gebonden aan het koolstofatoom met de meeste H-atomen, en de X-groep (bv. Br) aan het koolstofatoom met de minste H-atomen.
Wat is een carbokation en waarom is het belangrijk?
Een carbokation is een intermediair met een positieve lading op een C-atoom. Het speelt een cruciale rol in reacties zoals elektrofiele additie en bepaalt vaak waar het tweede deeltje zich zal binden.
Wat is het mesomeer effect?
Het mesomeer effect (M-effect) is de verschuiving van π-elektronen als gevolg van een eigen elektronenpaar op een atoom of groep. Dit stabiliseert het molecuul via mesomerie, waarbij elektronen gedeeld worden over meerdere atomen.
Wat is het verschil tussen +M- en –M-effect?
+M-effect: elektronen worden geschonken naar het systeem (bv. -OH, -OR)
–M-effect: elektronen worden onttrokken aan het systeem (bv. -NO₂, -CO, -CN)
Wat betekent mesomerie en hoe herken je het?
Mesomerie betekent dat een molecuul meerdere structuren (resonantie) kan hebben waarin de elektronen verdeeld zijn over meerdere bindingen. Herkenbaar aan pijltjes tussen structuren of aan elektronenparen op atomen naast dubbele bindingen.
Waarom ontstaat bij additie van HBr aan propeen vooral 2-broompropeen?
Door het +I-effect van de methylgroep wordt het meest stabiele carbokation gevormd bij het middelste C-atoom, waardoor Br daar bindt. Volgens Markovnikov komt de H bij het C met de meeste H’s.
Hoe weet je of een substituent conjugatie veroorzaakt?
Als een substituent rechtstreeks naast een C-atoom met een dubbele binding staat en zelf een vrij elektronenpaar of π-binding heeft, dan is er conjugatie → dit beïnvloedt stabiliteit en reactiviteit.
Wat zijn de kenmerken van een Lewiszuur en Lewisbase?
Lewiszuur = elektronenpaaracceptor (bijv. carbokation, H⁺)
Lewisbase = elektronenpaardonor (bijv. OH⁻, NH₃)