Chapitre 2 : Métabolisme des lipides
1/92
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No study sessions yet.
93 Terms
Pourquoi le métabolisme lipidique est-il central dans le cancer ?
→ Les cellules tumorales en prolifération rapide ont un besoin massif en lipides pour la croissance, la prolifération et l’adaptation au stress.
Quelle molécule constitue le carrefour central du métabolisme lipidique ?
→ L’acétyl-CoA, véritable nœud biochimique reliant de nombreuses voies métaboliques.
Quelles sont les principales sources cellulaires d’acétyl-CoA ?
Le glucose (via le pyruvate et la pyruvate déshydrogénase)
La glutamine (via le métabolisme réducteur)
Les acides gras (via la b-oxydation)
Les corps cétoniques et les acides aminés
Pourquoi les cellules cancéreuses augmentent-elles la disponibilité de l’acétyl-CoA ?
→ Parce qu’il est indispensable à la lipogenèse de novo et à de nombreux processus anaboliques.
Quels types de molécules lipidiques dérivent de l’acétyl-CoA ?
→ Les acides gras, triglycérides, phospholipides, eicosanoïdes de cholestérol, hormones stéroïdes et acides biliaires.
Que peut-on faire d’autres avec acétyl-Coa ?
Il peut être totalement oxydé en dioxyde de carbone et en eau pour fournir de l’énergie.
D’où provient la graisse ?
Les graisses sont une source importante de calories alimentaires. En général, 30 à 40 % des calories de l’alimentation américaine proviennent des graisses.
→ La graisse est la principale forme de stockage d’énergie.
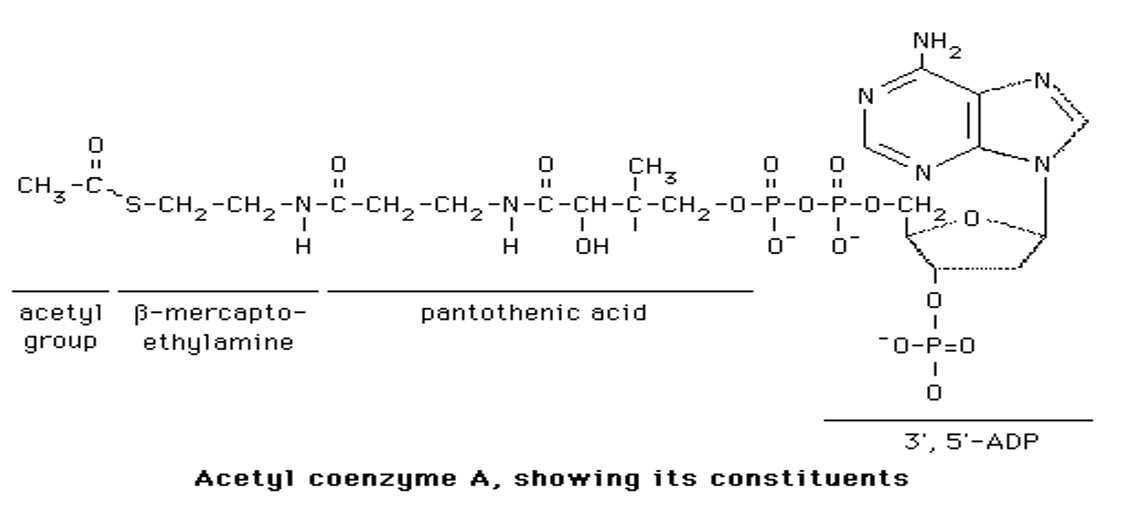
Quelle est la structure de l’acétyl-Coa ?
Groupe acétyl
Coenzyme A :
Bêta-mercaptoéthylylamine
Acide pantothénique (non synthétisé chez l’homme — un nutriment essentiel)
Phosphate
3', 5'-adénosine diphosphate
Quelle est la première étape de la lipogenèse de novo ?
→ L’export du citrate mitochondrial vers le cytosol.
Pourquoi le citrate est-il utilisé comme vecteur de carbone lipidique ?
→ Il permet de transférer le carbone issu du glucose ou de la glutamine vers les voies lipidiques
Combien d’enzymes orchestrent la transformation du citrate en acide gras ?
3 enzymes, toutes surexprimées dans les cancers.
Quelle enzyme convertit le citrate cytosolique en acétyl-CoA ?
→ ACLY (ATP citrate lyase).
Pourquoi ACLY est-elle cruciale dans les cellules cancéreuses ?
→ Elle est nécessaire à la production d’acétyl-CoA cytosolique et à la transformation tumorale.
Quelle enzyme convertit l’acétyl-CoA en malonyl-CoA ?
→ ACC (acetyl-CoA carboxylase).
Pourquoi le malonyl-CoA est-il un métabolite clé ?
→ Il constitue le précurseur indispensable à l’élongation des chaînes d’acides gras.
Quel est l’impact de l’inhibition d’ACC dans certains cancers ?
→ Une réduction significative de la croissance tumorale, notamment dans le cancer de la prostate.
Quelle enzyme catalyse la synthèse des acides gras longs ?
→ FASN (fatty acid synthase).
Quel est le produit principal de l’activité de FASN ?
→ Le palmitate à partir d’acétyl-Coa
Pourquoi FASN est-elle considérée comme un marqueur tumoral important ?
→ Elle est fortement surexprimée dans de nombreux cancers (sein, prostate) et associée à un mauvais pronostic comme le montre le marqueur OA-51 dans le cancer du sein.
Que devient le palmitate après sa synthèse ?
→ Il peut être allongé ou désaturé pour former une grande diversité d’acides gras complexes.
Quel est le rôle principal des acides gras dans les cellules tumorales ?
→ Fournir les lipides nécessaires à la synthèse des membranes cellulaires.
→ Formation de lipid droplets.
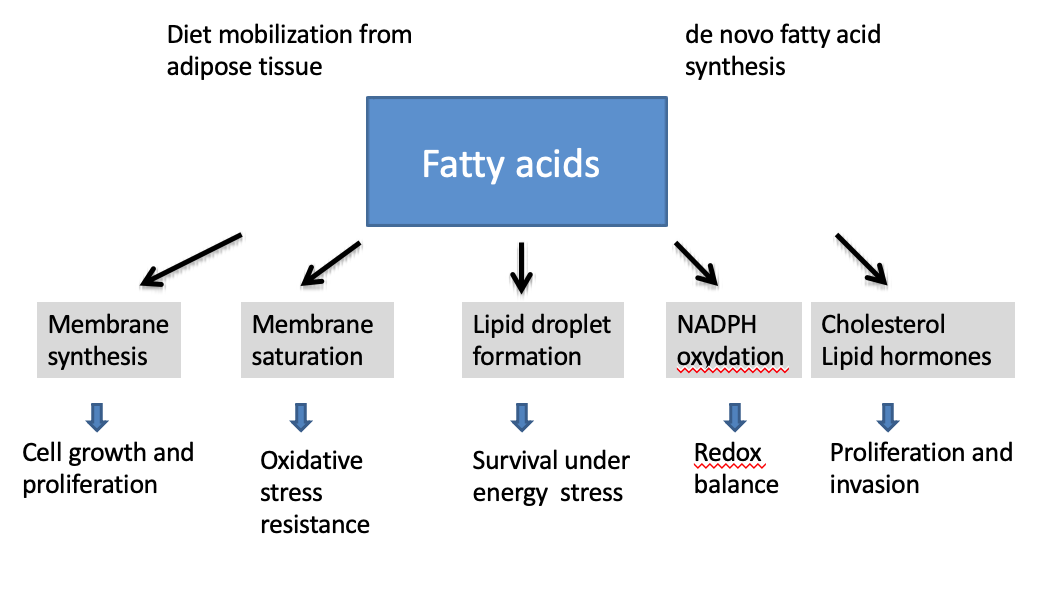
Comment la saturation des acides gras dans les membranes influence-t-elle la survie cellulaire ?
→ Elle augmente la résistance au stress oxydatif, protégeant la cellule d’un environnement réactif.
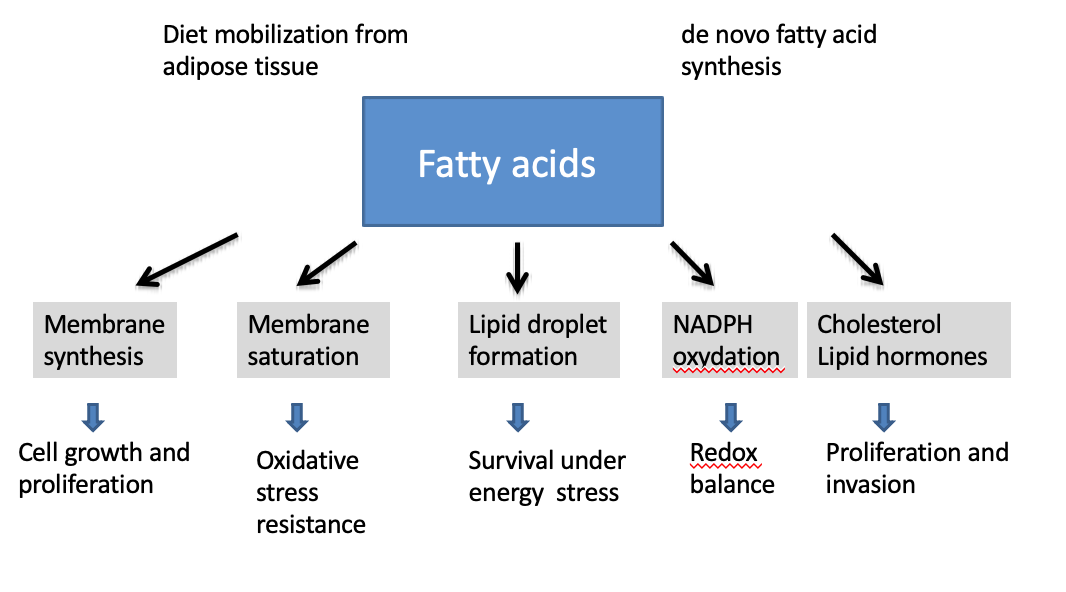
Que sont les lipid droplets et quel est leur rôle ?
→ Des réserves lipidiques servant de source d’énergie lors de stress métabolique.
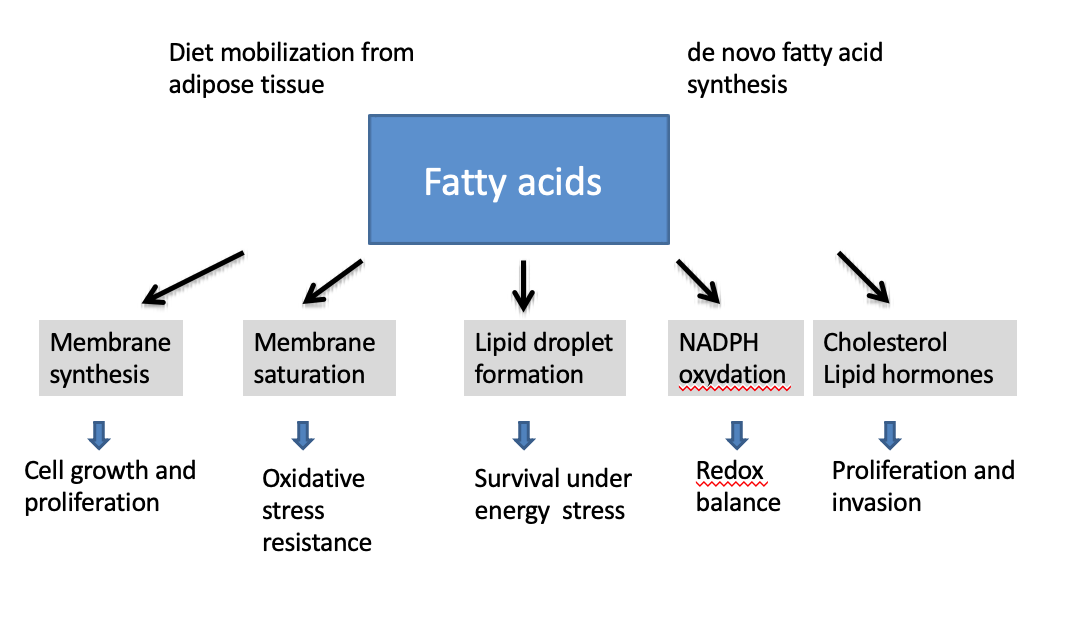
Pourquoi les lipid droplets sont-ils importants dans le cancer ?
→ Ils permettent aux cellules tumorales de survivre à des conditions défavorables.
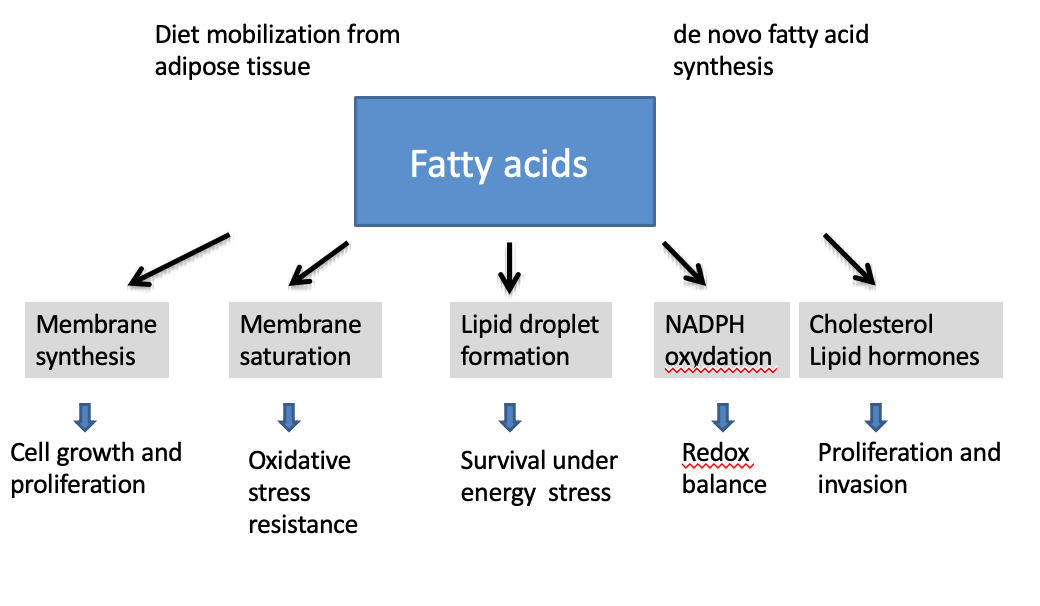
Quel est le lien entre lipogenèse et équilibre redox ?
→ La synthèse lipidique consomme ou produit du NADPH, essentiel au contrôle des ROS.
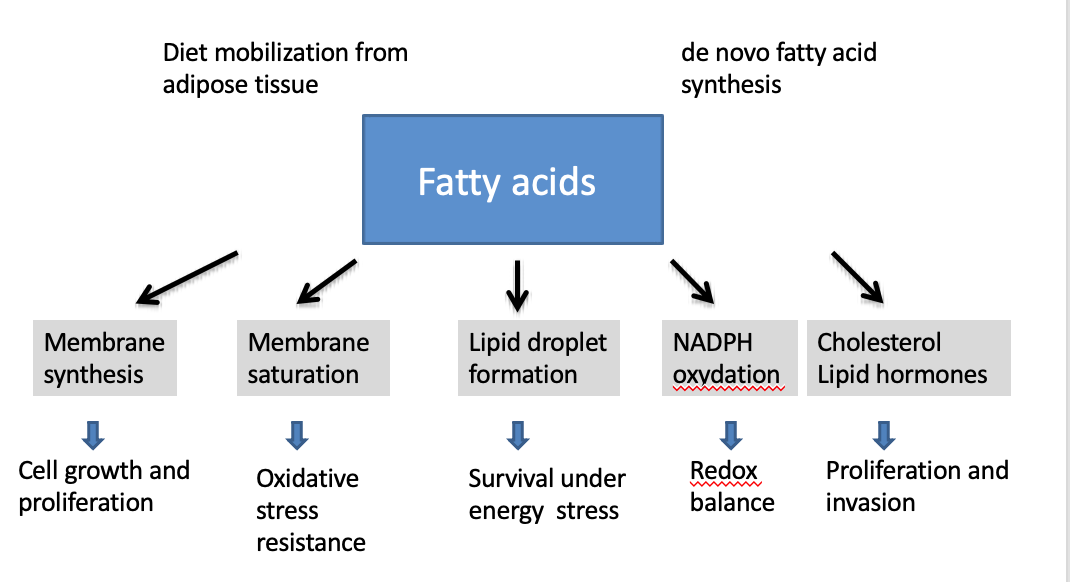
Pourquoi le cholestérol et les hormones stéroïdiennes sont-ils important dans les cellules cancéreuses ?
→ Il soutient la prolifération,l’invasion et certains formes d’hormono-dépendances tumorales
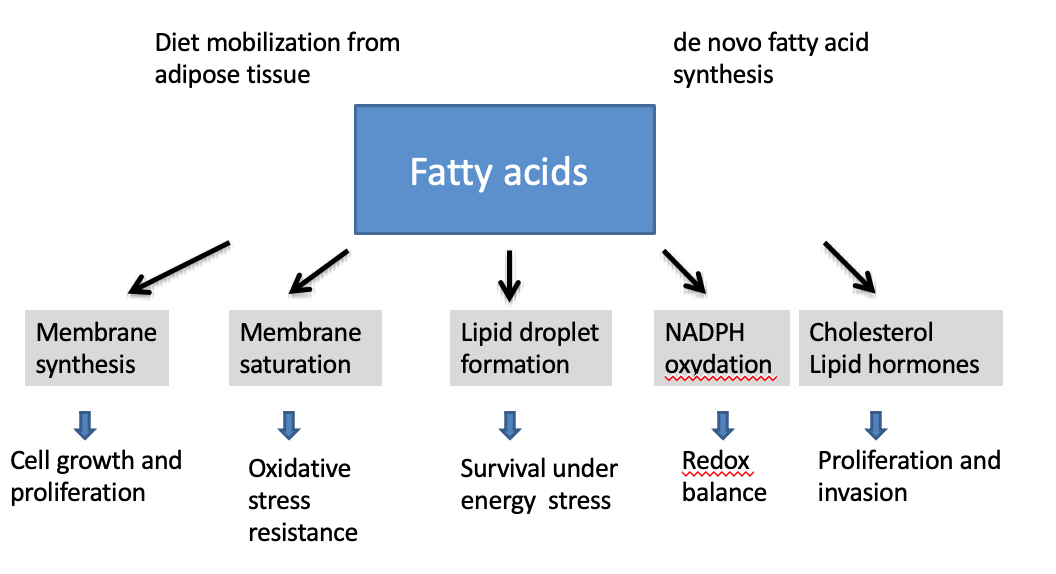
La lipogenèse tumorale est-elle toujours constitutive ?
→ Non, elle peut être activée de manière adaptative en réponse aux traitements.
Dans quel contexte thérapeutique la lipogenèse est-elle souvent augmentée ?
→ Lors de traitements anti-angiogéniques.
Pourquoi l’augmentation de la lipogenèse aide-t-elle à résister aux thérapies ?
→ Elle permet aux cellules de survivre malgré une baisse d’apport en nutriments.
Quel lien existe entre lipid droplets et agressivité tumorale ?
→ Leur accumulation est associée à des phénotypes tumoraux plus agressifs.
Pourquoi le métabolisme lipidique tumoral ne dépend-il pas uniquement de la lipogenèse de novo ?
→ Parce que les cellules tumorales exploitent aussi les lipides fournis par le microenvironnement, en particulier les adipocytes.
Quels métabolites les adipocytes libèrent-ils au profit des cellules tumorales ?
→ Des acides gras libres, des cytokines (IL-6, IL-8) et d’autres facteurs pro-tumoraux.
Quel est l’effet des acides gras libres (FFA) sur les cellules cancéreuses ?
→ Ils fournissent un carburant énergétique et des briques pour la biosynthèse lipidique.
Comment l’obésité et le diabète favorisent-ils la progression tumorale ?
→ En induisant une inflammation chronique et une libération accrue de nutriments utilisables par la tumeur.
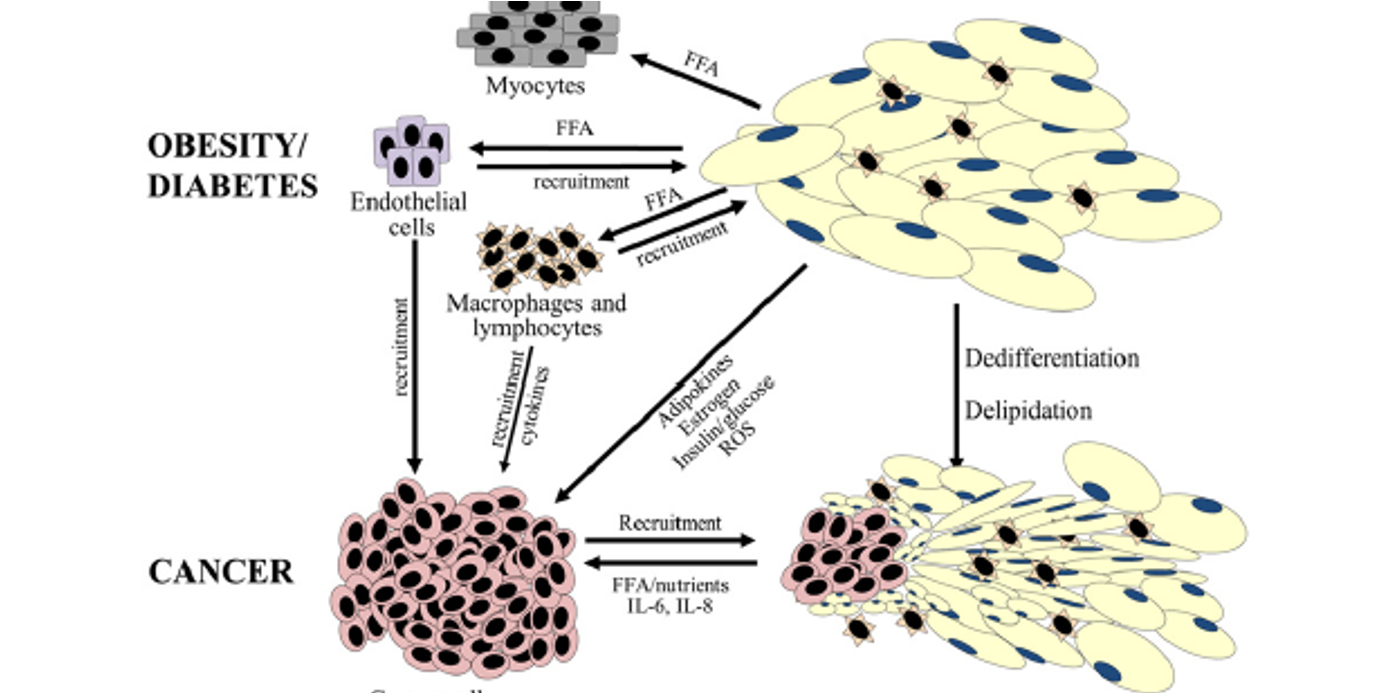
Quels types de cellules sont recrutés dans ce contexte inflammatoire ?
→ Des macrophages, des lymphocytes et des cellules endothéliales.
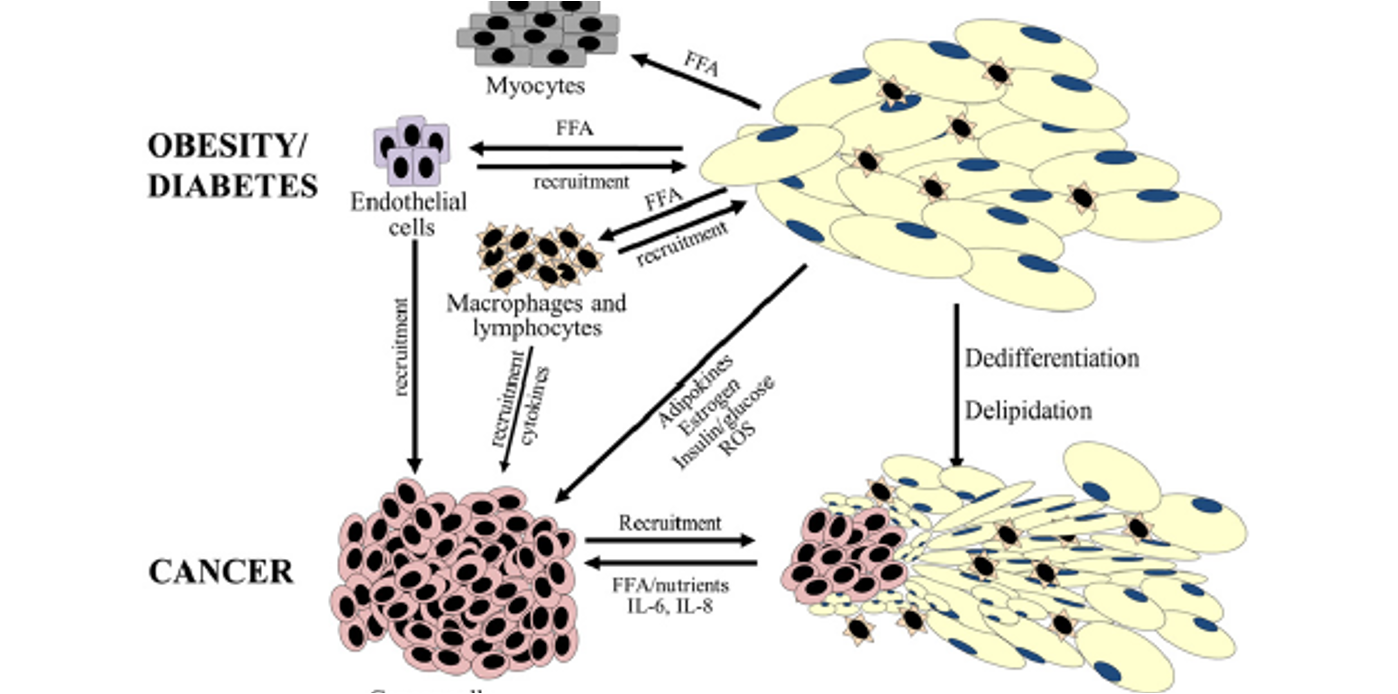
Que deviennent les adipocytes au contact direct de la tumeur ?
→ Ils subissent une délipidation et une dédifférenciation.
Pourquoi cette transformation des adipocytes est-elle pro-tumorale ?
→ Elle augmente la disponibilité en lipides et en signaux favorisant la croissance.
Quels cancers bénéficient particulièrement d’un environnement riche en tissu adipeux ?
→ Les cancers du sein, de l’ovaire et du pancréas.
Qu’est-ce que la cachexie ?
La cachexie (syndrome d’emaciation) est une affection qui provoque une perte de poids significative et musculaire
Qui est-ce qui est touché par la cachexie ?
Il touche souvent les personnes atteintes de maladies chroniques graves comme un cancer avancé et des maladies cardiaques. Un diagnostic de cachexie signifie souvent que la fin de vie est proche. Les professionnels de santé traitent la cachexie en gérant la condition sous-jacente et en améliorant la nutrition.
Quelle famille de facteurs de transcription contrôle la lipogenèse tumorale ?
→ Les facteurs SREBP (Sterol Regulatory Element-Binding Proteins).
Quel est le rôle physiologique normal de SREBP ?
→ Ajuster la synthèse des acides gras et du cholestérol selon les besoins cellulaires et du niveau intracellulaire de stérols.
Pourquoi SREBP est-il anormalement activé dans les cellules cancéreuses ?
→ Parce que des voies oncogéniques contournent les mécanismes de régulation physiologiques.
Quelles voies de signalisation stimulent l’activation de SREBP dans le cancer ?
→ Akt/mTORC1, E2F, la perte de pRB et certaines mutations de p53.
Quels suppresseurs de tumeurs freinent normalement l’activité de SREBP ?
→ LKB1 et AMPK.
Que se passe-t-il lorsque ces freins sont levés ?
→ Une activation chronique de la lipogenèse.
Quels gènes lipogéniques sont induits par SREBP ?
→ ACLY, ACC, FASN, SCD et d’autres enzymes de biosynthèse lipidique.
Où se situe SREBP avant son activation ?
→ Au niveau du réticulum endoplasmique.
Avec quelle protéine SREBP est-il associé dans l’ER ?
→ SCAP.
Quel est le rôle de la protéine INSIG ?
→ Retenir le complexe SREBP–SCAP dans l’ER lorsque les stérols sont abondants.
Que se passe-t-il lorsque le niveau de stérols diminue ?
→ SCAP se dissocie d’INSIG, permettant l’export du complexe.
Vers quel compartiment cellulaire SREBP est-il alors transporté ?
→ L’appareil de Golgi via des vésicules COPII.
Que subit SREBP au niveau du Golgi ?
→ Deux clivages protéolytiques successifs par deux protéases
Quel est le devenir du fragment actif de SREBP ?
→ Il migre dans le noyau.
Quelle est la fonction nucléaire de SREBP ?
→ Activer la transcription des gènes impliqués dans la biosynthèse lipidique et membranaire.
Comment les cellules cancéreuses détournent-elles le système SREBP ?
→ Elles miment un état de famine lipidique permanente.
Quel est le résultat métabolique de cette activation chronique ?
→ Un flux continu de lipides néosynthétisés.
Pourquoi ce flux lipidique est-il indispensable à la croissance tumorale ?
→ Il soutient la prolifération, la formation des membranes et l’adaptation au stress.
Quel lien existe entre SREBP et la résistance thérapeutique ?
→ L’augmentation de la lipogenèse aide les cellules à survivre à des contraintes métaboliques induites par les traitements.
Pourquoi la voie du mévalonate est-elle fondamentale dans le métabolisme lipidique tumoral ?
→ Elle est indispensable à la synthèse du cholestérol mais surtout à la production d’isoprénoïdes nécessaires à l’activation de nombreuses protéines oncogéniques.
Quel est le point de départ métabolique de la voie du mévalonate ?
→ L’acétyl-CoA.
Quelle enzyme catalyse la formation de l’acétoacétyl-CoA à partir de l’acétyl-CoA ?
→ L’acétyl-CoA acétyltransférase (ACAT).
Quelles enzymes transforment l’acétoacétyl-CoA en mévalonate ?
→ HMGCS puis HMGCR.
Pourquoi HMGCR est-elle une enzyme clé en cancérologie ?
→ Elle est la cible des statines et contrôle une étape limitante de la voie.
Quels métabolites dérivés du mévalonate sont essentiels à la signalisation oncogénique ?
→ Le farnesyl-pyrophosphate et le geranylgeranyl-pyrophosphate.
Quel est le rôle de ces intermédiaires isoprénoïdes ?
→ Permettre la prénilation et l’ancrage membranaire de protéines oncogéniques.
Quelles protéines sont classiquement dépendantes de la prénilation ?
→ Les petites GTPases comme RAS, Rho et Rac.
Pourquoi la prénilation est-elle indispensable à l’activité de RAS ?
→ Elle permet son ancrage à la membrane plasmique, condition nécessaire à sa signalisation.
Quel message conceptuel illustre la voie du mévalonate dans le cancer ?
→ Elle stabilise et active les moteurs moléculaires de la prolifération tumorale.
Que se passe-t-il lorsque les cellules tumorales internalisent beaucoup d’acides gras polyinsaturés ?
→ Ils peuvent être transformés en métabolites lipidiques réactifs.
Quels sont les principaux produits de la peroxydation lipidique ?
→ Le malondialdéhyde (MDA), le 4-hydroxynonénal (4-HNE) et les isoprostanes.
Pourquoi ces métabolites sont-ils potentiellement toxiques ?
→ Ils peuvent endommager l’ADN, modifier les protéines et altérer l’intégrité des membranes.
Pourquoi ces mêmes composés peuvent-ils aussi favoriser la tumorigenèse ?
→ À faibles doses, ils participent à la signalisation cellulaire, favorisant l’hétérogénéité et la plasticité métabolique des tumeurs.
Quel paradoxe du stress oxydatif est illustré dans le cancer ?
→ Un niveau modéré favorise la progression tumorale, tandis qu’un excès est létal.
Quelle enzyme protège les cellules cancéreuses contre la peroxydation lipidique excessive ?
→ La glutathion peroxydase 4 (GPX4).
Quel type de mort cellulaire est déclenché en cas de peroxydation lipidique incontrôlée ?
→ La ferroptose ou l’apoptose.
Pourquoi certaines tumeurs deviennent-elles dépendantes de GPX4 ?
→ Parce qu’elles vivent à la limite d’un stress lipidique toxique.
Quel est l’intérêt thérapeutique de cette dépendance ?
Que font les peroxydes lipidiques ?
Altération de l’expression génique via l’activation des PPARs
Modification de la fluidité cellulaire
Déclenchement de réponse au stress comme Unfolded Protein Response (UTR)
Favorise l’angiogénèse, l’inflammation et les réponses immunitaires locales
Quel nutriment est fortement capté pour soutenir cette activité biosynthétique ?
→ Le glucose.
Pourquoi les cellules tumorales captent-elles excessivement le glucose ?
→ Pour produire de l’ATP mais aussi des précurseurs carbonés destinés aux voies biosynthétiques
Comment cette reprogrammation est-elle exploitée en imagerie médicale ?
→ Par des PET scans utilisant le ¹⁸F-FDG ou des traceurs dérivés de la choline.
Sur quel principe est basé le PET-scan ?
Les cellules tumorales réactivent en permanence la lipogénèse de novo et captent anormalement le glucose.
Comment le glocuse alimente-t-il la croissance cellulaire ?
Via de l’ATP
En fournissant du ribose, du NAPDH et d’autres précurseurs nécessaire à la production de membranes, nucléotides et ribosomes.
Par quoi est guidée la reprogrammation métabolique des cellules cancéreuses ?
→ Elle est pilotée par les oncogènes et les suppresseurs de tumeurs qui coordonnent glycolyse, métabolisme de la glutamine et lipogenèse.
Comment la voie PI3K/Akt influence-t-elle le métabolisme tumoral ?
→ Elle augmente fortement l’entrée du glucose
Quel est l’effet de KRAS oncogénique sur le métabolisme ?
→ Il stimule la glycolyse et l’expression d’enzymes métaboliques clés.
Quel rôle jouent p53 et c-Myc?
Régule le métabolisme de la glutamine essentielle pour alimenter l’anaplorèse du cycle cellulaire et la production de citrate.
Pourquoi ces voies métaboliques sont-elles fortement interconnectées ?
→ Elles créent un environnement métabolique favorable à la croissance et à la division cellulaire.
Pourquoi cibler des régulateurs comme SREBP est-il thérapeutiquement intéressant ?
→ Parce que cela fragilise la dépendance des cellules tumorales à la lipogenèse.
Quel rôle global jouent les lipides au-delà de l’énergie et des membranes ?
→ Ils servent de plateformes de signalisation et de médiateurs de communication cellulaire.
Comment le métabolisme lipidique influence-t-il le microenvironnement tumoral ?
→ Il module l’angiogenèse, la réponse immunitaire et la résistance aux traitements.
Quelle est l’idée clé reliant oncogenèse et métabolisme lipidique ?
→ La reprogrammation métabolique est une composante active de la transformation tumorale et une source de vulnérabilités thérapeutiques.