🌱🧪 Biochemia - Kinetyka reakcji enzymatycznych ⚙️⏩️
1/39
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
40 Terms
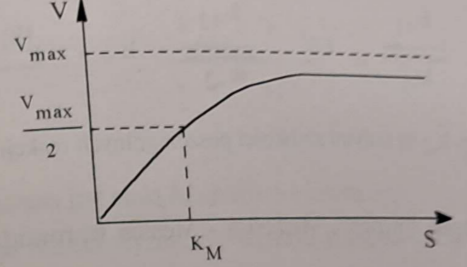
🪫 Przy niskich stężeniach substratu (S) - szybkość reakcji (V) jest proporcjonalna do stężenia substratu (reakcja I rzędu);
🔋 W miarę zwiększania stężenia substratu (S) - zależność szybkości od substratu zmniejsza się (reakcja mieszanego rzędu);
⚡ Przy wysokich stężeniach substratu (S) - szybkość reakcji (V) osiąga Vmax - jedynym czynnikiem ograniczającym szybkość reakcji jest stężenie enzymu.
🏃♂⚗ Opisz zależność szybkości reakcji (V) od stężenia substratu (S).
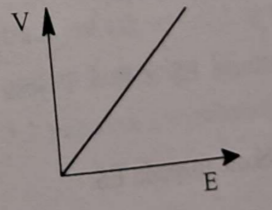
⚖✅ Szybkość reakcji (V) jest proporcjonalna do stężenia enzymu (E).
Liniowy wzrost szybkości reakcji jest widoczny tylko na początku - dalej następuje spadek zależności spowodowany:
nagromadzeniem produktów reakcji (zgodnie z regułą przekory);
spadkiem ilości substratu.
🏃♂⚙ Opisz zależność szybkości reakcji (V) od stężenia enzymu (E).
Opisz również dynamikę widoczności zmian, oraz czynniki wpływające na jej zmianę [2].
![<p><span data-name="man_running" data-type="emoji">🏃♂</span><span data-name="alembic" data-type="emoji">⚗</span><span><span> </span></span>Równanie określa ilościową zależność między szybkością reakcji enzymatycznej a stężeniem substratu.</p><p>Oznaczenia:</p><ul><li><p>K<sub>M</sub> - stała Michaelisa-Ment<span>z</span>en; K<sub>M</sub>=<span>{</span>([E]-[ES])[S]}/{[ES]} lub K<sub>M</sub>={k<sub>-1</sub>+k<sub>+2</sub>}/{k<sub>+1</sub>};</p></li><li><p>Vmax - szybkość maksymalna reakcji;</p></li><li><p>[S] - stężenie substratu;</p></li><li><p>[E] - stężenie enzymu;</p></li><li><p>[ES] - stężenie kompleksu enzym-substrat;</p></li><li><p>k<sub>+1</sub>, k<sub>-1</sub>, k<sub>+2</sub> - stałe szybkości reakcji.</p></li></ul><p></p>](https://knowt-user-attachments.s3.amazonaws.com/8551e98c-562e-4dfd-a3b6-ceadede0c47e.png)
🏃♂⚗ Równanie określa ilościową zależność między szybkością reakcji enzymatycznej a stężeniem substratu.
Oznaczenia:
KM - stała Michaelisa-Mentzen; KM={([E]-[ES])[S]}/{[ES]} lub KM={k-1+k+2}/{k+1};
Vmax - szybkość maksymalna reakcji;
[S] - stężenie substratu;
[E] - stężenie enzymu;
[ES] - stężenie kompleksu enzym-substrat;
k+1, k-1, k+2 - stałe szybkości reakcji.
⚖⚗ Opisz dynamikę równania Michaelisa-Mentzen.
Opisz również zależności wynikające z tego równania.
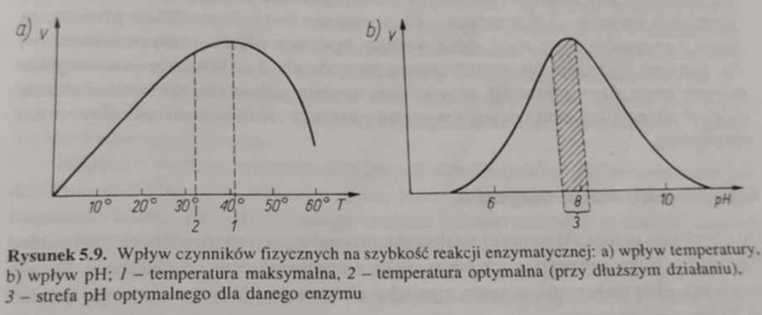
🏃♂⏩️ Początkowo szybkość reakcji (V) wzrasta wraz ze wzrostem temperatury;
🌡 Reguła van’t Hoffa precyzuje, że szybkość reakcji enzymatycznej podwaja się przy wzroście temperatury o 10oC;
🤒⛓💥️ Po osiągnięciu konkretnej temperatury (T≈42oC) następuje gwałtowny spadek szybkości reakcji (V), spowodowany denaturacją białek enzymatycznych.
🏃♂🌡 Opisz wpływ temperatury na szybkość reakcji enzymatycznej.
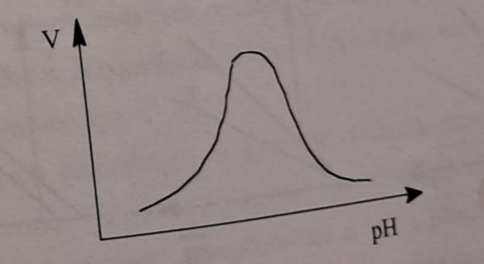
🤷♂ Optymalny poziom pH dla większości enzymów występuje w okolicach odczynu obojętnego.
W wyjątkowych przypadkach optimum przypada na odczyn kwasowy lub zasadowy;🔀🧩 pH powoduje również dysocjację podjednostek enzymów oligomerycznych;
⛓💥🍼 Skrajne wartości pH powodują denaturację białka enzymatycznego.
🏃♂ Opisz wpływ pH na szybkość reakcji enzymatycznej [3].
👍 Optimum pH:
🍗 Pepsyna - [1,5-2,5];
🍬 Amylaza ślinowa (słodowa) - [4,5];
🥤 Fosfataza kwaśna - [4,5-5,0];
🍗 Trypsyna - [8,0-9,5];
🌻 Lipaza trzustkowa [7,8-8,3];
🥤 Fosfataza zasadowa [8,0-9,0].
❓ Wymień optymalne wartości pH dla konkretnych enzymów:
🍗 Pepsyna;
🍬 Amylaza ślinowa (słodowa);
🥤 Fosfataza kwaśna;
🍗 Trypsyna;
🌻 Lipaza trzustkowa;
🥤 Fosfataza zasadowa.
⚙⛓💥 Inaktywatory działają hamująco na enzym poprzez denaturację całego białka enzymatycznego.
⛔️❔ Opisz sposób działania inaktywatorów.
⛔️❓ Rodzaje inaktywatorów:
🔨 Czynniki fizyczne:
zmiana pH;
🌡 zmiana temperatury;
⚗ Czynniki chemiczne:
🧯 rozpuszczalniki organiczne;
🪖 sole metali ciężkich.
⛔️❓ Wymień rodzaje inaktywatorów [2/4].

⛔️🤖 Inaktywacja/inhibicja kationami metali ciężkich (np. Pb2+, Ag+, Hg2+, Cu2+) polega na ich nieodwracalnym wiązaniu z enzymem.
⛑❗ Sposobem na odwrócenie tej inaktywacji jest wprowadzenie do układu/organizmu związków zawierających grupy tiolowe np. cysteina, lub chelatujące np. EDTA lub Wersanian.
⛔️🤖 Opisz sposób inhibicji/inaktywacji jonami metali ciężkich.
Opisz również sposób na odwracanie tego rodzaju inhibicji/inaktywacji.
⛓🥛 Składnikami reakcji enzymatycznej są enzym, substrat(y), koenzym, kofaktor. Ich wzajemne powiązanie w określony układ przestrzenny pozwala na zajście reakcji.
Inhibicja polega na działaniu modyfikującym przestrzenny układ tych składników, co zmniejsza szybkość reakcji.
🛑⚙ Opisz sposób działania inhibitorów.
Inhibicja od inaktywacji różni się odwracalnością:
🛑🔂 inhibicja może być odwracalna lub nieodwracalna;
⛔⛓💥️ inaktywacja jest tylko nieodwracalna.
🛑⛔️ Określ różnicę między inhibicją, a inaktywacją.
🛑❓ Typy inhibicji:
🏆 Inhibicja kompetycyjna;
🎩 Inhibicja niekompetycyjna;
🪖 Inhibicja akompetycyjna.
🛑❓ Wymień typy inhibicji [3].
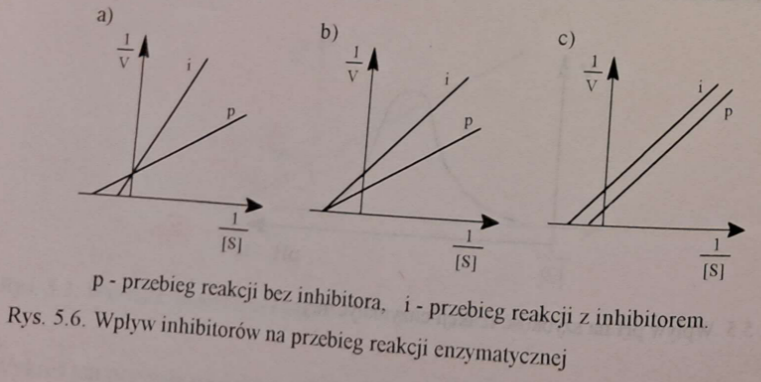
🛑⚙ Inhibitor ma strukturę cząsteczkową podobną do struktury substratu i rywalizuje z nim o miejsce aktywne enzymu. Zwiększenie stężenia substratu na powrót zwiększa szybkość reakcji enzymatycznej.
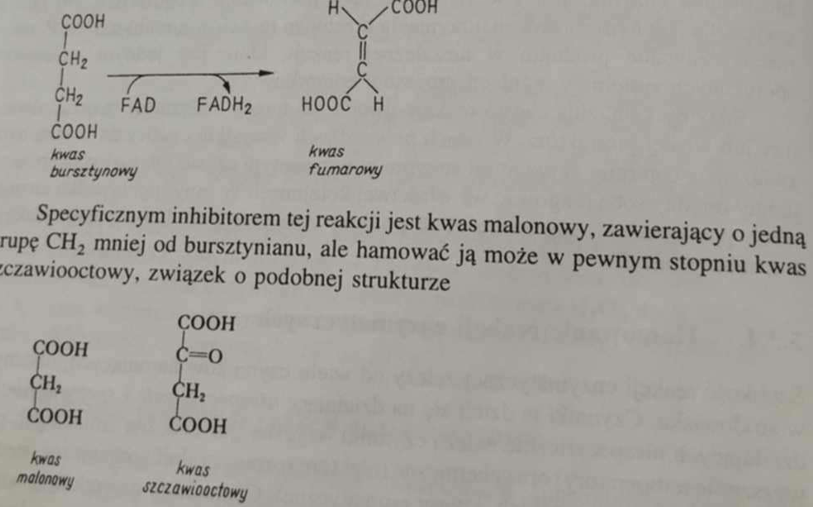
ℹ🛑 Klasycznym przykładem inhibicji jest działanie dehydrogenazy bursztynianowej - substratem, którego reakcję katalizuje enzym jest bursztynian, inhibitorem kompetycyjnym jest natomiast malonian, szczawian, szczawiooctan.
📉❓ Wzrasta wartość KM, wartość Vmax pozostaje niezmieniona.
🛑🏆 Opisz mechanizm inhibicji kompetycyjnej.
Opisz również wpływ na jednostki równania Michaelisa-Menten.
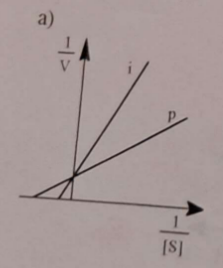
![<p><span>🛑🗺 </span>Inhibitor <strong>nie łączy się z centrum aktywnym, tylko z innym fragmentem enzymu</strong>, co zmienia strukturę centrum aktywnego uniemożliwiając tworzenie kompleksu enzym-substrat ES - nie rywalizuje z substratem, więc jest niewrażliwy na wzrost stężenia substratu [S].</p><p><span data-name="info" data-type="emoji">ℹ</span><span data-name="octagonal_sign" data-type="emoji">🛑</span> Klasycznym przykładem jest inhibitor <em>pepstatyna</em>, która może hamować <em>reninę</em>.</p><p><span data-name="chart_decreasing" data-type="emoji">📉</span><span data-name="question" data-type="emoji">❓</span><span><span> </span></span>Spada wartość V<sub>max</sub>, wartość K<sub>M</sub> pozostaje niezmieniona.</p>](https://knowt-user-attachments.s3.amazonaws.com/119cf7e9-cb65-4cc7-87c3-52ff1bee1138.png)
🛑🗺 Inhibitor nie łączy się z centrum aktywnym, tylko z innym fragmentem enzymu, co zmienia strukturę centrum aktywnego uniemożliwiając tworzenie kompleksu enzym-substrat ES - nie rywalizuje z substratem, więc jest niewrażliwy na wzrost stężenia substratu [S].
ℹ🛑 Klasycznym przykładem jest inhibitor pepstatyna, która może hamować reninę.
📉❓ Spada wartość Vmax, wartość KM pozostaje niezmieniona.
🛑🎩 Opisz mechanizm inhibicji niekompetycyjnej.
Podaj klasyczny przykład tego rodzaju inhibicji. Opisz również wpływ na jednostki równania Michaelisa-Menten.

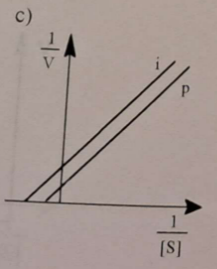
🛑🏗 Inhibitor nie łączy się z wolnym enzymem, natomiast reaguje z kompleksem enzym-substrat ES.
📉❓ Zmniejszają się wartości pozornej Vmax i pozornej KM.
🛑🪖 Opisz mechanizm inhibicji akompetycyjnej.
Opisz również wpływ na jednostki równania Michaelisa-Menten.
🧮 Aktywność molekularna/liczba obrotów;
🌏 Uniwersalna jednostka aktywności (U);
🎓 Katal (kat);
⚙ Aktywność właściwa enzymu;
⚖ Aktywność molarna.
⚙📈 Wymień sposoby wyrażania aktywności enzymu [5].
⚖ Liczba moli substratu, która przereaguje…
⚙ …z jednym molem enzymu…
⏱ …w ciągu 1 minuty.
…lub dokładniej…
dP/dt = V = k[ES] = k[E]t
k[E]t - suma stężenia enzymu wolnego i związanego w postaci ES;
Dla [E]=[ES], [E]t - stężenie moli centrów aktywnych [mol/dm3], stała k to aktywność molekularna, czyli:
Liczba moli substratu, która przereaguje…
…w ciągu 1 minuty…
…z 1 molem centrów aktywnych enzymu.
Określenie można zastosować jedynie przy znanej ⚖ masie cząsteczkowej i 🧩 budowie białka enzymatycznego.
📈🧮 Opisz sposób określania aktywności enzymu pod kątem aktywności molekularnej.
Określ również warunki konieczne dla określenia aktywności tą metodą.
⚙ Ilość enzymu, która…
⏱ …w ciągu 1 minuty…
⚖ …przekształca 1 µmol substratu.
1 U = 16,67 nKat
Określenie ma zastosowanie w standardowych warunkach:
🌡 T=30oC;
Optymalne pH;
⚗ Optymalne [S].
📈🌏 Opisz sposób określania aktywności enzymu pod kątem uniwersalnej jednostki aktywności (U).
Określ również warunki konieczne dla określenia aktywności tą metodą.
⚙ Ilość enzymu, która…
⏱ …w ciągu 1 sekundy…
⚖ …przekształca 1 mol substratu.
1 Kat = 6.107 U
Określenie ma zastosowanie w standardowych warunkach:
🌡 T=30oC;
Optymalne pH;
⚗ Optymalne [S].
📈🎓 Opisz sposób określania aktywności enzymu pod kątem jednostki Katala (Kat).
Określ również warunki konieczne dla określenia aktywności tą metodą.
🎓⚖ Liczba katali przypadająca na 1 kg aktywnego białka.
📈⚙ Opisz sposób określania aktywności enzymu pod kątem aktywności właściwej.
🎓⚖ Liczba katali przypadająca na 1 mol enzymu.
📈⚖ Opisz sposób określania aktywności enzymu pod kątem aktywności molarnej.
🔗🧱 Reakcja między dwiema cząsteczkami substratu(ów) nastąpi po zetknięciu odpowiednimi miejscami z wystarczająco dużą energią kinetyczną.
🔨🚦 Czynniki ograniczające:
💧 Prędkość dyfuzji - 2,27.10-5 cm/s (dla cząsteczek H2O przy T=25oC);
💢 Niekulisty kształt cząsteczek;
🍯 Lepkość roztworu;
🦠 Objętość komórek i organelli;
🌐 Rozmiar cząsteczki - z uwagi na wolniejsze tempo obrotu i mniejszy % udział sfery aktywnej im większa cząsteczka, tym mniejsza szansa na zderzenie z innym substratem z udziałem fragmentu reagującego.
🔨🚦 Opisz zależności dotyczące fizycznych czynników ograniczających szybkość reakcji nieenzymatycznych.
Nie chodzi o inaktywatory.
🧩 Aktywacja przez kofaktory;
🌋 Aktywacja proteolityczna;
🔗 Modyfikacja kowalencyjna;
🧩 Regulacja allosteryczna o charakterze aktywacji;
🍼 Aktywacja przez białka regulatorowe.
✅⚙ Wymień mechanizmy aktywacji enzymu [5].
⚙✅ Przekształcenie nieaktywnej formy enzymu (proenzymu, zymogenu) w formę aktywną.
Przykładowe zymogeny:
🍗 Trypsynogen;
🍗 Pepsynogen;
🍗 Chymotrypsynogen.
🍬 Ich wydzielanie następuje przez komórki trzustki, a aktywacja następuje po wydzieleniu do światła p. pokarmowego (dwunastnicy) poprzez odłączenie peptydu blokującego przez inny enzym proteolityczny.
⛓💥 Np. aktywacja trypsynogenu następuje z udziałem enteropeptydazy lub samej trypsyny, przez odłączenie heksapeptydu (Val-Asp-Asp-Asp-Asp-Lys).
🛡 Wydzielenie w formie nieaktywnej zabezpiecza komórki i narządy przed samostrawieniem.
🌋✅ Opisz mechanizm aktywacji proteolitycznej.
Wymień też przykładowe enzymy w formie nieaktywnej, opisz na przykładzie sposób wydzielania, oraz określ korzyści z takiego sposobu wydzielania.
🔩🪖 To inhibitor niekompetycyjny.
🔗🔧 Bierze udział w zjawisku allosterii, gdzie wiąże się z centrum regulatorowym białka allosterycznego.
🔩❓ Opisz czym jest modyfikator/efektor allosteryczny.
Określ z jakiego mechanizmu korzysta i w jakim zjawisku bierze udział.
🧩🔧 To podjednostka enzymu zawierająca centrum allosteryczne - miejsce wiązania modyfikatora.
🔗🔧 Bierze udział w allosterii - mechanizmie modyfikowania aktywności enzymu.
🛑❓Mechanizm hamowania może przybierać trzy formy:
🔗 tworzenia wiązań między podjednostkami;
⛓💥 rozrywanie wiązań między podjednostkami;
♻ zmiana trzeciorzędowej struktury podjednostki regulacyjnej, i pośrednio centrum aktywnego.
🍼🔧 Opisz czym jest białko allosteryczne.
Określ również jego funkcję w ramach tego zagadnienia, oraz formy pełnienia jej funkcji [3].
⭕🔧 Przy nieobecności efektora allosterycznego konformacja przestrzenna enzymu zmnienia się w sposób umożliwiający bądź ułatwiający przyłączanie substratu.
✅🔗 Opisz aktywacyjny charakter allosterii.
🍼🪫 Białkowy apoenzym pozostaje nieaktywny do czasu przyłączenia składnika niebiałkowego - kofaktora.
🪫🧩 Kompleks apoenzym-kofaktor nazywa się holoenzymem.
🧩❓ Rodzaje kofaktorów:
🤖 Kationy metali (np. Mg2+, Ca2+, Mn2+, Co2+, Zn2+,Mo2+, Mo3+);
🌱 Aniony niemetali (np. Cl-, SO42-);
🧩 Koenzymy - organiczne związki drobnocząsteczkowe (często pochodne witamin z grupy B np. NAD, FAD, koenzym A).
✅🧩 Opisz sposób aktywacji enzymów przez kofaktory.
Nazwij również kompleks, oraz wymień rodzaje kofaktorów [3].
☑ Utrzymywanie aktywnej konformacji enzymu;
✅ Aktywacja substratu/grup nukleofilowych;
🫧 Udział w reakcjach redoks (zmiana stopnia utlenienia).
🤖⚙ Opisz udział jonów metali w katalizie [3].
🧩🔧 Koenzym wiążący się trwale z enzymem nazywany jest grupą prostetyczną (np. FAD, hem);
🧩🚛 Mogą działać jako przenośniki:
🔩 grup funkcyjnych np. CoA przenosi grupy acylowe;
📍 protonów np. NAD;
⚡ elektronów.
🧩❓ Opisz charakter koenzymów [2].
☑🥤 To odwracalny proces polegający na zmianie aktywności chemicznej przez przyłączenie lub odłączenie grupy chemicznej - PO43-.
⚙🔗 Mechanizm przebiega przy pomocy:
🔗🥤 Kinaz białkowych - przenoszenie reszt fosforanowych z ATP na grupy hydroksylowe reszt aminokwasowych enzymu: seryny, treoniny, tyrozyny;
⛓💥🥤 Fosfataz białkowych - odłączają reszty fosforanowe.
✅🔗 Opisz aktywację przez modyfikację kowalencyjną.
Określ czynnik, przez który następuje aktywacja enzymu, oraz czynniki inicjujące mechanizmy w ramach tego sposobu aktywacji.
⚙🪫 Enzym jest nieaktywny w formie kompleksu podjednostek katalitycznych i regulatorowych. Po dysocjacji enzym zostaje aktywowany;
🔋🦴 Aktywność enzymu ulega zmianie po przyłączeniu kompleksu białka kalmoduliny i Ca2+.
✅🍼 Opisz aktywację przez białko regulatorowe [2].
⚙⚠ Enzym katalizuje przekształcanie jednego, konkretnego substratu. Nawet niewielka zmiana w strukturze substratu (np. izomer) uniemożliwia reakcję.
ℹ⚙ Przykład: Ureaza - rozkłada wyłącznie mocznik (do CO2 i NH3).
🔒⚠ Opisz zagadnienie swoistości bezwzględnej.
⚙❓ Enzym katalizuje reakcję dla grupy podobnych związków zawierających określony typ wiązania lub grupę chemiczną.
ℹ⚙ Przykład: fosfatazy - specyficzne wobec wielu estrów kwasu ortofosforowego bez względu na rodzaj alkoholu.
🔒❓ Opisz zagadnienie swoistości względnej.
Podaj też przykład enzymu i jego substratów.
⚠🔎 Enzymy wykazują swoistość bezwzględną wobec izomerów optycznych. W ludzkim organizmie enzymy działają wyłącznie na:
🧬 L-aminokwasy (składniki białek);
🍬 D-cukry (węglowodany).
ℹ⚙ Przykład: Dehydrogenaza mleczanowa - działa tylko na L-mleczan.
🔒🔎 Opisz zagadnienie swoistości optycznej.
Podaj również przykład takiego enzymu.
⚙🔛 Enzym nadaje reakcji jeden, ściśle określony kierunek - z danego substratu powstaje konkretny produkt, mimo że chemicznie ten sam substrat mógłby ulec wielu różnym przemianom.
ℹ⚙ Przykład: Pirogronian w zależności od dostępnego enzymu, może zostać przekształcony w cztery różne produkty:
🍼 Dehydrogenaza mleczanowa - mleczan;
🪫 Dehydrogenaza pirogronianowa - acetylo-CoA;
🔋 Karboksylaza pirogronianowa - szczawiooctan;
🧬 Aminotransferaza alaninowa - alanina.
🔒🔜 Opisz zagadnienie specyficzności kierunku działania.
Podaj również przykład substratu i jego przemian.
🩻🧪 Substancje wytwarzane przez organizm dla precyzyjnej kontroli metabolizmu lub ochrony tkanek przed samostrawieniem.
🛑🍼 Inhibitory białkowe:
🍗 Trzustkowy inhibitor trypsyny - małe białko (6kDa) wiążące się z centrum aktywnym trypsyny wewnątrz komórek trzustki;
🍗 ɑ1-antytrypsyna - główne białko osocza hamujące proteazy serynowe wydzielane przez neutrofile (granulocyty); chronią płuca przed degradacją elastyny i rozedmą;
🌋 TIMP (tkankowe inhibitory metaloproteinaz) - regulują aktywność enzymów proteolitycznych;
🩸 Antytrombina III - naturbitor trombiny i innych czynników krzepnięcia;
💩🛑 Metabolity - produkt końcowy może działać jako inhibitor allosteryczny.
🛑🌱 Wymień przykłady inhibitorów naturalnych [2/6].
💊🩸 Aspiryna (ASA, kw. acetylosalicylowy) - nieodwracalne hamowanie cyklooksygenazy (COX) acetylacją grupy serynowej centrum aktywnego (działanie przeciwzapalne i przeciwzakrzepowe);
💊🌻 Statyny - inhibitory kompetycyjne reduktazy HMG-CoA - kluczowego enzymu syntezy cholesterolu;
💊🧪 Allopurinol - analog puryn, hamuje oksydazę ksantynową (stosowany przy dnie moczanowej);
💊🦞 Metotreksat - inhibitor reduktazy dihydrofolianiowej (stosowany w nowotworach);
💊🧫 Penicylina - antybiotyk hamujący nieodwracalnie transpeptydazę glikopeptydową - (enzym niezbędny do budowy peptydoglikanu w ścianie bakterii);
💊🧫 Sulfonamidy - bakteriostatyki; hamują syntezę kw. foliowego u bakterii;
💊🦠 Leki antyretrowirusowe - inhibitory proteazy wirusowej/odwrotnej transkryptazy.
🛑💊 Wymień przykłady syntetycznych inhibitorów pełniących rolę leków [7].
💨☠ Związki fosfoorganiczne (np. Sarin, DIFF - diizopropylofluorofosforan) - nieodwracalne inhibitory acetylocholineazy (w. kowalencyjne z grupą -OH seryny centrum aktywnego); powodują gromadzenie acetylocholiny i porażenie UN;
💊 Cyjanki (CN-); 🫧 Tlenek węgla (II) (CO); 🐟 Siarkowodór (H2S) - hamują oksydazę cytochromową (wiążąc się z jonami Fe2+ i Fe3+); Blokują oddychanie komórkowe;
🤖☠ Metale ciężkie (np. Hg+; Pb2+; Ag+) - niespecyficzne inhibitory niekompetycyjne (reagują z grupami -SH cysteiny); Prowadzą do denaturacji lub blokują katalizę;
☣☠ Jodoacetoamid - alkiluje grupy -SH w enzymach (inhibicja nieodwracalna).
☠🛑 Wymień przykłady syntetycznych inhibitorów o postaci trucizn i środków bojowych [4].
⚖⚙ Kontrola zawartości białka enzymatycznego w komórce;
➖♻ Sprzężenie zwrotne - hamowanie szlaku enzymów przez produkt (zwykle enzym katalizujący pierwszą nieodwracalną reakcję w szlaku - “First Committed Step), a następnie:
✅ Aktywacja - przekształcenie nieczynnych proenzymów w postacie czynne;
🔛 Kompartmentacja - nierównomierny rozdział substratów i enzymów w różnych częściach komórki;
🧑🧑🧒🧒 Formowanie kompleksów wieloenzymatycznych.
🪛⚙ Opisz sposoby regulacji aktywności metabolicznej enzymów [2/3].