1ER PARCIAL INMUNO HEMATO
1/285
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
286 Terms
¿Como se obtiene la muestra para estudiar las proteínas plasmáticas?
Punción venosa
Porcentajes de Hematocrito y Plasma
Hematocrito 45%
Plasma 55%
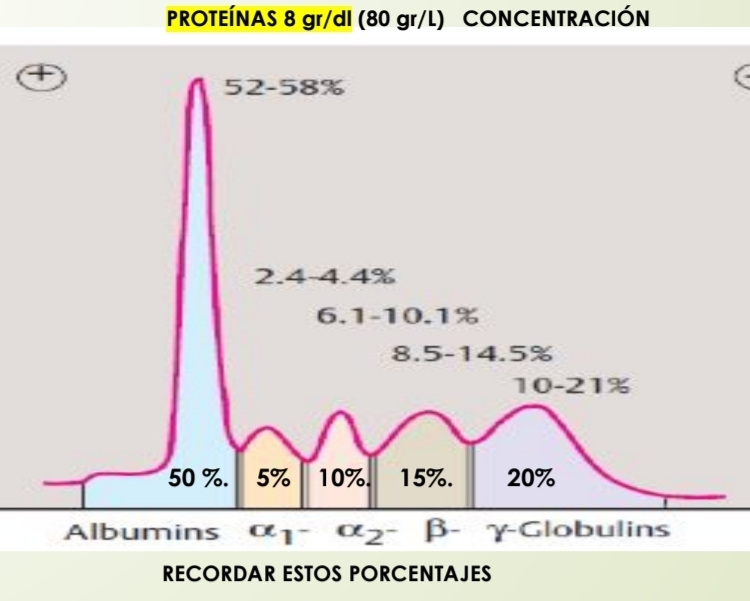
Grupos principales de proteínas plasmáticas en orden según su carga eléctrica
Albumina
Alfa 1 globulina
Alfa 2 globulina
Beta globulina
Gamma globulina
Funciones de las proteínas plasmaticas
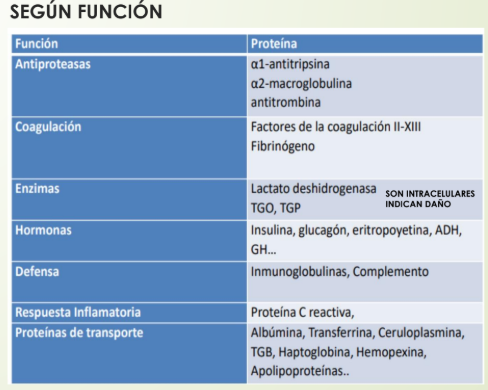
Funcion principal de la albumina
Mantener presión oncótica, transportar bilirrubina indirecta y hormonas.
¿Que pasa en una disminución de Albumina en plasma?
Edema por disminución de presión oncótica
Proteinas del grupo Alfa 1 globulinas
Antitripsina (anti-elastasa)
HDL (colesterol bueno)
Definicion y función de Alfa 1 tripsina
Una antiproteasa que inhibe la elastasa y protege el pulmón de la perdida del tejido elástico pulmonar.
Proteinas del grupo Alfa 2 globulinas
Celuloplasmina ➡ferroxidasa y cobre
Haptoglobina ➡hemoglobina
Macroglobulina ➡zinc
Proteinas del grupo B Globulinas
Transferrina➡ Fe+
Proteína C reactiva
Hemopexina ➡ Hemo
LDL (colesterol malo)
Hipoalbulinemia y causas clinicas principales
Disminución albumina
Insuficiencia hepatica
Síndrome nefrótico
Desnutrición
Disminucion de haptoglobina, indica…
Anemia hemolítica
Porque se consume al unirse a la hemoglobina libre.
Fución de transferrina y a que grupo de globina pertenece
Transporta hierro férrico (Fe3), presente en beta globulinas.
Definición de Proteína C reactiva y que significa su aumento
Es una proteína de fase aguda.
Aumenta en la inflamación e infección.
¿Cuales son las proteínas de la fase aguda positivas?
Alfa 1 antitripsina
Haptoglobina
Ceruloplasmina
Macroglobulina
Proteína C reactiva
Estas proteínas aumentan durante la inflamación como respuesta de las citoquinas pro inflamatorias.
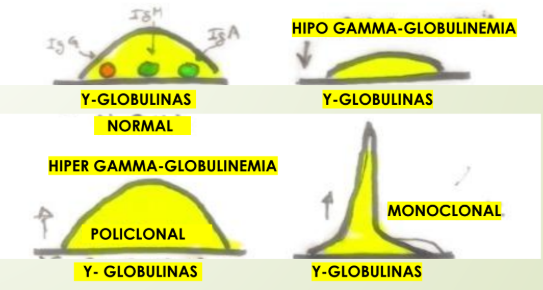
Definición de gamma globulinas y su función
Son inmunoglobulinas, son parte de la defensa inmunitaria
Diferencia entre aumento policlonal y monoclonal de gamma globulinas
Policlonal: VARIOS anticuerpos presentan aumento (monte)
Monoconal: UN solo anticuerpo presenta aumentom, asociado a Mieloma (pico)
Hemopexina ¿Que es y cual es su función?
Transporta grupos hemo libres al hígado, evita toxicidad.
¿Cuales proteínas plasmáticas disminuyen durante la inflamación? (proteínas de la fase aguda negativas)
Albumina y transferrina, disminuyen para conservar energía par la síntesis de proteínas de defensa.
Frente a inflamación/infección:
↑ Proteínas de defensa
↓ Proteínas de transporte
¿Que significa el punto isoeléctrico de una proteína y cual es el de la albumina?
Es el pH de una proteína que no tiene carga neta.
Albumina: 4.7
Efecto de el humo de cigarro sobre la alfa 1 antitripsina
El humo de cigarro inhibe a alfa 1 antitripsina, elastasa actúa y aumenta el riesgo de enfisema pulmonar.
Papel de las proteínas plasmáticas en el equilibrio ác-base
Son como buffers, captan o liberan protones, regulando el pH sanguineo.
¿Que proteínas plasmáticas son glucoproteínas?
Todas excepto la albumina.
¿Que proteínas plasmáticas transportan metales y cuales metales son?
Ceruloplasmina (Cobre)
Transferrina (Hierro férrico Fe3)
Haptoglobina (Hemoglobina)
Hemopexina (Hemo)
Ferroportina (Hierro ferroso Fe2)
¿Que es el signo de Godet y a que condición esta asociado?
El signo de Godet es la depresión que queda al pensionar un edema o area edematosa, asociado a una hipoalbuminemia
Proteinas plasmáticas con función antiproteasa
Alfa 1 Antitripsina
Alfa 2 Macroglobulina
¿Que es un proteinograma electroforético?
Tecnica que separa las proteínas plasmáticas según la carga eléctrica para diagnostico
Anemia hemolítica
↓ Haptoglobina (consume junto hemoglobina libre)
↓ Hemopexina (consume junto hemo libre)
↓ Alfa 2 globulinas (x ↓haptoglobina)
Puede haber disminución de albumina si el daño es renal o hay una inflamación crónica asociada
Anemia ferropénica
↑ Transferrina (para captar hierro disponible)
↓ Proteínas de la fase aguda:
↓ Haptoglobina (consume junto hemoglobina libre)
↓ Hemopexina (consume junto hemo libre)
↓ Alfa 2 globulinas (x ↓haptoglobina)
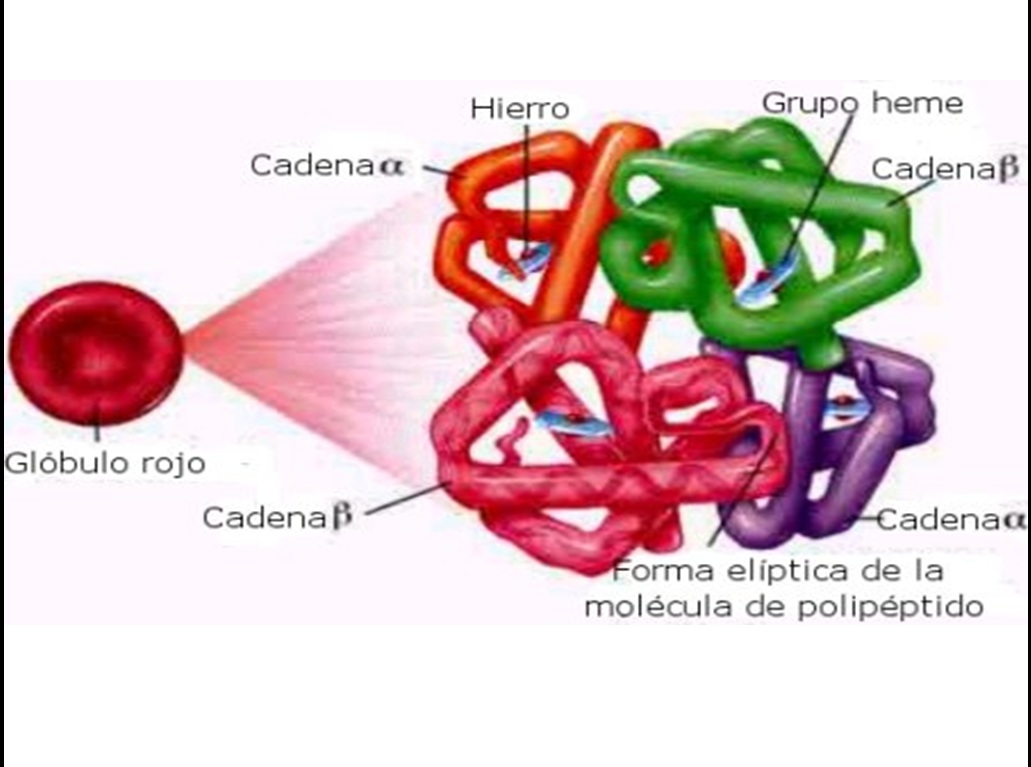
Glóbulo rojo y su composición principal
Formado por:
97% Hemoglobina
5% Metabolismo, mantiene forma y volumen
Produccion de energía de los glóbulos rojos
Glucólisis anaerobia (generan 2 ATP y lactato)
NO tienen mitocondrias, ni cadena respiratoria, producen ATP sin oxígeno.
Uso de energia producida x glóbulos rojos
Transportar gases
Regula equilibrio Ácido-Base
Mantenimiento de tono vascular (x ATP produce NO= oxido nítrico, vasodilatador)
Conservar integridad estructural
Proteinas del citoesqueleto del glóbulo rojo
Espectrina
Anquirina
Banda 3
Actina
Proteínas 4.1 y 4.2
Mantienen la forma, flexibilidad y permite el paso por el bazo y capilares estrechos.
Funcion de la bomba Na/K ATPasa y bomba Ca en glóbulo rojo
Mantienen el equilibrio osmótico
Evitan la lisis osmótica
Regula la forma, volumen celular y flexibilidad para su correcta circulación
Esferocitosis hereditaria
Enfermedad genética que afecta las proteínas del citoesqueleto del glóbulo rojos, propenso a la destrucción.
Fallo en su forma normal: se vuelve ESFERICO (menos flexible)
Destruido prematuramente
Causando: ANEMIA HEMOLÍTICA
Importancia de la forma BICONCAVA del glóbulo rojo:
Facilita la deformación para pasar x capilares estrechos y contribuye al flujo laminar en vasos grades.
Porcentaje de oxígeno que se une a la hemoglobina
97% del oxigeno se une a la hemoglobina
Forma: OXIHEMOGLOBINA
Oxigeno restante que no forma oxihemoglobina
3% oxida al Hierro Ferroso (Fe2+) ➙ Hierro Férrico (Fe3+)
Formando: Metahemoglobina y Superóxido (radical libre agresivo)
Superóxido: Radical libre (oxígeno con un electron extra), puede dañar biomoléculas y membranas celulares.
Hemoglobina con Hierro férrico: no puede transportar oxígeno, diminuendo la capacidad de transporte.
Detoxificar superóxido
Mediante la enzima: SUPERÓXIDO DISMUTASA
Superóxido ➙ Peróxido de hidrógeno (agua oxigenada)
Elimina el Peróxido de hidrógeno (agua oxigenada)
Mediante: GLUTATION PEROXIDASA
Peróxido de hidrógeno (agua oxigenada) + Glutatión reducido ➙ Peróxido de agua
Recuperacion del glutatión reducido
Glutation luego de ayudar a eliminar el Peróxido de hidrógeno (agua oxigenada), queda oxidado y debe recuperar su capacidad detoxificadora.
Se recupera por:
NADPH (producido x la via de las pentosas, especialmente: Glucosa 6 fosfato deshidrogenasa)
Importancia de Glucosa 6 fosfato deshidrogenasa.
¿Que pasa en una deficiencia?
Crucial para producir NADPH (regeneradora del Glutatión reducido)
Protege de daños oxidativos al glóbulo rojo.
DEFICIENCIA:
⇨ Anemia hemolítica x incapacidad para detoxificar radicales libres y generar glutatión
Causas de anemia hemolítica: La destrucción prematura de glóbulos rojos, por defectos en proteínas del citoesqueleto (Esferocitosis hereditaria) o deficiencias enzimáticas como glucosa-6 fosfato deshidrogenasa.
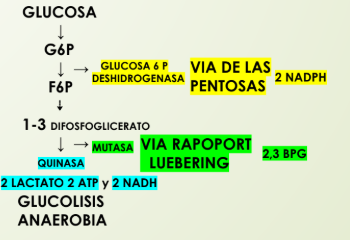
Que es y cual es la función de 2,3 Bifosfoglicerato (2,3-BPG)
Metabolito producido x glucólisis.
Modulador de la afinidad de la hemoglobina x O2
Facilita la liberación de O2 en tejidos hipóxicos
Produccion es costosa: su síntesis desvia a la glucosa de la producción del ATP. Sacrifica energia para favorecer liberacion de O2
Diferencias entre desoxihemoglobina y oxihemoglobina
Desoxihemoglobina (hemoglobina T o TENSA)
Se adhiere a la membrana
Orificio central mayor
Desplaza las enzimas hacia el citosol
⇈ Glucólisis y facilita liberación de ATP
(para vasodilatación)
MENOR afinidad con O2 (facilita su liberación)
Oxihemoglobina (hemoglobina R o RELAJADA)
NO se adhiere a la membrana
Orificio central menor
MAYOR afinidad con O2 (Lo retiene)
Papel del ATP liberado por el glóbulo rojo en la circulación
ATP estimula el endotelio para producir NO (óxido nitrico) dilatador de vasos sanguíneos.
Facilitando el paso del glóbulo rojo
Mecanismos para que el glóbulo rojo se deforme para pasar por capilares estrechos
Forma BICONCAVA del glóbulo rojo:
Facilita la deformación para pasar x capilares estrechos y contribuye al flujo laminar en vasos grades.
Da flexibilidad permite un paso eficiente por los capilares y un optimo intercambio gaseoso
Canales de Ca y K se activan x estímulos mecánicos:
Permiten SALIDA de H2O y ↓ Volumen celular
Proteinas que son el ANCLA de la membrana del glóbulo rojo
Proteina: BANDA 3
Ancla para la union de anquirina y espectrina
Formando la red del citoesqueleto
Función: Intercambio de aniones a traves de la membrana, facilitando el transporte de gases.
¿Que pasa con la hemoglobina libre fuera del glóbulo rojo?
Es toxica porque secuestra óxido nítrico (NO), puede causar daño vascular y renal
Destinos de la glucosa en le glóbulo rojo
70% glucosa x glucólisis anaeróbica para producir ATP
10% glucosa x vía de las pentosas para producir NADPH (necesario para la regeneración de glutatión reducido)
20% glucosa x vía shunt rapapolevering (Rapoport-Luebering, que se desvia para producir 2,3 bifosfoglicerato (modula la afinidad de la hemoglobina x O2)
¿Cuál es la enzima principal responsable para reducir la metahemoglobina(Fe3+) a hemoglobina funcional (Fe2+)?
Metahemoglobina reductasa (citocromo b reductasa).
Utiliza NADH como cofactor.
Puede reducirse también x:
Vitamina C
Glutatión reducido
Diferencias de NADH y NADPH en el glóbulo rojo
NADH ➠ Reduce: Metahemoglobina
NADPH ➠ Regenera: Glutatión reducido y elimina radicales libres
¿Que ocurre con el glutatión oxidado (GSSG) y como se recupera?
Glutation oxidado ➠ Reduce: glutatión reducido (GSH)
Mediante: Glutatión reductasa utilizando NADPH
¿Por que es importante que se mantenga la bomba sodio potasio ATPasa activa?
Evitar la entrada excesiva de sodio que causaría:
Lisis osmótica (se hinchan)
¿Relación hipoxia con la producción de 2,3 bifosfoglicerato?
Hipoxia ➠ Activa enzima: MUTASA (desvia glucosa produce 2,3BPG)
Facilitando la liberación de oxígeno en los tejidos.
Explicar como paso de superóxido a glutatión oxidado
¿Como recupero ese glutatión oxidado?
➡➡Superoxido
x la Superóxido dismutasa
➡ Peroxido de hidrogeno
x la Glutatión peroxidasa + Glutatión reducido (GSH)
➡Glutatión oxidado
x Glutatión Reductasa + NADPH
= Glutatión reducido✅
➡NADP (oxidado)
x Via de las pentosas (Glucosa 6 Deshidrogenasa)
¿Cómo se transporta el oxígeno?
Grupo hemo contine hierro y es hidrofóbico.
Su función es unir al oxígeno. Pero necesita estar unido a la globina para funcionar correctamente y evitar la toxicidad.
Hemo solo es toxico, se apila, con alta afinidad a monóxido de carbono (CO) y genera de superóxidos.
Hemoglobina adulta, características
Tetrámero compuesto por 2 cadenas alfa y 2 cadenas beta, cada una con un grupo hemo que puede unir oxígeno.
Globina reduce la afinidad del hierro por el CO2, dificultando que el CO se una al hierro.
Con 4 sitios de unión para el oxígeno (en cada grupo hemo de las 4 cadenas)
Hemoglobina y 2,3 BPG
El espacio entre las cuatro globinas, se puede unir 2,3 bifosfoglicerato.
Estabilizando la conformación T de la hemoglobina.
Metahemoglobina y el glóbulo rojo
Metahemoglobina= Hemoglobina con hierro férrico (Fe3), esta no se puede unir al oxígeno
El glóbulo rojo reduce a hierro ferroso (Fe2) mediante la enzima metahemoglobina reductasa
(manteniendo un nivel de 1% de metahemoglobina)
¿Por que la hemoglobina libre es toxica?
Porque el hierro y el hemo pueden generar radicales libres y secuestrar oxido nítrico.
Causando: Daño renal, hipertensión y daño glomerular
Histidina proximal y distal de la hemoglobina
Histidina proximal: Unida covalentemente al hierro del hemo, tira del el. Dando una CONFORMACION T
Histidina distal: No esta unida al hierro pero estabiliza union con el oxígeno y dificulta la union directa del CO
Hemoglobina tensa (T) y Hemoglobina relajada
Hemoglobina tensa (T): tracción de la Histidina proximal
⬇ Afinidad x O2
Facilita liberación de O2
Hemoglobina relajada (R): hemo es plano. Histidina distal tira de la dirección opuesta cuando el oxigeno esta unido.
⬆ Afinidad x O2
Dificulta liberación de O2
¿Que significa que la hemoglobina tenga un comportamiento cooperativo?
La unión de oxígeno a un sitio
Aumenta la afinidad de los otros sitios por el oxigeno
Facilitando la saturación progresiva de la hemoglobina
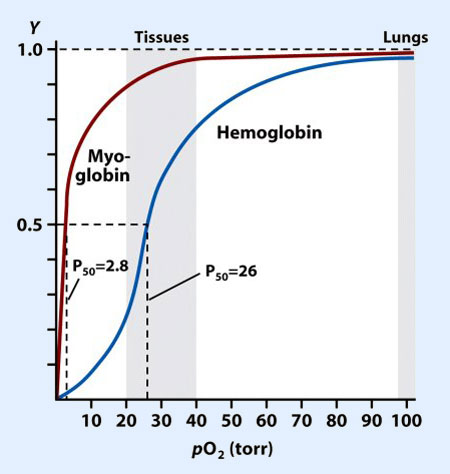
Curvas de la saturación de oxigeno de la hemoglobina y la mioglobina.
Curva muestra la relacion entre: saturación de hemoglobina y presión parcial de O2
Hemoglobina: Curva Sigmoidea (x su cooperatividad)
COEFCIENTE DE HILL >1= cooperatividad
Mioglobina: Curva Hiperbólica (saturándose rápidamente a bajas presiones parciales de oxígeno
COEFCIENTE DE HILL <1= NO cooperatividad
Desplazamiento DER: ⬇⬇ AFINIDAD O2, mayor liberación
Desplazamiento IZQ: ⬆⬆ AFINIDAD O2, menor liberación
Moduladores alostéricos y como afectan a la hemoglobina
Moleculas que se unen a sitios diferentes al sitio activo.
Modifican la afinidad de la hemoglobina por el oxígeno, pudiendo ser:
Positivos (Aumentan la afinidad)
Negativos (Disminuye la afinidad)
Efecto de 2,3 BPG en la hemoglobina
El 2,3 BPG se une al espacio cental en la hemoglobina.
Estabiliza forma hemoglobina T
⬇ Afinidad del O2 x la hemoglobina
Desplaza la curva de saturación: hacia la derecha
Facilita la liberacion de O2 en tejidos
Moduladores alostericos negativos
⬆ Temperatura
⬆ CO2
⬇ pH (efecto Bohr)
Disminuyen afinidad de hemoglobina x O2 (promoviendo su liberación)
¿Que es el efecto bohr?
Fenomeno donde:
⬆ [Hidrogeniones] o ⬇pH
⬆CO2
⬇ AFINIDAD de hemoglobina x O2
Facilita liberación de O2 en tejidos
Carbaminohemoglobina
CO2 unido a grupos amino terminales de las cadenas de globinas formando carbamatos
Estabiliza la hemoglobina T
⬇ Afinidad de la hemoglobina x el O2
Hemoglobina fetal con mayor afinidad x O2 que la materna. ¿Por qué?
Hemoglobina fetal: 2 cadenas alfa y 2 cadenas gamma
(Los adultos tienen beta en lugar de gamma).
El 2,3 BPG no se une eficazmente a la hemoglobina fetal:
2,3 BPG se une preferentemente a cadenas beta, y estas no existen en la hemoglobina fetal.
No es afectada x 2,3 BPG
Manteniendo ⬆ afinidad para captar O2 de la madre.
¿Donde se forma la hemoglobina en el desarrollo?
Hemoglobinas embrionarias se forman:
Saco vitelino
Higado y bazo fetal
Hemoglobina adulta: se produce en la médula ósea (final del embarazo o posnatal)
Hemoglobinopatias
Enfermedades relacionadas a la hemoglobina
Problemas de sintesis: Talasemias
Problemas estructurales: Anemia falciforme (HbS)
Hemoglobina en presencia de CO (monoxido de carbono)
CO se une al hierro del hemo con alta afinidad
Formando: Carboxihemoglobina
Esta impide la union y liberación de O2
Aumentando: afinidad x O2, en el resto de subunidades
Afecta la entrega de O2 a los tejidos, causando sintomas de hipoxia e incluso la muerte.
Tratamiento: Con oxígeno al 100%, casos graves terapia en cámara hiperbárica para desplazar el CO2 de la hemoglobina
Hemoglobina libre y el oxido nitrico (NO)
Hemoglobina ayuda a liberar ATP
Estimula la producción de NO del endotelio
Provocando: Vasodilatación
Hemoglobina libre: SECUESTRA ÓXIDO NÍTRICO (NO)
Puede causar: vasoconstricción e hipertensión
Efecto alosterico positivo
Cuando una subunidad de la hemoglobina se oxida a hierro férrico (Fe3)= metahemoglobina
Induce un efecto alosterico positivo
⬆ Afinidad de la hemoglobina x O2 (de las otras subunidades)
Dificulta la liberacion de O2
¿Porcentaje de CO2 se transporta en sangre unido a la hemoglobina?
15% del CO2 se transporta unido a la hemoglobina como carbaminohemoglobina
80% del CO2 se transporta en forma de bicarbonato en la sangre
Función de glutation y NADPH en el globulo rojo
NADPH producido en la via de las pentosas
Mantiene el glutatión reducido
Protege los glóbulos rojos de daños oxidativos
¿Que sucede con la glucosa durante la hipoxia en el globulo rojo?
20% glucosa se desvia a la fomacion de 2,3 BPG
Mediante: MUTASA
⬇Produccion de ATP
Facilitando la liberación de O2
¿Como ingresa la glucosa al glóbulo rojo?
Ingresa por transporte pasivo GLUT1
Utilizada para producir energía y metabolitos:
2,3 BPG
NADPH
Esenciales para la protección del globulo rojo
Hemoglobinas que predominan en el embrión y en el adulto
Embrion: hemoglobinas embrionarias cadenas, alfa y epsilon o zeta
Adulto: predomina hemoglobina con cadenas alfa y beta
Anemia falciforme
Hemoglobinopatía causada por una mutación en la cadena beta.
La valina remplaza al ác glutámico en la posición 6.
Formando: Hemoglobina S
Altera la forma y función de los glóbulos rojos
¿Qué es la talasemia?
Transtorno de síntesis de hemoglobina donde hay producción deficiente o anormal cadenas:
Alfa
Beta
Causando: ANEMIA
¿Qué es la Carboxihemoglobina y cuál es su nivel normal en sangre?
Carboxihemoglobina= Hemoglobina unida al monóxido de carbono (CO)
Normalmente: 1% en sangre, pero puede aumentar con la exposición al CO
Fumar puede aumentar la carboxihemoglobina hasta un 15%
Reduciendo la capacidad de transporte de O2, causando fatiga y dificultad para el ejercicio
Metahemoglobina reductasa
Es una enzima que reduce:
Hierro férrico (Fe3) (de la metahemoglobina) ➠ Hierro ferroso (Fe2), restaurando la capacidad de union al oxigeno.
¿Qué sucede en hemolisis?
La hemolisis libera hemoglobina libre
Secuestra el Óxido Nítrico
Causa: Vasoconstricción, hipertensión y daño vascular
¿Cuantas cadenas polipeptídicas tiene la hemoglobina y de qué cromosomas provienen?
Hemoglobina tiene cuatro cadenas polipeptídicas:
2 alfa provenientes del cromosoma 16
2 beta provenientes del cromosoma 11
¿Como varían las combinaciones de hemoglobina durante el desarrollo?
Embrión (menos de 8 semanas):
Cadenas zeta del cromosoma 16
Cadenas Epsilon o gamma del cromosoma 11
Feto (mayor a 8 semanas)
Hemoglobina alfa-gamma
Adulto:
Hemoglobina alfa-beta
¿Dónde se forma la hemoglobina y en que células se sintetiza?
Hemoglobina se forma en los progenitores eritroides
Proeritroblasto
Eritroblastos
Reticulocito
NO SE SINTETIZA EN GLOBULOS ROJOS MADUROS. (xq carecen de mitocondias y ribosomas)
Proporción de hemoglobina en el glóbulo rojo maduro
95% de hemoglobina en el globulo rojo maduro
Tipos principales de hemoglobina en el adulto
Hemoglobina A (97% alfa-beta)
Hemoglobina A2 (2% alfa-delta)
Hemoglobina F (1% alfa-gamma, residual) (Es fetal)
¿Que hemoglobina predomina en el feto y como cambia después del nacimiento?
Feto predomina la hemoglobina fetal (HbF)
2 cadenas alfa y 2 cadenas gamma
80% al nacer y disminuye aproximadamente hasta 1% despues del primer año
Talasemia alfa y beta
Talasemia alfa: faltan genes alfa (Cromosoma 16)
Talasemia beta: faltan genes beta (Cromosoma 11)
Causa: desequilibrio en la produccion de cadenas globinicas y problemas en la formacion de hemoglobina
Anemia falciforme
Mutacion en la cadena beta de la globina
AA glutamico en la posición 6 es remplazado x valina
Formando: hemoglobina S
¿Como se forma el tetrámero de hemoglobina?
2 dimeros (c/u con cadena alfa + hemo y cadena beta + hemo)
2 dimeros se unen para formar: TETRÁMERO de hemoglobina (con cuatro grupos hemo)
Enzima que inicia la sintesis del hemo y que cofactor requiere
Enzima: ALA sintasa (en mitocondria)
Inicia la sintesis del hemo y requiere vitamina B6 (piridoxal fosfato) como cofactor
Sintesis del Hemo
Formación aminolevulínico (ALA) x ALA sintasa (mitocondria) (req. como cofactor VitB6 piridoxal fosfato)
➕️ Eritropoyetina e hierro (en medula osea)
➖️ Hemo
ALA va hacia citosol y se convierte: Porfobilinogeno (PBG) mediante la ALA deshidratasa (citosol)
Cuatro Porfobilinogeno = Tetrapirrol lineal
UROPORFILINOGENO:
Transformación a coprofibrinogeno
Regresa a la mitocondria y forma: protoporfirina IX
Incorporación de hierro x la ferroquelatasa (mitocondria) para formar hemo
¿Que enzima de la sintesis del hemo son inhibidas por el plomo?
El plomo inhibe la ALA deshidratasa y la ferroquelatasa, causando anemia por saturnismo debido a la disminución en la sintesis de hemo.
¿Cual es la diferencia entre ALA sintasa 1 y ALA sintasa 2?
ALA sintasa 1 = en tejidos no eritroides (higado, músculo), regulada negativamente por el hemo.
ALA sintasa 2 = está en progenitores eritroides de la medula ósea, regulada por eritropoyetina e hierro.
¿Como regulsla eritropoyetina la sintesis de hemo?
Eritropoyetina, estimulada x hipoxia.
⬆ Actividad de ALA sintasa en la médula ósea
Para aumentar la producción de ⬆ hemoglobina
¿Que sucede con el hierro liberado tras la degradacion del hemo?
Hiero liberado es exportado x:
La ferroportina como hierro ferroso Fe2+.
Celuloplasmina oxida (Fe2+) a hierro férrico (Fe3+)
Luego se transporta en transferrina.
Degradacion de grupo hemo en macrófago
Hemoxigenasa corta hemo liberando:
Beliverdina, hierro y monóxido de carbono
Brliverdina es luego convertida en: bilirrubina indirecta (no conjugada) x bilirrubina reductasa.
Transporte:
Bilirrubina indirecta tranportada x albumina
Hemo libre x hemopexina
Hemoglobina libre x haptoglobina