cations : réactions identification
1/45
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
46 Terms
séparation des cations
Tous les cations X. qui VS les autres
I. précipitent dans HCl dilué à chaud :
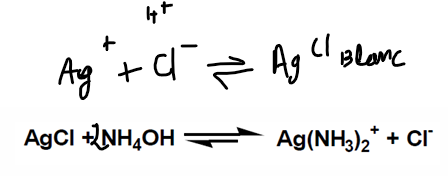
Ag+ soluble dans NH3 aq
Hg22+ insoluble dans NH3 aq
II. précipitent en sulfure de métaux (issu de l’hydrolyse de thioacétamide en milieu HA)
IIa : As3+, Sn2+, Sb3+ → Précipité soluble dans les alcalis
IIb : Hg2+, Pb2+, Bi3+, Cu2+, Cd2+ → précipité INsoluble dans les alcalis
III. précipitent en hydroxyde de métal avec NH4OH en présence de NH4Cl (pour effet d’ion commun et favoriser la forme NH4OH VS NH4+ + OH-)
IV. précipitent en milieu neutre ou alcalin A EBULLITION pour éviter l’état colloïdal : Mn2+, NiS, CoS, ZnS
V. Ca2+, Sr2+, Ba2+
donne des carbonates dans le carbonate ammoniacal
Métal M : MCl2, MS2, M(OH)2 solubles dans H2O
sels solubles avec NH2 COO- dans H2O
VI. Pas de réactifs pour les séparer : solubles et polluants de l’eau
→ Mg2+, Li+, K+, Na+, NH4+

argent
séparer l’Ag+ puis d’identification

argent
“séparer” Ag pour avoir Ag+ pour réaction de l’argent
Précautions avec le mercure
la forme soluble ionique peut réagir et donner du mercure métallique solide dans la solution
—> ne pas sécher les solutions
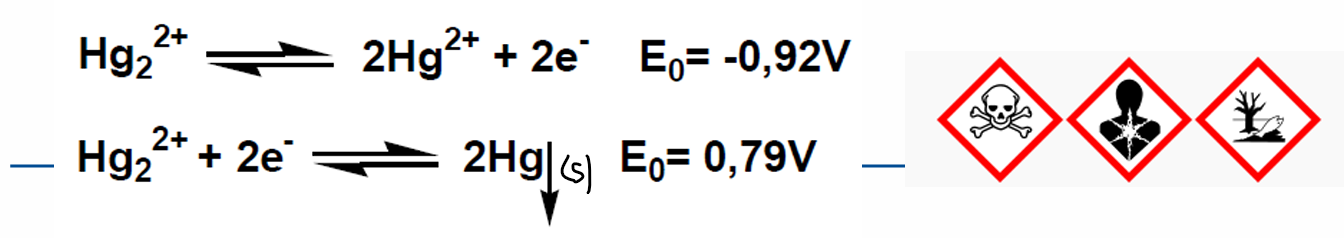

mercure
groupe 1 Hg22+


mercure
groupe IIb (Hg 2+)
Mercure : usage en analyse
Mesurer la taille des pores d’un solide adsorbant pour vérifier la forme bien irrégulière
—> car + grande surface de contact pour adsorption de molécules
Mercure adsorbant : explication
1° presse hydraulique augmente P sur Hg
2° Hg va entrer dans le solide (par des pores et canaux) et s’adsorber
-> au + la P est forte, au + le Hg atteint les petites cavités.
3° mesure Hg qui entre dans le solide (VS V restant) en f de la Pression exercée sur Hg
-> variation de hauteur de mercure : quand Hg entre, volume diminue, quand Hg sort, V augmente et ça se voit dans le petit tube fin

réactions dans la partie impureté
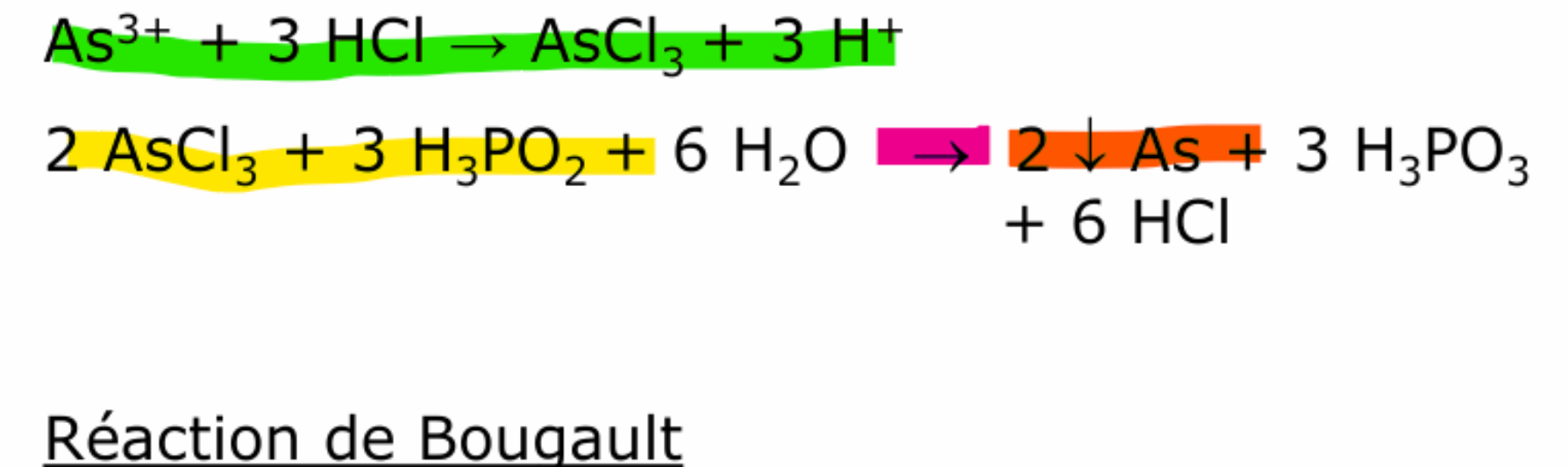

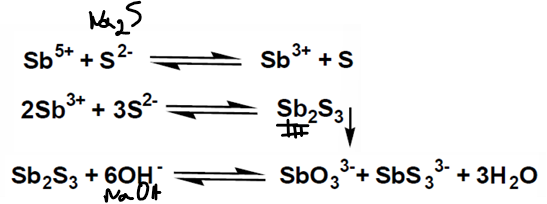
antimoine

chlorure d’étain dihydraté
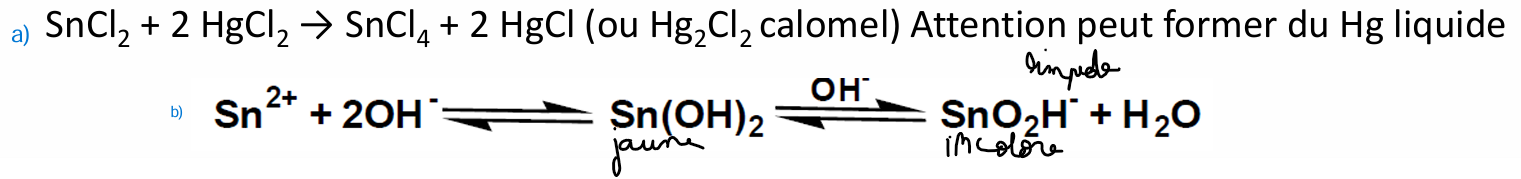

plomb
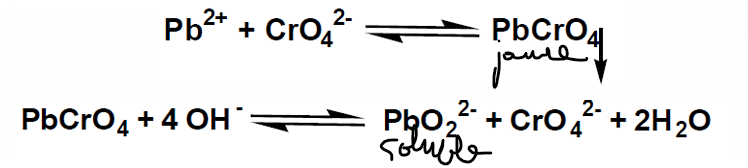

plomb
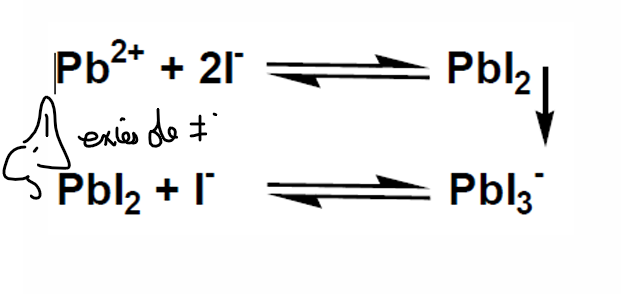

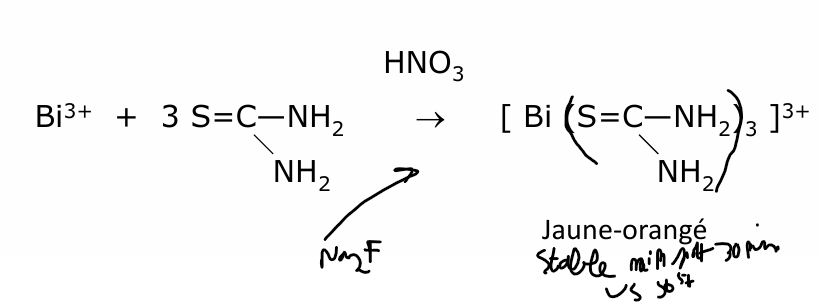
bismuth


bismuth

sulfate de cuivre (et non pas cuivre spé)
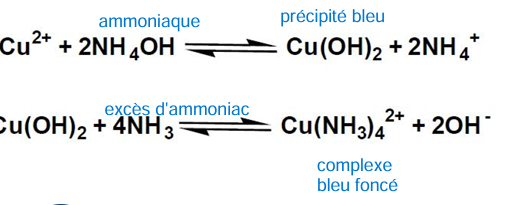

sulfate de cuivre (et non pas cuivre spé)
SO4 2- + Ba2+ —> BaSO4

Cadmium (non pharmacopée) CdSO4 ° 8/3 H2O
a- SO4 ²- + BaCl2 → BaSO4
b- CdSO4.8/3 H2O + Na2S → P jaune

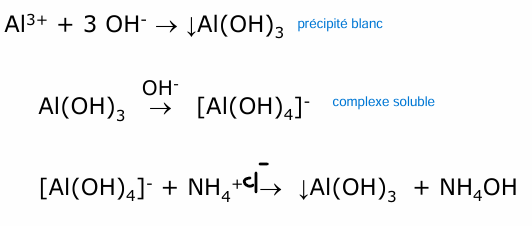
aluminium
Partie thioacétamide → pour éliminer les 1ers groupes ou autres bails

fer
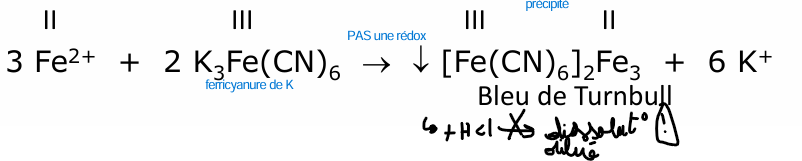

fer
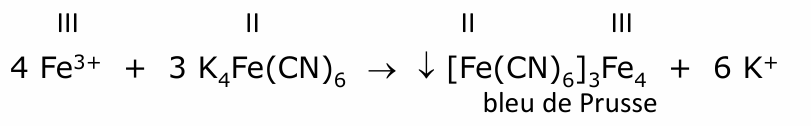

fer
tkt l’extraction à l’alcool isoamylique, pas de réaction
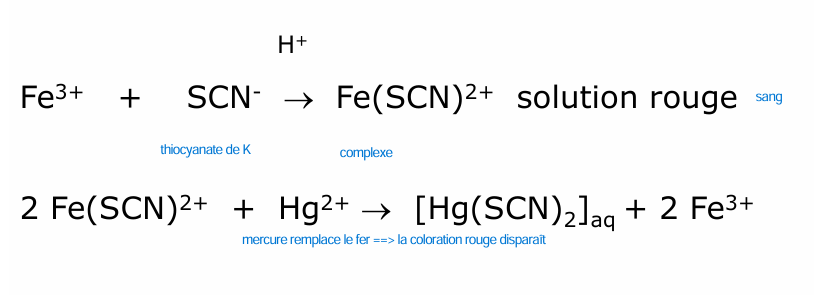
chrome
Spectrométrie d’émission atomique à plasma à couplage inductif ICP-AES
réaction avec persulfate mais pas de test pharmacopée


manganèse
Mn2+ + (NH4)2S → MnS rose pâle —ac acétique—> précipité se dissout
Manganèse : identification au bismuthate
bismuthate oxydant plus fort que KMnO4 donc équilibre vers formation de KMnO4 = solution violette
! sédiment (orange) précipite de oxyde de bismuth
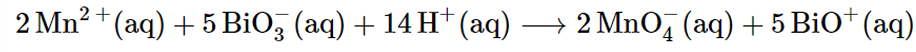

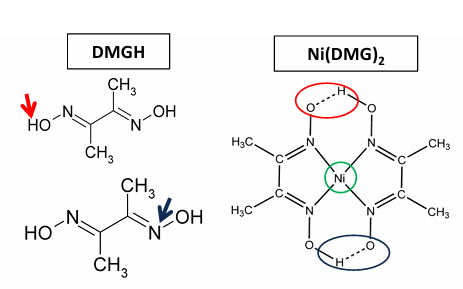
Nickel
déprotoner DMG
formation du complexe à 2 DMG + complexant le Ni.
nickel (diméthylglyoxime)2
et SAA dans four à graphite

Cobalt
Dans alcool amylique : formation d’une coloration (complexe) bleue de l’ion tétrathiocyanatocobaltate : (NH4)2 [Co(SCN)4] bleu
Puis + H2O —> complexe hydraté rose
K complexation eau > K complexation alcool (amylique)

cobalt
Dans ac acétique : formation de hexanitritocobaltate III de potassium
+ KNO2 cristaux —> précipité jaune [Co(NO2)6]K3
![<p>Dans ac acétique : formation de hexanitritocobaltate III de potassium</p><p>+ KNO<sub>2 </sub>cristaux —> précipité jaune [Co(NO<sub>2</sub>)<sub>6</sub>]K<sub>3</sub></p>](https://knowt-user-attachments.s3.amazonaws.com/4cbfc7e4-5d5a-48ed-ac02-d6a2c2219aea.png)

zinc


calcium

calcium
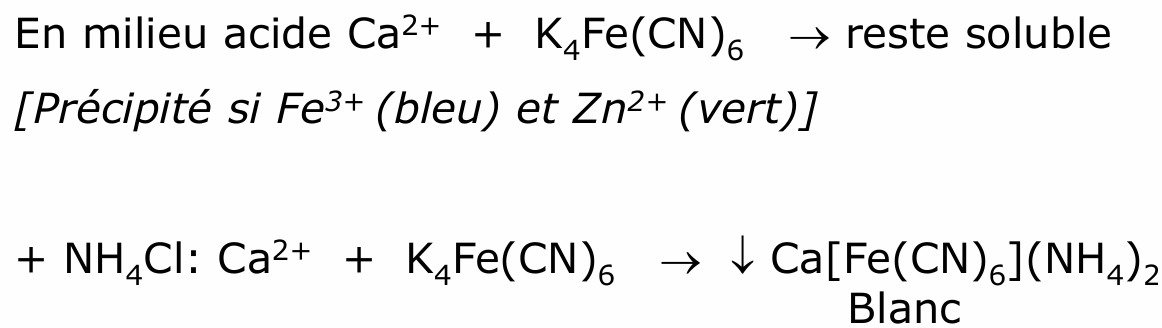

strontium (mono acétate de calcium)
Couleur rose pour le test à la flamme pour détection de strontium

Baryum identification
test à la flamme SAE —> verte
avec dichromate de potassium
permanganate de potassium
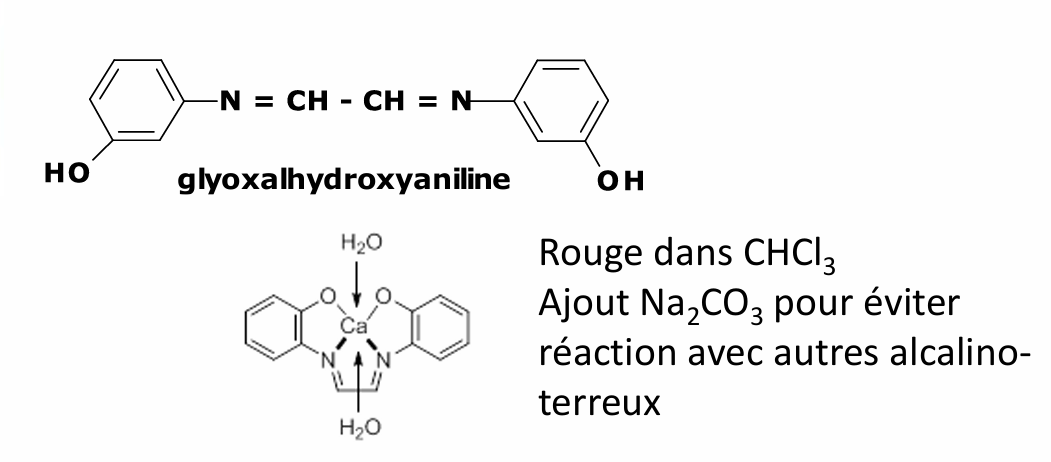
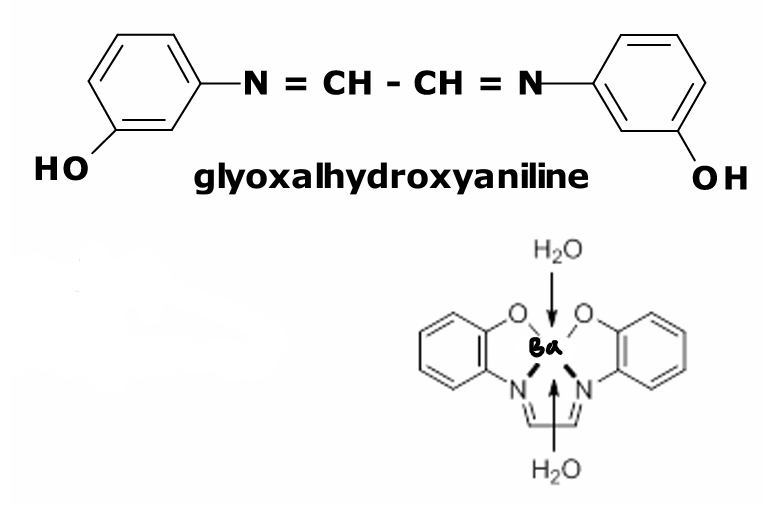
avec glyoxalhydroxyanile
Baryum avec le dichromate de potassium dans acétate de sodium
Dans CH3 COO Na (car H+ et favoriser la réaction vers la droite) : 2 Ba2+ + Cr2O72- + H2O —> 2 BaCrO4 + 2 H+
Baryum avec permanganate de potassium
adsorption du KMnO4 (rose) sur le précipité de BaSO4 —> décolo de la solution et le précipité devient + foncé
Baryum avec glyoxalhydroxyanile
complexe

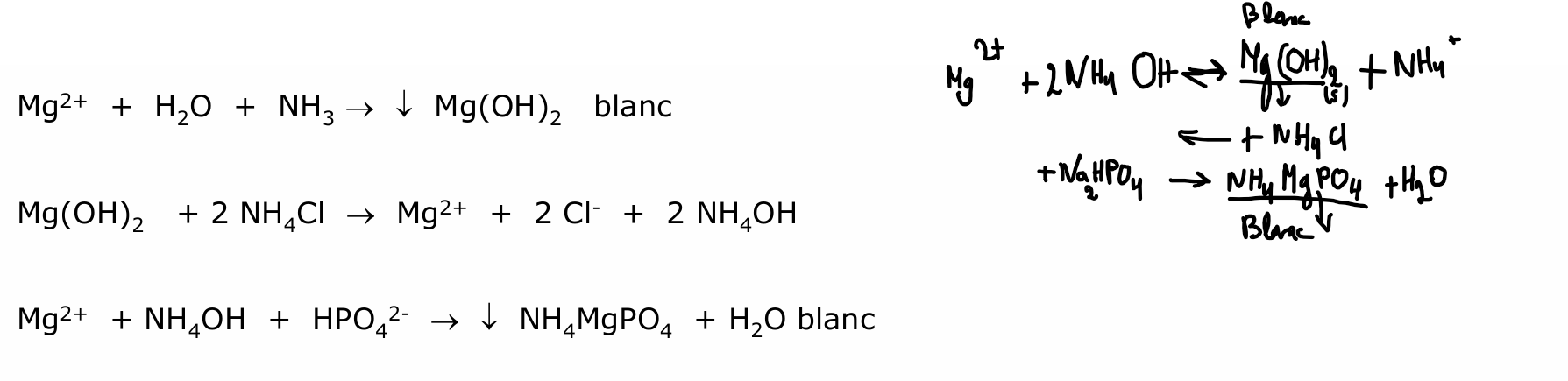
magnésium
+NH4 Cl pour effet d’ion commun —> dissolution de l’hydroxyde
formation d’un co précipité spécifique au Mg2+

carbonate de lithium (non spé au lithium) et non pharmacopée


carbonate de lithium (non spé au lithium) et non pharmacopée
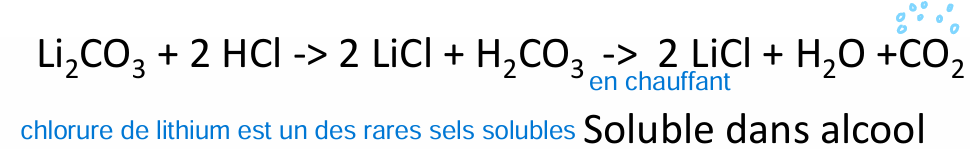
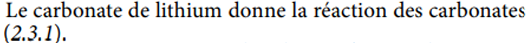
voir carbonates


Potassium
Formation d’un précipité blanc
Na2CO3 et Na2 S pour être sûr que y a pas les groupes 5 et 4 cations
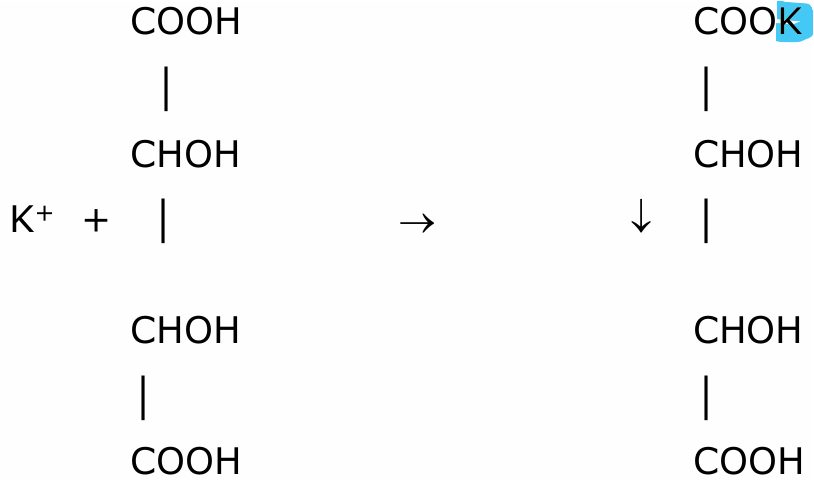

potassium
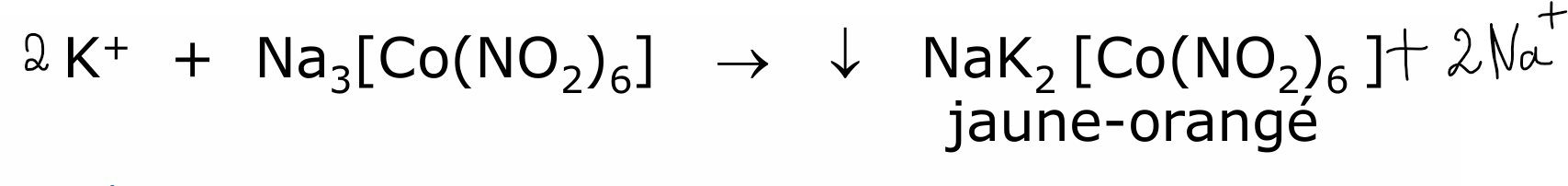

sodium
Frotter avec baguette de verre si nécessaire : faire tomber une impureté —> atteindre + rapidement le V critique pour former le cristal/précipité plus facilement
(+K2CO3 pour vérifier que y a pas d’autres cations)
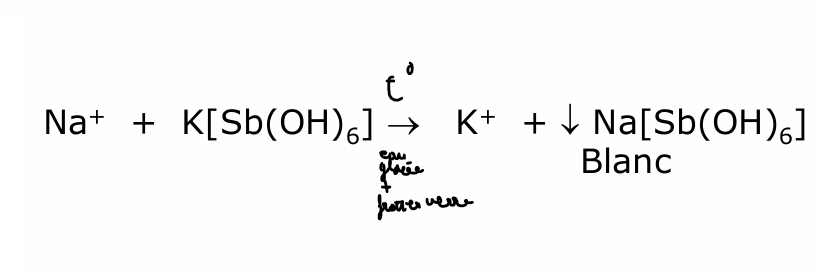

sodium
Agitation ne solubilise pas le précipité de Na + méthoxyphénylacétique
+ NH4 OH —> dissolution du précipité
+ (NH4)2CO3 pour vérifier qu’il n’y ait pas d’autres précipités
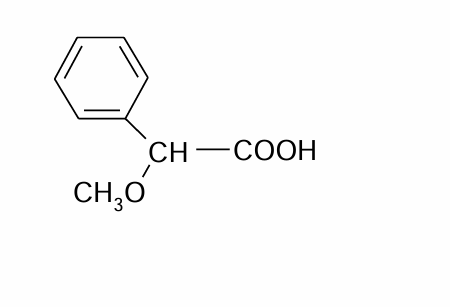

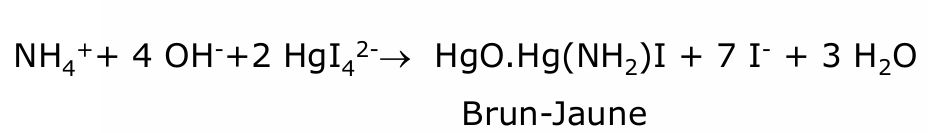
ammonium
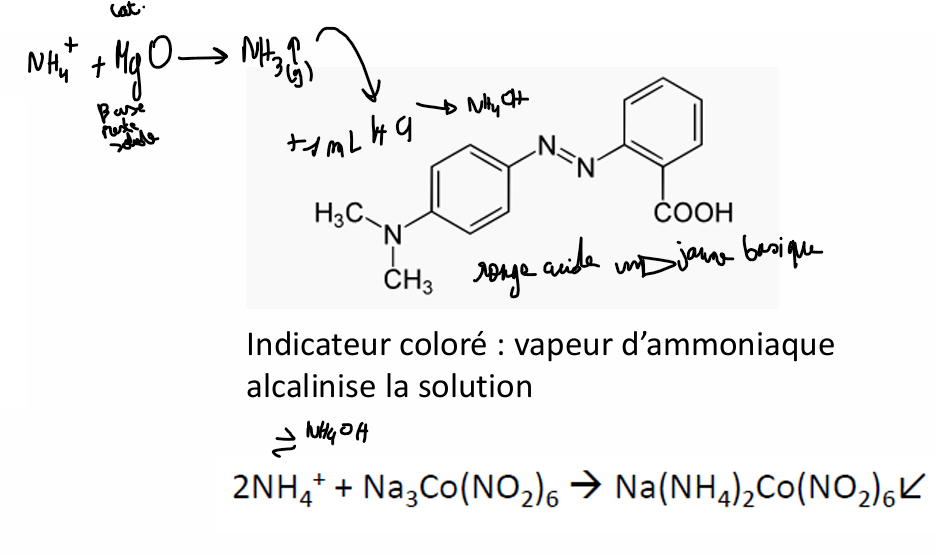

ammonium
essai limite d’impureté :
la colo jaune n’est pas plus intense que le témoin
boucher le tube à essai car NH3 volatile