T18 | Gene therapy
1/17
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
18 Terms
🧬 O que é Terapia Génica?
Tratamento de uma doença através da transferência do material genético, DNA ou RNA, para as células dos pacientes.
Terapia génica tradicional:
Adição genética - uma cópia normal de um determinado gene defeituoso é colocada nas células alvo, restaurando a função normal do gene que estava defeituoso.
Silenciamento genético - Uso do RNA de interferência ou oligonucleótidos antisense para inibir a expressão do gene defeituoso, tendo o mRNA como alvo.
🎯 Objetivo da Terapia Génica
Obter expressão duradoura e eficaz do gene terapêutico (“transgene”) num nível suficiente para:
Melhorar ou curar sintomas da doença
Minimizar efeitos adversos
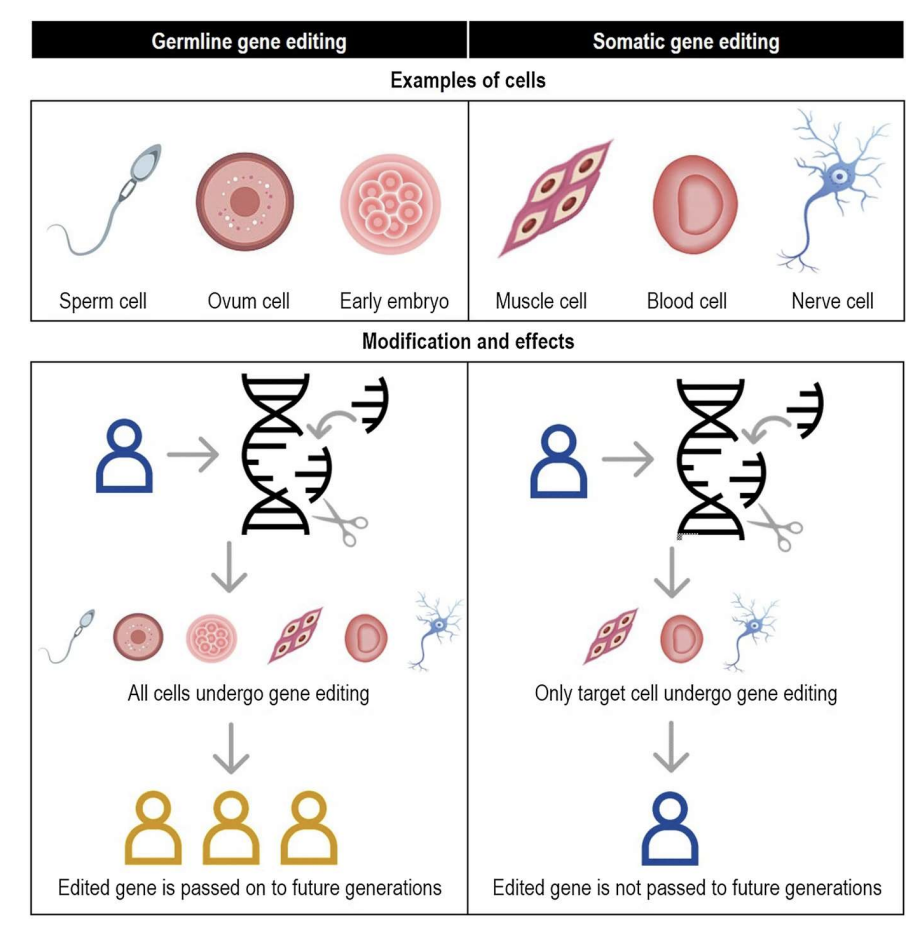
🧬 Terapia Génica Somática vs Germinal
Terapia genética somática
Aplica-se a células somáticas, ou seja, as células do corpo que não são óvulos nem espermatozoides.
O objetivo é corrigir ou modificar genes defeituosos nessas células para tratar doenças.
As alterações feitas não são herdadas, ou seja, não passam para os filhos. Só afetam a pessoa tratada.
Exemplo: usar terapia genética para tratar células do fígado ou do sangue de uma pessoa com uma doença genética.
Terapia genética da linha germinal (GGT - Germline Gene Therapy)
Envolve a edição genética em gâmetas (óvulos ou espermatozoides) ou em embriões antes da implantação (ou seja, muito cedo, antes da gravidez).
A grande promessa desta terapia é evitar que doenças genéticas sejam passadas aos descendentes — ou seja, corrige o problema antes mesmo de a pessoa nascer.
Mas é tecnicamente muito mais difícil, porque requer:
Fertilização in vitro (FIV)
Testes genéticos nos embriões (antes de serem implantados)
Manipulação genética com técnicas como CRISPR
A eficiência ainda é muito baixa, ou seja, nem sempre funciona como se espera.
Existem grandes preocupações éticas e de segurança:
Riscos desconhecidos para o bebé e para futuras gerações
Possibilidade de "designer babies" (manipulação de características não médicas)
Por isso, nenhuma terapia genética da linha germinal está aprovada clinicamente até agora.
Estratégias para introdução de genes
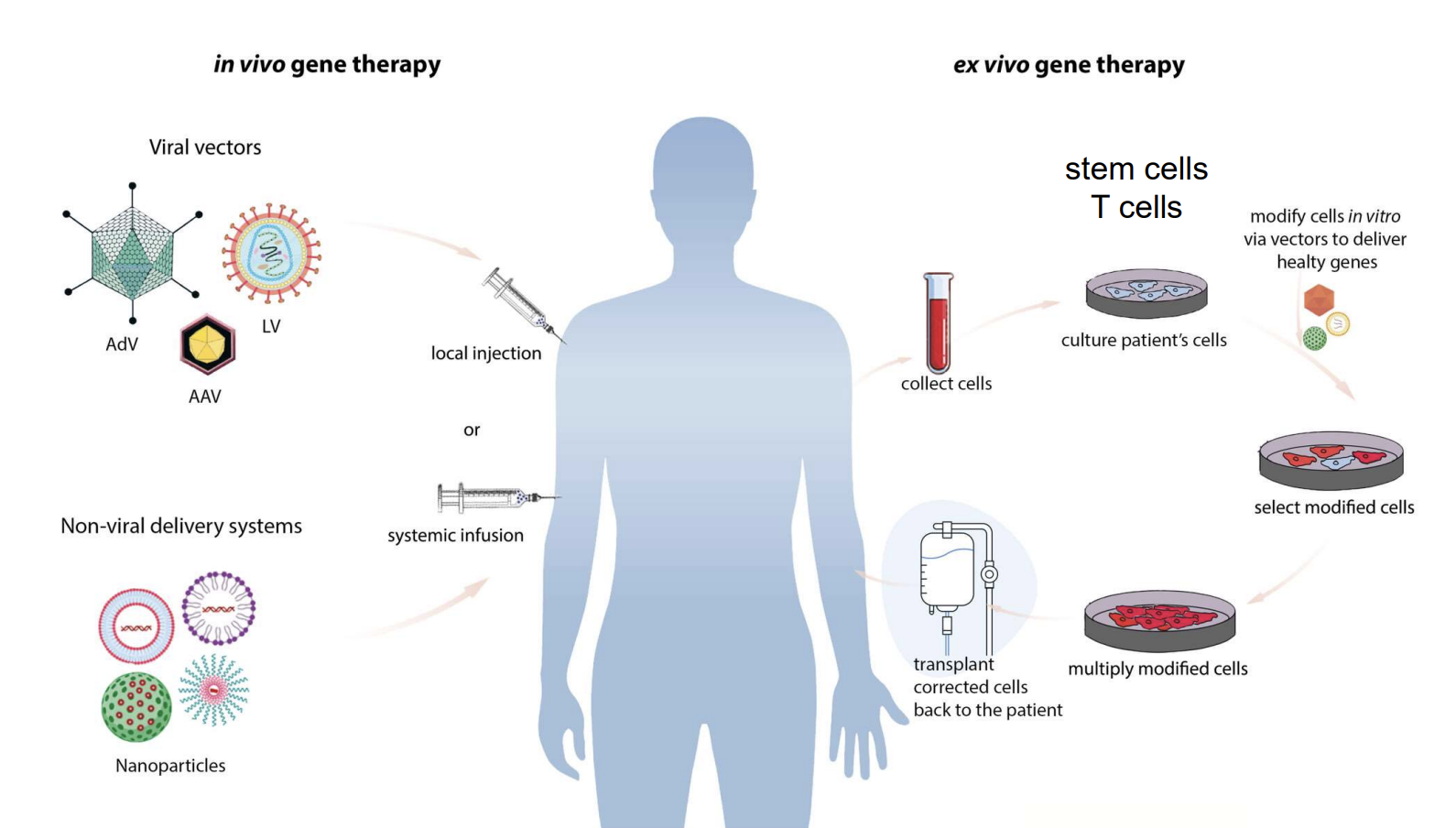
A terapia genética tem como objetivo tratar doenças através da introdução de genes terapêuticos nas células de um paciente. Existem duas estratégias principais:
a entrega in vivo (diretamente no paciente). Os métodos in vivo introduzem o material genético diretamente no organismo, geralmente por injeção ou infusão.
a entrega ex vivo (as células são modificadas fora do corpo e depois reintroduzidas no paciente). Os métodos ex vivo consistem em recolher células do paciente (por exemplo, células estaminais ou células do sistema imunitário), modificá-las geneticamente em laboratório com recurso a vetores virais ou ferramentas de edição genética, e posteriormente transplantar as células modificadas de volta para o paciente.
Estas duas abordagens diferem quanto ao processo, aos alvos celulares, às ferramentas utilizadas e à aplicação clínica.
⚖ Regulação Europeia para Medicamentos de Terapia Génica
Classificados como medicamentos de terapias avançadas. Devem conter ácidos nucleicos recombinantes e o efeito terapêutico está ligado diretamente à sequência genética ou ao seu produto de expressão.
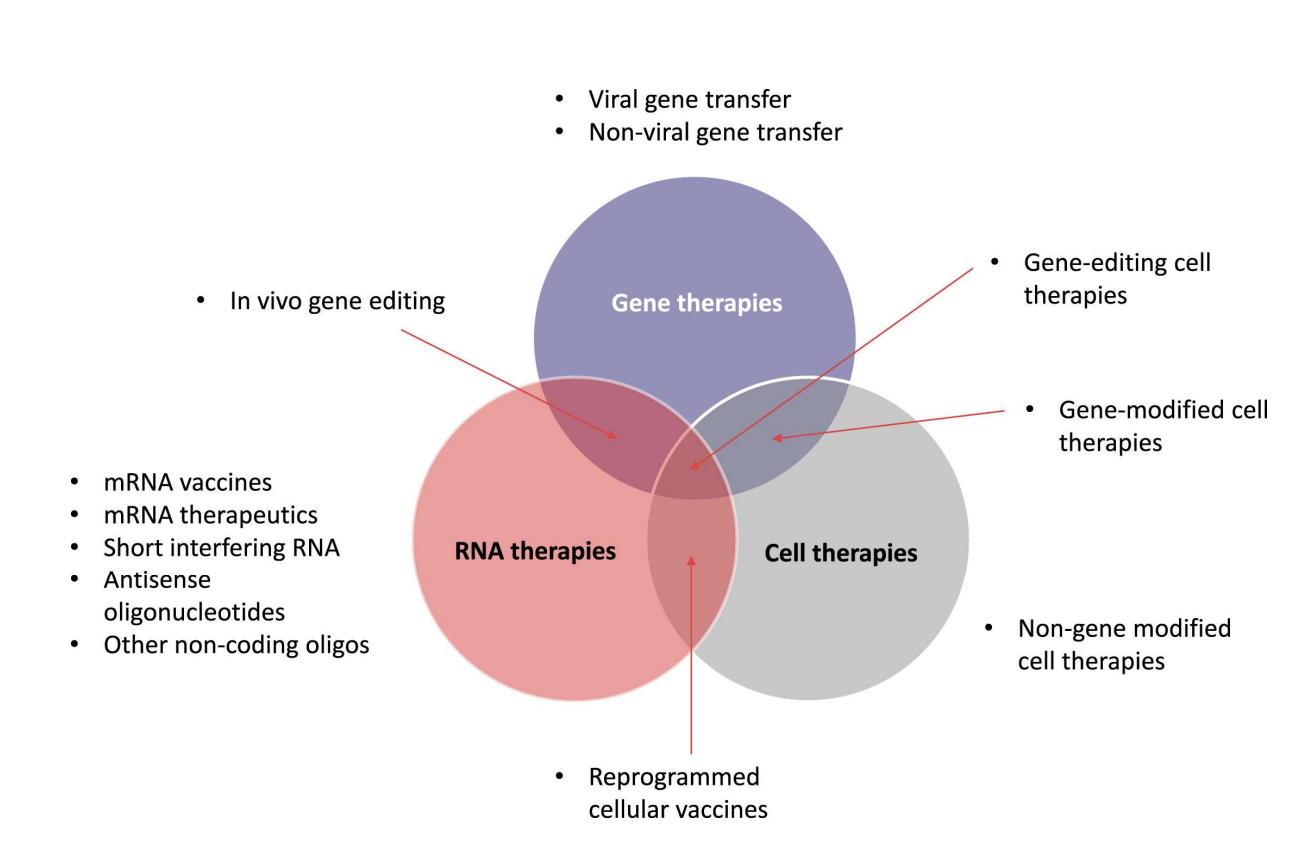
Tipos de vetores
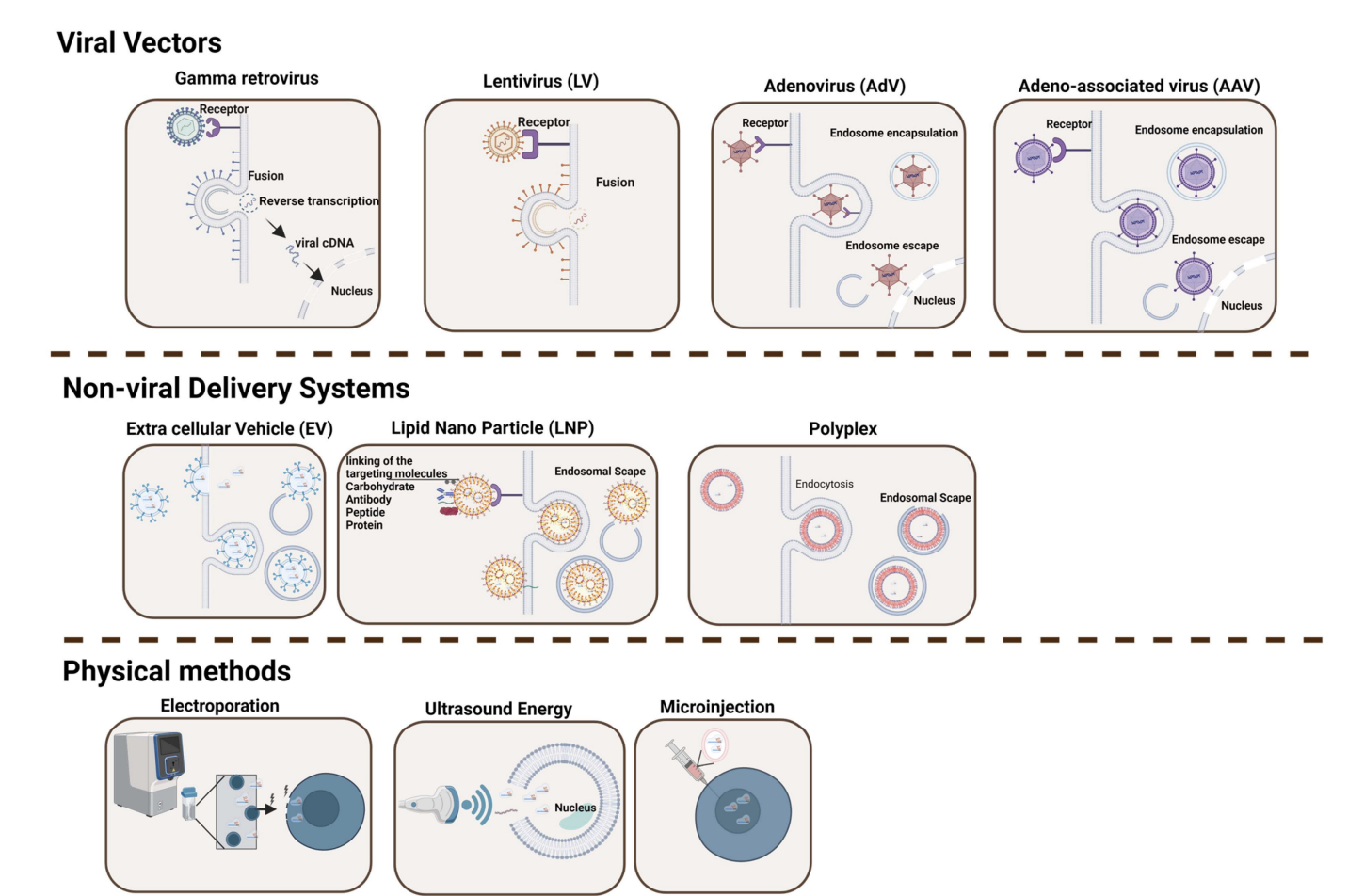
🦠 Vetores Virais – Comparação

São naturalmente capazes de infetar células humanas.
Os adenovirus e adeno-associados não integram no genoma - tem imensos serotipos mais específicos e podemos escolher o serotipo mais adequado facilmente
Os lentivírus integram no genoma
🧬 Terapia Génica com AAV (Adenovírus)
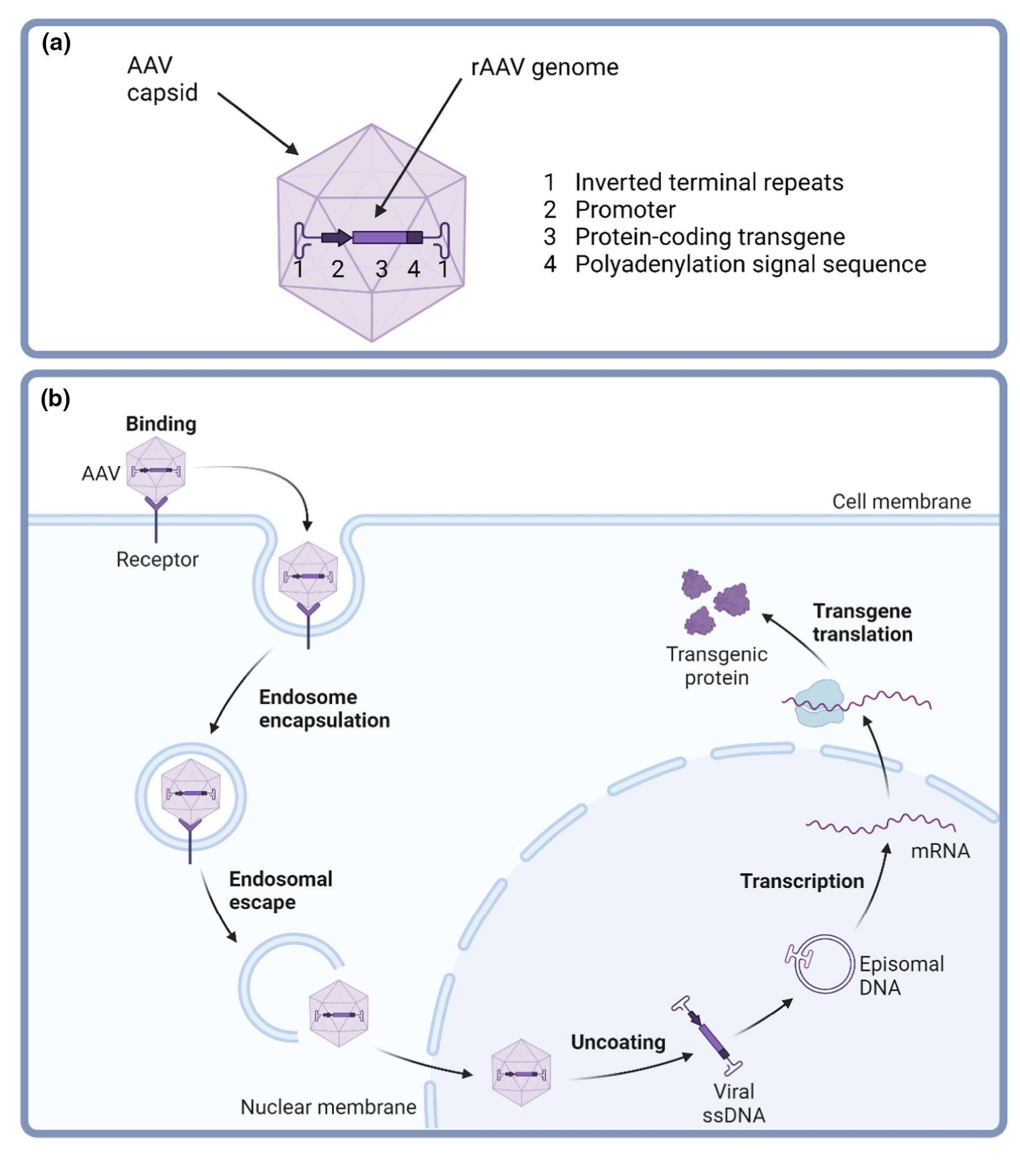
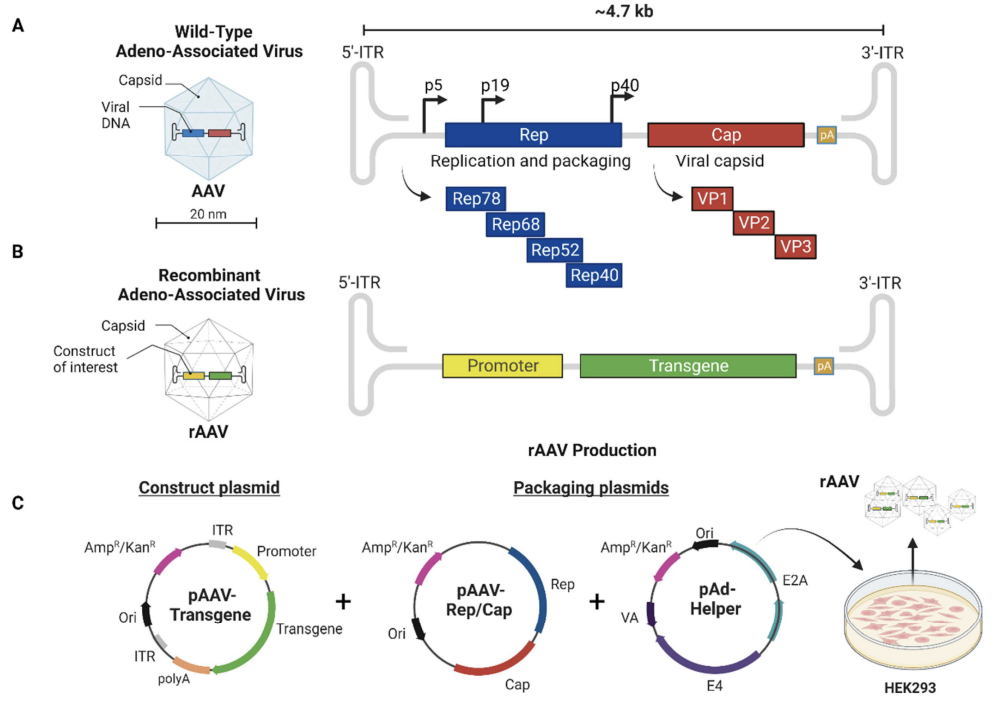
AAV (vírus adeno-associado) é um dos vetores virais mais usados em terapia génica, especialmente em doenças genéticas raras. Quando se fala em "terapia génica com AAV", estamos a referir-nos à utilização deste vírus (modificado para ser seguro) como veículo para entregar um gene terapêutico a células do corpo.
– Exemplo: Zolgensma®
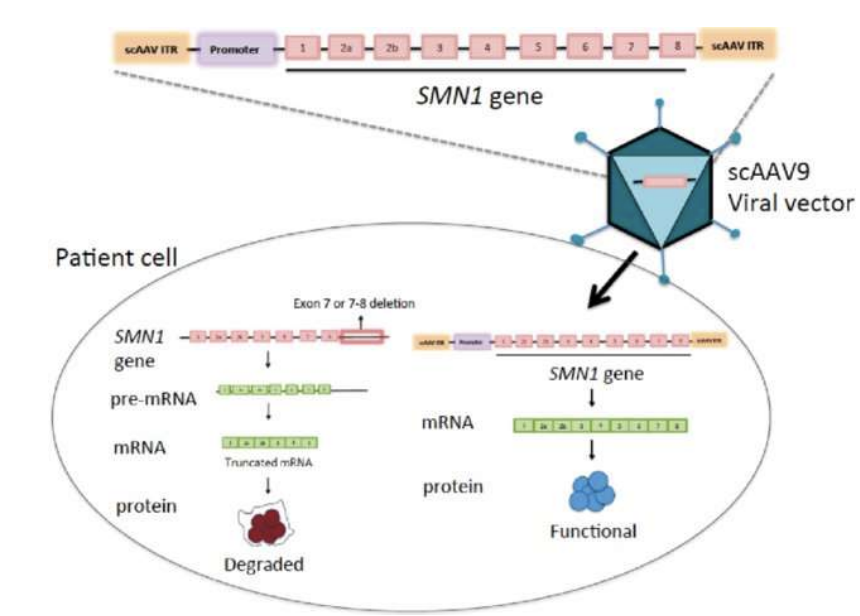
Terapia génica única para atrofia muscular espinal (AME) administrada por infusão intravenosa a crianças com menos de dois anos de idade, que entrega uma cópia saudável do gene SMN1 através de um vetor AAV9, restaurando a função dos neurónios motores.
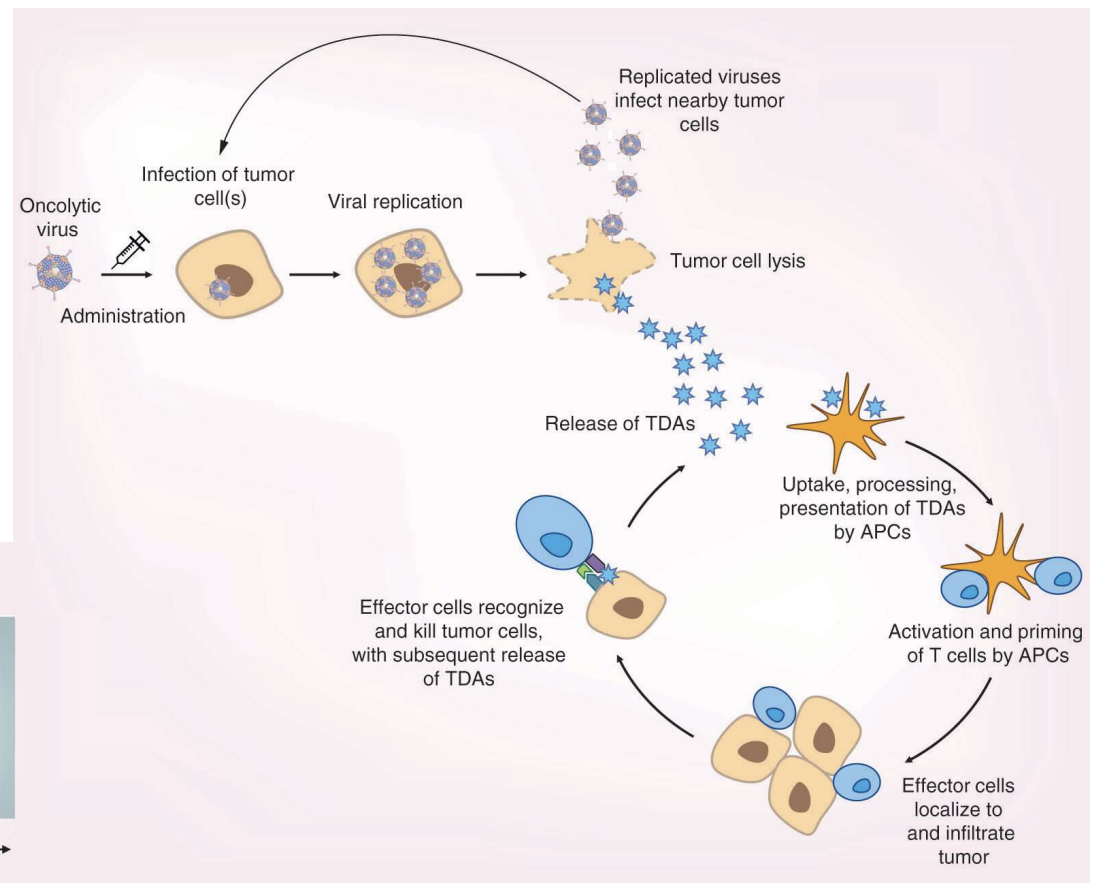
🦠 Vírus Oncolíticos – Exemplo: Imlygic® (HSV-1)
Vírus HSV-1 modificado para infetar e destruir seletivamente células tumorais
Induz resposta imune antitumoral
Expressa GM-CSF para ativar células apresentadoras de antigénio (APCs)
Usado em melanoma e cancro pancreático
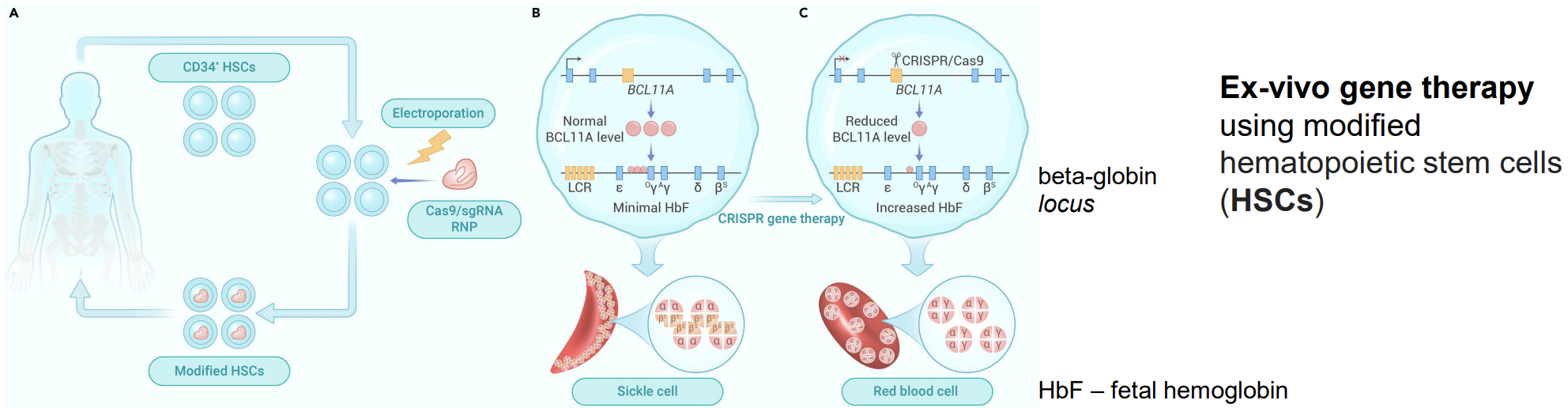
🧬 Edição Génica com CRISPR – Casgevy®
Para anemia falciforme e β-talassémia
Primeira terapia CRISPR aprovada em humanos
Atua ex vivo em células estaminais hematopoiéticas
sgRNA dirige Cas9 à região potenciadora do gene BCL11A
Corte gera indels por NHEJ, reduzindo ligação de GATA1 → ↑ Hb fetal (HbF)
🚫 Vectores Não-Virais – Vantagens e Limitações
Vantagens:
Menor imunogenicidade
Evitam mutagénese por inserção
Versatilidade: DNA, RNA, mRNA, CRISPR
Mais fáceis de fabricar e escalar
Desvantagens:
Eficiência de transfeção mais baixa
Expressão geralmente transitória
Precisam de otimização para tecidos específicos
Dificuldades de entrada celular e fuga endossómica
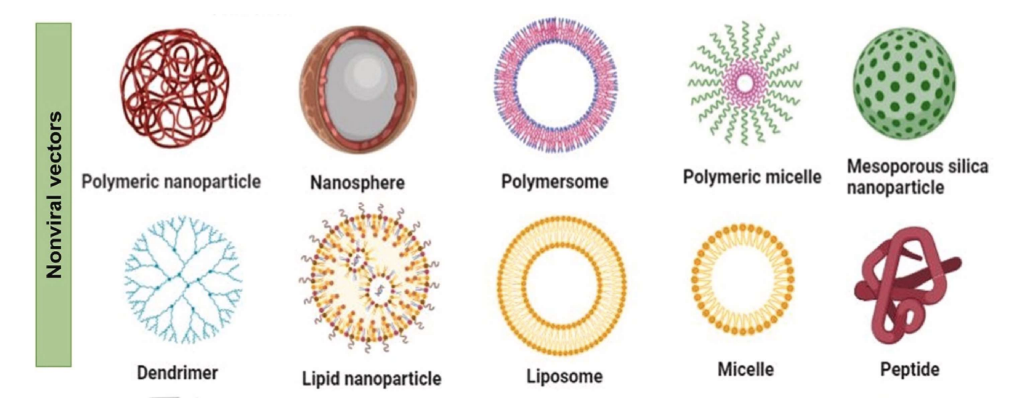
🧪 Tipos de Vetores Não-Virais
1. LNPs & Lipossomas:
Usados em vacinas mRNA COVID-19
Composição: lípidos ionizáveis, colesterol, PEG
Ex: Onpattro® (patisiran) – 1º siRNA aprovado (LNP com PEG-DMG e DSPC)
2. Nanopartículas Poliméricas (PNPs):
Ex: quitosano, PEI, PLGA
Formam polyplexes, polímerosomes, dendrímeros
Superfície personalizável
3. Peptídicos:
Ex: CPPs (cell-penetrating peptides)
Facilitam translocação da membrana
4. Nanopartículas Inorgânicas:
Ex: ouro, sílica, óxido de ferro
Usadas para entrega + imagem + libertação controlada
💉 Onpattro® (patisiran) – siRNA Terapêutico
Alvo: amiloidose hATTR (mutação TTR)
siRNA inibe produção da TTR mutada
Formulado com LNPs → ↑ tempo de circulação, evita agregação
Componentes como PEG-DMG e DSPC estabilizam e prolongam eficácia
🧪 Ensaios Clínicos em Terapia Génica
Estão em crescimento, com terapias já aprovadas para doenças raras e oncológicas
Novas abordagens incluem terapias baseadas em edição (CRISPR), RNA e vetores híbridos
⚠ Desafios Futuros na Terapia Génica
Segurança:
Resposta imune (ex. contra AAV)
Risco de mutagénese insercional
Toxicidade por dose elevada de vetor
Entrega:
Baixa eficiência em certos tecidos
Dificuldade em atravessar barreiras (ex. hematoencefálica)
Acesso e Produção:
Escalabilidade limitada
Custos elevados
Regulamentação complexa e variável
🌐 Perspetivas Emergentes
Edição de nova geração: base/prime editing mais seguros
Vetores inovadores: AAV modificados, lentivírus auto-inativáveis
IA & bioinformática: personalização da terapia e desenho vetorial
Modelos preditivos: organoides, sistemas microfisiológicos, ratinhos humanizados
🧠 Conclusão Final
A terapia génica está a evoluir de uma abordagem para doenças raras para terapias sistémicas e personalizadas. O futuro depende da precisão, segurança e escalabilidade.