Chem 10º
5.0(3)Studied by 144 people
Card Sorting
1/125
Earn XP
Description and Tags
Last updated 8:55 PM on 12/12/23
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
126 Terms
1
New cards
Configuración electrónica
La manera en la que los electrones están ordenados y distribuidos en los distintos orbitales atómicos

2
New cards
Niveles de energía
representan que tan cerca al núcleo se encuentran los electrones (periodos en la tabla periódica)
1 = más cerca
7 = más lejos
1 = más cerca
7 = más lejos
3
New cards
Subniveles de energía
Representan los orbitales que tienen las mismas características dentro de un nivel de energía. (El número de subniveles corresponde al nivel de energía)
S P D F
S P D F
4
New cards
Electrón
una partícula sub-atómica con carga negativa. Crean compuestos (reacciones químicas)
5
New cards
Protón
una partícula sub-atómica con carga positiva. Define que elemento es (da la identidad)
6
New cards
Neutrón
una partícula sub-atómica con carga neutra (igual positivo que negativo) que se encuentra en el núcleo del átomo. Define el tipo de átomo, si es un isótopo.
7
New cards
Átomo
Es la partícula más pequeña de materia que no se puede descomponer químicamente (carga neutra)
8
New cards
Isótopos
Es una variante de un elemento químico en el cual el número de neutrones cambia —sin que cambie el elemento químico—
9
New cards
Electrones de valencia
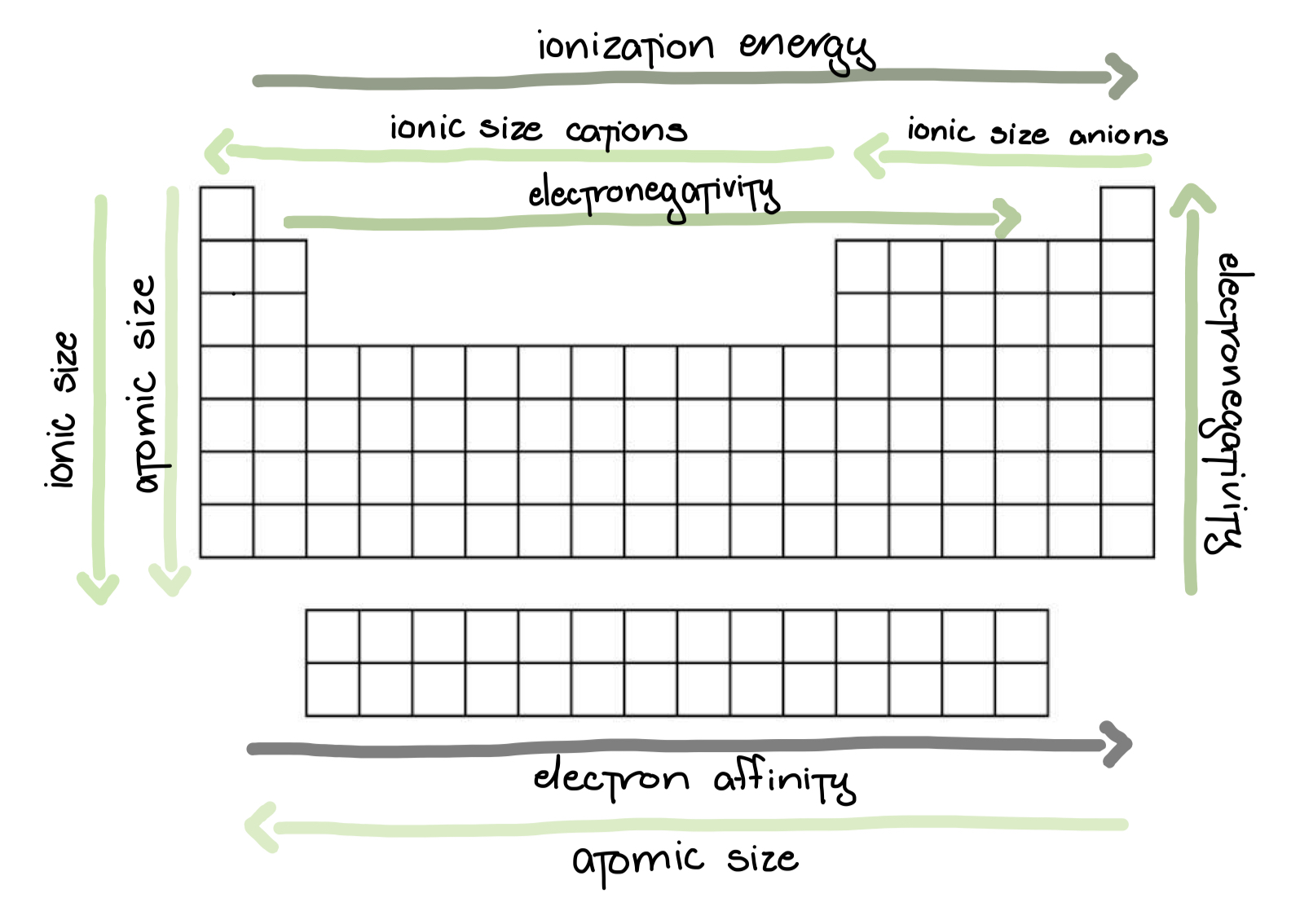
Los electrones que se encuentran en la capa más externa (la última)
10
New cards
Propiedades químicas
Son las características que se hacen evidentes durante una reacción química
11
New cards
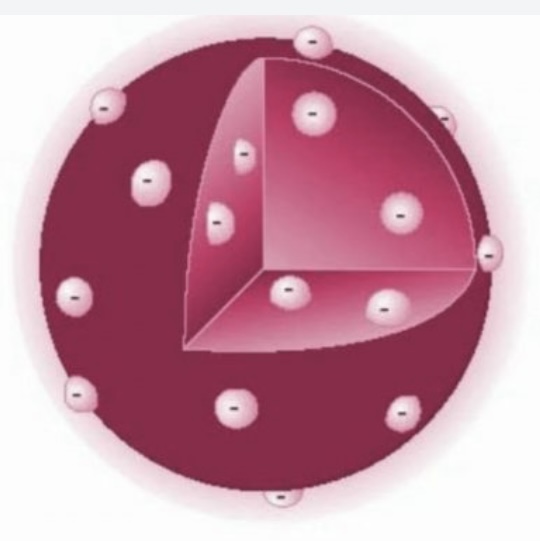
Modelo de Thompson
Los átomos están compuestos por una esfera de carga positiva con electrones (carga negativa) están incrustados en ella
12
New cards
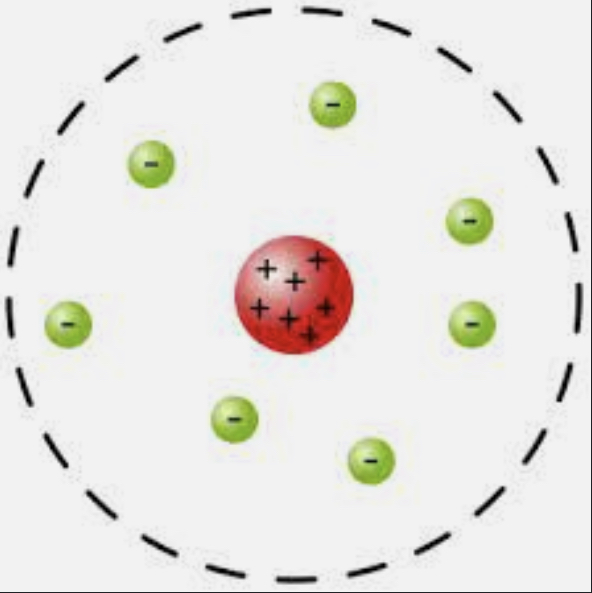
Modelo de Rutherford
Los átomos tienen una zona nuclear con carga positiva con electrones circulando alrededor
13
New cards
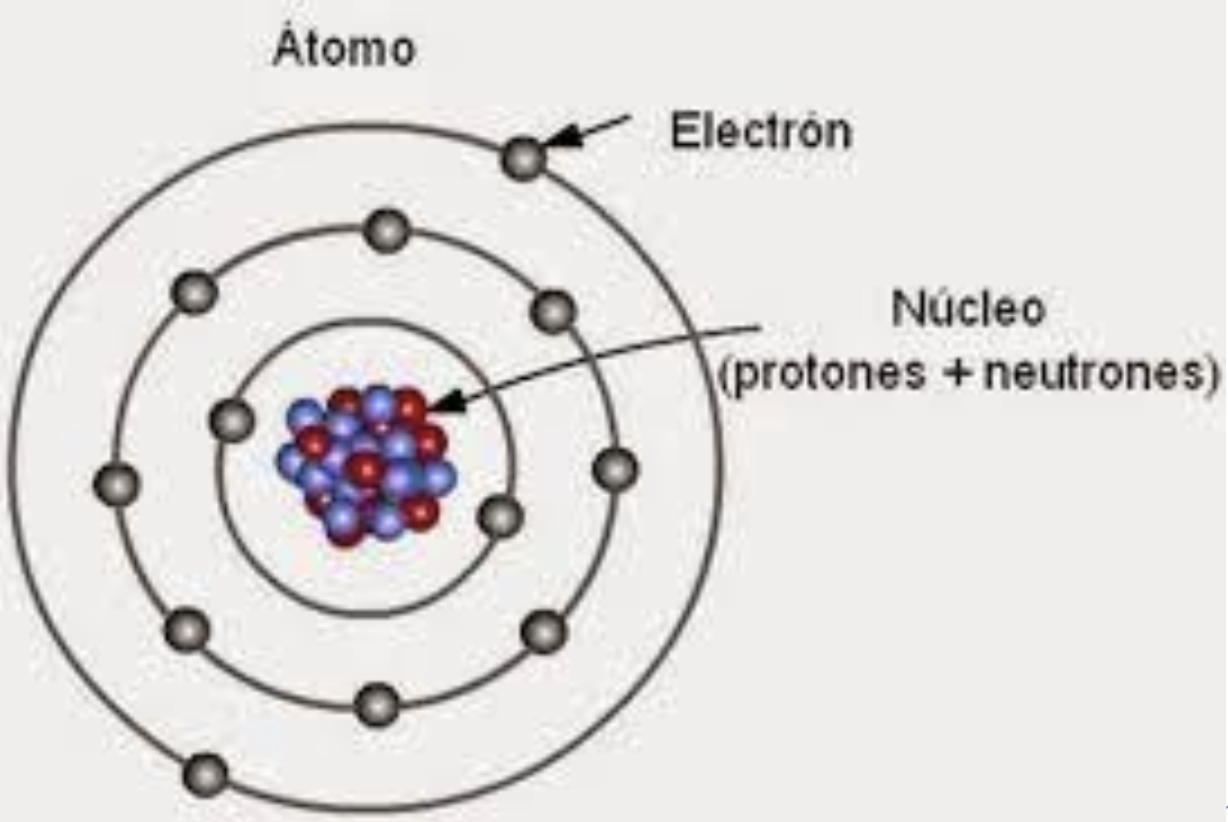
Modelo de Bohr
El átomo tiene un núcleo que continene protones y neutrones mientras que los electrones se encuentran en orbitales y niveles establecidos alrededor del núcleo
14
New cards
Iones
Son átomos cargados positiva o negativamente
15
New cards
Cationes
Son iones con carga positiva (menos electrones)
16
New cards
Aniones
Son iones con carga negativa (más electrones)
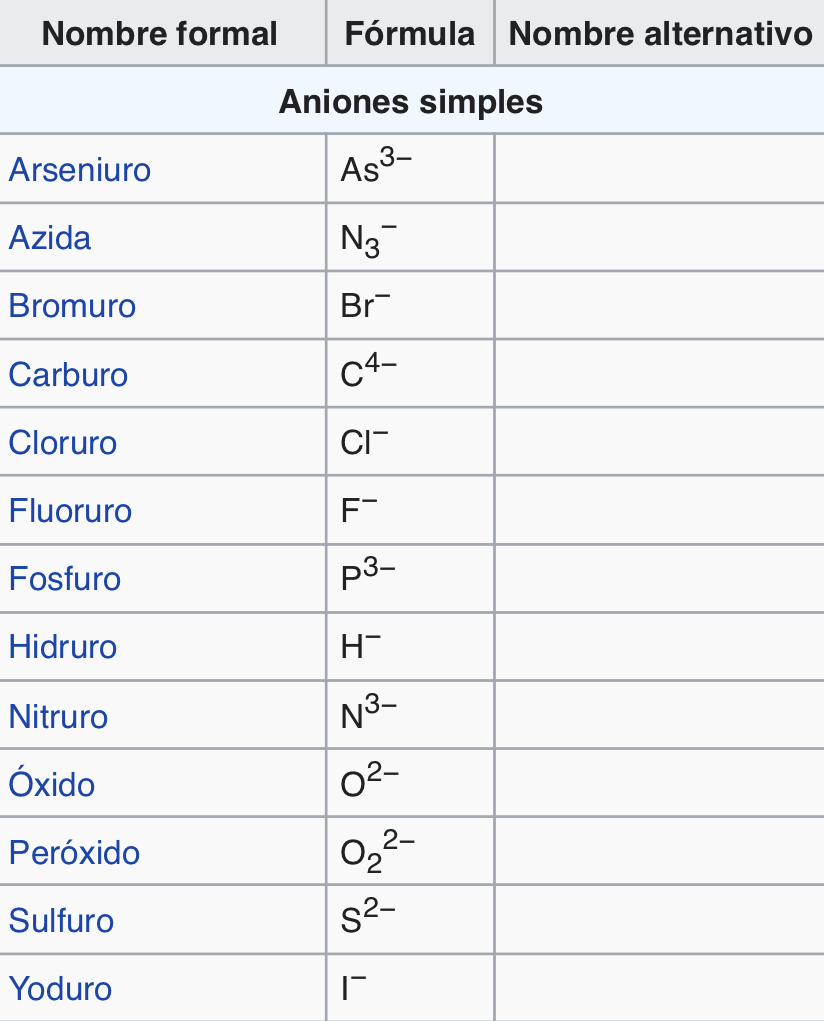
17
New cards
Elementos químicos
sustancias puras ya que la materia está compuesta de un mismo tipo de átomo
18
New cards
Números cuánticos
Definen el comportamiento de los electrones en un átomo. Son 4: N, L, M, Ms
19
New cards
Principio de Aufbau
Un principio que sigue la regla de Hund y representa los orbitales como cajitas (los subniveles se llenan en orden (1s después 2s y so on)
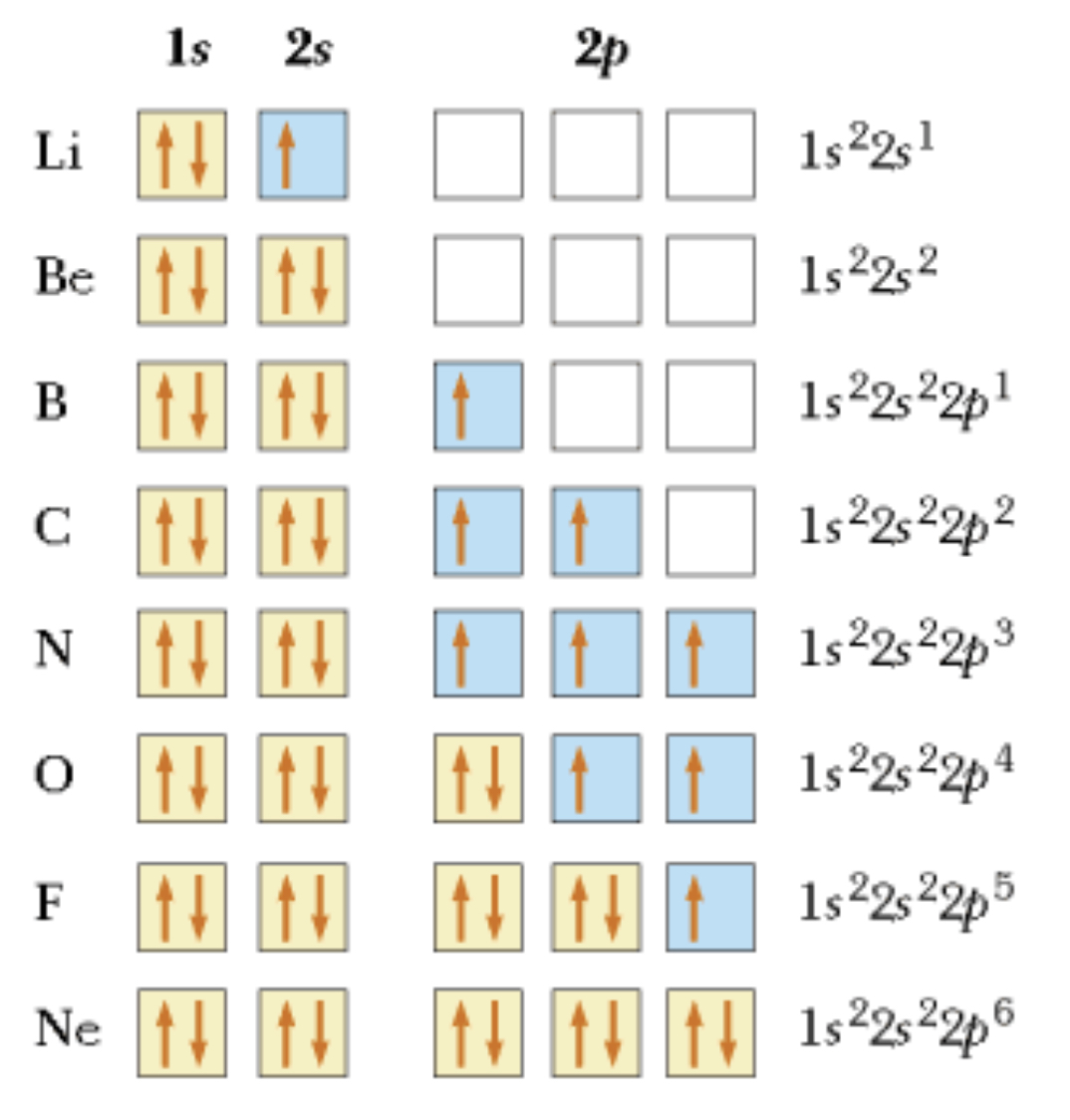
20
New cards
Electronegatividad
La habilidad/la fuerza de un átomo para atraer electrones de otro átomo
• Decrease from top to bottom in a group
• Increase from left to right in a period
• Decrease from top to bottom in a group
• Increase from left to right in a period
21
New cards
Clases de elementos
• Metales (alkalinos, alkalino-terreos, metales de transición, tierras raras)
• Metaloides
• No-metales (halogenos (A7), anfígenos (A6), gases nobles)
• Metaloides
• No-metales (halogenos (A7), anfígenos (A6), gases nobles)
22
New cards
Periodos/Series
Las líneas horizontales en la tabla periódica. Hay ciertas propiedades que los elementos en cada periodo tienen en común (representan el nivel de energía)

23
New cards
Grupos/Familias
Las líneas verticales en la tabla periódica. Hay ciertas propiedades que los elementos en cada grupo tienen en común (Grupos A & B)

24
New cards
Propiedades físicas
Las propiedades de la materia que se pueden ver y medir sin alterar la estructura atómica, la composición
25
New cards
N (número cuántico)
Representa el nivel de energía (1-7) y se encuentra en la tabla periódica
26
New cards
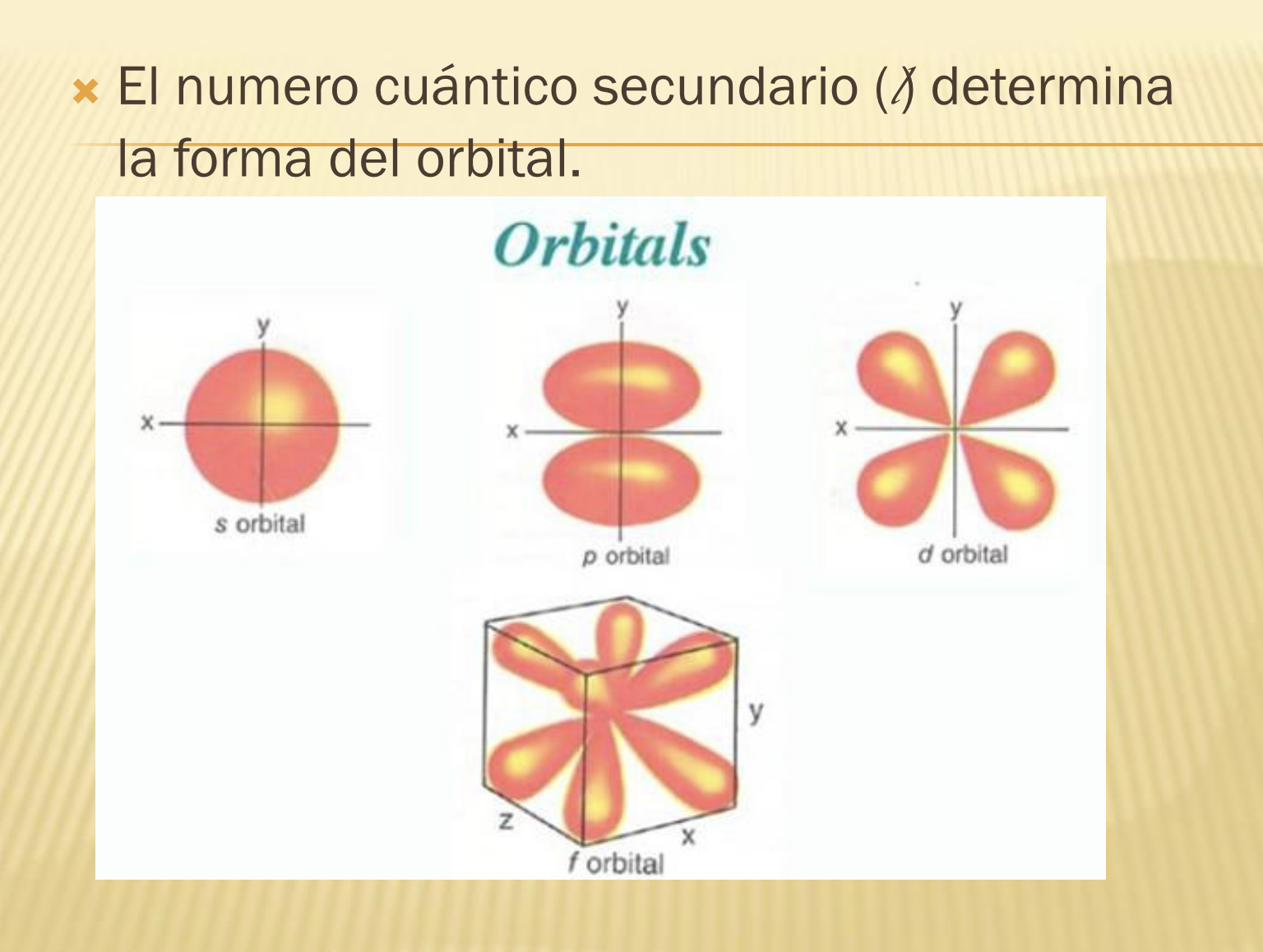
L (número cuántico)
Determina la forma del área en la que estarán los electrones (orbitales)
27
New cards
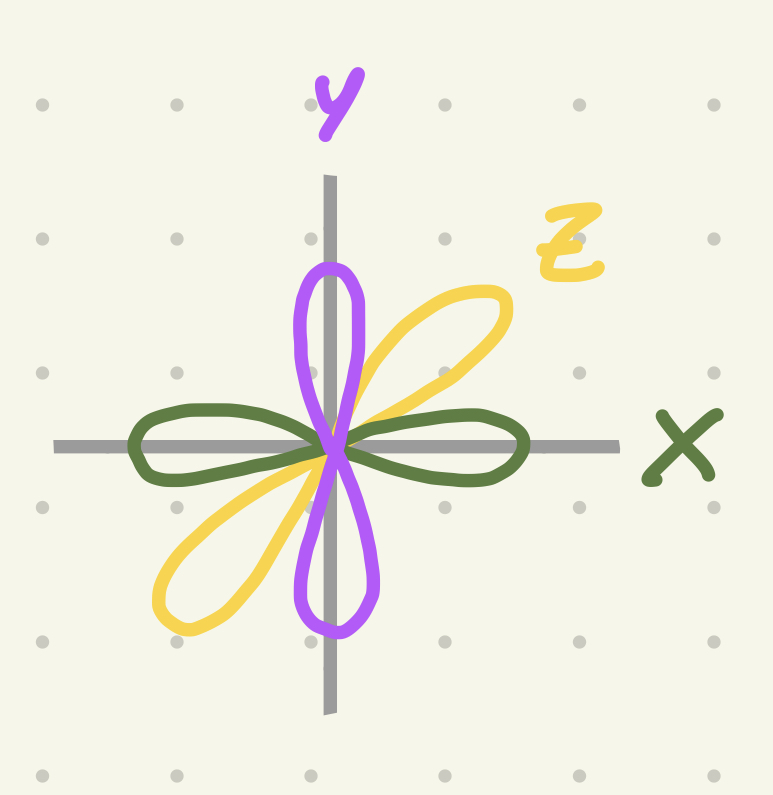
M (número cuántico)
Determina el sentido/la dirección en la cual están los electrones (X, Y o Z)
28
New cards
Ms (número cuántico)
Determina el spin/la rotación de los electrones. Si van hacia arriba o hacia abajo

29
New cards
Cómo pueden 2 electrones estar juntos?
Por ser 2 partículas con carga negativa se repelen, pero, al tener spins opuestos pueden convivir relativamente cerca sin crear una explosión
30
New cards
Metaloides
Elementos que tienen características de metales y no-metales
31
New cards
Subnivel S
Tiene 2 electrones = 1 orbital. Forma esférica
32
New cards
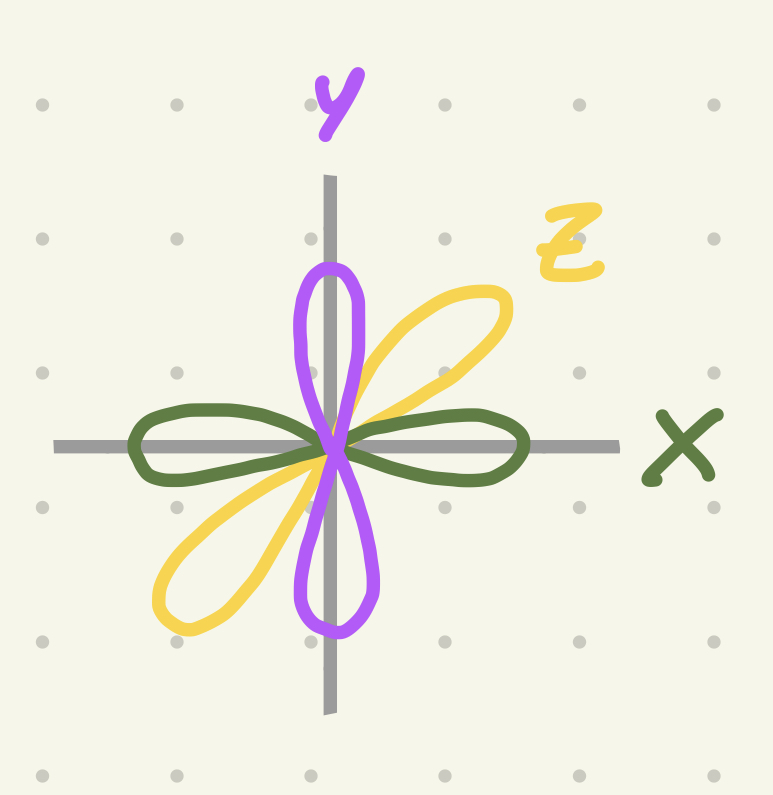
Subnivel P
Tiene 6 electrones = 3 orbitales. Forma lobular
33
New cards
Subnivel D
Tiene 10 electrones = 5 orbitales
34
New cards
Subnivel F
Tiene 14 electrones = 7 orbitales
35
New cards
Enlaces iónicos
Es un enlace químico entre cationes (metales) y aniones (no metales) en los cuales el cation le entrega electrones al anion
36
New cards
Enlaces covalentes
Un enlace químico entre no-metales en los cuales los 2 átomos compartment electrones (formando pares de electrones)
37
New cards
Polaridad
La cantidad de electronegativad ejercida por los átomos en un enlace covalente (electronegatividades iguales = apolaridad)
(electronegatvidades distintas = polaridad)
(electronegatvidades distintas = polaridad)
38
New cards
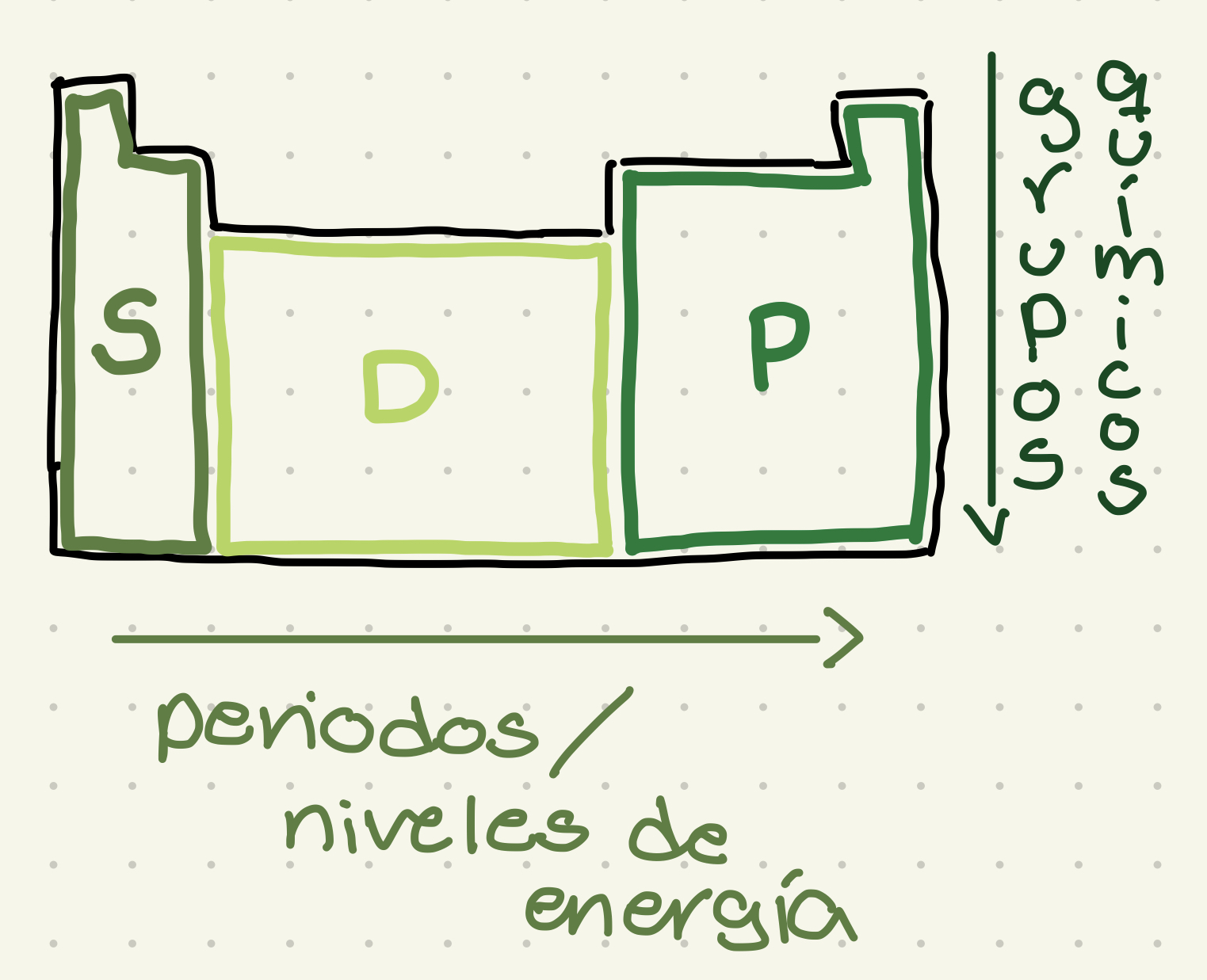
División en la tabla periódica
La tabla periódica se divide en periodos, grupos y el último orbital de la configuración electrónica de los elementos.
39
New cards
Element squares
The squares in the periodic table. They display:
• names
• symbols
• Atomic number
• Atomic mass
• names
• symbols
• Atomic number
• Atomic mass

40
New cards
Halógenos
Son una clasificación de elementos no metales encontrados en la tabla periódica (del flúor al astato)
41
New cards
Espectro electromagnético
Es un área/región en el cosmos en la cual se encuentra concentrada la radiación electromagnética
42
New cards
Rayos X
Uno de los subniveles de la radiación electromagnética.
43
New cards
Estructura de Lewis
Es una manera visual de representar los electrones de valencia (últimos electrones) de un átomo y los enlaces iónicos y covalentes
44
New cards
Principio de Heisenberg (incertidumbre)
Si lo sabemos todo sobre dónde se encuentra una partícula (la incertidumbre de posición es pequeña), no sabemos nada sobre su momento (la incertidumbre de momento es grande), y viceversa. (Se puede tener cierto conocimiento del recorrido de las partículas en una onda pero no conocimiento exacto de la posición en un momento indicado)
45
New cards
Teoría Cuántica
la teoría que describe el comportamiento de la materia, la radiación y todas sus interacciones a nivel microscópico. Describe la dualidad onda-partícula de los electrones
46
New cards
Fotones
Las partículas encontradas en ondas de radiación de luz visible
47
New cards
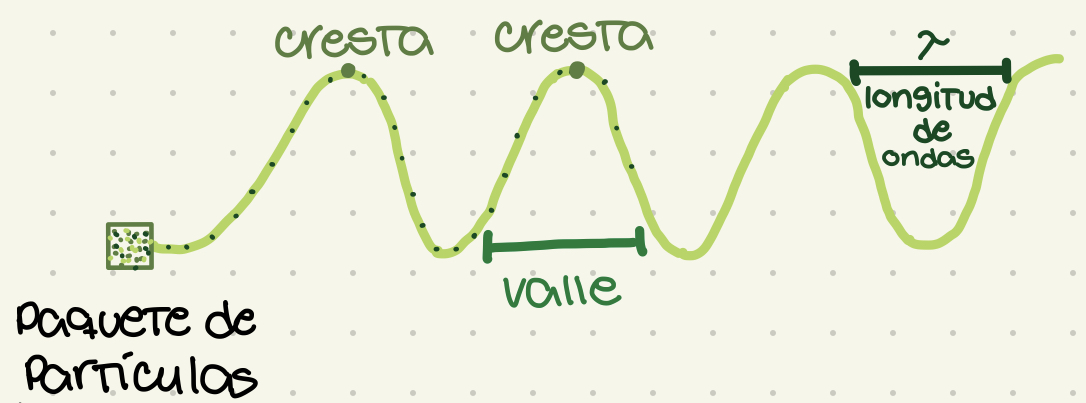
Longitud de onda
Distancia entre cresta y cresta. Representado por lambda (letra griega: λ). Define la violencia y el sub-tipo de radiación.
48
New cards

Hibridación
Es la acción entre átomos que se solapan (montan) y se deslizan entre ellos creando enlaces por medio de sus electrones (crean fricción para crear enlaces)
49
New cards
Salto electrónico
Cuando los electrones absorben tanta energía (radiación electromagnética) que necesitan saltar a un orbital con mayor capacidad de energía y viceversa. (De nivel a nivel)
50
New cards
Radiación electromagnética
Tipo de energía que carga a los electrones y causa o disminuye la excitación de los electrones (lo que causa el salto electrónico)(se absorbe y se emite) (cada elemento puede absorber más o menos dependiendo de las propiedades químicas)
51
New cards

Aleación
Enlace entre elementos metálicos. Ningún elemento acepta la electrones creando así el modelo del mar electrónico.
52
New cards
1ra ley de termodinámica
Conservación de la energía: no se crea ni se destruye, simplemente se transforma o transita
53
New cards
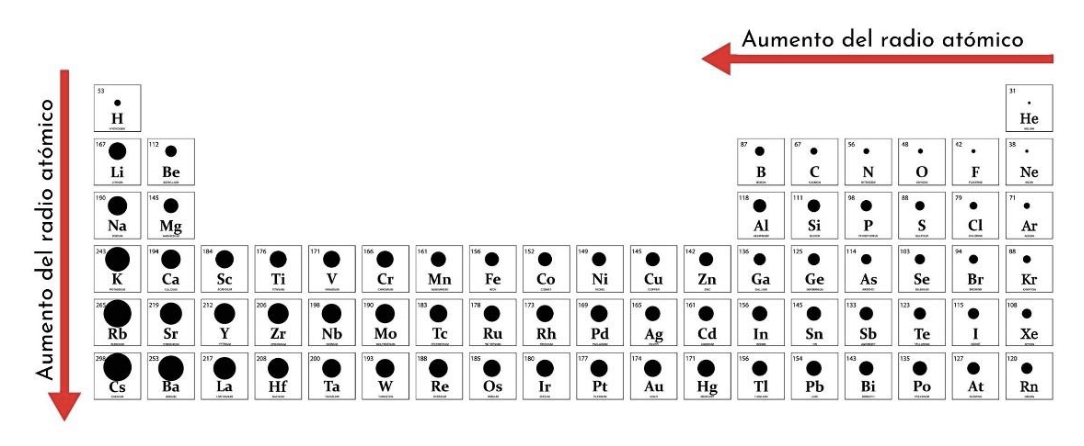
Tendencia de radio atómico
Aumenta de derecha a izquierda y de arriba hacia abajo
54
New cards
Radio atómico
Distancia que existe entre el núcleo y la capa de valencia (la más externa). El tamaño del átomo.
55
New cards

Zonas del espectro electromagnético
7 zonas que van de izquierda a derecha, de menor a mayor intensidad (de menos a más violencia) en el sub-tipo de radiación
56
New cards
Hormesis
alta exposición a un tratamiento (puede ser con radiación) por un instante para curar/eliminar cualquier enfermedad (debe tenerbalance)
57
New cards
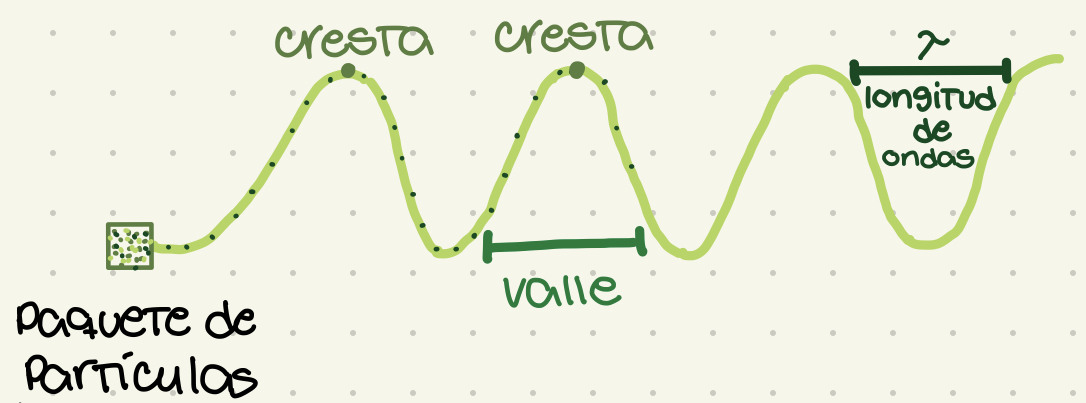
Ondas
La manifestación de la radiación electromagnética. Un paquete de partículas moviéndose en trayectoria de ondas.
58
New cards
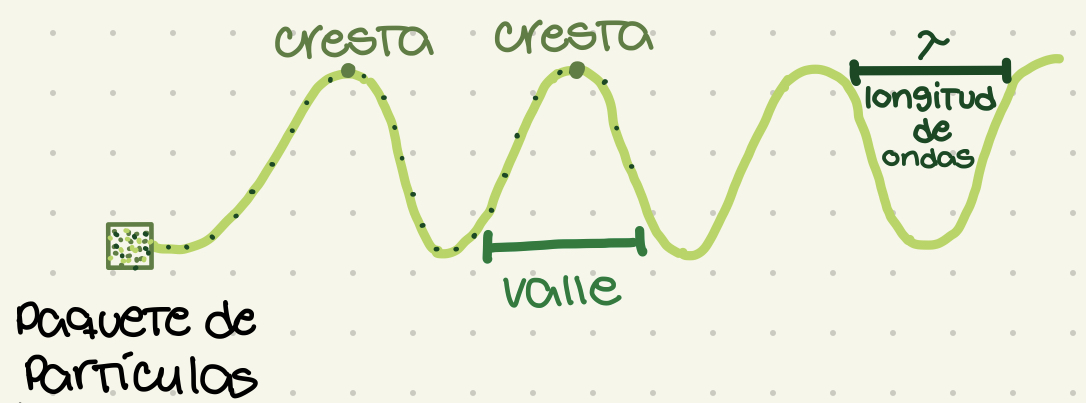
Cresta
El punto más alto de la onda
59
New cards
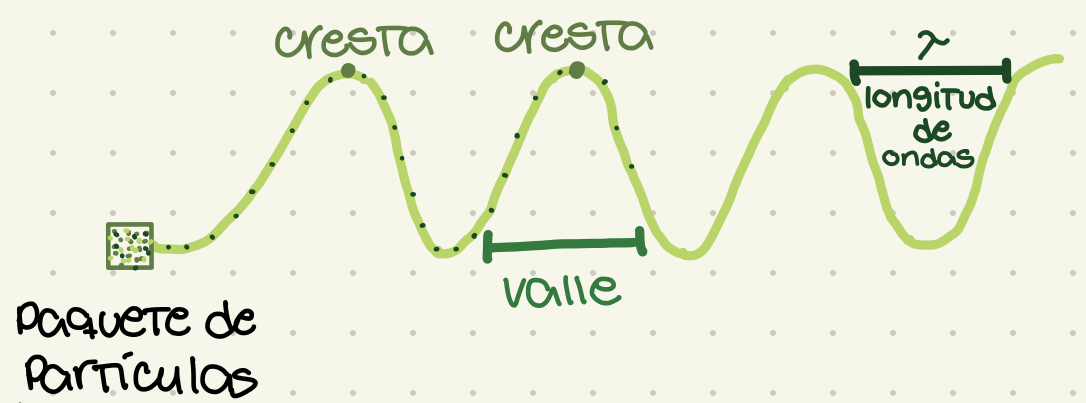
Valle
El punto más bajo de la onda. La base de la onda
60
New cards

Mayor longitud de onda
Menos intensidad en la radiación
61
New cards

Menor longitud de onda
Mayor intensidad en la radiación
62
New cards
Fotones
Las partículas que se encuentran en las ondas de luz visible
63
New cards
Efecto fotoeléctrico
También conocido como fotoemisión. La expulsión de electrones cuando la luz brilla en un metal
64
New cards
Conexión entre modelo de Bohr y modelo de Schrodinger
La dualidad onda-partícula.
65
New cards
Dualidad onda-partícula
Base de la teoría cuántica. Los electrones se pueden mover como ondas
66
New cards
Modelo de mar electrónico
El rebote/flujo continuo de los electrones de átomo en átomo en una aleación
67
New cards
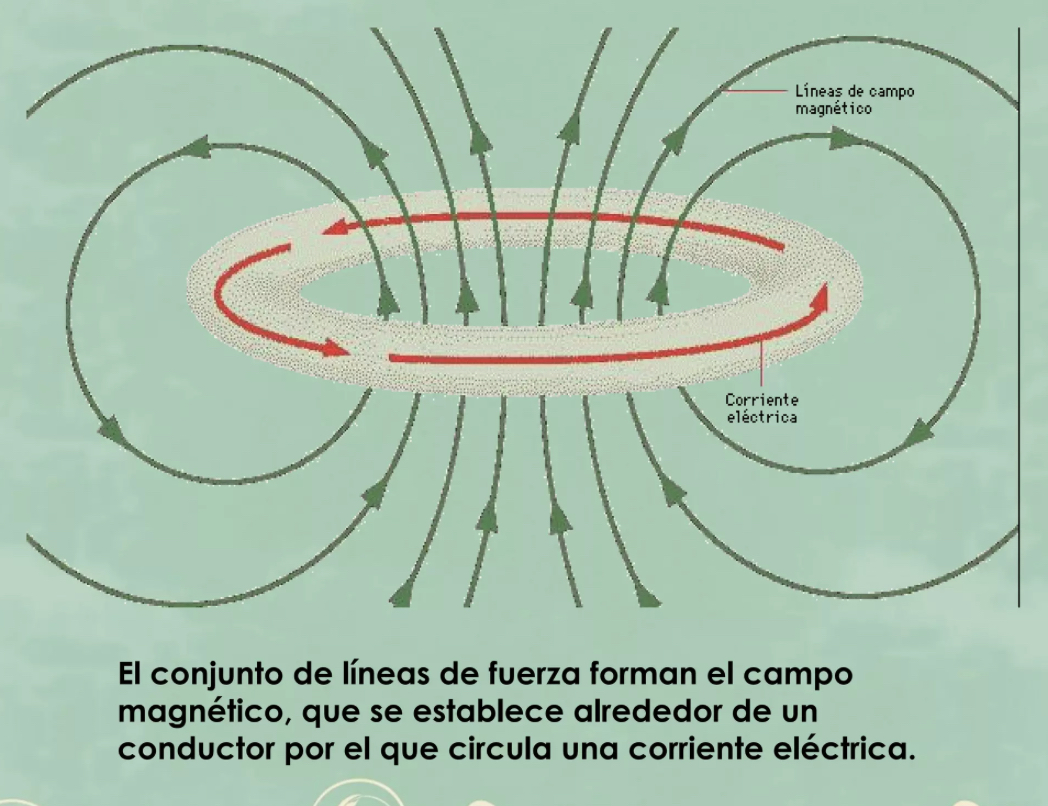
Campo electromagnético
una combinación de campos de fuerza eléctricos y magnéticos invisibles. (Cuando hay corriente en un campo eléctrico la magnitud del campo magnético cambia con el consumo de poder, la fuerza del campo eléctrico quedará igual)
68
New cards
Conductividad eléctrica
Habilidad de la materia para permitir el flujo de la corriente eléctrica a través de sus partículas.
69
New cards
Aniones poliatómicos
una molécula que ha sido ionizada al ganar o perder electrones. (e.g. OH-)
70
New cards
Números cuánticos
Indican las características del comportamiento de e- en los átomos.
71
New cards
Óxidos metálicos
Enlace entre un metal + oxígeno
(Solo se usa el # de átomos del oxígeno)
1- mono, 2- bi/di, 3- tri, 4- tetra, 5- penta, 6- hexa, 7- hepta, 8- octa
(Solo se usa el # de átomos del oxígeno)
1- mono, 2- bi/di, 3- tri, 4- tetra, 5- penta, 6- hexa, 7- hepta, 8- octa
72
New cards
Campo magnético
tienen su origen en las corrientes eléctricas: una corriente más fuerte resulta en un campo más fuerte.
73
New cards
Campo eléctrico
tiene su origen en diferencias de voltaje: entre más elevado sea el voltaje, más fuerte será el campo que resulta. (Existe aunque no hay corriente)
74
New cards
Cómo se lee una fórmula química?
Derecha a izquierda
75
New cards
Hidróxidos/Bases/Álcalis
Enlace entre metal + OH (hidróxido)
OH siempre tendrá valencia de -1
2- bi/di, 3- tri, 4- tetra, 5- penta, 6- hexa, 7- hepta, 8- octa
OH siempre tendrá valencia de -1
2- bi/di, 3- tri, 4- tetra, 5- penta, 6- hexa, 7- hepta, 8- octa
76
New cards
Anidridos
Enlace entre no metales + oxígeno
(Se mencionan ambos # de átomos)
1- mono, 2- bi/di, 3- tri, 4- tetra, 5- penta, 6- hexa, 7- hepta, 8- octa
(Se mencionan ambos # de átomos)
1- mono, 2- bi/di, 3- tri, 4- tetra, 5- penta, 6- hexa, 7- hepta, 8- octa
77
New cards
Ácidos hidrácidos
H + no metal (grupo A6/A7)
“Ácido” + raíz del no metal + “hídrico”
“Ácido” + raíz del no metal + “hídrico”
78
New cards
Sales binarias
Metal + no metal
Raíz no metal + “uro” + de metal
Raíz no metal + “uro” + de metal
79
New cards
Raíz del redox
Reducir (red), oxidar (ox)
80
New cards
¿A qué se debe la raíz del redox?
Porque en toda reacción química hay un elemento que se reduce y otro que se oxida, el redox mide la estabilidad y por ende el balance entre la reducción y la oxidación
81
New cards
¿Qué mide el redox?
mide la estabilidad de un enlace qxco
82
New cards
¿Cuál es la fórmula del redox?
Nivel 1 • Nivel 2 (left) - Nivel 1 • Nivel 2 (right) = 0 (should be)
83
New cards
¿ Cuántos niveles son al calcular redox?
3
84
New cards
Nivel 1 (redox)
El número de átomos en la fórmula qxca
85
New cards
Nivel 2 (redox)
Números de valencia
86
New cards
¿Cómo se determina el signo de la valencia?
Los metales son “+“ y los no metales “-” (el que está más a la derecha es “-”)
87
New cards
Nivel 3 (redox)
La fórmula en la que se determina la estabilidad
88
New cards
Maneras de encontrar la valencia
1. Cruce de valencia
2. Con la tabla periódica
2. Con la tabla periódica
89
New cards
Ácidos oxácidos
H + no metal + O
Valencia 1 = acido + (“hipo” + raíz no metal + “oso”)
Valencia 2 = acido + (raíz no metal + “oso”)
Valencia 3 = acido + (raíz no metal + “ico”)
Valencia 4+ = acido + (“hiper” + raíz no metal + “ico”)
Valencia 1 = acido + (“hipo” + raíz no metal + “oso”)
Valencia 2 = acido + (raíz no metal + “oso”)
Valencia 3 = acido + (raíz no metal + “ico”)
Valencia 4+ = acido + (“hiper” + raíz no metal + “ico”)
90
New cards
Valencia de H
+1
91
New cards
Valencia de Oxígeno
-2 (almost always)
92
New cards
uma
(Unidad de masa atómica) promedio de isótopos de un elemento
93
New cards
Configuración geométrica espacial
Disposición tridimensional de una molécula (define si es polar o no polar)
94
New cards
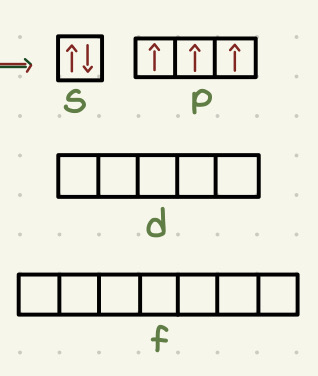
Regla de Hund
Los orbitales se llenan de manera estable (tienen que tener todos 1 electrón (hacia arriba) antes de tener un segundo electrón (hacia abajo)
95
New cards
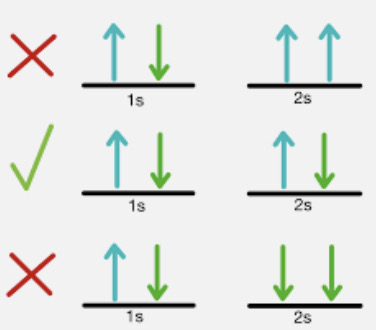
Regla de Pauli
Electrones deben tener spins opuestos, si tienen spins iguales no pueden ocupar el mismo estado cuántico
96
New cards
Ion poliatómico
Iones que tienen más de 1 átomo (se usa nomenclatura de las sales ternarias)
97
New cards
Fuerzas intermoleculares
Interacciones de carácter electroestático por las cuales se mantienen unidas las moléculas de enlaces covalentes
98
New cards
Fuerzas de Van der Waals
• Fuerzas Keesom (dipolo-dipolo)
• Fuerzas Debye (dipolo-inducido)
• Fuerzas de dispersión de London (dipolo instantáneo-inducido)
• Fuerzas Debye (dipolo-inducido)
• Fuerzas de dispersión de London (dipolo instantáneo-inducido)
99
New cards
Fuerzas Keesom
Las fuerzas que unen 2+ moléculas polares
100
New cards
Fuerzas Debye
Las fuerzas que unen 2+ moléculas no-polares