Kolloidika
1/97
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
98 Terms
Írj két példát kolloid rendszerekre a hétköznapokból!
sörhab, tej, köd, füst, mosószerek, vér, festék, kozmetikumok
Csoportosítsd a kolloidokat a szerkezetük alapján!
INKOHERENS rendszerek: kolloid diszperziók → liofób (elvileg aprítással előállíthatók), makromolekuláris oldatok → liofil, asszociációs kolloidok (surfactantok) → liofil (utóbbi 2: kolloidoldatok)
KOHERENS rendszerek (gélek): porodin → korpuszkuláris, retikuláris → fibrilláris, spongoid → lamelláris
Mi történik egy kolloiddal (pl. arckrém) pár hónap után és miért?
A kolloid rendszerek idővel destabilizálódhatnak/szételegyedhetnek, ami leülepedéshez vagy a részecskék aggregálódásához vezethet, mert nem elég stabil.
Bogyóméret változatossága → időbeli stabilitás ettől függ (ha pl. tejből víz lediszpergálva (bogyók egy mérettartományban) → néhány napig úgy marad, aztán elegyedik szét)
Mi az összefüggés a részecskeméret és a felület között?
Minél kisebb a részecskeméret, annál nagyobb a felület (babák felülete > miénk), annál nagyobb a diszperzió foka
Mi az összefüggés a részecskét felépítő atomszám és a felszínen lévő atomszám között?
Minél kevesebb részecske építi fel a molekulát, annál több atom tartózkodik a felszínen és annál kevesebb vcan a molekula belsejében (fordítva is igaz: több atom összesen → felületen kevesebb hányada) → végtelen nagy fázisnál nem kell felületttel számolni
A kolloid diszperziók, makromolekuláris oldatok és a surfactant oldatok milyen stabilitási tulajdonságokkal rendelkeznek?
kolloid diszperziók: liofóbok (oldószerutálók) → termodinamikailag NEM STABILAK, kinetikailag lehetnek STABILAK
makromolekuláris oldatok: liofilek (oldószerszeretők)
surfactant oldatok: liofilek → termodinamikailag és kinetikailag STABILAK
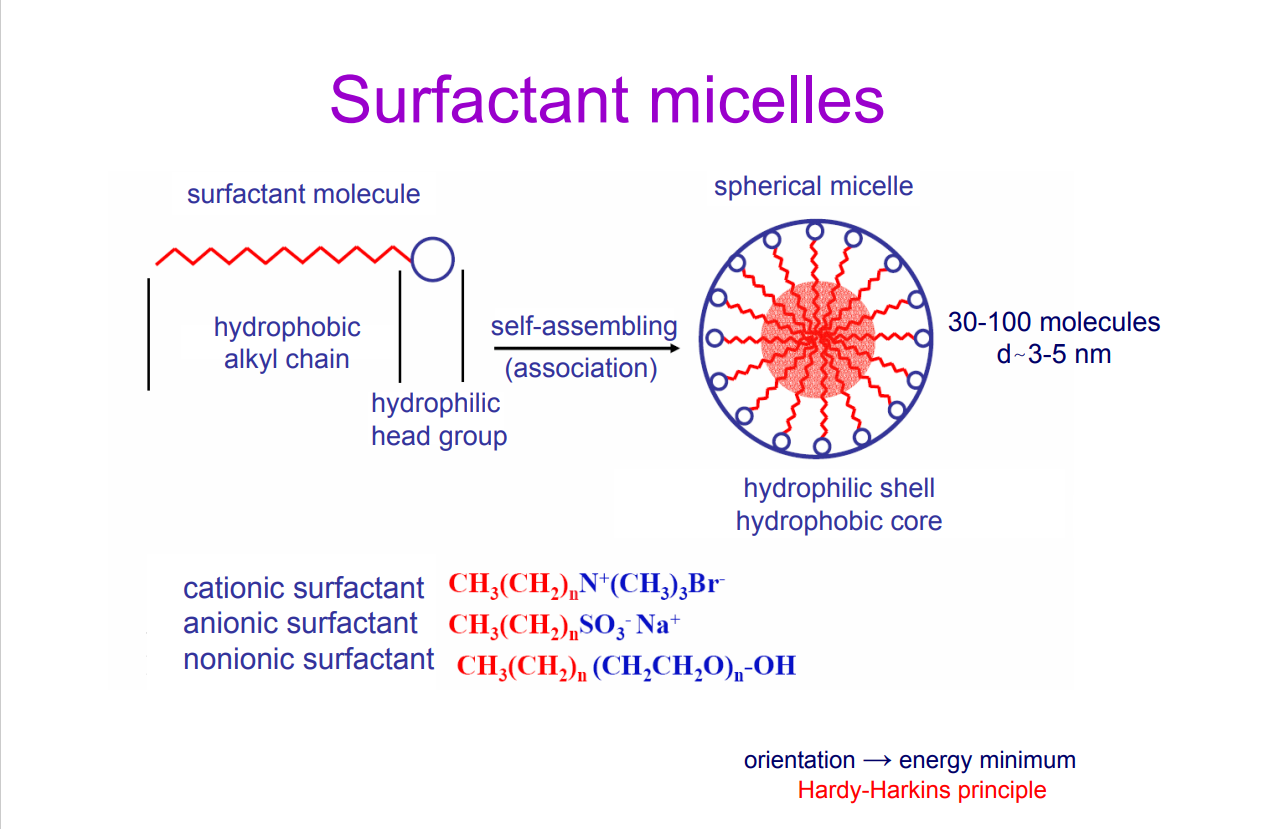
Hogyan épülnek fel a surfactantmicellák és hogyan lehet őket csoportosítani?
surfactantmolekula: hidrofób farok (benne SZH-lánc) & hidrofil fej (benne töltéssel rendelkező funkcióscsopi) →összeállás→ szférikus micella: hidrofil burok, hidrofób mag
KATIONSURFACTANT: CH3(CH2)nN+(CH3)3Br-
ANIONSURFACTANT: CH3(CH2)nSO3-Na+
NEMIONOS S.: CH3(CH2)n(CH2CH2O)n-OH

Milyen alakot vehet fel egy aggregálódó surfactant vagy micella?
szférikus, cilinder, lamelláris, inverz, bikontinus, vezikulum(, ellipszoid, planáris)
→ specifikus interakciók/kovalens kötések vezethetnek olyan micellákhoz, amit nem változtatnak alakot/méretet
kis tömegű s.: ΔH → micellak. entalpiára kedvezőtlen, entrópiára pozitív → osz. sajátosságai teszik lehetővé a micellizációt: magas felületi fesz., n. magas kohéziós E, magas dioelektromos állandó, magas fp.
Miből áll egy plazmamembrán?
lipid kettősréteg & asszociált fehérjék és glikolipidek & koleszterin
Mi a különség a HDL és az LDL között?
HDL (high-density lipoprotein): 8-11 nm biomolekulaaggregáció, benne koleszterin, foszfolipid, apolipoprotein A (jó koleszterin)
LDL (low-density lipoprotein): 18-25 nm (rossz koleszterin)
Mi a gél fogalma?
szilárd/félszilárd rendszer, amely legalább 2 komponensből tevődik össze, sűrített tömegből áll és folyadékkal van átitatva; egy olyan hálózat, amelynek nincsenek szilárd határai, nem szedimentálódik, erős van der Waals kötésekkel közük
Xerogélek pórusméreteit hogyan lehet csoportosítani?
micropórusos: 2 nm alatt
mezopórusos: 2 - 50 nm
makropórusos: 50 nm felett
Hogyan alakul a liogélek részecskemérete a hőmérséklet emelésével?
T emelésére zsugorodnak (de pH-tól is függenek)
Hogyan lehet a diszperz rendszereket méret szerint osztályozni?
valódi oldatok: molekuláris diszperziók → ionok, molekulák gázban, folyadékban; 1 nm alatt, könnyű diffúzió, papírfilteren átmegy, nem szeparálható, nem szórja a fényt
finom diszperziók: kolloid diszperziók → szolok (liofób kolloidoldatok); füst, filmek és habok; 1 - 1000 nm közt, lassú diffúzió, ultrafiltrációval/szemipermeábilis membránnal elválasztható, szórja a fényt (Tyndall-effektus)
durva diszperziók: a legtöbb gyógyszerészeti szuszpenzió és emulzió, por, sejtek, homok; 1 mikrométer felett (nagy részecskék), nem diffundál, filtrációval elválasztható, kevergetni kell, hogy szuszpendált maradjon
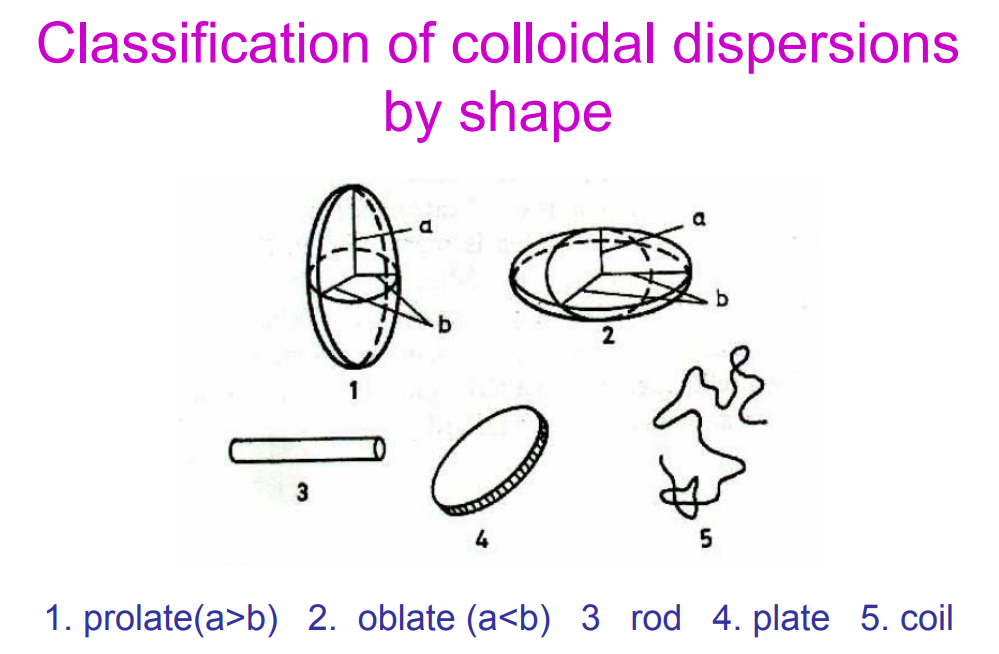
Osztályozd a kolloid diszerperziókat alak alapján!
prolát: y-tengely hosszabb az x-nél (szerintem hajaz egy tojásra, bácsi szerint rugby-labda)
oblát: x tengely hosszabb az y-nál = diszkosz alakú
rúd/bot (rod)
tányér (plate)
orsó/feltekeredett (coil)
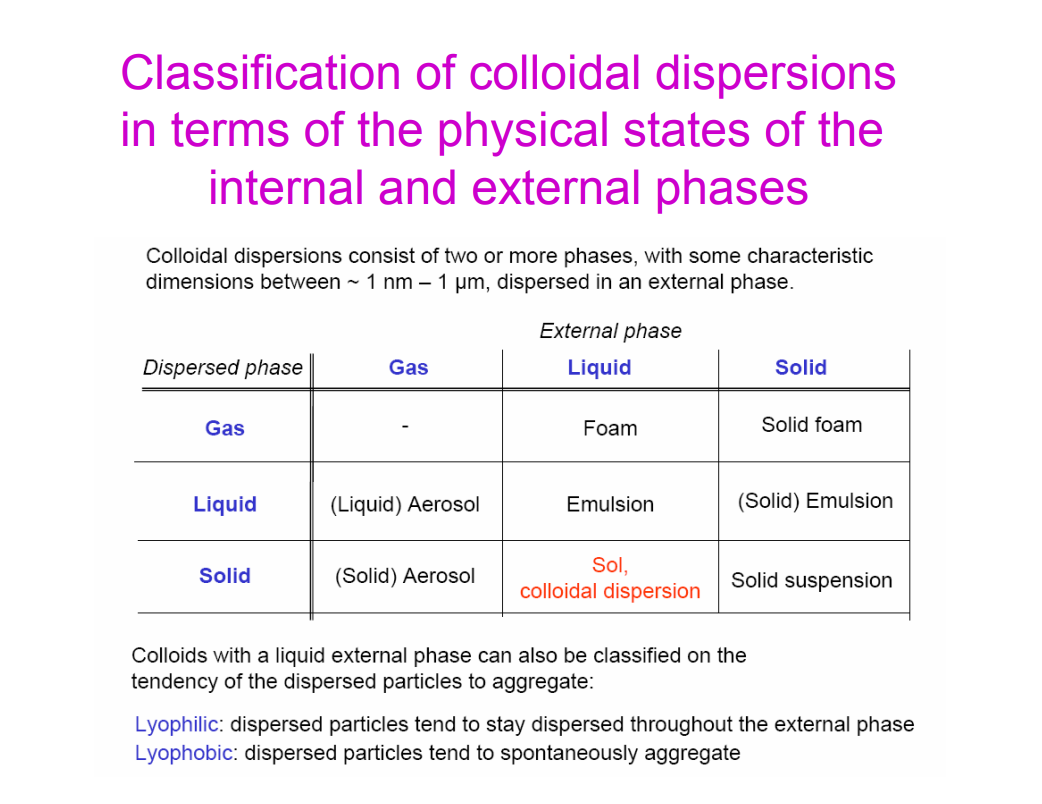
Osztályozd a kolloid diszperziókat a külső és belső fázisok alapján!
első betű: diszergált fázis (belül), 2. betű: diszpergáló fázis (kívül)
G/G (gáz a gázban): NEM LÉTEZIK!
L/G = folyékony aeroszolok: köd, spray, pára
S/G = szilárd aeroszolok: füst, laza korompor (jelentsen akármit is)
G/L = habok: szénsavas víz, sörhab, tejszínhab, hab
L/L = (mikro)emulziók: majonéz, nyers olaj, tej (O/W), vaj (W/O)
S/L = szolok (szintézis), kolloid diszperziók, szuszpenziók (természetes): festék, tinta, fogkrém
G/S = szilárd habok (aerogélek, xerogélek)(zárt cellás: igazi fal; nyitott: köztük lyukak): hungarocell, poliuretán, polisztirénhab, szilikagél
L/S = szilárd emulziók: opál, gyöngy
S/S = szilárd szuszpenziók: grafitszemcsék vasban, színes műanyagok
Írd le a Brown-mozgást!
A kolloidrészecskék az oldószerben szabálytalanul mozognak, miközben ütköznek egymással
Mi a Tyndall-effektus lényege?
A fényt a diszperz fázisú kolloid abszorbeálhatja, szórhatja, polarizálhatja, törheti és visszaverheti
Egy folyadékra milyen erők hatnak?
felszíni molekulák: adhezív → asszimmetrikus erők
folyadék belsejében lévők: kohezív → szimmetrikus erők
egyenlőtlenség miatt a felületi molekulákat a folyadék belsejében lévők belfelé húzzák → felszínkontrakció (felületi feszültség) → legkisebb felület/egységnyi térfogat: csepp →→ energia hatására nagyobbodás, molekula közepéről a felszínre: FELÜLETI SZABADENERGIA
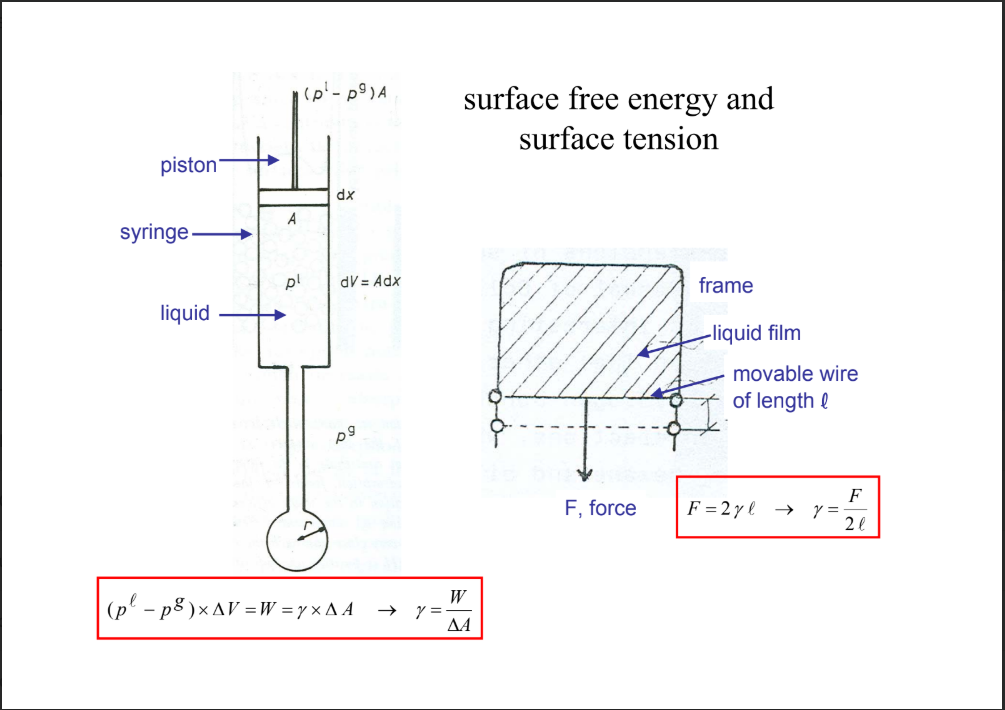
Írd le a felületi szabadenergia jelét, mértékegységét, kiszámolási képletét és definícióját!
jele: gamma/γ
mértékegység: mJ / m2
kiszámolási képlet: γ = W / ΔA
definíció: az a munka, amely ahhoz szükséges, hogy egységnyi területtel megnöveljük egy folyadék felületét / hogy egy végtelen nagy felületet 1 m2-rel megnöveljünk / megmutatja, mennyi munkát kell befektetni 1 csepp kipréseléséhez
minél nagyobb a vonzóerő, annál nagyobb ez is
Gibbs- és Langmuir-monoréteg alapján: ha ez csökken, akkor a felületek közti nyomás is csökken

Írd le a felületi feszültség jelét, mértékegységét, kiszámolási képletét és definícióját!
jele: gamma/γ
mértékegység: mN / m
kiszámolási képlet: γ = W / ΔA = mJ / m2 = mN * m / m2 = mN / m
definíció: egy erő, amely a folyadék felületén hat megfelelő szögekben
számszerűleg egyenlő és dimenzióban egyenértékű a felületi szabadenergiával
ez is csökken, ha a folyadék polaritása csökken
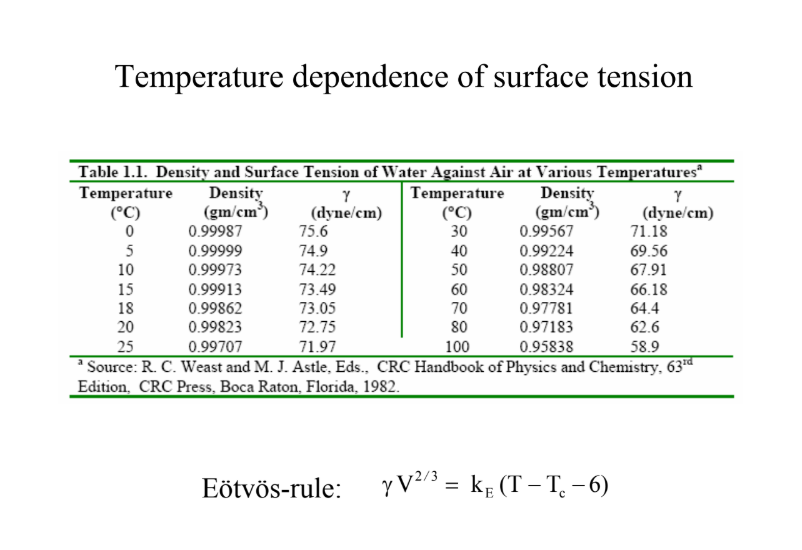
Írd le a felületi feszültség hőmérsékletfüggését!
Eötvös-szabály: azért kell bele a 4-6, mert a Tc (kritikus hőmérséklet) alatt ennyivel már nem lehet folyadék halmazállapotról beszélni
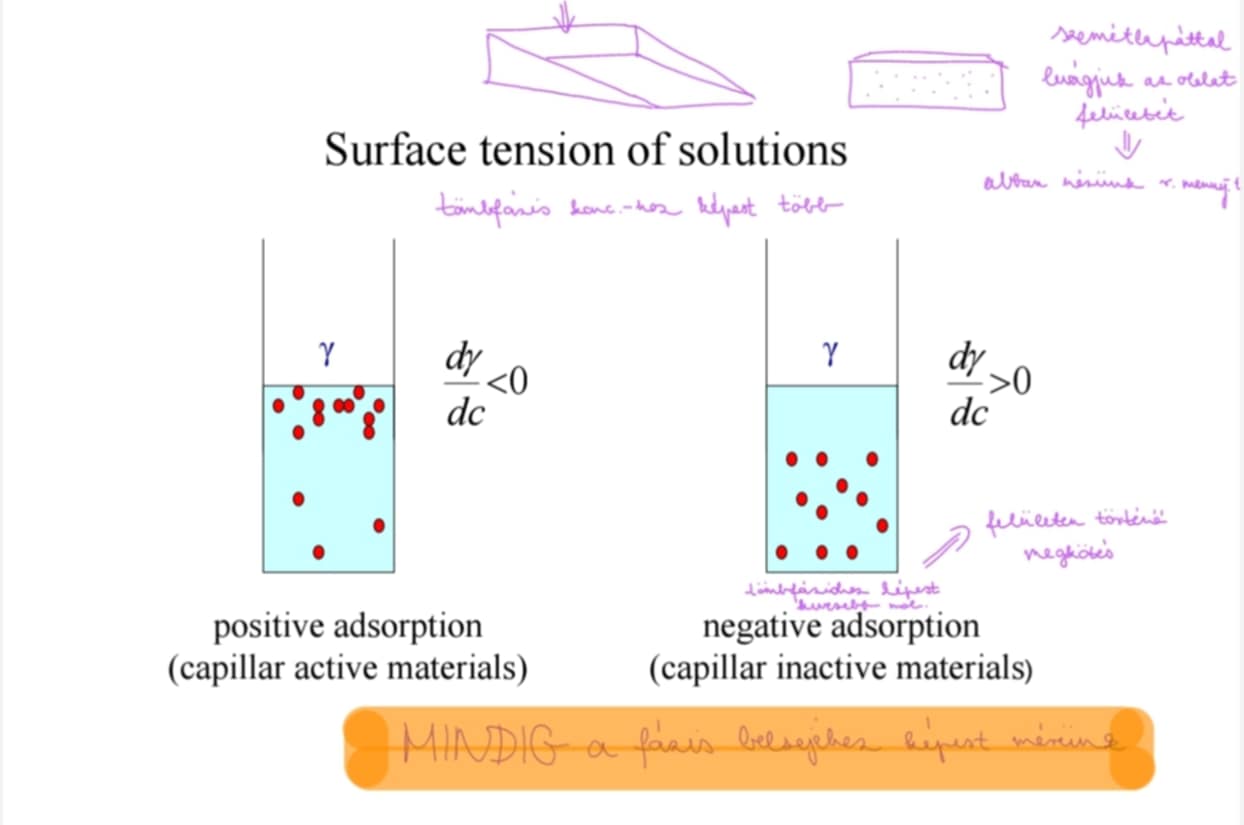
Sorolj fel felületi feszültség mérésére alkalmas módszereket!
kapillárisemelkedési módszer (capillary rise method): γ ≈ ½ r * rhó * g * h → gőznyomás görbült felületek felett
sztalagmometria: γ ≈ nref / n γref -γ → Traube: lefelé, gravitáció hajtja, relatív számolás (cseppek hozzájárulnak); Donnan: felfelé, végek meghajlítva, nyomáskülönbség hajtja; drop volume (kamerával mérve); drop weight (elektronikus mérleggel); du Noüy-gyűrű és Wilhelmy-plate és drop shape(pendant drop, pendant bubble, sessile drop image); spinning drop method (γ = Δ rhó ω2 R3 / 4 (határfelületi feszültség))
Írd fel a Gibbs-adszorpciós izotermát!

Írd fel a Traube-törvényt!
Bármely homológ sorozatba tartozó vegyületek híg vizes oldataiban a víz felületi feszültségének egyenlő mértékű csökkenéséhez szükséges moláris koncentráció háromszorosára csökken az oldott anyag szénhidrogénláncában minden további CH2-csoport esetén.
vizes oldatok szénen: minél rövidebb a szénlánc, annál jobban oldódik
inverz Traube-t.: toluololdatok szilikagélen: minél hosszabb a szénlánc, annál jobban oldódik
→ Lundelius-szabály: minél kevésbé oldható, annál jobban adszorbeálódik
Hogyan lehet csoportosítani az aeroszol gyógyszereket?
szárazpor inhalálók: páciens-vezérelt, erőtársított szállítás
nebulizátorok: pneumatikus, ultrahangos
adagolt dózisú inhalátorok: standard inhalátorok (propellánsok), helycsinálók és légzésaktiváló inhalátorok
Honnan tudja a zsírcsepp, hogy hol a tányér széle?
ha monomolekuláris rétegről beszélünk: teljesen szétterül (fí1 = fí2 =0); ehhez S 0 vagy nagyobb kell legyen (adhézió > kohézió (olaj-olaj: összeolvad))
szétterülési együttható: S = γ(w) - γ(o) - γ(ow) = W(A) - W(K) → PÉLDA: benzolcsepp a vízre: 1. benzol nem oldódik → később a szétterülő csepp kiszivárgása a víz/levegő határfelületre → olaj visszahúzódik a lencsébe
ha nem terül szét, csepp alakot vesz fel (belapul), gravitáció nem befolyásolja a csepp alakját
adhézió: olaj-víz határfelülete: γ(ow); energiája:
ΔG(A) = γ(ow) - γ(o) - γ(w) = -W(A)
Neumann-szabály alapján fog elhelyezkedni:
γ(w) = γ(o) * cos(fí1) + γ(ow) * cos(fí2) → ha a 3 vektort egybe toljuk össze
ha S 0-nál kisebb, akkor lesz ez
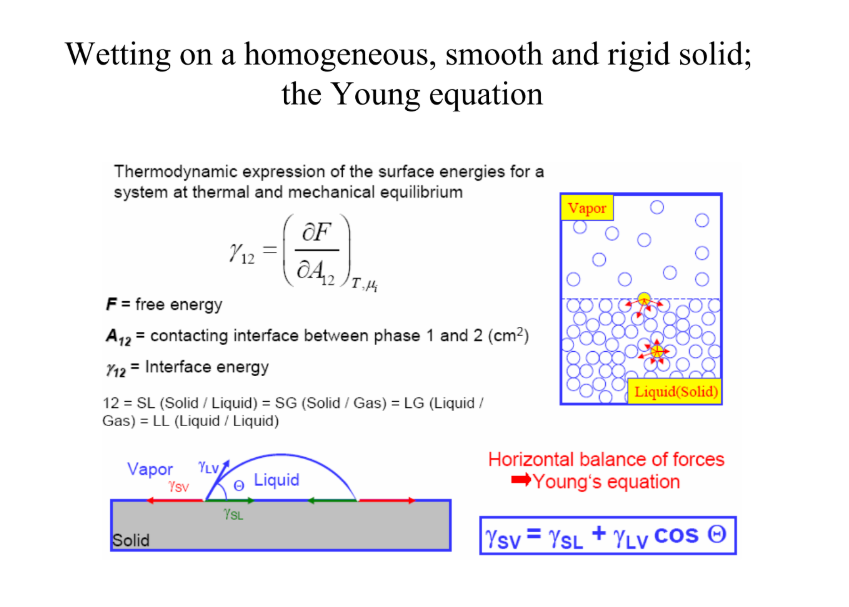
Melyik egyenlet írja le a folyadékok szilárd felületen való viselkedését? (le is kell vezetni)
Young-egyenlet: γ(SV) = γ(SL) + γ(LV) * cos(fí) → sima
felületi energia TD-i kifejeződése:
(γ12) = (parc. der. F / par. der. A(12))T, mű(i)
γ12: felületközti E; A12: 1-es és 2-es fázis közti kontakt, F: szabadenergia
ADHÉZIÓ (sz és l közt) ÉS KOHÉZIÓ (l és l) ESETÉN: Young-Dupré egyenlet: W(A) = γ(LV) (1 + cos(fí))
S = W(A) - W(C) = γ(SV) - γ(LV) - γ(SL) =
= γ(LV) (cos(fí) - 1) → feltétel a teljes szétterüléshez: S 0 vagy nagyobb
Milyen szöget zárnak be a kapillárissal az anyagok nedvesítő és nem nedvesítő esetben?
fí (kontaktszög) kisebb, mint 90 fok: VÍZ NEDVESÍTI a kapillárist: piramisszerűen felmászik oldalt pl.: üveg;
a kapillárisban felmászik a víz
fí nagyobb, mint 90 fok: VÍZ NEM NEDVESÍTI: lyukszerűen ,,beszívja’’ a folyadékot a paraffin
a kapillárisban lesüllyed a higanyszint
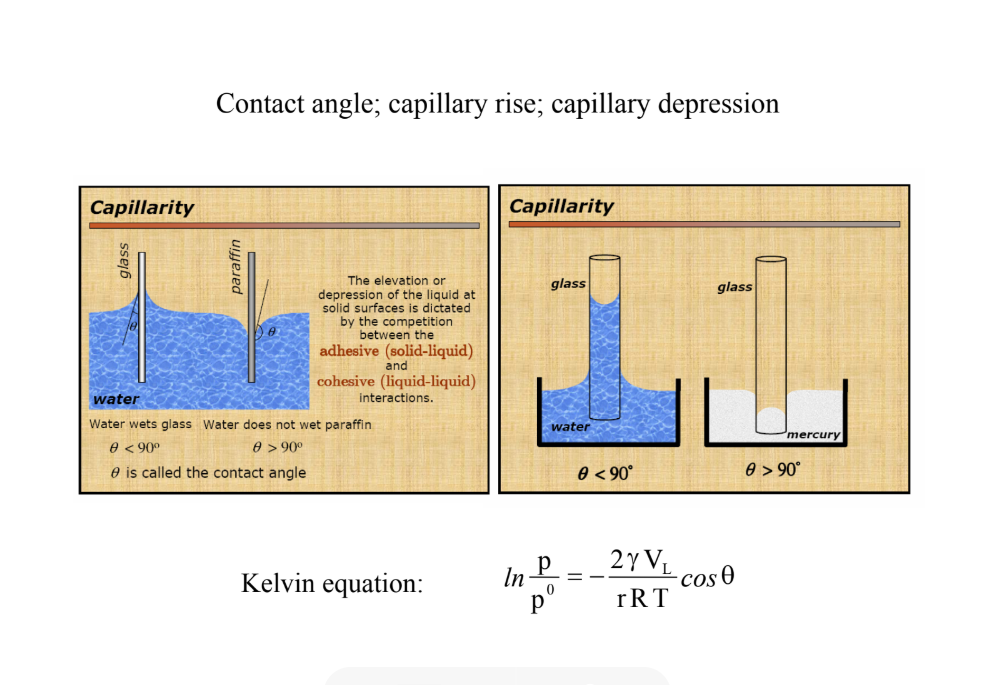
Hogyan lehet zsíros koszt eltávolítani egy szilárd felületről?
detergenciával: roll-up, emulzifikáció, szolubilizáció
→ a detergens úgy hat, hogy megváltoztatja a kontaktszöget
néhány surfactant habot képez: stabil levegő-víz interfázis, de ez nem feltétlenül jelenti, hogy jó detergensek: nem a szil-foly vagy foly-szil interfázisra hat
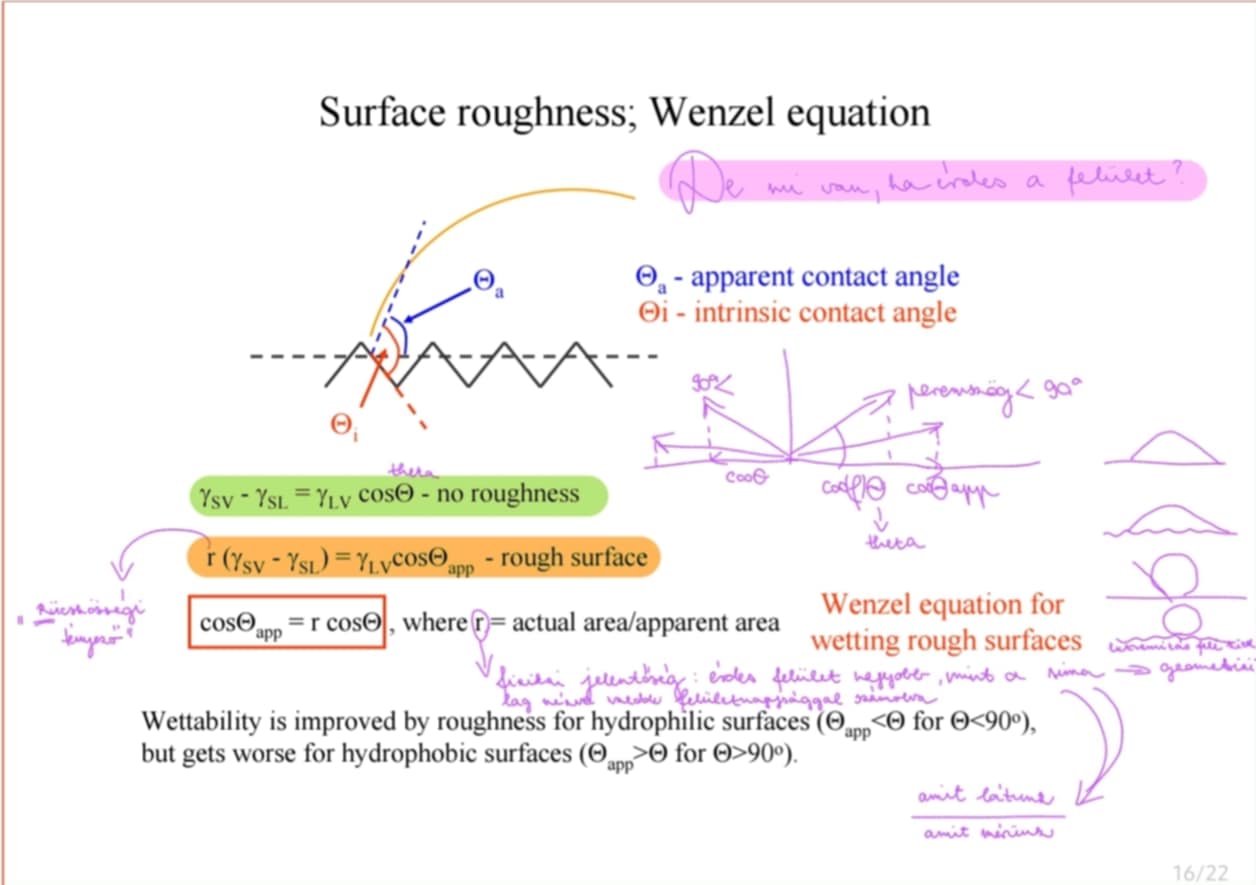
Miért és hogy lehet előállítani öntisztuló felületeket?
Alapja: érdes felület → Wenzel-egyenlet:
r (γ(SV) - γ(SL)) = γ(LV) * cos(fí)(app)
szuperhidrofób felület: fí > 150 fok (fakir drop); a kohézió lényegesen nagyobb az adhéziónál
LÓTUSZEFFEKTUS: különböző mikrostruktúrák által okozott felületi érdességen és az epikutikuláris viasz hidrofób tulajdonságain alapul
hasznuk: öntisztító felületek gyártása (hidrofób felületen átszaladva a vízcsepp felveszi a koszt)
Mi az adszorpció definíciója?
molekulák kötődése folyékony fázisból a szilárd anyag felületéhez → ellentéte: deszorpció = kötött molekulák eltávolítása
MNDIG HŐFELSZABADULÁSSAL JÁR
adszorbát: megkötött anyag, adszorptív: megkötendő anyag
Milyen típusai vannak az adszorpciónak?
fiziszorpció: másodlagos kémai kötőerők vannak, dinamikus egyensúly, spontán
kemiszorpció: másodlagos kötőerők nincsenek! → nagyon szelektív, csak bizonyos anyagokat köt meg, nem spontán
GÁZSZORPCIÓS KÜLÖNBSÉGEK:
F: van der Waals
ΔH(ads): 40-nél kevesebb kJ/mol; ritkás aktivációs energia; teljesen reverzibilis; multirétegek, alacsony adszorpciós hő
K: kémiai kötés
ΔH(ads): 50-200 kJ/mol;60-100 kJ/mol E(a); kicsit vagy nem reverzibilis; egy réteg, magas adszorpciós hő

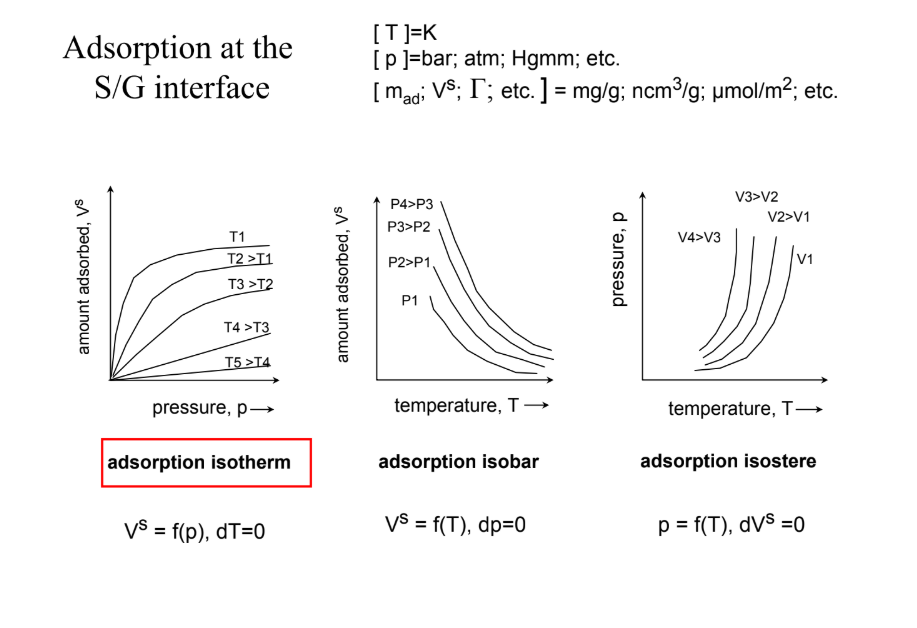
Vezess le egy adszorpciós izotermát!
fontos: adszorbeált gázminőség, fiz/kém, adszorpciós E, kémiai kötéstípus
adszorpció izotermája megadja az adszorbeált gáz mennyiségét a nyomásának függvényében rögzített hőmérsékleten (x: p (gáznyomás); y: I (adszorbeált gáz mennyisége)
IUPAC alapján 6féle izoterma különíthető el (screen) → az egyik altípusa: Langmuir! & Giles szerint 20féle (híg)
meghatározás: koncentrációanalízissel: UV-spektroszkópia, differenciálinterferometria, tömegspekt.
képlet: (ns: tényleg elnyelt anyag, szigmás: V-csökkentett felületi többlet)
ns = nszigma(v) = V0 / m (c0 - c)
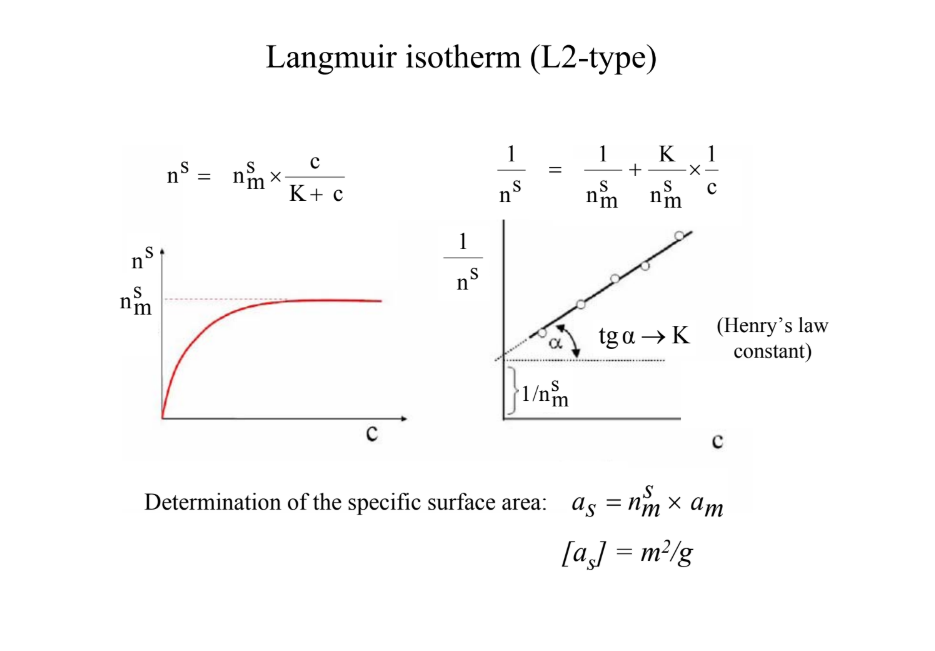
Vezesd le a Langmuir-izotermát!
első típusa az adszorpciós izotermáknak (IUPAC), 2. típus (SLHC): oldószer a felülethez erősen köt, kompetitív osz.-oa. verseny → n(s): mg/g → egységnyi szil.-on megkötött anyag; Langmuir hülye jele: mikromol/m2; c → mg/dm3, mmol/dm3
feltételei: homogén felület; egyrétegű adszorpció, adszorbeált molekulák közt ne legyen interakció
OLDALT LÉVŐ LEVEZETÉS!

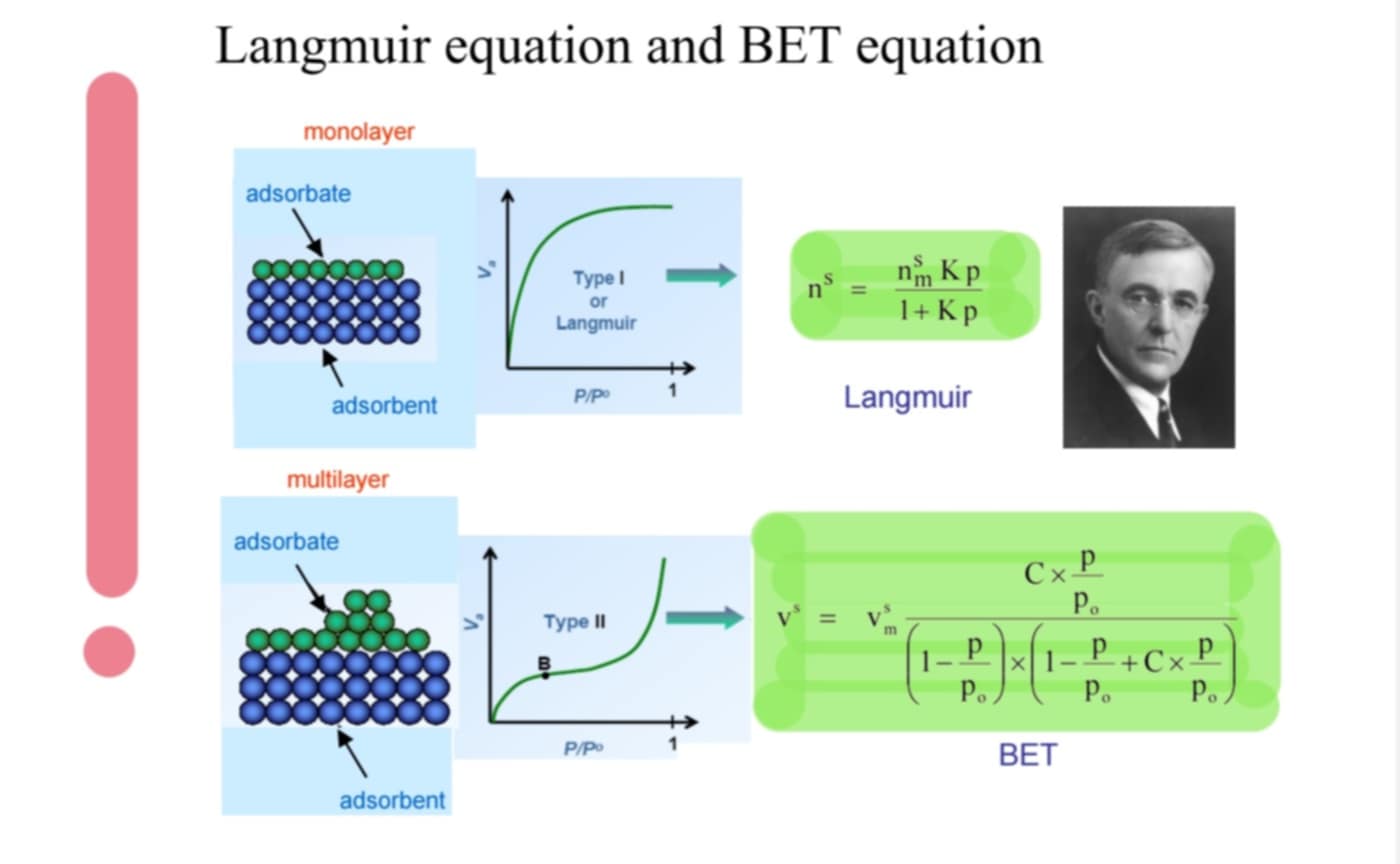
Mit tudsz a BET-módszerről?
Langmuir módosítása: többrétegnél is használható
BET-egyenlet nem működik az egész izotermára: más mechanizmusok alacsony és magas nyomáson
speciális felületnél az egyenletek és a grafikon is módosul: Langmuir → 1/n(s) = 1/nm(s) + 1/(K nm(s))* 1/p
BET-modell: 0,05 < p/p(0) < 0,3
a(s) = n(m) *A *N(A)
a(s): spec felület (m2/g); n(m): egyrétegkapacitás (mol/g); A: 1 mol. által elfoglalt terület (m2/molekula); N(A): Avogadro (mol./mol)
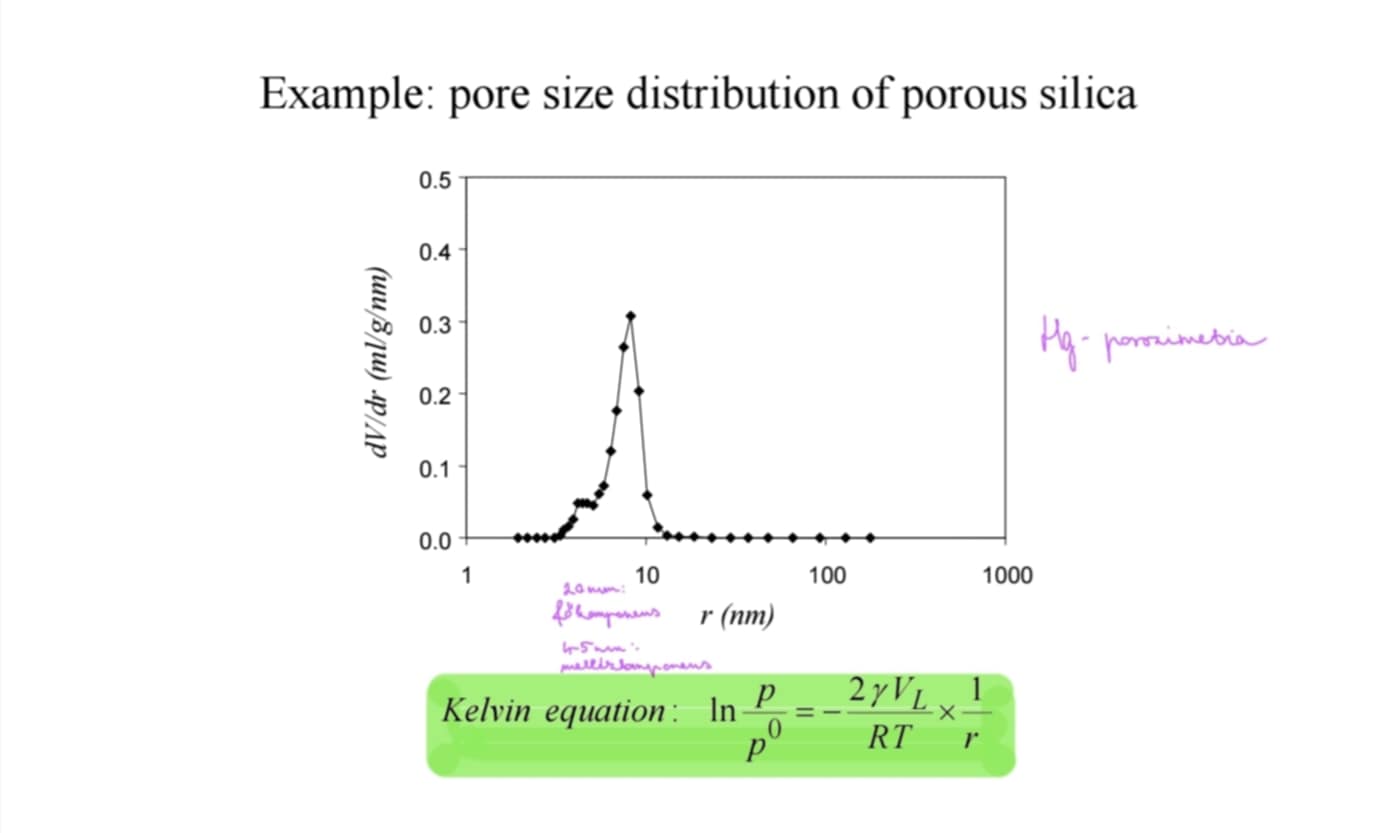
Milyen alakja lehet egy pórusnak és mivel mérhető?
Pórusméretmegoszlás milyen egyenlettel jellemezhető?
rés, cilinder, tintásüveg, ék
mérhető: Hg-porozimetria (mezo, makro), N2 kapilláriskondezáció (mikro, mezo, makro)
Kelvin-egyenlet: mert már aggasztóan sokszor ott volt :(
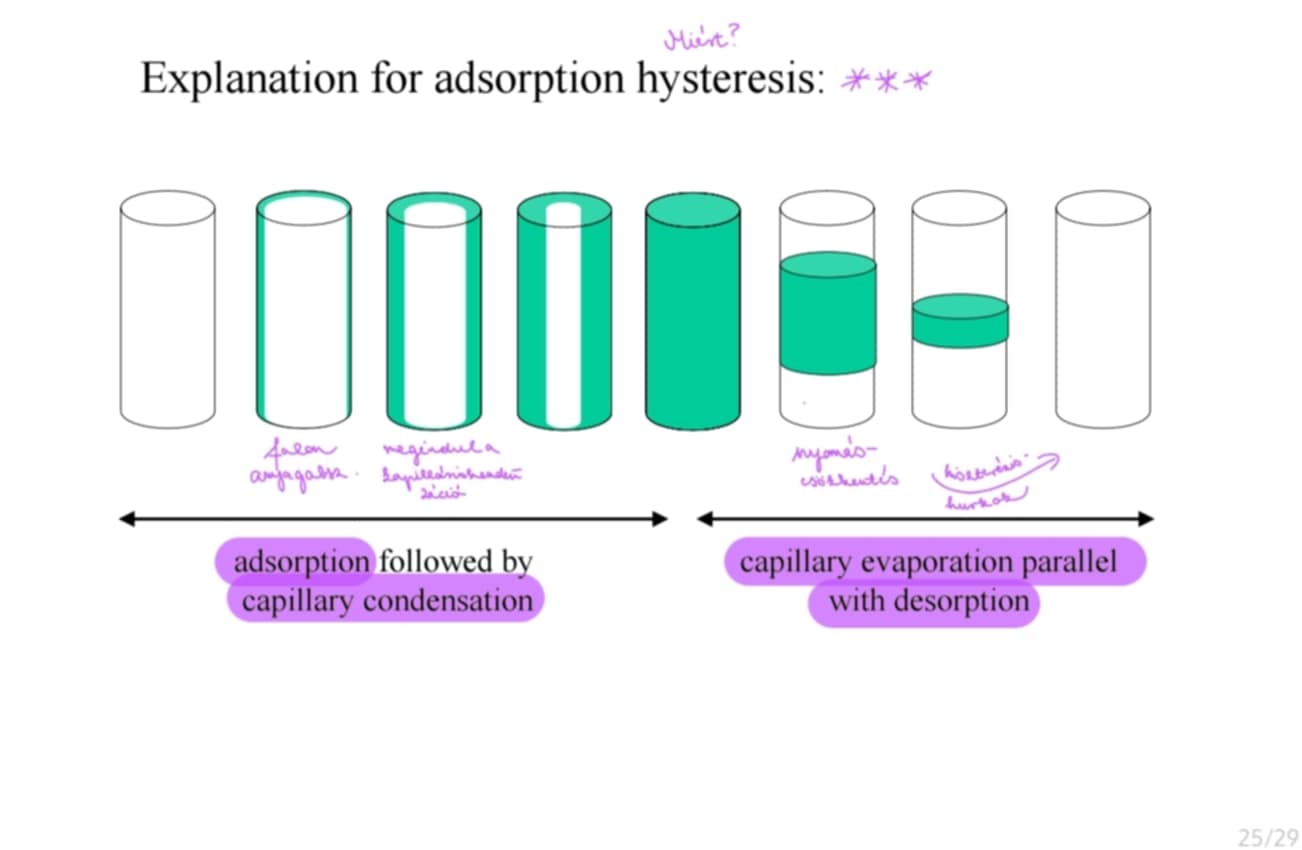
Hogyan magyarázható az adszorpciós hiszterézis?
az adszorpciót követheti kapilláriskondenzáció: hosszában nyeli el → falon anyagadszorpció
kapillárispárolgás párhuzamos a deszorpcióval: vízszintesen megy össze → nyomáscsökkentés: hiszterézishurkok
RAJZ
Milyen előnyei vannak a mosogatószernek és a folyékony szappannak?
mosogatószer: magas surfactantkoncentráció, viszonylag alacsony viszkozitás, kitűnő zsírleszedés
szappan: alacsony surfactantkoncentráció, magsabb viszkozitás, gyengéd a bőrön
bennük: nátrium-lauril-szulfát
Hogy és miből készül a szappan?
triglicerid szaponifikációja:
állati zsír - triglicerid + 3 NaOH → víz & hő → glicerin + szappan
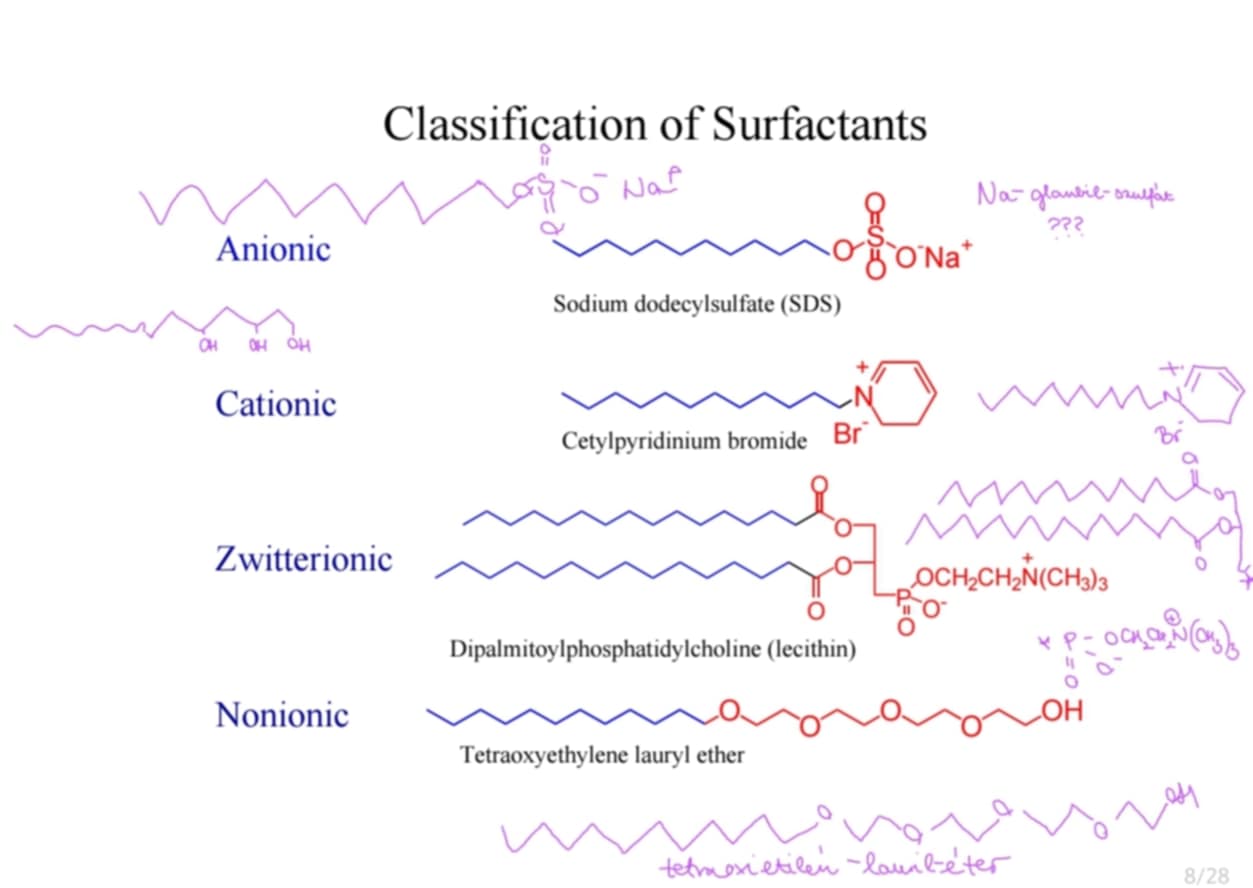
Csoportosítsd a surfactantokat! ***
ANIONOS: felületaktív rész negatív töltést tartalmaz → pl.: alkánkarbonsavsók: szappan, alkánszulfonsavsók: detergensek, alkil-aromás szulfonsók, foszfátok
KATIONOS: felületaktív rész pozitív töltést tartalmaz → pl.: aminsók, negyedrendű ammóniumsók
KETTŐS IONOS: mindkét töltés rajta → pl.: hosszúláncú aminosavsók, betainok (foszfolipidek)
NEMIONOS: felületaktív rész nem rendelkezik töltéssel → pl.: hosszúláncú éterek, zsírsavészterek, amidok
RAJZUK IS KELL!
(fázis alapján: középső fázis - hexagonális folyadékkristály, rendezett fázis - lamelláris fk.)
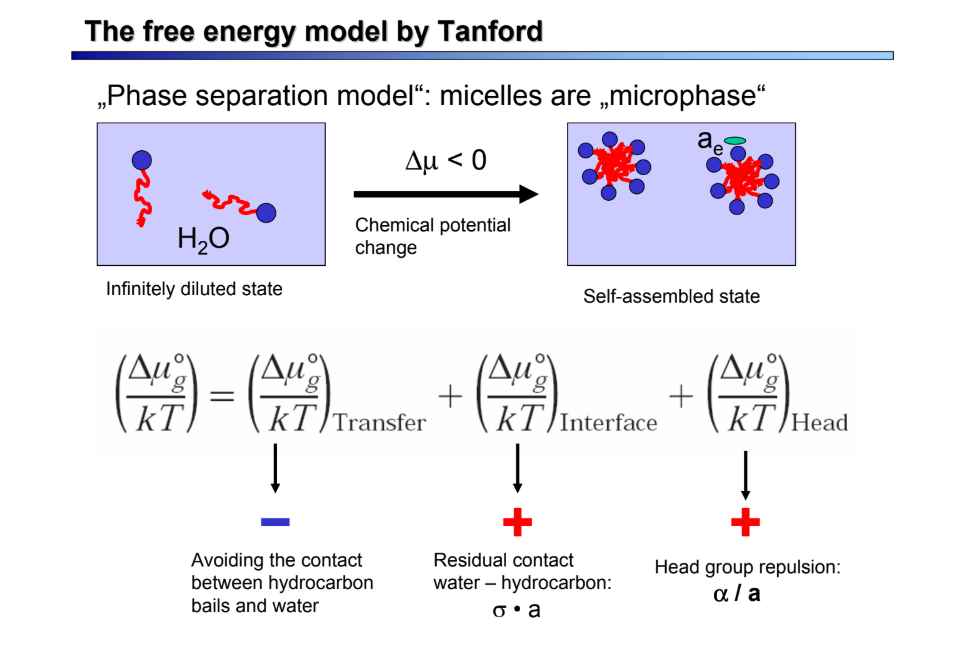
Mi a Packing-paraméter?
egy olyan paraméter, amely meghatározza a micella kialakuló szerkezetét, megmutatja előre a micella formáját (egyensúlyi érték változhat) → képlet: P = V / (a0 *Lc) → V: surf. faroktérfogat, a0: aggregáló interfázis egyensúlya/mol, L: farokhossz
pl.: szférikus micella g aggregációs számmal:
V(core) = g *V = 4πR3/3 A = g * a0 = 4πR2→R = 3 V/a0
R kisebb/egyenlő, mint L → 0 < V/(a * L) </= 1/3
</= 1/3: szférikus, </= 1/2: cilinder, </= 1: kettősréteg!
csak a fejcsopi (de az ő területe a hidrofób farokhossztól függ!) szabályozza az egyensúlyi aggregátumszerkezetet az a0 fejterületén keresztül: nagy fejcsopi = nagy a → szférikus; vissza is: lamelláris
farok NINCS hatással az aggregátum alakjára és méretére, de alakváltozás lehet, ha hossz hosszvált.
NEMIONOS S.: m, alfa, a0 kicsi → nagy P → 2xréteg/lamelláris; m nagy → kicsi P → cilinder
IONOS: sóadás alfa taszítását csökk. → ae csökk. → P nő → szférikus átalakul cilinderessé
EGY/2FARKÚ: P 2farkúnál 2x → 2xréteg szférikus/glob. helyett
OSZ. HATÁS: felületközti nyomás csökk. → a0 nő → P csökken → 2xr. micellává, rúd szférikussá
T-HATÁS: T nő → fejcsopi sztérikus taszítása csökken → alfa csökk., a0 csökk. → P nő
micellában nem egyenletes deformáció
Milyen jellemzői vannak egy peptidmicellának?
kicsi, vírusméretű részecskék (10-50 nm)
hasonló a lipidmolekulákhoz
peptidmagból (hidrofób rész) és PEG-héjból (hidrofil) állnak
peptidmag összetétele lehetővé teszi a peptid/fehérje szolubilizálását
kis molekulákhoz is jó
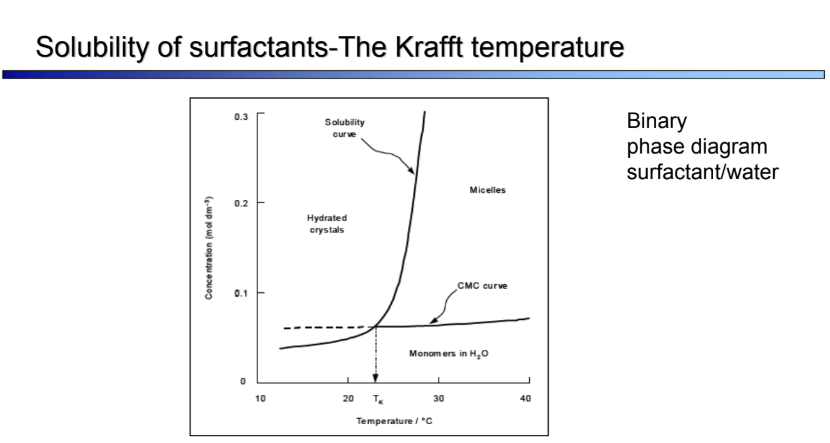
Mire használható a Kraft-pont, a felhősödési pont és a cmT?
Krafft-pont: = az a pont, ahol az oldhatósági görbe talizik a CMC görbével →→ Krafft-hőmérséklet meghatározása = egy ,,olvadáspont’’
= az a pont, amely alatt nincsenek micellák → IONOS SURFACTANTOKRA (erősen hőméréskletfüggőek)
felette az oldhatóság élesen növekszik a micellaképződésnek köszönhetően, alacsony T - ez is alacsony, szűk tartományban gyorsan emelkedik → egy bizonyos T felett nem lehet micella! (micellaképződés: S + (n-1) S → S2 + (n-2) S → Sn-1 + S → Sn aggregáció folyamatos → kooperatív jelenség: Kn = [micellák]/[monomerek]n = [Sn]/[S]n → CMC = (nKn)-1/n
felhősödési pont: néhány surfactant(polietilén-polietilén-oxid alapú) dehidratálódik és hőmérsékletemelésre a fázisok szétválnak
pluronics (polipropilén-oxid-polietilén-oxid (PPO-PEO) alapú felületaktív anyagok: micellák PEO szegmenseinek dihidratációja miatt alakulnak ki: kritikus micella hőméréklet = cmT
→ NEMIONOS SURFACTANTOKRA
![<p><strong>Krafft-pont:</strong> = az a pont, ahol az oldhatósági görbe talizik a CMC görbével →→ Krafft-hőmérséklet meghatározása = egy ,,olvadáspont’’</p><p>= az a pont, amely alatt nincsenek micellák → IONOS SURFACTANTOKRA (erősen hőméréskletfüggőek)</p><p>felette az oldhatóság élesen növekszik a micellaképződésnek köszönhetően, alacsony T - ez is alacsony, szűk tartományban gyorsan emelkedik → egy bizonyos T felett nem lehet micella! (micellaképződés: S + (n-1) S → S2 + (n-2) S → Sn-1 + S → Sn aggregáció folyamatos → kooperatív jelenség: Kn = [micellák]/[monomerek]<sup>n</sup> = [Sn]/[S]<sup>n </sup>→ CMC = (nKn)<sup>-1/n</sup></p><p><strong>felhősödési pont: </strong>néhány surfactant(polietilén-polietilén-oxid alapú) dehidratálódik és hőmérsékletemelésre a fázisok szétválnak</p><p>pluronics (polipropilén-oxid-polietilén-oxid (PPO-PEO) alapú felületaktív anyagok: micellák PEO szegmenseinek dihidratációja miatt alakulnak ki: <strong>kritikus micella hőméréklet = cmT</strong></p><p>→ NEMIONOS SURFACTANTOKRA</p>](https://knowt-user-attachments.s3.amazonaws.com/424f13a7-ecf4-4b75-9e54-4886ac08d134.png)
Milyen tényezők vannak hatással a cmc-re (= kritikus micellakoncentráció)/ surfactant molekuláris szerkezetére?
szénhidrogénlánc: ha HC-hossz nő → cmc csökken
ha HC-elágazik → cmc nő; ha HC telítetlen → cmc nő
hidrofil csopi: típusfüggő - ionos: ekvivalenciánál kis hatás; nemionos: alacsony cmc
szám nő → cmc nő; pozíció: középső > terminális
hozzáadott anyagok:
egyszerű elektrolitok: nemionos: nem hat rá, ionos: taszítás csökken → cmc csökken
alkoholok: cmc csökken → alkohol HC-lánchossza, SAA lánchossza, alkoholkoncentráció
szénhidrogének: oldhatóvá tétel → taszítás csökken → cmc csökken
hőmérséklet: nemionos SAA → micellaméret nő → cmc csökken
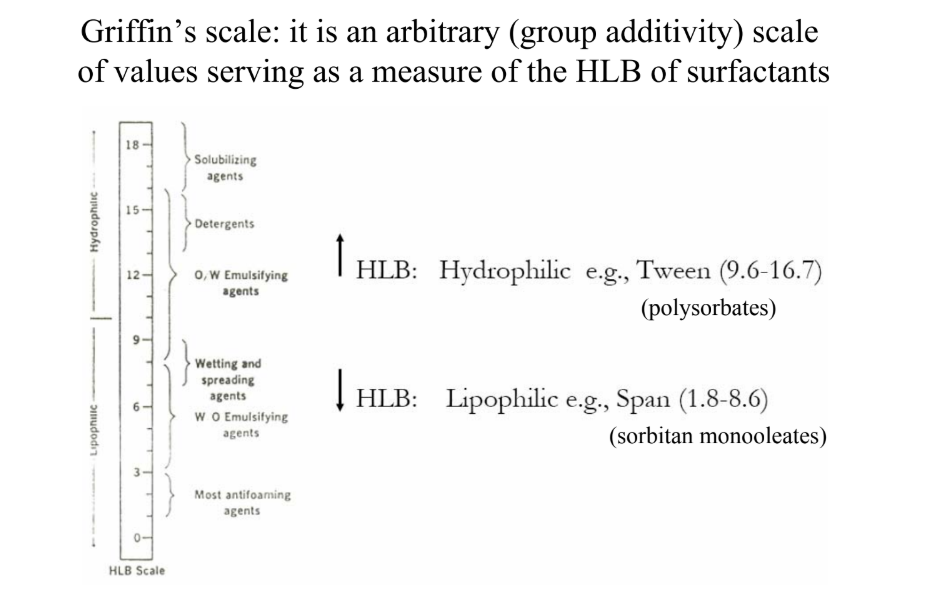
Mit jelez a HLB-érték?
HLB = hidrofil-lipofil egyensúly → amfifil surfactantokra
HLB 1-3: antihabok, inverz micellák
HLB 3-8: W/O emulzifikálók
HLB 7-9: nedvesítő- és elterítőszerek (kenőcs, krém)
HLB 8-16: O/W emulzifikálók
HLB 13-16: detergensek - mosószerek
HLB 15 felett: szolubilizálók
első 3 lipofil, utána hidrofil
a vízoldékonyság elvesztése nélküli felületaktivitás megfelelő és meglehetősen kényes egyensúlyt igényel a poláris csopi hidrofilitása és az amfifil molekula szénhidrogén részének hidrofóbsága közt
minél nagyobb ez az érték, annál jobban oldódik vízben
többértékű alkoholos zsírsavészterek HLB-jét gliceril-monoszterátként számítjuk: HLB = 20 (1- S/A)
S: észter elszappanosítási értéke, A: zsírsav savértéke
GRIFFIN-skála: csoporthozzáadás
surf. keverékekkel elérhető a kívánt emulzifikálóhatás
Mik a detergencia feltételei?
surfactantadszorpció energiája nagyobb legyen az új felület E-jánál
s. új sz/l interfázisa alacsonyabb legyen, mint az előző sz/olaj interfázis: kontaktszög nő
spontán olajadsz. a micellákba
Írj 2 példát adszorpcióra, amely sz/oldat interfázison történik! Milyen faktorok szabályozzák az adszorpciót?
egy enzim metabolikus aktivitását gátló gyógyszerek:
gyógyszer - adszorbeál, enzim - adszorbens
enzimeket és toxoidokat Al-oxid és Ca-foszfát gélek adszorbeálják
enzim - adszorbeál, gél - adszorbens
FAKTOROK: oldtkoncentráció, hőmérésklet, adszorbensfelület (nő → nő), szennyeződéseltávolítás, adszorbens-oldószer interakció és oldószerversengés, oldat-pH
GYÓGYSZERÉSZETI HASZNÁLAT: színtelenítőszerek, szárítószerek, adsz. kromatográfia, orvosi adszorbensek, hosszanható gyógyszerek → tisztítás, c híg oldatokból, adsz, szűrőpórusfalon, kolloid- és emulzióstabilitás
Miért süllyed el egy test a folyadékban és milyen erők hatnak rá ilyenkor? Hogy határozható meg a bemerülési munka? ***
Gurvics-szabály: minél nagyobb a szilárd anyag immerziós hője az oldószerben/minél nagyobb a folyadék affinintása a felületen, annál kevesebb anyag adszorbeálódik

Mit tudsz a polimeradszorpcióról sz/l interfázisban?
kis mol. adsz.-val (pl. surf., ionok) nagy különbségek: oka a polimerek sok konfigurációja folyadékokban és felületeken (loop-tail) → nagyobb entrópiaveszteség/molekula, mint kicsiknél → adsz. kár
ΔG0 csökkenés is nagyobb, mivel rengeteg a polimerben a kapcsolódás lánconként → adsz. öröm
általában lassabb az adsz, mint a kicsiknél
MEGHATÁROZÓ: adszorbeált pol. mennyiség (adsz. izotermán), polimerkonformáció a felületen → minél nagyobb a polimermolekualtömeg, annál jobban adszorbeálódik a felületen ugyanabból az osz.-ből
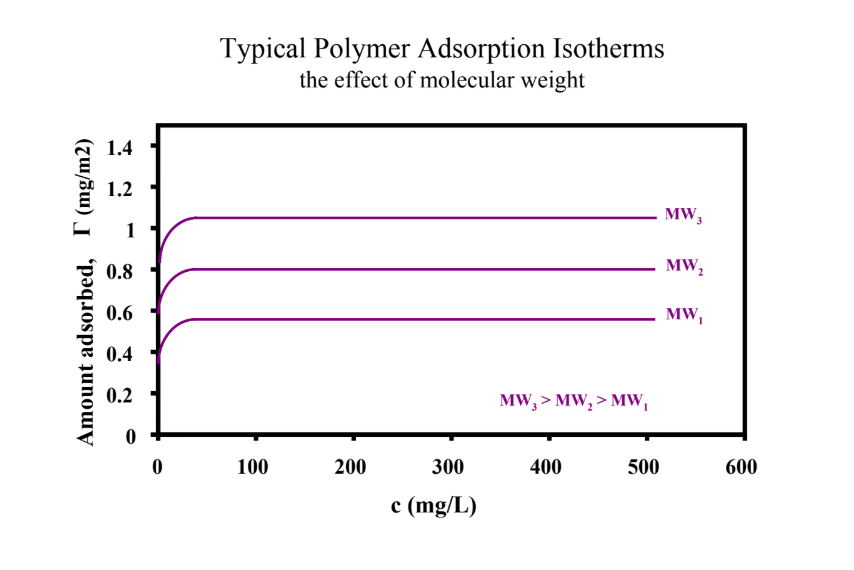

Milyen forrásai lehetnek a felületek közti/határfelületi töltéskülönbségnek szilárd/vizes oldat határán?
különböző ionoldhatóság: egyes ionos kristályok felületén lévő rácskationok/anionok számában enyhe egyensúlyhiány van → pl. AgI, BaSO4, CaF2, NaCl, KCl
felületi ionok helyettesítése: pl. rácshelyettesítés kaolinban → Al helyettesítésével negatív lesz
specifikus ionadszorpció: OH- és H+, többértékű ionok: Ca2+, Mg2+, La3+, SO42-, ionos felületaktív anyagok, polielektrolitok (nagyon szeretik, felülettöltést meghat.)
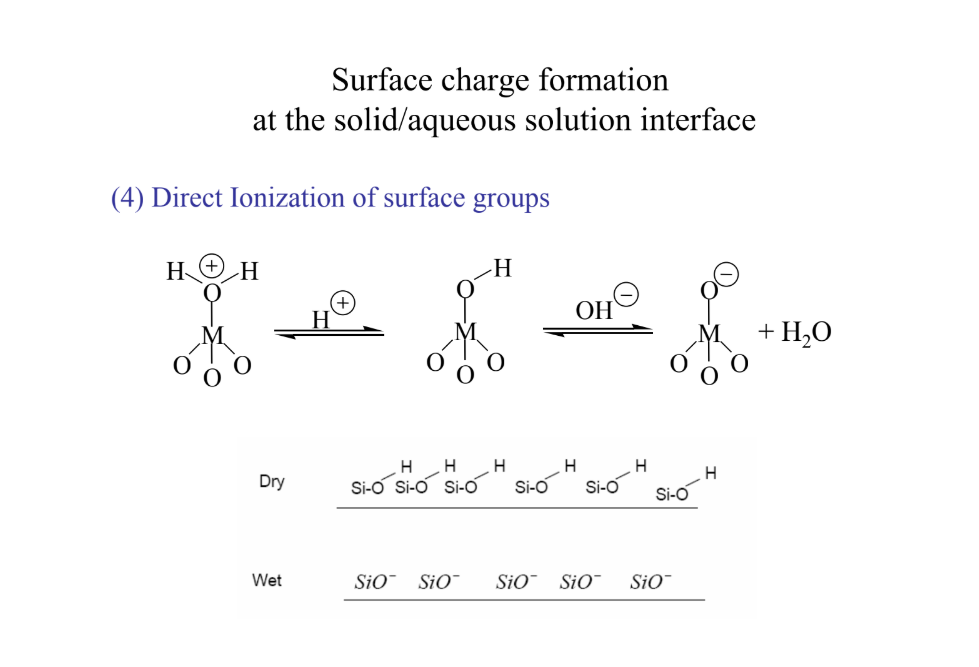
felületi csoportok közvetlen ionizálása: kép → vizesnél H-ek leszakadnak (pH-változtatás)
ioncsereadszorpció (nem egyenértékű ionadsz.): gyanták → az oldatfázisból kationok/anionok cseréjére használt szerves/szervetlen polimerek
szerves gyanták: polimergerinc nem vesz részt a kötésben → funk. cs.: anion/kation komplexképzésére szervetlenek: Al-szilikátok (pl. zeolit)- KATIONCSERÉLŐ
réteges kettős hidroxidok (LDH) - ANIONCSERÉLŐ
egységnyi anyagmenny.-re cserélhető ionkapacitás: CEC, AEC
szelektivitás: kation/anioncsere, csopin belüli is
csere azonos alapon történik, csereiontöltést semlegesíteni kell
erős ioncserélők: 2-12-es pH közt is ionizáltak maradnak, gyengék elveszíthetik
gyenge kationcs.: karboxilsav (-COO-Na+), erős: szulfonsav (-SO3-Na+), gyenge anioncs.: 1., 2. és 4. rendű aminok (-N+R3Cl-), erős: 4. r. amin (-N+R3-Cl-)
Mi történik a vízdeionizációja során?
kép (sóoldattal regenerálás)

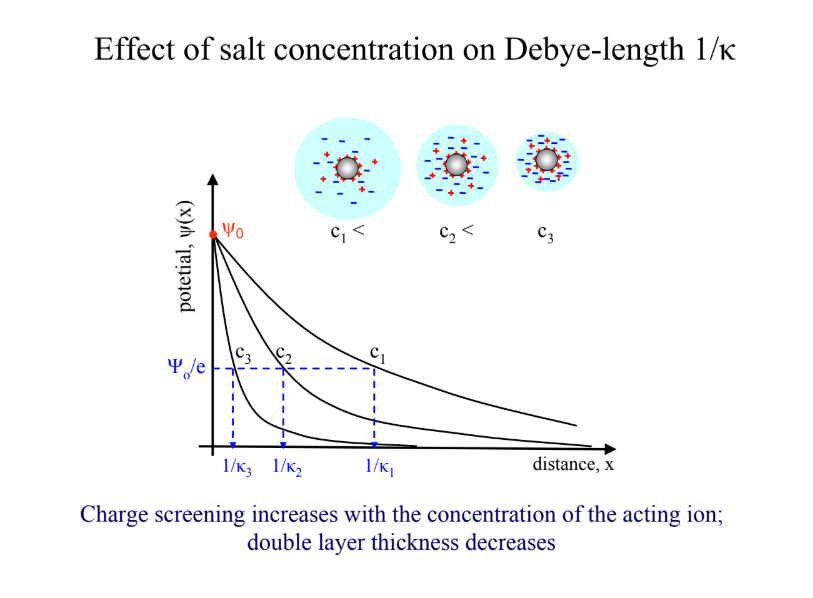
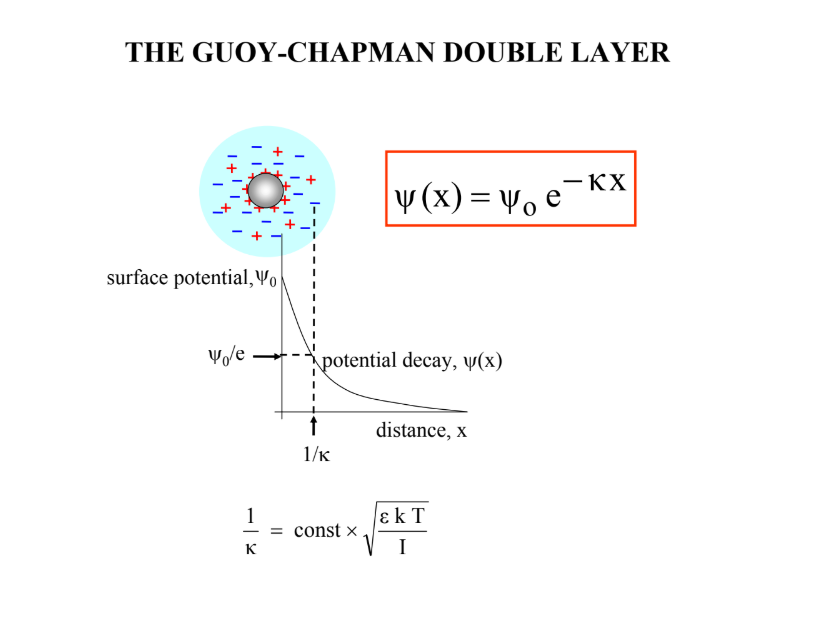
Mik a Guoy-Chapman kettősréteg feltételei? Milyen hatása van a sókoncentrációnak?
felületi töltés elkenődik
ionok = pontszerű töltések
nincs specifikus ionadszorpció
dielektromos állandó legyen állandó
anionok: magasról meredekebben, kationok: alulról tompábban → taliznak
a töltésszűrés a ható ion vegyértékszámával nő, kettősréteg vastagsága csökken (annál kompaktabb)
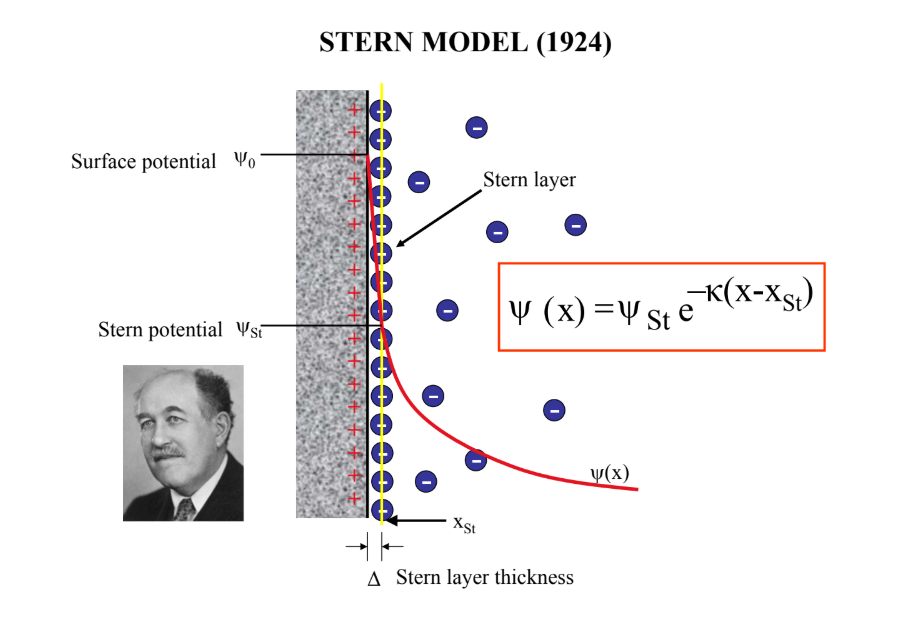
Mi a Stern-potenciál és mi az előnye a többihez képest?
nagyon egyszerűen leírható vele a felületi áttöltődés (pillantszerű!)
számít a felületen lévő kötőhelyszám
Stern-rétegvastagságban a koionok felületi potenciálja nő, ellenionoké csökken, aztán mindkettőnél éles váltás
hasadási sík: a rétegen belüli ionok a részecskével együtt mozognak (merev kapcsolat)
hidrodinamikus nyírás síkja = csúszási sík: a Stern-réteg határa → ami ezen túl van, nem mozog együtt a r.-vel
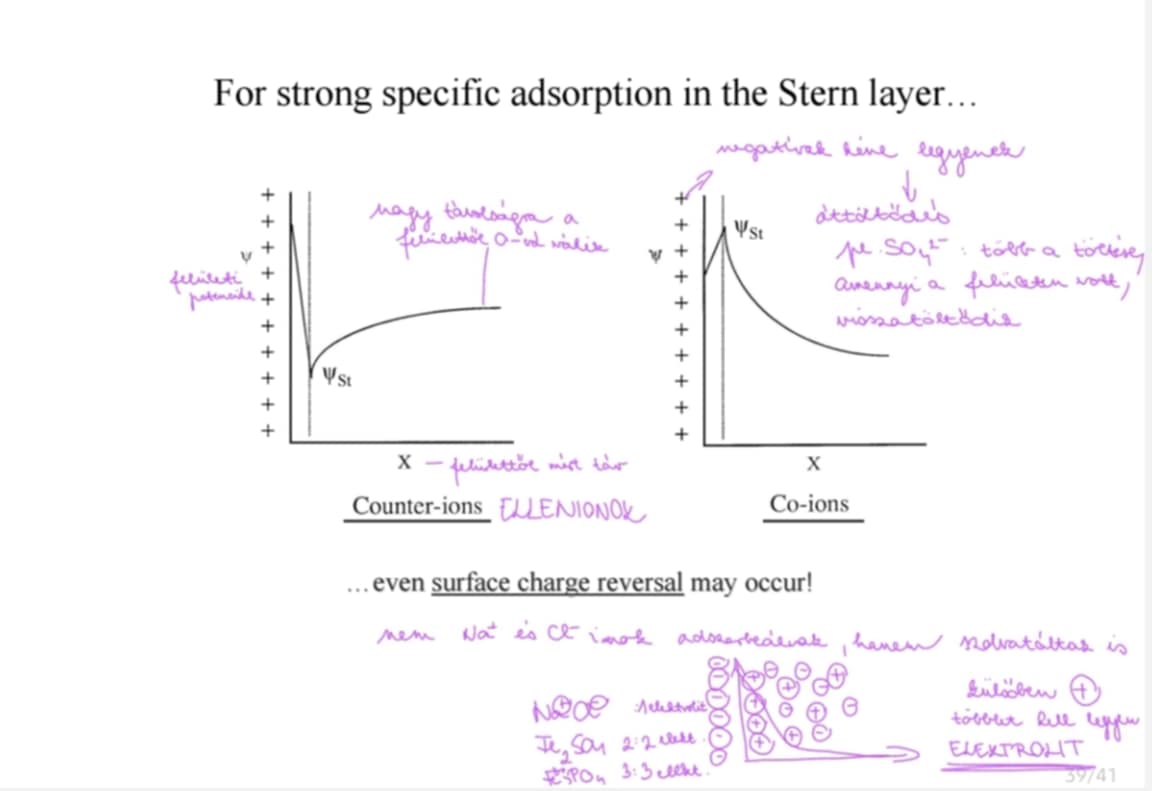
Mik az ionok kristályrácson történő adszorpciójának általános szabályai?
rosszul oldódó kristályos szil. anyagokon előnyösen olyan anionok és kationok adszorbeálódnak, amelyek azonosak/nagyon hasonlóak a kristályrácsalkotó ionhoz pl. szil. a. - AgCl & KCl/AgNO3/KBr/CuSO4 oldatával → sajátion felvételére hajtanak, ha nem fém a felület
savas oldatban H+, lúgosban OH- adszorbeálodik spec.
Schulze-Hardy-szabály: 3értékű ionok (Al3+, PO43-) erősebben adsz., mint a 2értékűek (Ba2+, SO42-), ők pedig jobbak az 1értékűeknél (Na+, Cl-)
több hidratált ion - kevésbé erős adsz., kevésbé hidratált - erősebben adsz. a szil. felületre → alkálifémionok: Li+ > Na+ > K+ > Rb+ > Cs+ HIDRATÁCIÓ ÍGY CSÖKKEN, ADSZORP. ÍGY NŐ → Li+ legjobban hidratálva, de legkevésbé adszorbeálva
vízzel érintkező felületek gyakrabban - töltésűek, mint a +-ak (kationok: jobban hidratáltak)
Honnan tudjuk biztosan, hogy a micellák valóban így néznek ki?
kis szöges fényszórással:
deuterált polisztirol + toluol → szőrös micellák
Mi az a CMC/c(k)?
= kritikus micellaképződési koncentráció:
ha c kicsi → surfactantok adszorpciója a levegő-víz határfelületen történik
ha c > CMC: micella képződik
képlet: ΔG0mic = μ0mic - μ0solv = RT * ln(CMC)
általában nemionos surfactantoknál alacsonyabb (10*-4 - 10*-3 M, több aggregálódik), mint ionosoknál (10*-3 - 10*-2 M, kevesebb aggregálódik)→ hirtelen változások a CMC-ben a micellaképződés miatt
ionosok: vezetőképesség ≈ mozgékonyság
értéke függ a poláris csopitól és a szénlánchossztól → minél nagyobb az apoláris lánc, annál kisebb CMC (mivel így a hidrofób rész nő) (karboxil: legmeredekebb, szulfonát: közepes, szulfát: leglaposabb)
log(CM) = a - b* log(c(só))
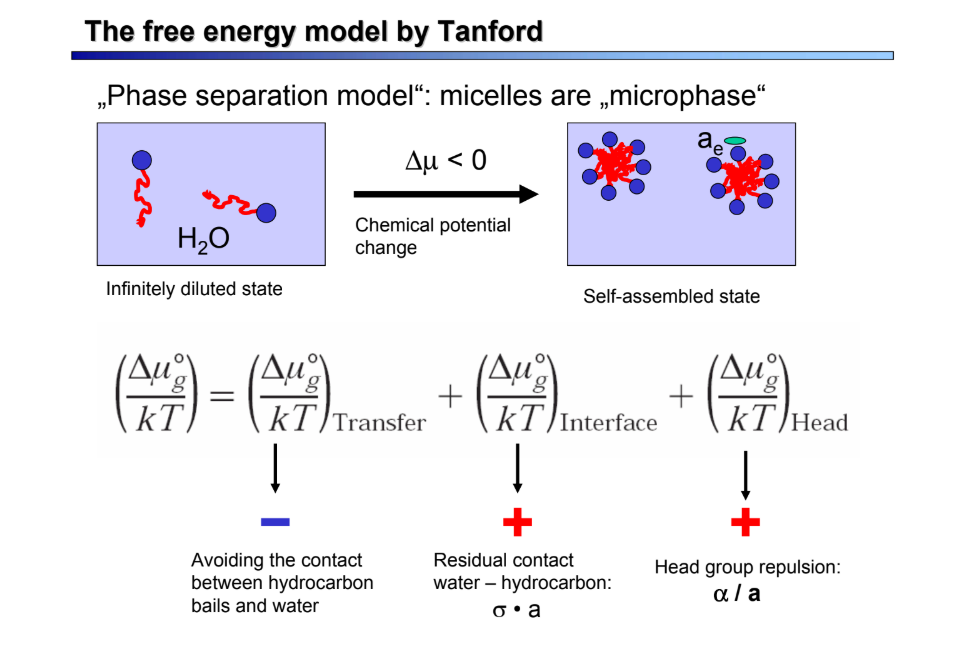
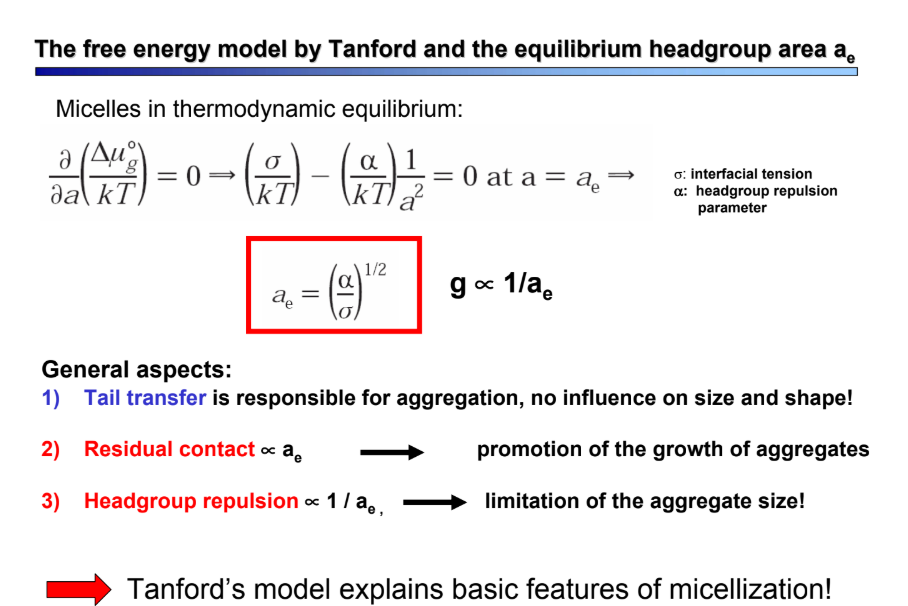
Mi a Tanford-modell?
fázisszeparációs modell → leírja a micellizáció alapvető jellemzőit
farok áthelyezése felelős az aggregációért, nem befolyásolja a méretet és a formát
maradék érintkező: a0 → aggregátumnöv. elősegítése
fejcsopitaszítás: 1/a0 → méretkorlátozás!
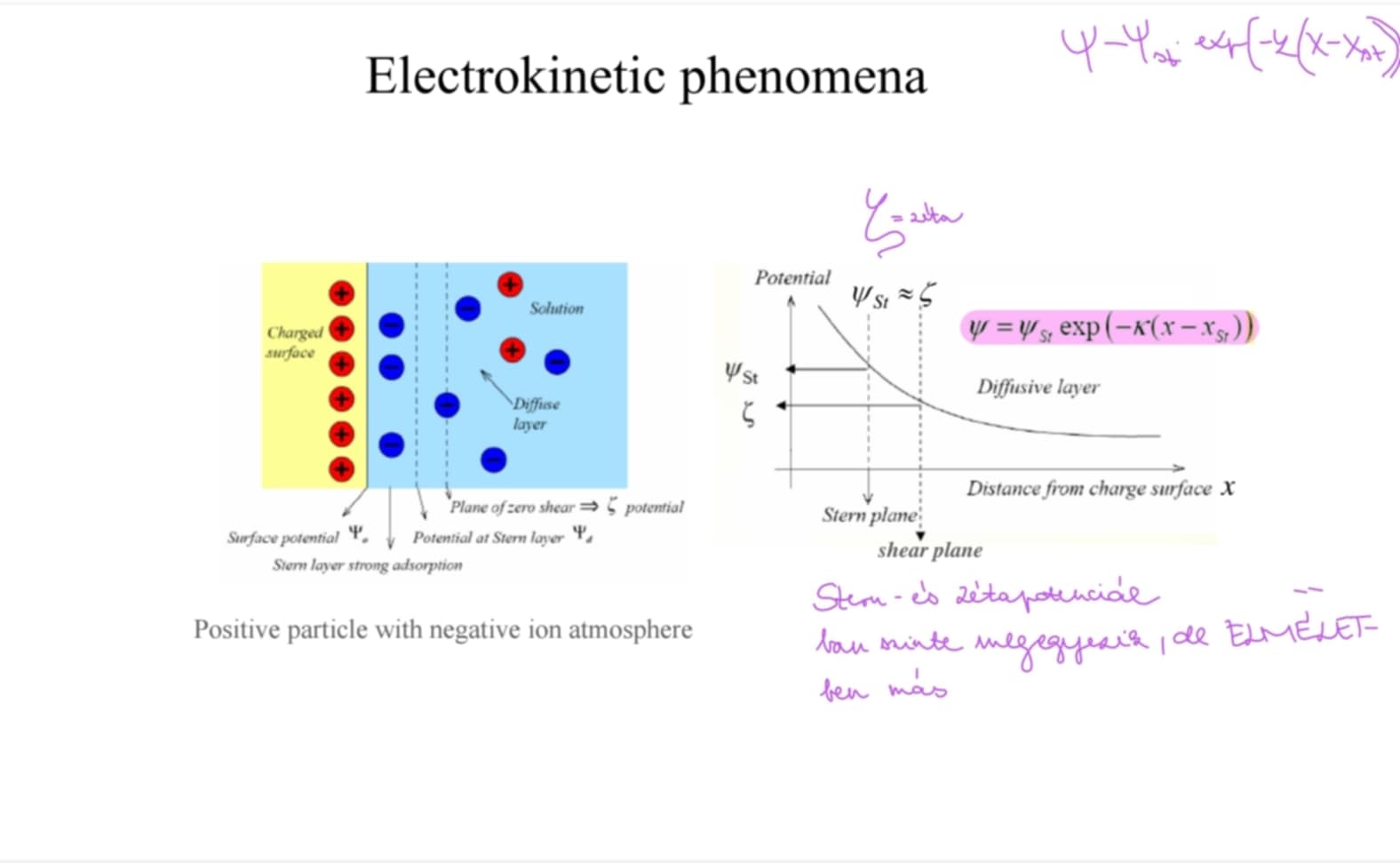
Mi a zéta-potenciál jele, definíciója, számolási és mérési módja? ***
= a nyírási síkon mért elektromos potenciál (elektrokinetikai jelenségek 2 fázis differenciális mozgásából származnak, ahol az interfázis egy elektromos kettősréteg → ez a szil. felülettől egy bizonyos távra lenyíródik, vékony film lesz a szilárd a.-gal)
jele: zéta = ζ
elektrolitoldattal érintkező szilárd felület ált. el. töltést hordoz (szigma0) → eredménye: egy el. pot. a felületen + egy csökkenő pot. (,,szigony’’), amikor az oldaton áthaladunk a felülettől távolodva → befolyásolja az ionok eloszlását a folyadékban
Két régió n. fontos: a felülettel közvetlenül szomszédos Stern-réteg (ionméret!) + 1 diffúz réteg → diff.r. és a szil. felület közötti töltéskül. miatt az egyiknek a másikhoz viszonyított elmozdulása töltésleválást okoz → potkül.-t generál/egy el. pot. alkalmazása az egyiknek a másikhoz viszonyított elmozdulását okozza → a szilárd felület és a folyadék relatív mozgása nyírófelületen történik (ahol a potenciál a zéta)
értéke az elektrokinetikai jelenségek mérésével határozható meg → majdnem azonos a Stern-potenciállal, így a diffúz réteg elején lévő potenciál mértékét adja meg
IZOELEKTROMOS PONT: az a pH, ahol a zéta potenciál 0 (ahol a csúszási síkon nincs töltés) → töltött, hidratált felület: ΔpH először megemeli a zétát, aztán lecsökken a kettősréteg összenyomása miatt
ha növeljük az oldatkoncentrációt, IEP marad a helyén, csak meredekebb lesz a függvény
kül. anyagok IEP-jai más pH-n vannak: porok koaguálódnak, ha ell. töltésűek (zétap. - pH fv.)
kicsi pH: nincs elég OH- → + töltés: de csökken a graf.
ahol OH- = H+ → teljes kiegyenlítődés: -íról n. fel., egyenes
nagy pH: nincs elég H+ → - töltés, kicsi pH fordítottja
ha polielektrolit adszorb.: gyorsan, majd lassan emelkedik
minél vastagabb a kettősréteg, annál nagyobb a zétap. (ábrázolva: elektr. pot. - felülettől való táv grafikonon)
mérése: MIKROELEKTROFORÉZIS (u(elf) = v(elf)/Ex → v(elf): dx/dt (mikrom/s), Ex = U/l (ez nem i) (V/cm) → Smoluchowski, Hückel) → Zeta Mark 21 géppel, Colloidal Dynamics Acoustosizer, Brookhaven Zeta Plus, Paar Physica EKA
szervezetbeli hatás: ha alacsony, vvt-k összeragadnak

Sorold fel az elektrokinetikai jelenségeket! ***
elektroforézis: részecske mozog, potenciált adunk rá (zétapotenciál eredménye) (mozgó határ elektroforézis, papíre., horizontális elektrofor., kapilláriselektrofor.)
ülepedési potenciál: részecske mozog, potenciált mérünk
elektroozmózis: közeg mozog, potenciált adunk rá
áramlási potenciál: közeg mozog, potenciált mérünk

Csoportosítsd a polimereket előfordulás szerint, kémiai összetétel alapján, láncszerkezet alapján, feldolgozási tulajdonságok a., fizikai/mechanikai tul./végfelhasználás alapján! ***
ELŐFORDULÁS SZERINT:
természetes: fehérje, NS, cellulóz, radír, kem.
mesterséges: nylon, dacron, poiletilén, teflon
KÉMIAI ÖSSZETÉTEL ALAPJÁN:
homopolimer: egyféle monomer
kopolimer: 1-nél többféle monomer: random (ABBA), alternáló (ABAB), blokk (AAABBB), graft (AAAA-BBB : vmelyik oldalsóról leágazás) (diblokk: AB, trib.: ABC, ABA, multi: ABCD)
alternálót kivéve mindegyik adszorbeált polimerlánckonformációnak is számít!
LÁNCSZERK. ALAPJÁN:
lineáris (magas denzitású PE)
elágazó (al. d. PE)
térhálós (pl. elasztomerek)
FELDOLGOZÁSI TUL. A.:
hőre keményedő: oldhatatlan és csak duzzadó (hálózatos pol.)
hőre lágyuló: nem térhálósodnak, oldódnak, megolvadnak és folynak (lienáris, elágazó)
FIZ./MECH. TUL./VÉGFELHASZN. A.:
műanyagok, gumik (elasztomerek), szálak, bevonatok, ragasztók
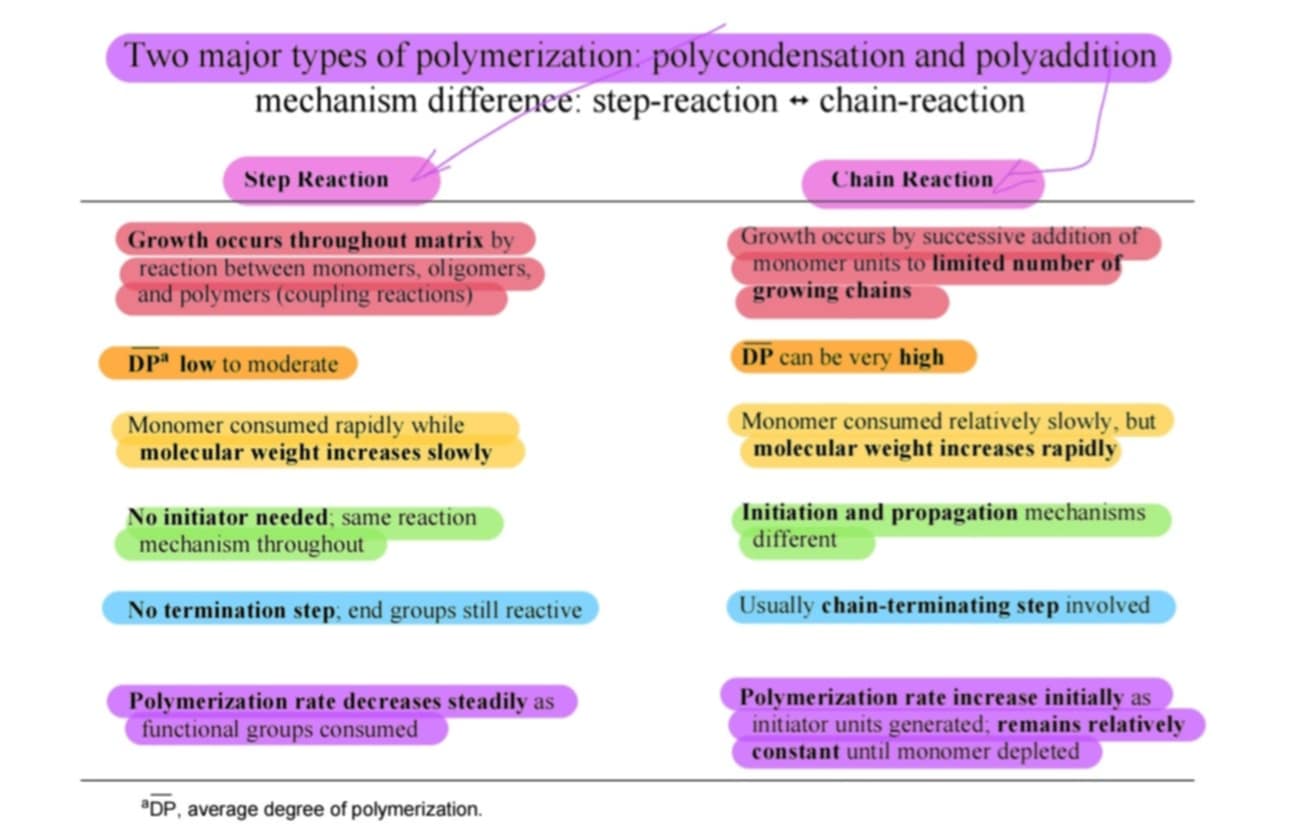
Melyik 2 folyamatát tanultuk a polimerizációnak? *
POLIKONDENZÁCIÓ: lépéses pol. → ált. 2 kül. monomer kombinálódik vízvesztés során
pl.: diamin + disav = poliamid + víz
POLIADDÍCIÓ: láncpolimerizáció/növekedés, iniciátor → monomermol.-ok kapcsolódnak össze egymással atomvesztés nélkül
pl.: iniciáció → propagáció → termináció: párosodás/kombó/diszproporció
KÖZTÜK KÜLÖNBSÉGEK A KÉPEN
Írj 3-3 példát kondenzációs és addíciós polimerre! A monomerjüket is írd le (ahol tudjuk)!
KONDENZÁCIÓS:
poliamid: nylon, poliuretán: Perlon, poliészter: Dacron
ADDÍCIÓS:
propilén → PP (polipropilén)
vinil-klorid → PVC (polivinil-klorid)
etilén → PE (polietilén)
sztirol → PS (polisztirol)
Sorold fel a 4 szabadgyökös polimerizációs módszert!
bulk polimerizáció (legegyszerűbb, hőátadás rossz)
szuszpenziópolimerizáció (hőátadás jobb, van iniciátor)
oldatpolimerizáció (hőátadás n. hatékony, körny. bajok)
emulziópolimerizáció (nagyüzemi előkészítés, latexhez, szupermagas M-ek eá.) → emulzió: O/W, inverz e.: W/O

Mi a theta-állapot és -hőmérséklet? 2 módszer a meghatározására?
= olyan oldószer, amelyben a szegmens-szegmens interakciók nagyon gyengék vagy 0 → polimer ez alapján veszi fel a 3D-szerkezetét (fluktuálódó vagy random feltekeredés)
a benne lévő kölcsönhatásoktól függ: szegmens-szegmens (n. erős), szegmens-osz., osz.-osz.
= az a hőmérséklet, ahol már nem zsugorodik és nem duzzad egy adott T-n → tkp. az állapot is ez
Flory expenziós faktor: alfa → ha 1-nél nagyobb: jó oldószer, mert kitágul
ha 1-nél kisebb: rossz oldószer, mert összezsugorodik
ha polimer-pol. interakciók erősebbek a pol-osz-nél: alfa 1-nél kisebb → rossz osz., öh.
ha pol-osz erősebbek a pol-pol-nél: alfa 1-nél nagyobb → jó osz., lánc kiterjed,
HA POL-POL = POL-OSZ: THETA-ÁLLAPOT; alfa = 1;amorf olvadással megegyezik
2 módszer a megvalósítására: PVC feloldása poliuretánban, megfelelő oldószer és megfelelő használata
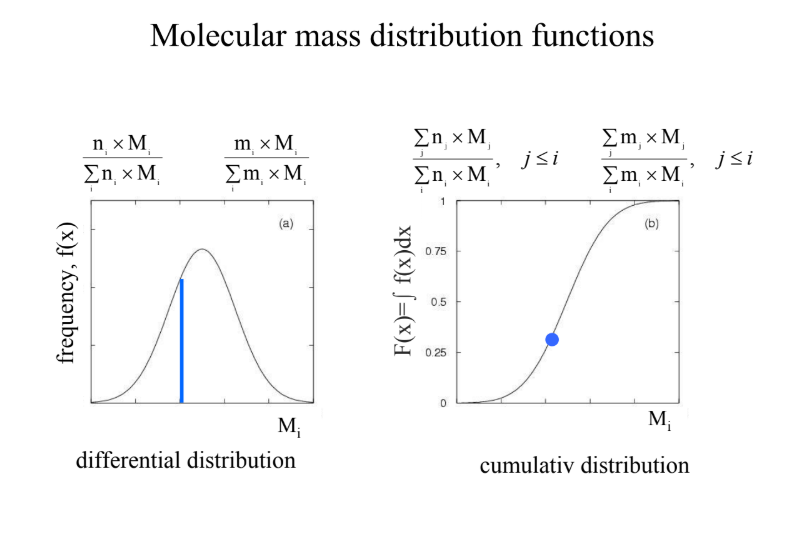
Hogyan határozható meg a polimer molekulatömege? (3 módszer) → MOL.TÖMEGELOSZLÁSI FÜGGVÉNYEK
szintetikus polimerek: mindig van lánchosszváltozás, POLIDISZPERZEK
élő szervezeteké: fix lánchossz, HOMODISZPERZEK
MOL.TÖMEGELOSZLÁSI FÜGGVÉNYEK:
n(i) * M(i)/szumma (n(i) * M(i))
m(i) * M(i)/szumma (m(i) * M(i))
→ differenciális megoszlás: fordított U (frekv. -y, M - x-tengely)
szumma n(j) M(j)/ szumma n(i) *M(i) j=/< i
szumma m(j) M(j)/ szumma m(i) *M(i) j=/< i
→ integrális megoszlás: fél S (F(x) = derivált f(x)dx -y, Mi - x)
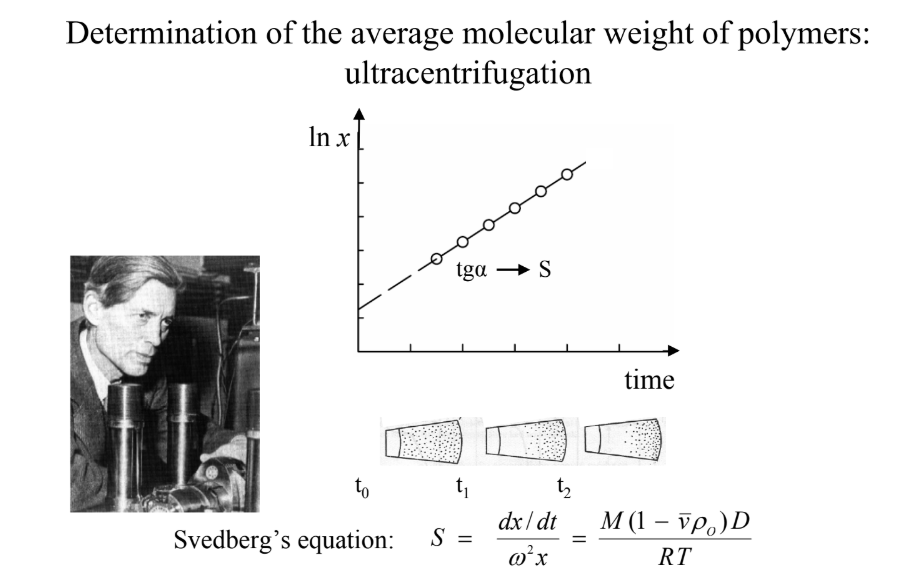
A polimerek molekulatömegének meghatározása: 3 módszer felsorolása. Melyek ezek? NEM SZÁMOLÁS
kapillárisviszkozimetria (lehet relatív, specifikus, csökkentett, inherens, intrinszik) → Ostwald-féle viszkoziméter: η/η0 →kerekítve: t/t0
ultracentrifugálás: Svedberg-egyenlet
ozmometria: redukált ozmotikus nyomás egyenlete
turbidimetria/nefelometria: fényszórás → polimerfrakcionálás
gél kromatográfia: fehérjeelválasztás méret alapján: nagy mol. - hamar kint , kicsi - sokáig bent
méretkizárásos (SEC) kromatográfia = gélpermeábilis: nagy mol. - hamar kint (r(g)>> d), kicsi - sokáig bent (r(g) << d)
gélpermeációs krom. (GPC)

Hogyan tudod KISZÁMÍTANI a moláris tömegeket?
nem meghatározás és nem eloszlás
szám szerinti átlag
tömeg szerinti átlag: mindig több, mint a szám szerinti
M(k) és M(v)
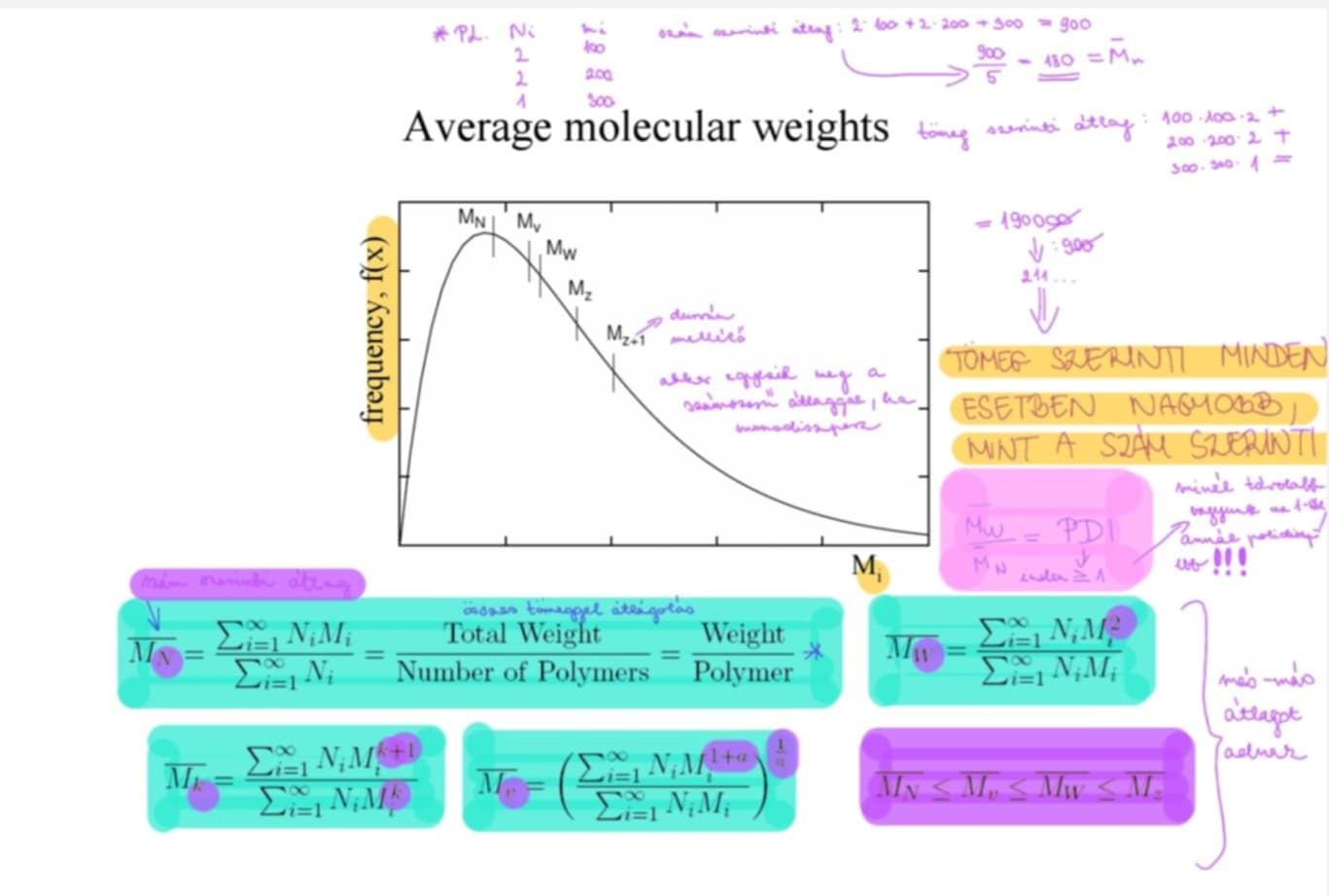
Mi a PDI és mi határozható meg vele? ***
M(w)/M(N) = PDI → minél távolabb vagyunk az 1-től, annál polidiszperzebb
= polidiszperzitás-index
ha monodiszperz: M(w)/M(N) = 1
ha polidiszperz: M(w)/M(N) > 1
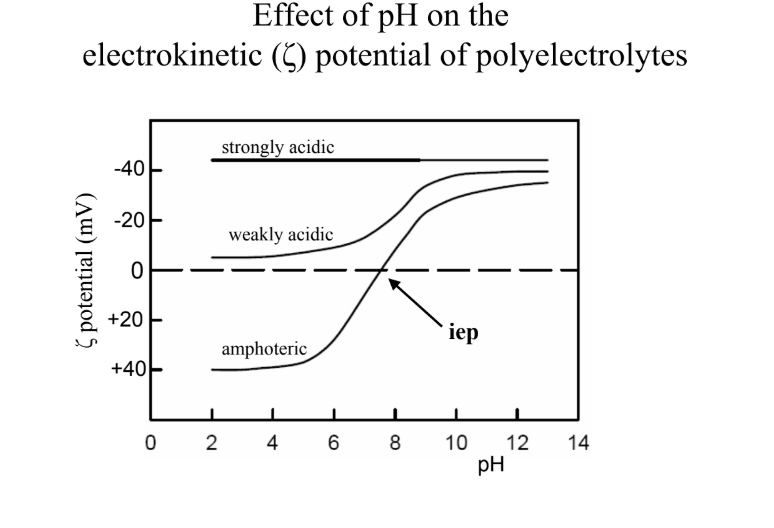
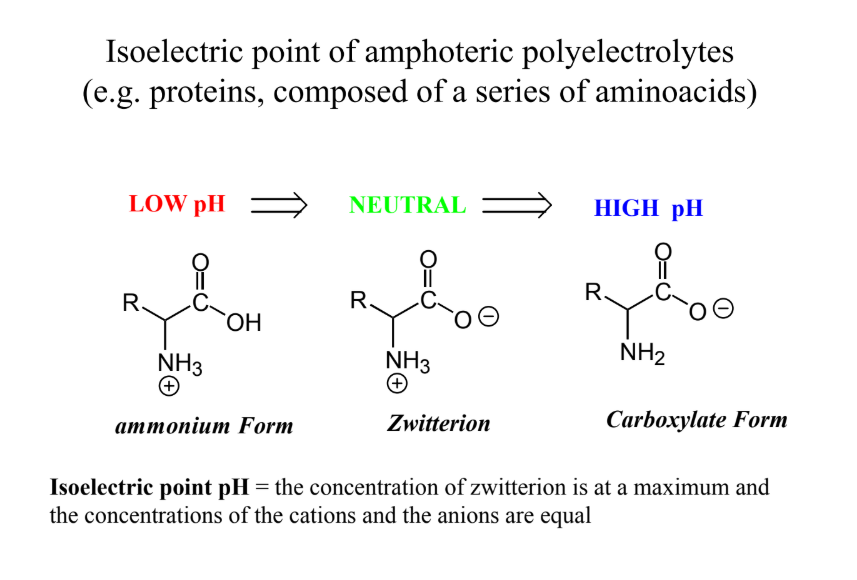
Hogyan lehet a polielektrolitokat csoportosítani?
ANIONOS: pl. → PSS(polisztirén-szulfonát)
KATIONOS: pl. → PEI(elágazó polietilén-imin)
AMFOTER: pl. → zselatin
izoelektromos pont pH = kettősion koncentrációja maximális és kation- és anionkoncentrációk megegyeznek; ilyenkor egy AS/peptid/fehérje nem töltött, bázikus R-csopikhoz magasabb pH kell, savas R-csopikhoz alacsonyabb, hogy elérje az IEP-t
→ lizin komplexebb: 2 bázikus csopija miatt: dikationos → monokationos → dipoláris → anionos
ηrel egyre laposabb a polielektrolitkonc. függvényében, ha az egyszerű elektrolitkonc. nő → oka: charge screening
izolabilis feh.: kicsapódik iep-nél, izostabilis: nem csapódik ki dehidráció nélkül
legnegatívabb potenciál: erősen savas oldatánál
Mi a koaleszcencia?
a kolloidrészecskék összeolvadása egy nagy kolloiddá, nem tartják meg a felületüket
Hogyan lehet a kolloidrészecskék közötti vonzó potenciált növelni?
van der Waals vonzó kh.: vonzópotenciál → - A r/12x = V(A)(x)
A: Hamaker-konstans: nem változtatható
anyagi minőségének megváltoztatásával → pl. kvarc cseréje fémre → sokkal jobb A
2 részecske közötti táv lecsökkentésével (x) → kevesebbel osztunk, nagyobb a V
részecskesugár növelésével: többet osztunk → nagyobb V
akkor a legnagyobb az energiája a van der Waals-nak, ha A minél nagyobb
Hogyan lehet a kolloidrészecskék közötti taszítást növelni?
kolloidstabilitáshoz szükségesek taszító erők az ütköző részecskék között
elektromos töltések vagy kapcsolódó polimerrétegek szűrik a vonzást
elektrosztatikus potenciál: ell. töltések taszigálják egymást → Coulomb-taszítás: elektrosztatikusan stabilizál → TASZÍTÁS NÖVELHETŐ, HA EZ NŐ, JOBBAN TASZIGÁLNAK, és az aggregáció is akadályozott
sztérikus potenciál: részecskefelületek összeérnek → nem stabilizálhatók → entrópiaakadály: sztérikus stabilizálás (feltételei: nagy adszorbeált menny., nagy rétegvastagság, nagy adszorpciós E, jó osz., alacsony konc.)
Flory polimer/osz. interakció paraméter (X): ha fél alatt van, taszító; ha felette: vonzó
DLVO-elmélet szerint (elektrosztatikus stabilizálási teória): az elektrosztatikus taszítást befolyásolja a STERN-POTENCIÁL (ψStern) és az ELEKTROMOS KETTŐSRÉTEG VASTAGSÁGA (1/κ)
Mi a DLVO-teória lényege?
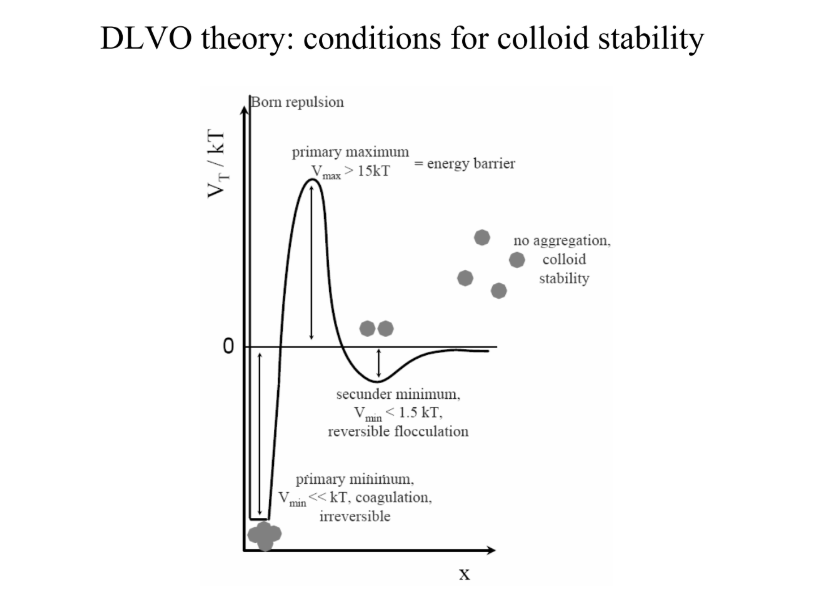
V(T) = V(A) + V(K) alapján összeadódnak az értékei, így megkapjuk a végső potenicálértéket
V(T)/ k*T >/= 10: kolloidstabilitás
k: Boltzmann-állandó
T: hőmérséklet: minél melegebb van, annál gyorsabban közlekednek a részecskék → ezt meg akarjuk akadályozni: T-állandóság
akkor stabil, ha a taszító erő 10-15x nagyobb, mint a vonzó: egyedül stabilabbak
ha a vonzás nagyobb: nincs ellenállás: előbb-utóbb az egész összetapad → ez NEM JÓ (koaguláció)
KOLLOIDSTABILITÁS FELTÉTELEI:
1. felületi töltéssűrűség magas - elektrolitkonc. alacsony, magas potenciálköszöb → stabil
2. másodlagos minimum megjelenése: x > 3 nm → még mindig magas köszöb → kinetikailag stabil
3. potenciálküszöb kicsi → lassú koaguláció
4. 0 > küszöb → gyors koaguláció a CCC-ben (critical coagulation concentration) → instabil
5. nincs potenciálküszöb: erős vonzópot. → nagyon gyors koaguláció
1 → 5: elektrolitkonc. nő, diffúz elektr. kettősréteg vékony
TASZÍTÁS: + → 0, VONZÁS: - → 0, ÖSSZESEN: - → + → 0
megmutatja, milyen arányban kell +1, +2 és +3 iont hozzáadni: Schulze-Hardy-szabály → 1/z 6.-on (1000:16:1,3)
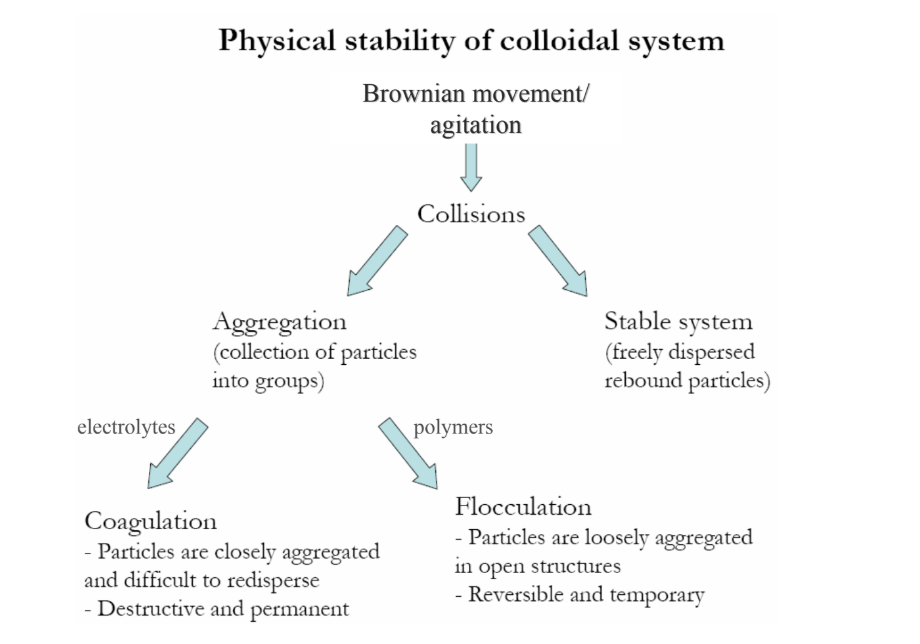
Milyen mechanizmusokkal történhet koaguláció?
PERIKINETIKUS: Brown-mozgás általi ütközések
DIFFERENCIÁLIS ÜLEPÍTÉS: polidiszperz szuszpenzió
ORTOKINETIKUS: indukált ütközések keverés, nyírás által előidézve
gyors koag.: minden ütközés aggregációhoz vezet → magas elektrolitkonc.
lassú koag.: csak egy részük vezet hozzá → alacsony/közepes e.konc.
Mi az emulzió fogalma? Mik egy emulgeálószer feltételei és hogyan lehet őket csoportosítani?
bizonyos méretű folyadékcseppek szuszpenziója (diszpergált forma) egy 2., vele nem elegyedő folyadékban (diszpergálószer)
em. szer feltételei:
jó felületi aktivitás
képes kell legyen egy sűrített film kialakítására
diffúziós sebesség: a határfelülethez hasonló az emulzióképződés idejéhez
CSOPORTOSÍTÁS:
surfactantok: anionos (Na-sztearát, K-laurát, Na-dodecil-szulfát), kationos (4.r. ammóniumsók, aminohidrokloridok), nemionos (poliglikol, lecitin)
szilárd anyagok: amfifil tulajonságokkal: korom, szilikagél, agyag
Hogyan lehet csoportosítani az emulziókat?
DISZPERZ FÁZIS ALAPJÁN:
O/W: olajcseppek diszpergálva vízben
W/O: vízcseppek diszpergálva olajban
befolyásolja: olaj-víz fázisarányok, T, adalékanyagok jelenléte, szilárd részecskék, mint stabilizálószerek (Pickering-emulzió), nedvesítési feltételek (olaj-víz érintkezési (kontakt)szögek a szil. anyagon
A FOLYADÉKCSEPPEK MÉRETE ALAPJÁN:
0,2 - 50 nm: makroemulzió (csak kinetikailag stabil)
0,01 - 0,2 nm: mikroemulzió (kinetikailag és termodinamikailag is)
Mi a Pickering-emulzió?
nagy stabilitású emulzió, amelynél az olaj/víz interfázist szilárd részecskék stabilizálják
Hányféleképpen készíthető emulzió?
olajcsepp + surfactant vagy
+ polimer
+ szilárd részecskék
delta G = gamma *delta A >> 0: hatalams E-befektetés kell
koaleszcenciánál ez 0 alatti: deszorpciós E-tól függően megelőzés/indukálás
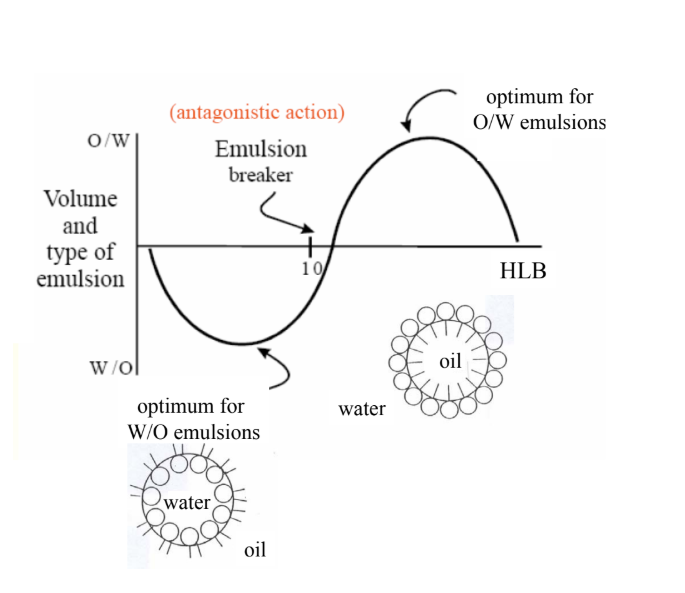
Milyen kapcsolat van a CPP és a HLB közt?
CPP = critical Packing-paramer → P = v /(l * a0) → molekuláris paraméterek összefoglalása (fejcsopiméret, lánchossz, hidrofób farokV), intenzív változókkal (T, I) összekapcsolva
v: SZH-magtérfogat, l: SZH-lánchossz, a0: hatékony fejcsopiterület
összefüggés HLB (hidrofil-lipofil es.)-lel: P = 1/HLB, ha értéke 10, a surfactant ugyanakkora affinitást mutat olajra és vízre isminél több vízoldható csopi van a molekulában, annál magasabb a HLB (=emulgeálási viselkedés jelzése: száma majd attól függ, hogy végül milyen fázisban van) + PIT-módszer (O/W: em. szer 20-60 fok közt; W/O: 10-40 fokkal lejjebb) + CER (HLB-megfeleőség, mol.V, alak, kém. term.)
ha O/W: CPP < 1, HLB > 10
ha W/O: CPP > 1, HLB < 10
mikroemulziók CPP-je: 1 → spontán létrejönnek
MIre jó a Bancroft-törvény?
ha az emulgeálószer vízben oldódik → O/W emulzió keletkezik → magas HLB-jű surf. (15 körüli HLB)
ha az em. szer olajban old. → W/O emulzió kel. (optimumuk: 5 körüli HLB)
MERT az emulziótípus jobban függ az em. szer természetétől, mint a jelenlévő olaj vagy víz relatív arányától vagy az emulzió előállításának módszerétől → alacsony HLB-jű surf.
lefelé induló hullám alakú grafikon
Hogyan lehet eldönteni, hogy milyen emulzióról van éppen szó? ***
teszteket kell végezni
festésteszt
hígítási teszt
elektromos vezetőképességi teszt (O/W kezdetben stabilabb vezető)
refraktív index mérése
szűrőpapír teszt
+mikroszkóp tárgylemezre: víz & emulzió & olaj → összehúzás: amelyikkel elegyedik/összefolyik, az van kívül
Hogyan stabilizálható egy emulzió?
vegyes összetételű felületaktív anyag hozzáadásával (jobb, mint 1-gyel): NaCl hozzáadása lauril-alkoholhoz és NA-lauril-szulfáthoz
(nincs összefüggés a csepptöltés és e.stab. közt W/O-ban, de O/W-ben nemionos em. szerbe kerülhet töltés → nem jó → sztérikus gát: kiszáradás és SZH-lánc konformációváltozása)
ált. viszkozitásnöveléssel: ütközésszám csökken, cseppszám nő, koncentráltan ált. stabilabbak
cseppek méreteloszlásának egyenletessé tételével
diszpergált fázis térfogatcsökkentésével
hőmérséklet csökkentésével
emulgeálószer hozzáadásval
hidratációs erőkkel: O/W, sztérikussal: W/O ionos surfactantokkal
szilárd porokkal: hidrofób erők (nedvesítés)
Hogyan érhető el az inverz micella?
HLB/CPP arány megváltoztatásával:
Na-szappan (O/W) → +BaCl2 → Ba-szappan (W/O)
O/W → W/O: T-változtatás nemionosoknál, elektrolitkisózás ionosoknál → MERT: ezek megzavarják a vízmolekulákat a nemionos és ionos surf. körül, surf. oldhatóság megváltoztatva (felületgörbület is változik)
hozzáadás sorrendje: vizet rakok olajba + emulgeálószer → W/O (fordítva is)
emulgeálószer olajban oldhatóvá téve: W/O e.
O/W arány nő → W/O (ford. is)
O/W T-emelése →hidrofóbabb lesz az em. szer → W/O
elektrolitok és egyéb adalékok hozzáadása: pl. → O/W = Na-cetil-szulfát + koleszterin stabilizál →többértékű Ca hozzá: ford.
Mit jelent a creaming?
az 1 mm-nél nagyobb cseppek a gravitációs erők hatására előnyösen felülre/alulra telepedhetnek
instabilitás, de nem súlyos (koal., em. törés)
valószínűsége homogenizálással csökkenthető (sűrűségkülönbség megakadályozása) → ehhez többfázisú em. kell
Hogyan lehet destabilizálni egy emulziót?
ÉS eltörni?
fizikai módszerekkel: centrifugálással, finom rázással/kevergetéssel, alacsony intenzitású ultrahangos rezgésekkel, filtrációval
T: kb. 70 fokon eltörnek
elektromos úton
ELTÖRÉS: fázisszeparációval
Ostwald-éréssel
aggregációs folyamatokkal (flokkuláció, kuag., összeolv.)
fázisinverzióval
szedimentációval, centrifugálással, filtrációval, hőkoagulációval, kisózással
Hogyan lehet komplex emulziókat létrehozni?
olaj + lipofil surf. → keverés: W/O
bele hidrofil surf.-ba → keverés: W/O/W
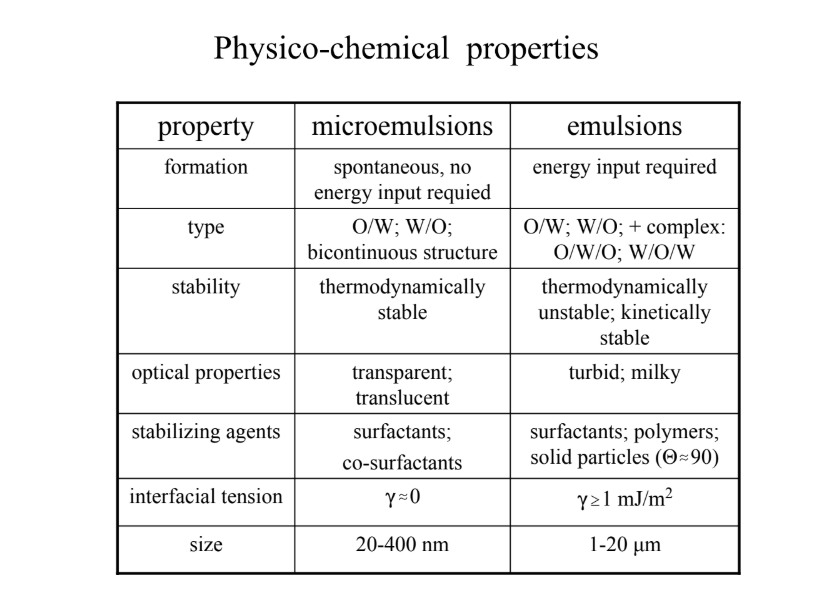
Mi a különbség normál- és mikroemulziók keletkezése közt?
bikontinuális szerkezet: csak mikroemulzióknál jöhet létre (HLB: 10, CPP: 1)
mikroknál: határfelületi feszültség 1000x kisebb, mint normál emulzióknál
mikroe.: SPONTÁN KELETKEZIK, nem kell E-befektetés
Winsor I: O/W; W II: W/O, W III: bikontinus
normál e.: E-befektetés kell
Kolloidrészecskék alakjait hogyan osztályozhatjuk?
IZOMETRIKUS: gömb, kocka, oktahedron
ANIZOMETRIKUS: prolát, rúd, fibrilláris, oblát, lamella, tányér
→ ezek alakulnak ki a primer részecskékből:
korpuszkuláris, fibrilláris, lamelláris, 2. r.-k → aggl. → koherens rendszerek
Anizometrikus részecskék osztáylozása mezomorfiásan (random szerk. és kristályrács közt?
nematikus: kb. párhuzamos
smektikus: y-irányú elrendeződés is van
taktoid: csigaszerűen
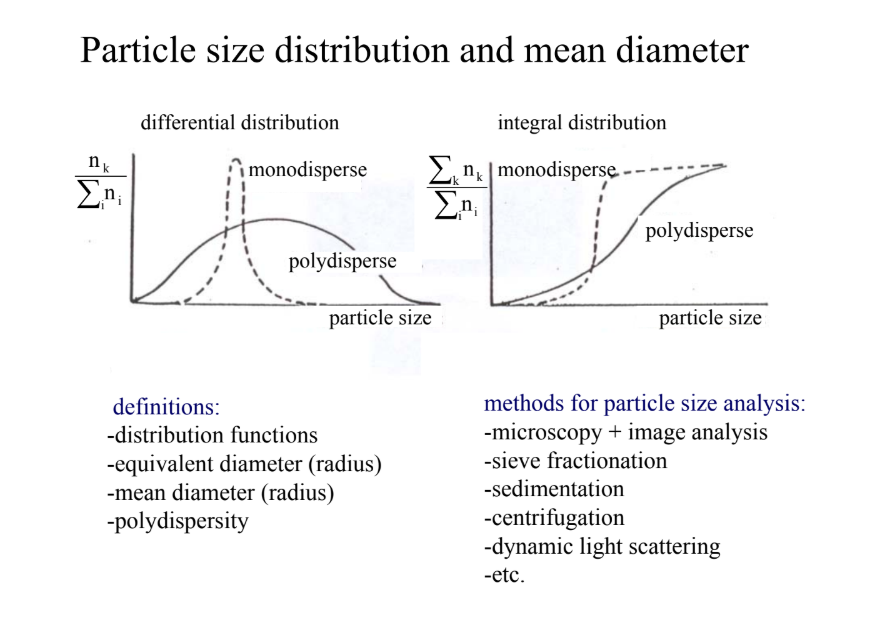
Írd fel a részecskék méret szerint eloszlását! diff. + integrális görbe ***
fogalmak:
eloszlási funkciók, egyenérték átmérő, átlagos átmérő, polidiszperzitás
meghatározási módok:
mikroszkópia & képelemzés
szita frakcionálás
szedimentáció
centrifugálás
dinamikus fényszórás
Mi az ekvivalens sugár definíciója?
hipotetikus gömb alakú részecske sugara, amely ugyanolyan sűrűségű és ülepedési sebességű, mint az adott részecske → DINAMIKUS
annak a körnek a sugara, amelynek területe megegyezik az adott részecske 2D-s képének területével → STATIKUS
olyan kör sugara, amelynek kerülete megegyezik a részcseke kerületével (adott r. 2D-s képe) → STATIKUS
A MÉRÉSI MÓDSZERTŐL FÜGG!
Mit ír le a Stokes-egyenlet?
az ülepedési sebességet: minél nagyobb a közegviszk., annál lassabban
v = delta h / delta t = 2 r2 pí g / (9 viszk)
Mik a liofób kolloidok?
azok a diszperziók, amik TD-lag instabilak és csak rövid ideig léteznek
MI a peptizáció?
az összeállt kis kolloidok részecskékre szétesése
Hogyan tudunk aeroszolokat készíteni? Hogy mozoghatnak?
diszpergálás: folyadéknebulizáció, pulverizáció, száraz neb.
kondenzáció: köd → párakond.;por: deszubl.
kémia reakciók: gázfázisú r., exoterm r. (foly/szil fázis)
MOZGÁSUK:
szedimentáció
intercepció
imapkció
diffúzió/Brown-mozgás
lerakódási sebsség közepes mértenél a leglassabb
Hab instabilitásánál milyen szerepe van a Plateau-határnak?
Hogy lehet őket stabilizálni?
ott a nyomás sokkal alacsonyabb → kapillárisáramlás oka → víz ide folyik, amíg instabillá nem válik
pl. glicerin + szappanoldat: viszk. nő, habfolyás lassul → összeesés
HABSTABILIZÁLÁS:
elektrosztatikus: ionos surf.
sztérikus: nemionossal
kiszáradás/vízelvezetés
durvulás
filmszakadás
HABZÁSGÁTLÓK: habképződés előtt hozzáadva, habzóanyagok cseréje/oldása
HABTÖRŐK: mechanikai, lökéshullámok, kompressziós h., UH, forgó szerszámok, fűtés, elektromos szikra
ANTIHABOK: meglévő habokhoz adva, kis cseppekként, lamellákon szétterülés és megtörés
Gibbs-Marangoni-effektus: csillapítja az elvékonyodást, mérsékli a vízelvezetést, növeli a habstabilitást
HABDESTABILIZÁLÓK:
habstabilizáló kiszorítása habzásgátlóval
habképzőszer átalakítása habgátlóvá (pl. olaj tojásfehérjéhez)
T-emelés, viszkozitáscsökkenés
tixotrópia
egyes liofil szoloknál fellépő jelenség, melynek során a kolloid struktúra (gélszerkezet) nyírással való lerombolása után regenerálódni képes
Az a jelenség, amikor egy anyag viszkozitása csökken nyíró igénybevétel, pl. keverés ideje alatt, de ha a keverést megszüntetik (pihentetés) egy idő után kisebb, vagy nagyobb eltéréssel visszaáll a kiindulási viszkozitás.