1) Princip fluorescence, fluorochromy, vnitřní a vnější fluorescence
1/57
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
58 Terms
„Viditelné“ světlo
elektromagnetické vlnění o vlnové délce 400 - 700 nm
elementární částice = foton - představuje kvantum elektromagnetické energie (světla)
duální povaha - vlnová i částicová (dle metody studia)
vlnová délka (λ)
délka jednoho kmitu (400-700 nm)
frekvence (f)
počet kmitů za sekundu (4-81014 s-1 [Hz])
Vztah mezi vlnovou délkou a frekvencí:
c=λf
f=c/λ
λ=c/f
rychlost světla je konstantní
energie fotonu:
E=hf
E=hc/λ
rychlost světla konstantní
Planckova konstanta: h = 6,62610-34 Js
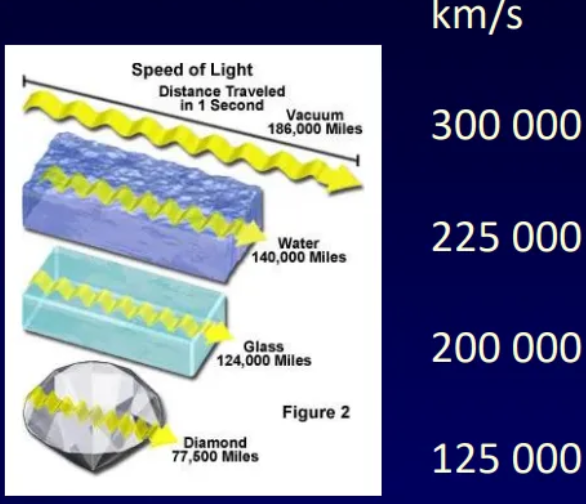
Rychlost světla (c)
c = 300.000 km*s-1
konstantní ve vakuu
snížení rychlosti -> zkrácení vl. délky
definice metru v SI - 299 792 458 m/s
vlivy na barvu světla
frekvence stejná -> barva stejná
vlnová délka → barva
amplituda → jas
vlnová délka ~ barva světla
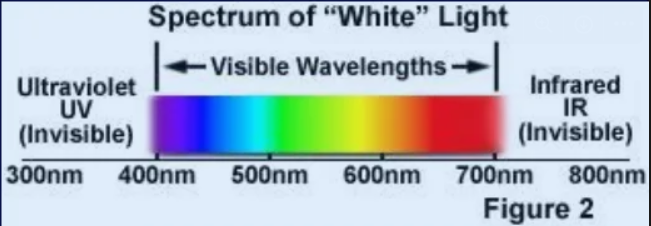
300nm - 400 nm
ultrafialová
400 nm - 500 nm
fialová - modrá - zelená
500 nm - 600 nm
zelená - žlutá - oranžová
600 nm - 700 nm
oranžová - červená
700 nm - 800 nm
infračervená
LUMINISCENCE
jev při kterém vysílá látka do prostoru světlo
dělení luminiscence dle indukce
chemiluminiscence vs. fotoluminiscence
chemiluminiscence
vyvoláno chemickou reakcí
např. oxidace luciferinu luciferázou u světlušky,
tlející dřevo – václavka, ECL detekční činidlo pro western blotting
Fotoluminiscence
záření je vyvoláno jiným zářením
Fotoluminiscence se dále dělí na
a) fluorescence
b) fosforescence
fluorochrom
= fluorofor, látka schopná fluorescence
excitační záření
luminiscenci vyvolává
emisní záření
vysílané látkou
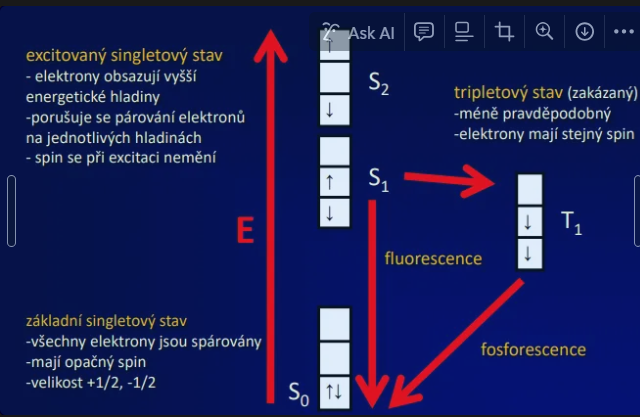
Podstata fluorescence
Excitace a emise, Jablonskiho diagram
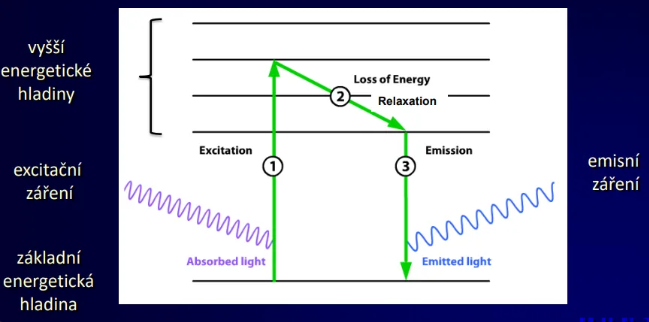
Průběh fluorescence
excitace elektronů fotony ze základní energetické hladiny do excitovaného stavu trvání 10-15 s
excitovaný stav pokles na nejnižší hladinu excitace (relaxace) ztráta energie ve formě tepla, trvání 10-14 – 10-11 s
emise světla => fluorescence, trvání 10-7 – 10-9 s = doba dohasínání
photobleaching
degradační proces barviv vystavených intenzivnímu světlu, vedoucí k jejich oslabení nebo ztrátě fluorescenčních vlastností.

fosforescence
Doba, během které excitované molekuly vydávají světlo po energizaci, trvá déle než fluorescence, často v řádech mikrosekund až hodin.i.e. doba dohasínání 10-3 – 102 s
excitovaný singletový stav
elektrony obsazují vyšší energetické hladiny
porušuje se párování elektronů
na jednotlivých hladinách
spin se při excitaci nemění
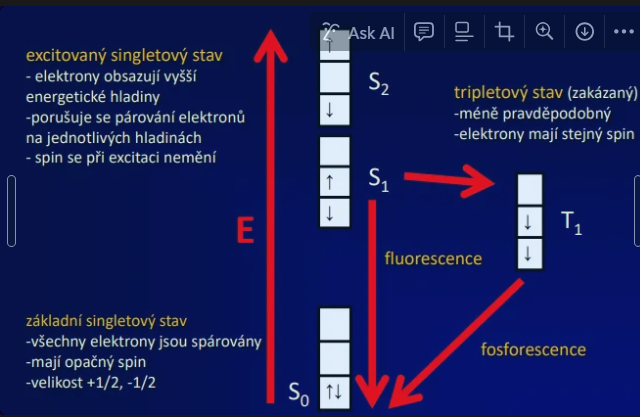
základní singletový stav
všechny elektrony jsou spárovány
mají opačný spin
velikost +1/2, -1/2
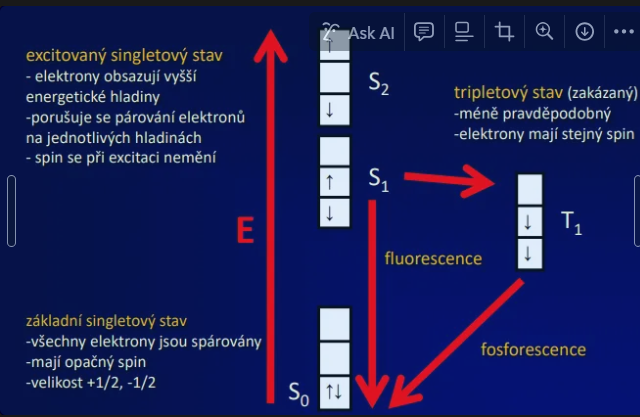
tripletový stav (zakázaný)
méně pravděpodobný
elektrony mají stejný spin
Spin
je kvantová vlastnost elementárních částic - vnitřní moment hybnosti částice. Spiny částic přispívají k celkovému momentu hybnosti soustavy.
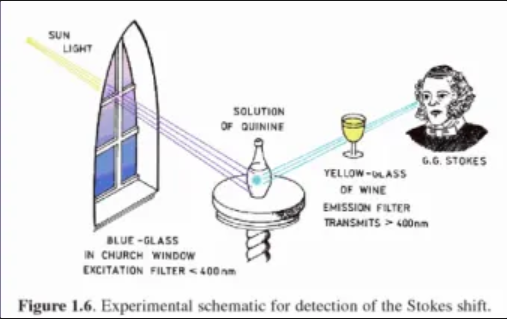
Stokesův posun
Vlnová délka excitujícího světla je menší než emitovaného (λex< λem)
Energie excitujícího světla je větší než emitovaného (Eex> Eem)
V rámci relaxace v excitovaných stavech dochází ke ztrátě energie
fluorochromy charakterizuje
Absorbční (excitační) a emisní spektrum, Molární extinkční koeficient (molární absorptivita), Kvantový výtěžek fluorescence (Qantum Yield = QY)
Absorbční (excitační ) spektrum
závislost intenzity fluorescence na excitační vlnové délce (měřeno při konstatní emisní vlnové délce)
Emisní spektrum
závislost intenzity fluorescence na vlnové délce při konstantní vlnové délce excitace
vztah absorpčního a emisního spektra
obě spektra mají své maxima
vzdálenost mezi nimi – Stokesův posun
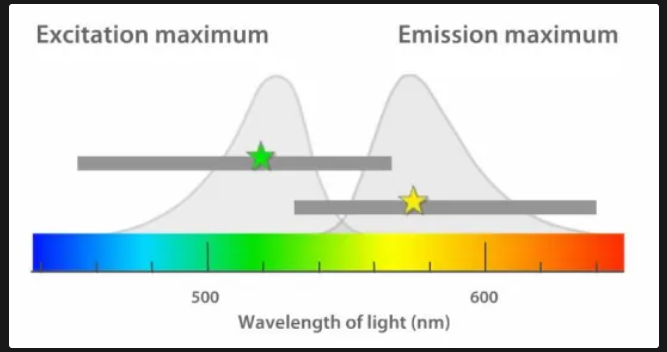
Emisní spektrum určitého fluorochromu
je nezávislé na vlnové délce excitace
emise z nejnižšího excitovaného stavu (S1)
mění se pouze intenzita fluorescence
intenzita emisního spektra odpovídá amplitudě excitace
Symetrie mezi absorpčním a emisním spektrem
- struktura vibračních hladin základního i excitovaných stavů je stejná
- absorpce (excitace) a emise do odpovídajících hladin nastává se stejnou pravděpodobností
- absorpční a emisní spektra zrcadlově symetrická
Molární extinkční koeficient (molární absorptivita)
vyjadřuje míru schopnosti látky absorbovat světlo
Lambert-Beerův zákon
A = - log I / I0 = log I0/I = ɛ · c · l
A – absorbance (bez jednotek)
I / I0 – transmitance (T, propustnost)
ɛ – molární extinkční koeficient (l·mol-1·cm-1)
c – molární koncentrace (mol·l-1)
l – dráha (cm)Kvantový výtěžek fluorescence (Qantum Yield = QY)
Kvantový výtěžek fluorescence (Qantum Yield = QY)
QY = počet emitovaných fotonů / počet absorbovaných fotonů
vyjadřuje míru schopnosti excitačního vlnění vyvolat fluorescenci
maximálně = 1 (teoreticky; energetické ztráty)
struktura fluorochromů
často obsahuje polycyklické nenasycené sloučeniny a atomy
(s více elektrony – např. P, S)
čím více benzenových jader, tím více roste absopční maximum
benzen 262 nm
naftalen 272 nm
antracen 375nm
tetracen 475nm
pentacen 580nm
Fluorescence látek a skupiny fluoroforů může být
Vlastní (vnitřní) nebo Nevlastní (vnější)
Vlastní (vnitřní) fluorescence látek
Přirozeně se vyskytující fluorofory/fluorochromy
aminokyseliny, kofaktory enzymů, chlorofyl, „přírodní“ fluorescenční proteiny (green fluorescent protein,…)
Nevlastní (vnější) fluorescence látek
liší se podle přímé nebo nepřímé vazby fluorochromu
Přímá vazba fluorochromu
na molekuly nebo buněčné struktury
použití sondy -> označení DNA, buněčné stěny, plazmatických membrán, organel…
detekce mitochondriální aktivity - respiračního vzplanutí, koncentrace H+ (pH indikátory), membránový potenciál..
Nepřímá vazba fluorochromu
použití značky
navázání na imunoglobulin (protilátku) nebo úsek nukleové kyseliny, phalloidin, annexin V… -> následné označení buněčné struktury
aminokyseliny jako přirozené fluorofory
tryptophan, tyrosine, phenylalanin
hlavní zdroj fluorescence proteinů v UV spektru
indolová skupina Trp
Trp v sekvencích jen 1%
metabolicky náročná syntéza
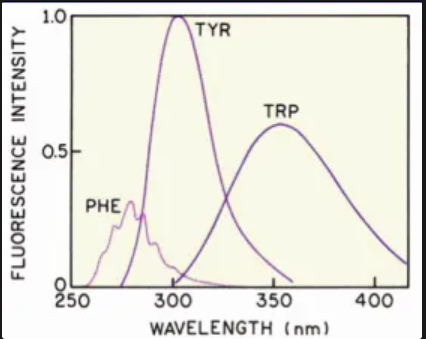
kofaktory jako přirozené fluorofory
Nikotinamid adenin dinukleotid (NADH)
Flavin adenin dinukleotid (FAD)
NAD+ není fluorescenční - fluorochrom = redukovaný nikotinamidový ring
chlorofyl
chlorofyl
porfyrinové jádro + Mg
Stokesův posun až 200nm
využití:
hodnocení výskytu fytoplanktonu ve vodě
studium fotosyntézy
fyziologický stav rostlin – stres (pokles fl.)
Nevlastní (vnější) fluorescence - charakteristika
značky jsou vázány k molekulám (proteiny, peptidy,
oligonukleotidy..) kovalentní vazbou
proteiny – vazba na aminové (NH2-), thiolové (SH-) skupiny nebo histidinové řetězce
požadavky pro nevlastní fluorescenci
vysoká intenzita fluorescence
stabilita při ozařování
minimální vliv na biologické vlastnosti vzorku
značky mohou být
Rhodaminy, Fluorescein isothiocyanate (FITC), Cy značky (Cyanine dyes), Alexa Fluor Dyes (Molecular Probes)
Rhodaminy
historicky nejpoužívanější fluorescenční značky
převážně na protilátky
ve formě derivátů
vysoký kvantový výtěžek 0,3-0,8
photobleaching
tetramethylrhodamine isothiocyanate (TRITC)
ex. – 541nm, em. – 572nm
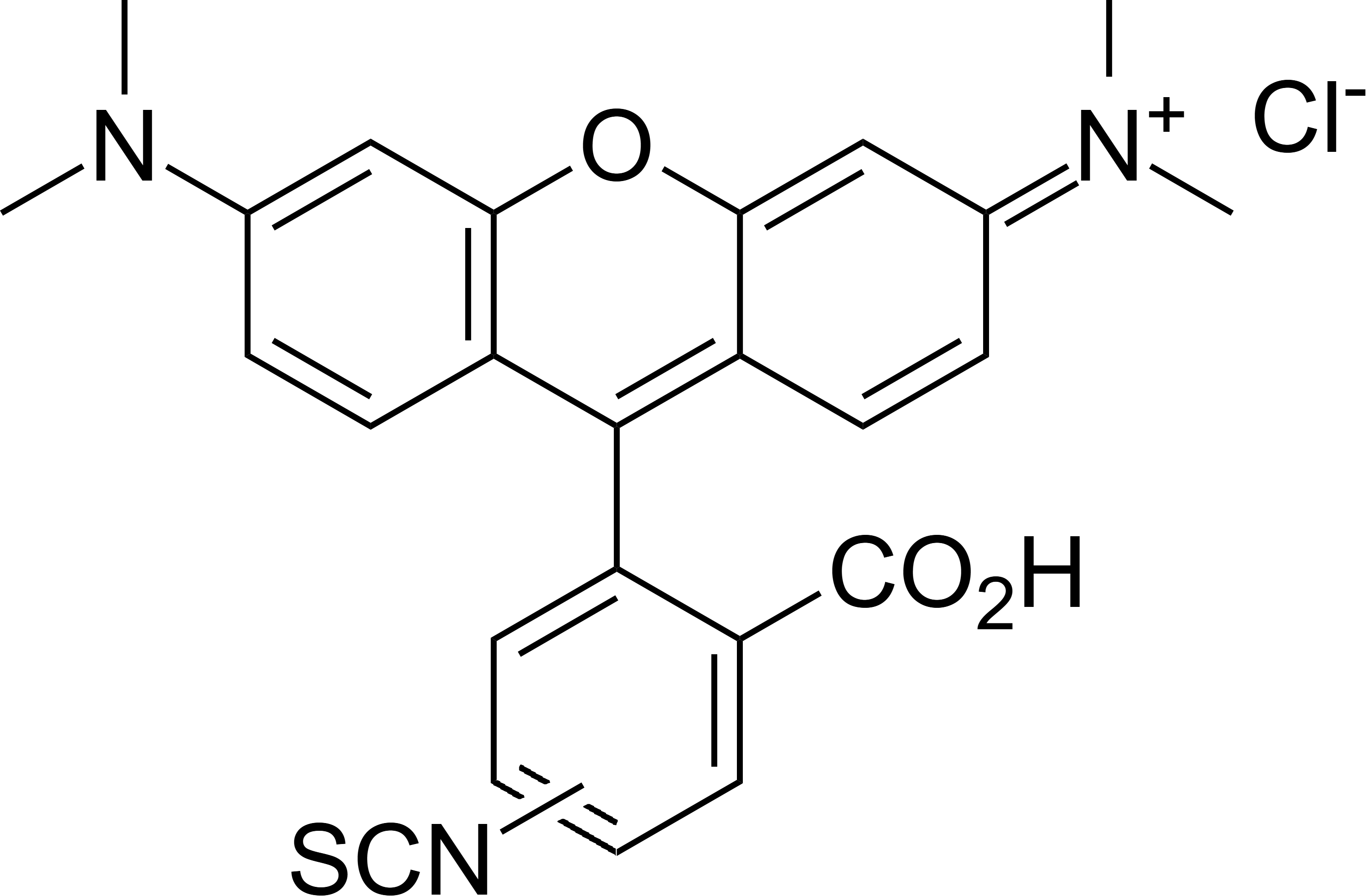
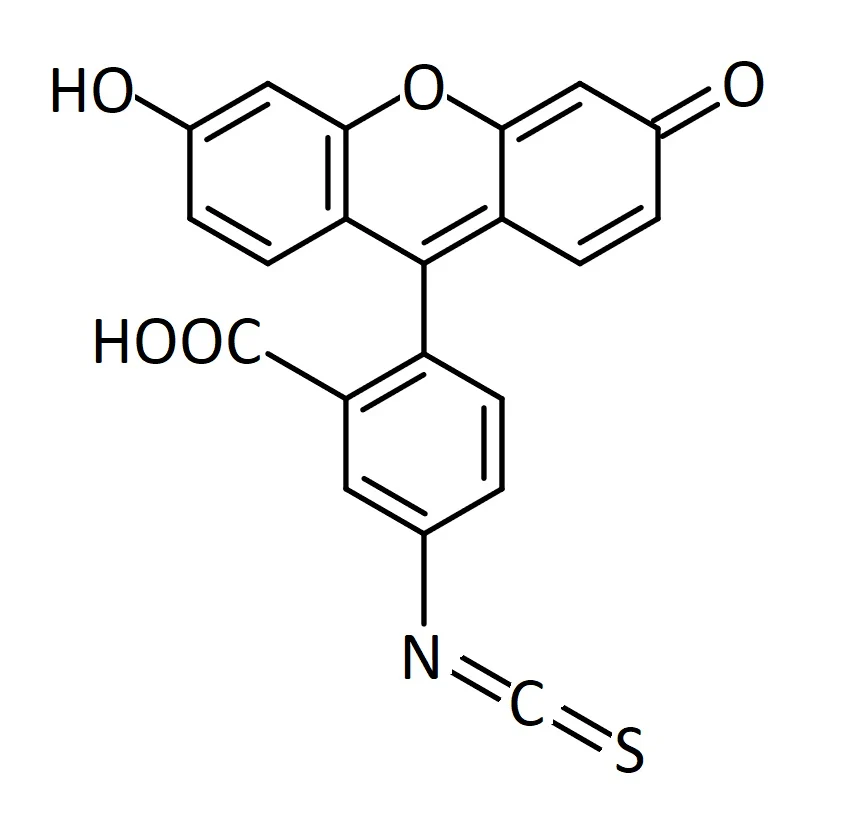
Fluorescein isothiocyanate (FITC)
ex. - 495 nm, em. - 521 nm
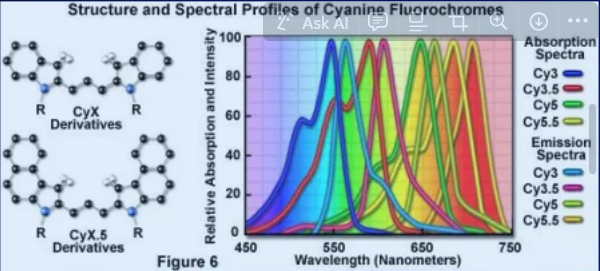
Cy značky (Cyanine dyes)
zástupci Cy2, Cy3, Cy3.5, Cy5, Cy5.5, Cy7
částečně nasycené heterocykly + další aromatická jádra
ex. a em. spektra podobná klasickým fluoroforům
kratší Stokesův posun (∼30nm)
fotostabilní
vyšší kvantový výtěžek
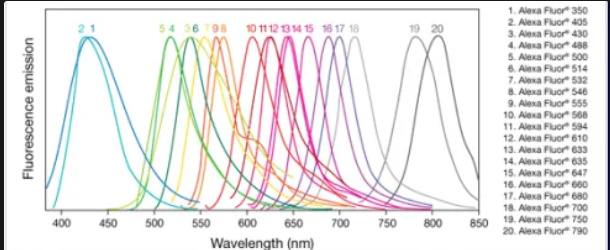
Alexa Fluor Dyes (Molecular Probes)
sulfonovaný derivát rhodaminu
vyšší kvantový výtěžek svítivost
zesílená fotostabilita (↓photobleaching)
pH stabilita
dlouhodobě stabilní
využití – živé buňky, tkáňové řezy, fixované preparáty
great variety of exc. a em. maxim
označení podle vlnové délky zdroje excitačního záření
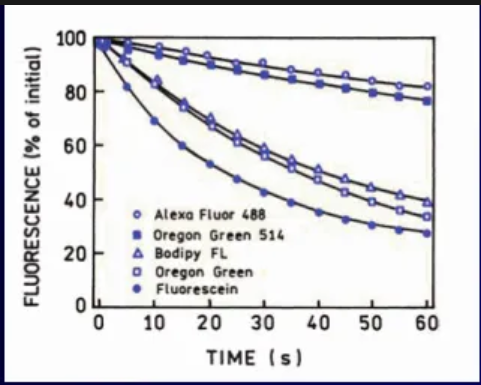
Fotostabilita fluorochromů
v každý fluorofor podléhá vysvícení v průběhu souvislého osvětlení
ve FM silná intenzita dopadajícího záření
nejstabilnější – značky Alexa Fluor
není znám princip předpovědi stability dle struktury
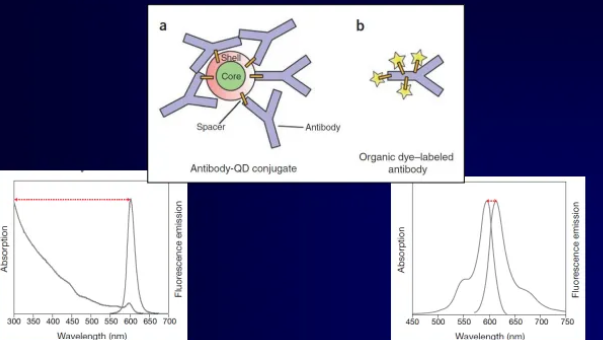
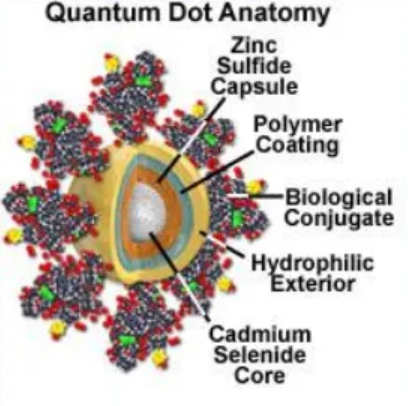
Quantum dots
florofory (značky) = po absorbci fotonů emitují
světlo o větší vlnové délce
anorganické nanokrystaly
velikost 10-20nm (GFP 4,2 x 2,4 nm)
složení quantum dots
jádro: několik 100x-1000x molekul polovodičového materiálu (Cd, Se, Te)
obal: polovodič (ZnS), stabilizuje jádro, zlepšuje optické a fyzikální vlastnosti
plášť: amfifilní polymer, umožňuje vazbu dalších molekul
vnější plášť: polyethylene glycol (PEG) – snižuje nespecifickou vazbu
Vlastnosti quantum dots
vlnová délka emise závisí na velikosti částice
umožňují vícebarevnou detekci jedním excitačním zdrojem
možnost konjugace s primárními i sekundárními protilátkami nebo streptavidinem
více molekul IgG na jednu částici
vyšší jas než klasické fluorofory
násobně vyšší stabilita
velký Stokesův shift
vazba QD na protilátku – srovnání s „klasickým“ konjugátem