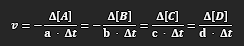VELIČINY - CHEMICKÁ TERMODYNAMIKA
1/13
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
14 Terms
SOUSTAVA (systém)
část prostoru s jeho hmotnou náplní oddělená od okolí skutečnými nebo smyšlenými hranicemi
typy soustav podle propustnosti hranic vůči energii a hmotě
OTEVŘENÁ – s okolím si vyměňuje částice i energii
UZAVŘENÁ – s okolím si vyměňuje pouze energii, nikoli částice
IZOLOVANÁ – s okolím si nevyměňuje částice ani energii
STAVOVÉ VELIČINY
popisují stav soustavy v daném okamžiku
závisí pouze na počátečním a koncovém stavu soustavy
dělíme je na:
extenzivní – lze je sčítat, závisí na velikosti soustavy, např.: m, V, n
intenzivní – nelze je sčítat, nezávisí na velikosti soustavy, např.: p, t,
TERMODYNAMICKÉ DĚJE PŘI KONST. STAV. VELIČINĚ:
izobarický
izobarický – konst. tlak
izotermický – konst. teplota
TERMOCHEMIE
zabývá se studiem tepelného zabarvení (změny tepla) chem. reakcí
(REAKČNÍ TEPLO, ENTALPIE, ENTALPIE)
REAKČNÍ TEPLO
= množství tepla, které soustava během reakce vymění s okolím
ENTALPIE
= rozdíl reakčního tepla reaktantů a produktů za stand. podmínek (kJ/mol)
extenzivní stav. vel., vyjadřuje množství tepelné energie v látce, nelze změřit, lze však vyčíslit její změnu v průběhu reakce, změna entalpie je rozdíl mezi entalpií reaktantů a produktů
reakce:
EXERGONICKÁ (exotermická) – energie (teplo) se uvolňuje do okolí
(E reaktantů > E produktů)
ENDERGONICKÁ (endotermická) – energie (teplo) se spotřebovává
(E reaktantů < E produktů)
TERMOCHEMICKÉ ZÁKONY:
1. Termochemický zákon (Lavoiser-Laplaceův)
reakční teplo reakce přímé a zpětné je stejné až na znaménko
2. Termochemický zákon (Hessův)
výsledné reakční teplo chemické reakce nezávisí na způsobu jejího průběhu, ale pouze na počátečním a konečném stavu
celkové reakční teplo vícestupňových reakcí je dáno součtem reakčních tepel všech dílčích reakcí
STANDARTNÍ SLUČOVACÍ TEPLO
ΔHslučovací0 = [kJ * mol-1 ]
› reakční teplo reakce, při které za standartních podmínek vznikne 1 mol sloučeniny
› standartní slučovací tepla prvků jsou nulová
STANDARTNÍ SPALNÉ TEPLO:
ΔHspalné0 = [ [kJ * mol-1 ]
reakční teplo reakce, při kterém je 1 mol látky spálen v nadbytku kyslíku za standartních podmínek
standartní spalná teplo konečných produktů (CO2, H2O) jsou nulová
CHEMICKÁ (REAKČNÍ) KINETIKA
studuje průběh chem. reakcí – rychlost, faktory ovlivňující rychlost
CHEM. REAKCE = srážky molekul reaktantů, po nichž následuje zánik některých vazeb a vytvoření vazeb nových
srážky molekul – 2 teorie:
TEORIE AKTIVOVANÝCH SRÁŽEK (SRÁŽKOVÁ TEORIE):
reakce podmíněna vzájemnou srážkou reaktantů a produktů
srážka musí být efektivní (molekuly musí být při srážce vhodně prostorově orientované a musí mít dostatečnou kinetickou energii)
AKTIVAČNÍ ENERGIE = energie, kterou musí molekuly reaktantů překonat, aby z nich mohly vzniknout produkty
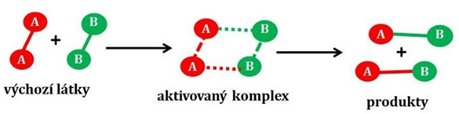
TEORIE AKTIVOVANÉHO KOMPLEXU:
dojde ke vzniknu aktivovaného komplexu původní vazby jsou oslabeny – energie se spotřebovává současně se nové vazby tvoří – energie se uvolňuje energie částic v průběhu se mění celková aktivační energie je nižší než u srážkové teorie |
REAKČNÍ RYCHLOST:
rychlost, kterou se spotřebovávají (ubývají) výchozí látky nebo kterou se tvoří produkty
= množství přeměněné energie za čas
jednotka: mol/s
pro rovnici aA + bB —> cC + dD
= změna koncentrace látky, a = stechiometrický koeficient
rychlost reakce přímé:
rychlost reakce zpětné: