CHEM. ROVNOVÁHA
1/8
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
9 Terms
CHEM. ROVNOVÁHA
je stav soustavy, v němž se nemění její chemické složení, i když v ní neustále probíhají chemické děje, účinky těchto dějů se navzájem ruší
ustavuje se pouze u reakcí, kde probíhají zvratné jevy
v průběhu reakce ubývá reaktantů a přibývá produktů reakce se postupně zpomaluje, až (ustaví se dynamická rovnováha)
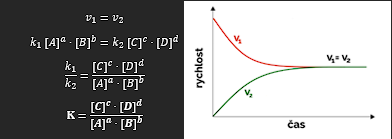
GULDBERGŮV – WAAGŮV ZÁKON:
popis rovnováhy pomocí rovnovážné konstanty reakce
rychlost chemické reakce je v každém okamžiku rovna koncentraci reaktantů
platí pro libovolný počet reaktantů a produktů
charakterizuje složení reakční směsi po dosažení chem. rovnováhy (předpovídáme, zda se reakci vyplatí provádět či nikoli)
K > 1 – reakce posunuta ve prospěch produktů
K = 1 – koncentrace produktů je rovna koncentraci reaktantů
K < 1 – reakce posunuta ve prospěch reaktantů
LE CHATELIERŮV PRINCIP:
aplikace principu akce a reakce na chem. rovnováhy
porušením rovnováhy vnějším zásahem (akcí) je vyvolán děj (reakce) směřující ke zrušení účinku vnějšího zásahu
akcí porušíme chem. rovnováhu reakcí se chem. rovnováha v soustavě obnoví
VNĚJŠÍ VLIVY OVLIVŇUJÍCÍ POSUN CHEM. ROVNOVÁHY:
ZMĚNA KONCENTRACE LÁTEK
zvýšení koncentrace reaktantů rovnováha posunutá vpravo (zvýšení rychlosti reakce)
(zvětšení jmenovatele rovnovážné konstanty musí se zvětšit i čitatel, aby byla zachována rovnováha)
snížením koncentrace reaktantů (zvýšením koncentrace produktů) rovnováha posunutá vlevo snížení rychlosti reakce
ZMĚNA TEPLOTY – mění se hodnota Kr:
zvýšení t podpoření rychlosti endotermické reakce (soustava přijímá teplo a my tak proces usnadníme)
snížení t podpoření rychlosti exotermické reakce
endotermická reakce:
zvýšení t zvětšení hodnoty K rovnováha posunuta doprava urychlení reakce
snížení t zmenšení hodnoty K rovnováha posunuta doleva snížení rychlosti reakce
exotermická reakce
zvýšení t zmenšení hodnoty K rovnováha posunuta doleva snížení rychlosti reakce
snížení t zvětšení hodnoty K rovnováha posunuta doprava urychlení reakce
ZMĚNA TLAKU
pouze u plynů
rovnováhu ovlivňuje pouze u reakcí, kde jsou rozdílné objemy reaktantů a produktů
zvýšení tlaku posunutí rovnováhy ve směru menšího objemu (moly)
snížení tlaku posunutí rovnováhy ve směru většího objemu (moly)
termochemické rovnice
jsou v nich vyjádřeny i skupenství látek
- (g) – plyny
- (l) – kapaliny
- (s) – pevné látky
ENTROPIE
= míra neuspořádanosti soustavy; čím je její hodnota vyšší, tím je soustava stabilnější