Orbitali
1/17
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
18 Terms
Forme degli orbitali
Orbitale s(L=0), orbitale p (L=1), orbitale d (L=2), orbitale f( L=3)
Numero massimo di elettroni per orbitale
S Max 2, p Max 6, d Max 10, f Max 14
Principio di aufbau
Gli orbitali vengono riempiti in ordine di energia crescente
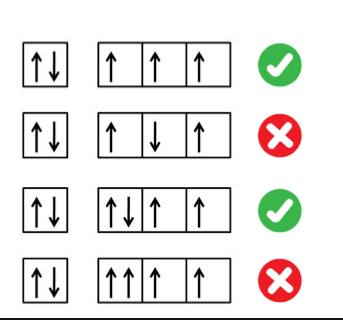
Principio di esclusione di parli
In un unico orbitale non possono trovarsi più di due elettroni e devono avere numero quantico di spin opposto
Principio di hund
Gli elettroni si distribuiscono singolarmente (tutti gli orbitali devono avere almeno un elettrone) negli orbitali degeneri (con la stessa energia) prima di accoppiarsi
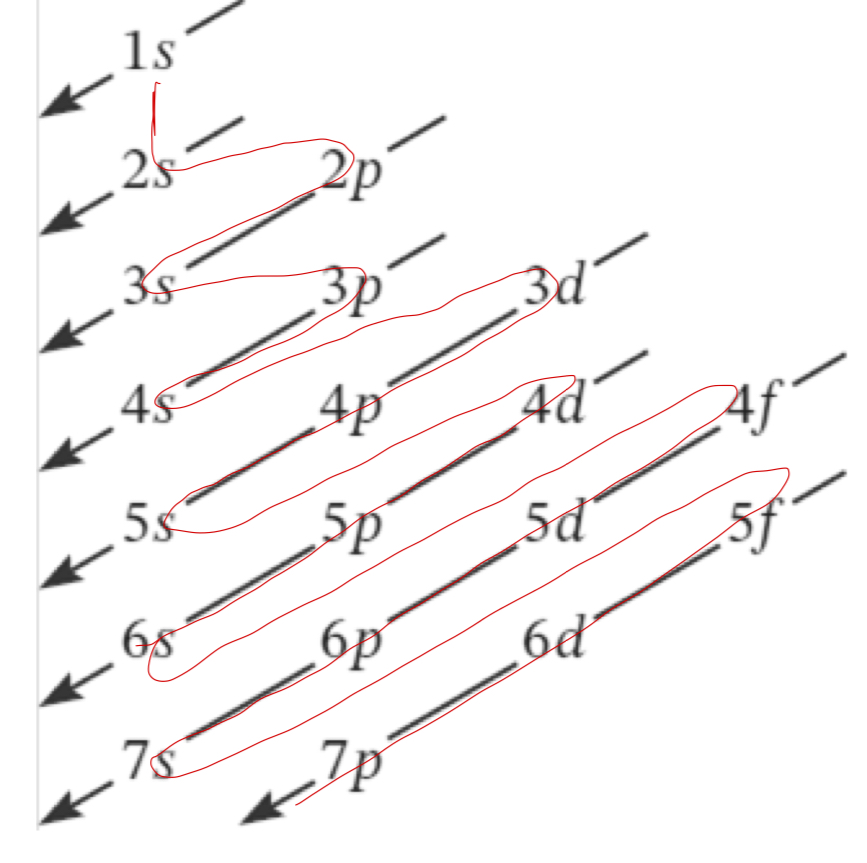
Ordine di riempimento
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, q4f, 5d,6p, 7s…..
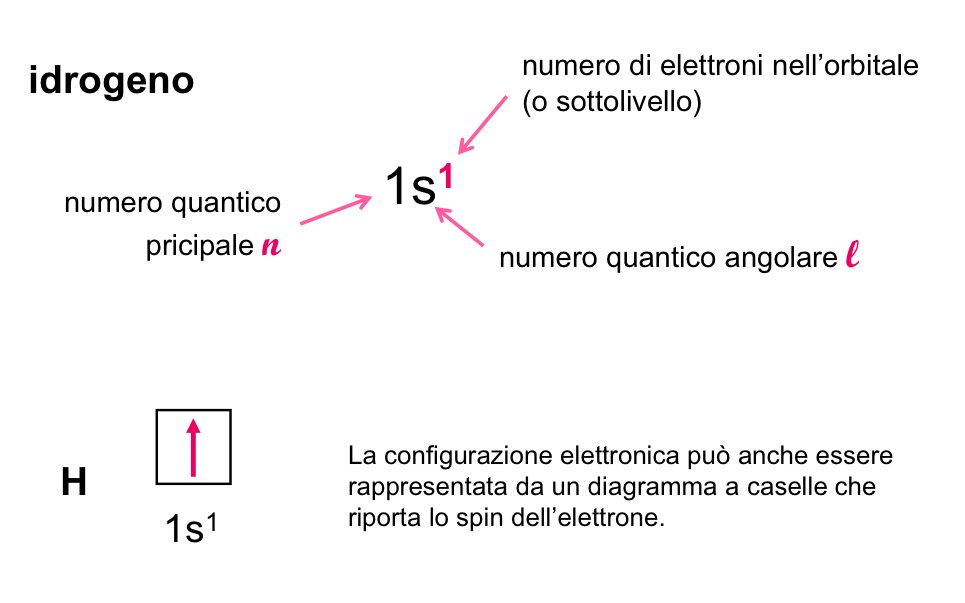
Configurazione elettronica
Il modo in cui gli elettroni sono distribuiti trai vari orbitali atomici
Sistema periodico
Organizzazione degli elementi chimici in base al numero atomico crescente e proprietà periodiche ricorrenti
Cosa sono i periodi
Righe orizzontali (1-7), indicano il livello energetico principale(n) dell’ultimo elettrone
Cosa sono i gruppi
Colonne verticali (1-18), gli elementi di uno stesso gruppo hanno lo stesso numero di elettroni di valenza, ossia comportamento chimico simile
Blocco S,p,d,f, significato
Identificato il tipo di orbitale dove si trova l’ultimo elettrone Blocco s → gruppi 1-2 Blocco p → gruppi 13-18 Blocco d → metalli di transizione. Blocco f → lantanidi e attinidi
Proprietà periodiche: raggio atomico
Aumenta lungo il gruppo, diminuisce lungo il periodo
Proprietà periodiche: energia di ionizzazione
Aumenta lungo il periodo, diminuisce lungo il gruppo
Proprietà periodiche: elettronegatività
Aumenta da sinistra a destra, diminuisce dall’altro in basso. (F è l’elemento più elettronegativo)
Proprietà periodiche: affinità elettronica
Quantità di energia rilasciata o assorbita quando un atomo acquista un elettrone.
Metalli, non metalli e semimetalli
Metalli: conduttivi, malleabili, tendono a perdere e⁻
Non metalli: isolanti, tendono ad acquistare e⁻
Semimetalli: proprietà intermedie
Numero di ossidazione e gruppi
Gli elementi del gruppo 1 hanno n.o. +1, gruppo 2 → +2
Il n.o. varia nei metalli di transizione e nei gruppi del blocco p
Gas nobili (gruppo 18)
Completano l’otteto (tranne he), inerti per configurazione stabile- ns²np⁶