Fiche 2 - Le tableau périodique
1/31
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
32 Terms
Quelles sont les propriétés des métaux?
Bons conducteurs thermiques et électriques
Ductiles et malléables
Éclat
Solides à la température ambiante, sauf le mercure
Réagissent au contact de l’acide
Quelles sont les propriétés des non-métaux?
Mauvais conducteurs thermiques et électriques
Plusieurs sont gazeux à température ambiante
Friables lorsque solide
Quelles sont les propriétés des métalloïdes?
Propriétés des métaux et des non-métaux, qui peuvent varier selon les conditions dans lesquelles ils se trouvent
Que représente une période?
Le nombre de couches électroniques
Qu’est-ce qu’on en commun les éléments d’une même famille?
Ils ont tous le même nombre d’électron de valence
Quel est le nom de la 1ère famille?
Les alcalins
Quel est le nom de la 3e famille?
La famille du Bore
Quel est le nom de 7e famille?
Les halogènes
Quel est le nom de la 8e famille
Les gaz inertes ou les gaz nobles
Quelles sont des propriétés des alcalins?
Métaux mous et très réactifs
Réagissent à l’humidité dans l’air
N’existent pas sous forme d’élément dans la nature
Quelles sont des propriétés des alcalino-terreux?
Métaux très malléables et réactifs
Brûlent facilement
N’existent pas sous forme d’élément dans la nature
Quelles sont des propriétés des halogènes?
Non-métaux qui réagissent facilement pour former des composés (entre autre sels)
Désinfectants puissants
Quelles sont des propriétés des gaz nobles?
Non-métaux très stables
On les retrouve tels quels dans la nature
Combien d’électrons de valence a un élément dans la famille du Carbone?
4
Combien d’électrons de valence a un élément dans la famille de l’Oxygène?
6
Combien d’électrons de valence a un élément des alcalino-terreux?
2
Combien d’électrons de valence a un élément des halogènes?
7
Combien de couches électroniques a l’hydrogène?
1
Quels sont des exemples de périodicité des propriétés?
Le point de fusion et d’ébullition, le rayon atomique, l’énergie de première ionisation, la masse volumique, l’électronégativité, etc.
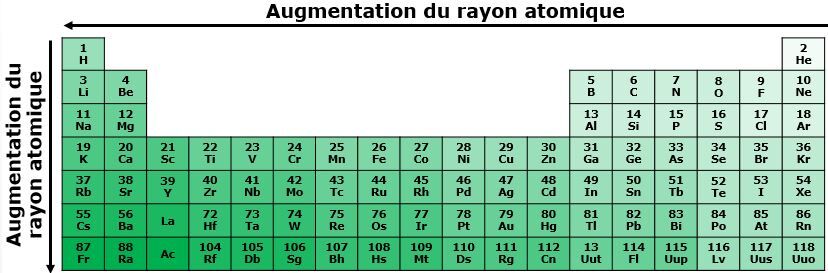
C’est quoi le rayon atomique?
Le rayon atomique représente le rayon de l’atome ou, en d'autres mots, le rayon de la sphère que forme l’atome.
De quelle façon augmente le rayon atomique dans le tableau périodique?
Dans une même période, le rayon atomique augmente de droite à gauche dans le tableau périodique. Lorsqu'on se déplace vers la droite, le numéro atomique augmente, ce qui signifie qu'un plus grand nombre de protons est présent dans le noyau. Ces charges positives exercent une force d'attraction plus grande sur les électrons situés sur les couches électroniques, ce qui les rapproche du noyau. Le rayon atomique est donc plus petit pour ces éléments.
Dans une même famille, le rayon atomique augmente de haut en bas dans le tableau périodique. En se déplaçant vers le bas du tableau périodique, le nombre de couches électroniques augmentent. Les électrons se retrouvent donc de plus en plus loin du noyau, ce qui contribue à l'augmentation du rayon atomique.
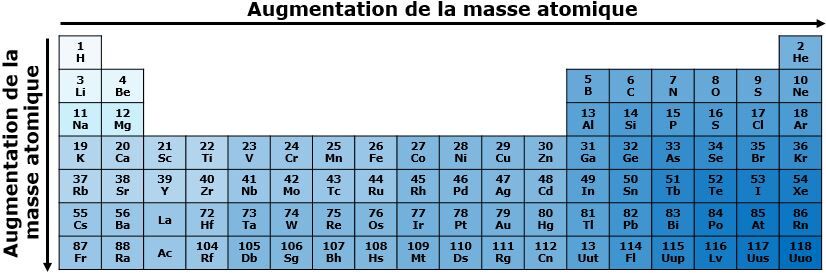
C’est quoi la masse atomique?
La masse atomique représente la masse de toutes les particules formant l'atome, soit les protons, les électrons et les neutrons.
De quelle façon augmente la masse atomique?
Dans une même période, la masse atomique augmente de gauche à droite dans le tableau périodique. Puisque le nombre de particules de l’atome augmente de gauche à droite avec le numéro atomique, la masse atomique augmente également dans la même direction, car un plus grand nombre de particules implique nécessairement une plus grande masse.
Dans une même famille, la masse atomique augmente de haut en bas dans le tableau périodique. Comme le numéro atomique augmente de haut en bas, un plus grand nombre de protons se retrouvent dans les atomes situés dans le bas du tableau périodique, ce qui implique nécessairement une plus grande masse atomique.
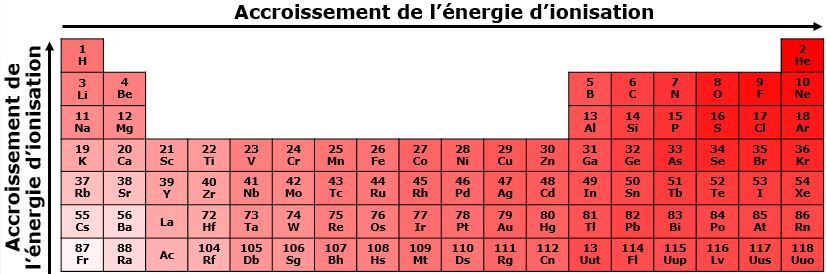
C’est quoi l’énergie de première ionisation?
L'énergie d'ionisation représente l’énergie nécessaire pour arracher un électron à un atome.
Comment augmente l’énergie d’ionisation?
De manière générale, dans une même période, l'énergie d'ionisation augmente de gauche à droite dans le tableau périodique. Dans les atomes situés à droite, le noyau atomique exerce une plus grande force sur les électrons. Ces électrons nécessitent donc une plus grande quantité d'énergie pour qu'ils soient arrachés. À l'opposé, les atomes situés à gauche dans le tableau périodique exercent une force plus faible sur les électrons, car les électrons sont plus loin du noyau et qu'un plus petit nombre de protons est présent dans le noyau.
De manière générale, dans une même famille, l'énergie d'ionisation augmente du bas vers le haut du tableau périodique. La quantité d'énergie nécessaire pour retirer un électron est plus petite pour les éléments du bas du tableau, car la force d'attraction entre les électrons de valence et le noyau est plus petite. Ces électrons étant moins attirés, il est plus facile de les arracher que dans un élément situé dans le haut du tableau.
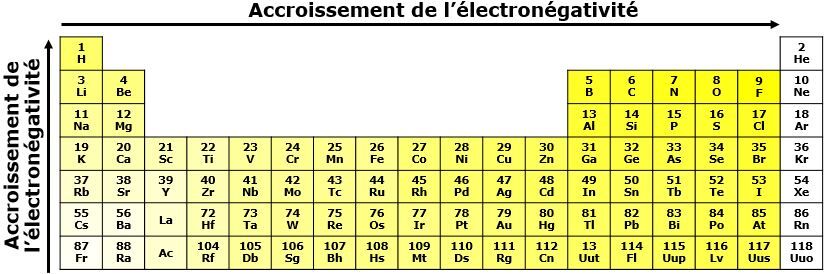
C’est quoi l’électronégativité?
L'électronégativité est la force avec laquelle le noyau d’un atome attire les électrons impliqués dans une liaison chimique.
Comment augmente l’électronégativité?
Dans une même période, l'électronégativité augmente de gauche à droite dans le tableau périodique. Au fur et à mesure que l'on se déplace vers la droite, les atomes ont tendance à gagner des électrons afin d'acquérir une configuration électronique stable. Ainsi, les non-métaux ont une plus forte tendance à acquérir des électrons, alors que cette tendance est plus faible pour les éléments à gauche.
Dans une même famille, l'électronégativité augmente du bas vers le haut du tableau périodique. Puisque les atomes du bas du tableau périodique sont plus gros, la force d'attraction exercée par le noyau est plus faible étant donné la plus grande distance entre les charges positives du noyau et les électrons situés sur la dernière couche électronique. Par conséquent, plus l'atome est grand, plus l'électronégativité diminue.
!! Gaz inertes = aucune électronégativité !!
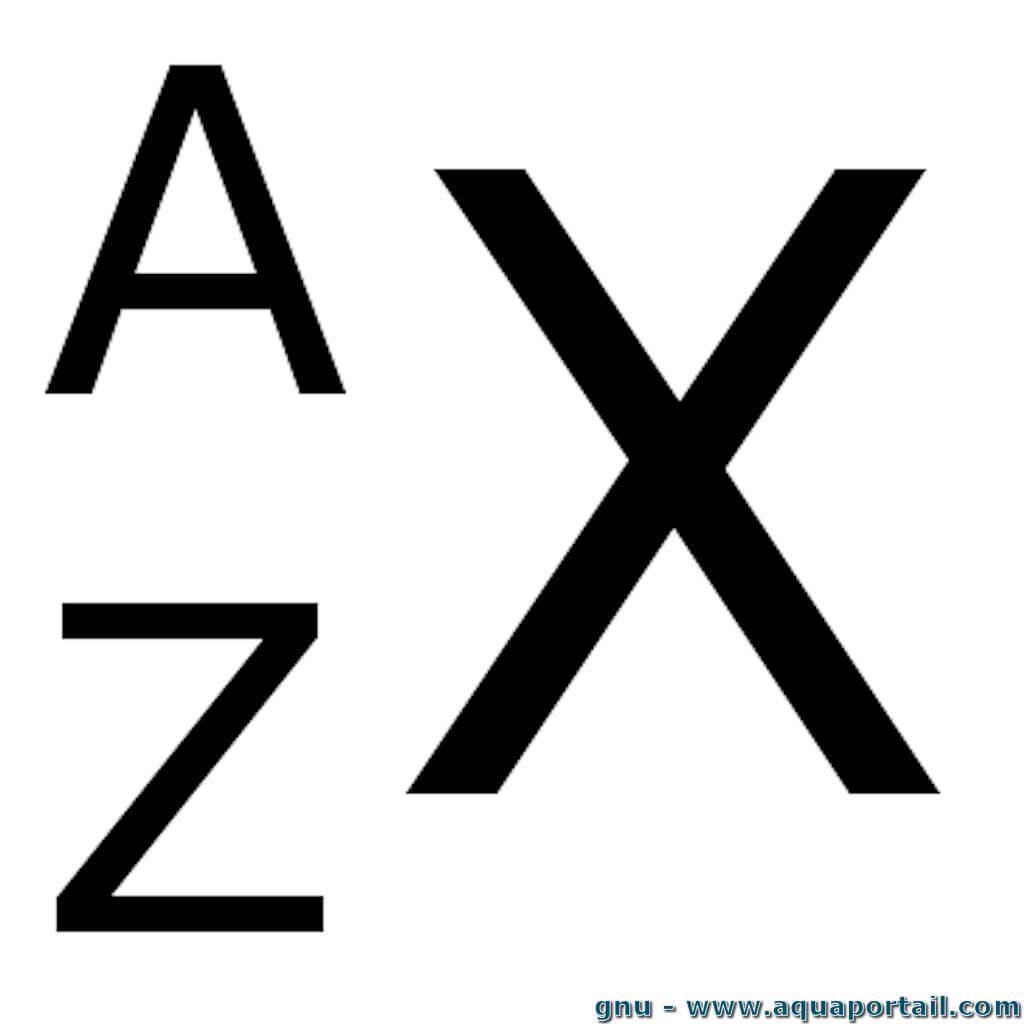
Que représente le A dans cette notation?
Le nombre de masse (protons + neutrons)
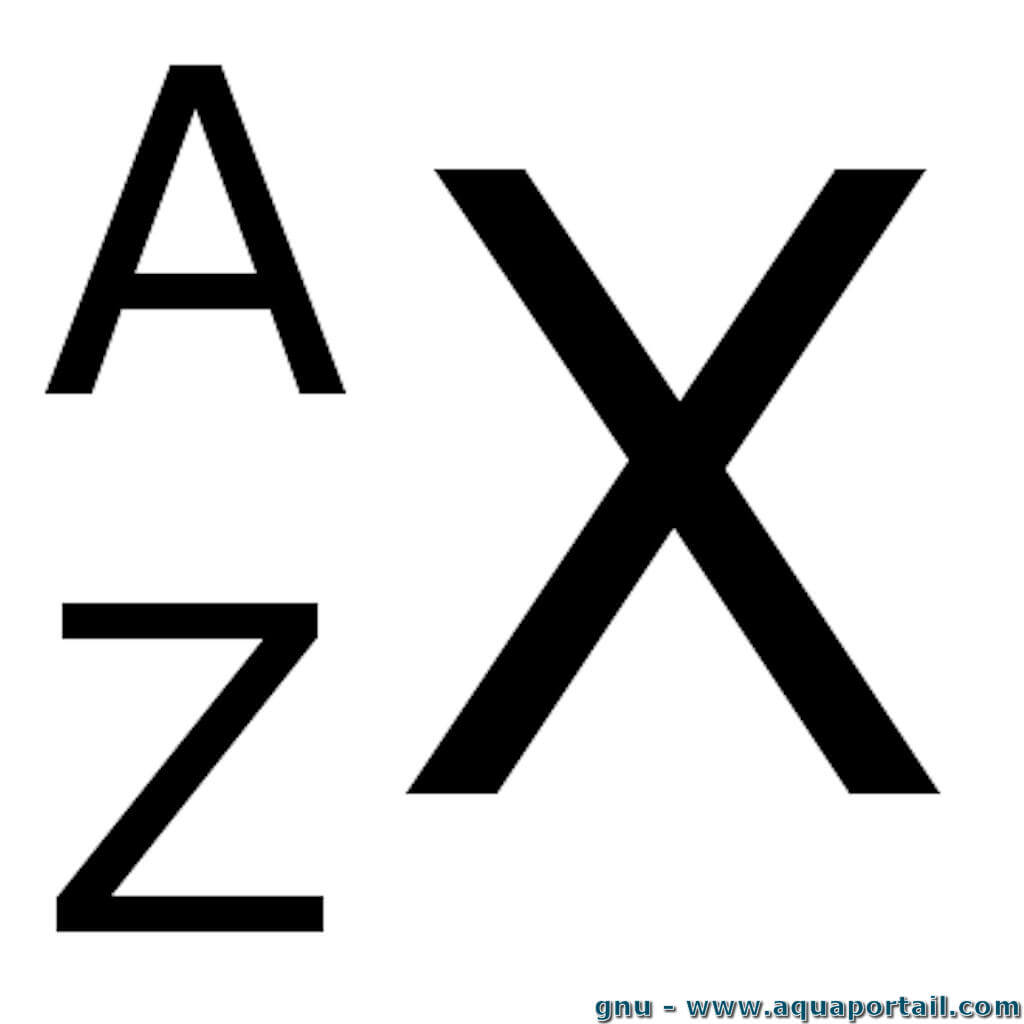
Que représente le Z dans cette notation?
Le numéro atomique
Un isotope a un nombre différent de:
1) neutrons
2) protons
3) électrons
1) neutrons
Vrai ou faux?
Les masses volumiques du tableau périodique sont des moyennes?
Vrai! Ce sont des moyennes qui tiennent compte de la proportion des différents éléments de la nature
Quelle est la formule de la masse atomique relative?
Masse atomique relative = (m de l’isotope x quantité atome de l’isotope) + (m de l’isotope x quantité atome de l’isotope) / nombre total d’atomes