zellbiologie 6
1/8
Earn XP
Description and Tags
protein degradation -- page 7/20
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
9 Terms
on a deux grandes techniques de dégradation des protéines selon la quantité à dégrader
peu de protéine
→ protéasome qui se trouve dans le cytosol
l’ouverture du protéasome est petite et il faut 1) déplier la protéine et 2) la transporter activement
beaucoup de protéine
→ dans le lysosome, organelle avec le pH le plus faible
il y a plusieurs technique pour importer des choses dans le lysosome, on en reparlera plus tard. L’avantage c’est qu’on peut dégrader plusieurs protéines en même temps et même des organelles entières
plus de détail sur le protéasome 26S
il est composé de deux sous-unité:
coeur catalytique 20S
cylindrique et formé de quatre anneaux empilés, les deux anneaux extérieurs sont composés de 7 unité α et les deux anneaux intérieurs sont composés de 7 unité β
les centres catalytiques (3) sont situés dans les anneaux β
particules régulatrices 19S
situées aux extrémités, elles reconnaissent les protéines polyubiquitinée, les déplient et les introduit dans le coeur catalytique
elles contiennet des ATPases qui emploient l’énergie de l’ATP pour
ubiquitin
c’est une petite protéine, on les fixe sur les protéines que l’ont doit dégrader. La région 19S du protéasome les reconnait et les détache de la protéine. Les ubiquitine ne sont donc pas dégradées dans le protéasome et elles sont recyclées
protéasome et ATP
la première étape c’est de déplier et faire entrer la protéine dans le protéasome, pour cela on a besoin d’ATP qui se fait hydrolyser → on déplie un peu la protéine. Ensuite on change le vieux ADP avec un nouvel ATP, celui ci tire la protéine dans le protéasome.
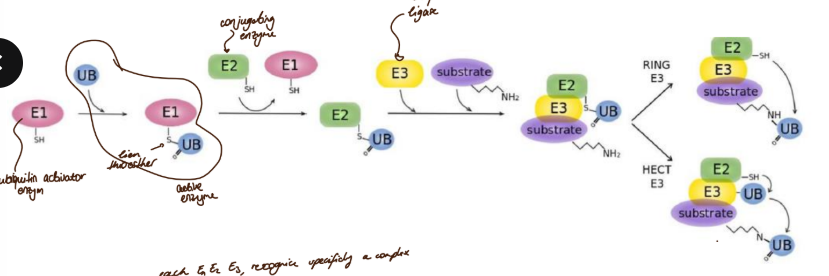
Ubiquitination of proteins
une enzyme E1 (ubiquitin activator enzym) lie une ubiquitine. Un lien thioesther se forme
une deuxième enzyme E2 (conjugation enzym) prend la place de E1 et se lie à l’ubiquitin
une troisième enzyme E3 (ubiquitine ligase) intervient, elle rapproche le substat avec la E2 chargée
liaison de l’ubiquitine
soit en une étape, l’ubiquitine passe de la E2 à la partie N terminale du substrat
soit en deux étapes, l’ubiquitine passe de la E2 à la E3, puis de E3 au substrat
on doit fait ce cycle 4 fois, afin de fixer assez d’ubiquitine et de rendre visible le signal
Non-degradative proteasomal digestion
parfois après la digestion de protéine on se retrouve avec des peptides, ceux ci rentrent dans le RE, se fixe à un MHC (protéines du système immunitaire)
C’est MHC vont aller sur la membrane plasmique et montrer à l’extérieur de la cellule le genre de peptide produit. Les T cell passent par là, si elles ne détectent que nos peptides, tout va bien. En revanche si on a une infection virale, on dégrade aussi les protéines de virus, elles sont aussi présentées mais elles ne passent pas le teste
type de transport dans le lysosome — type d’autophagy
chaperone-mediated autophagy
on a un canal qui importe les protéines dans le lysosome
c’est un peu comme le protéasome pathway, on peut importer dans le lysosome qu’une protéine — unfolded— à la fois.
microautophagy
il y a une invagination de la membrane puis une formation de vésicule en pincant l’invagination puis les enzymes dégradent non seulement le contenu de la vésicule mais aussi sa membrane parce qu’elle n’est pas “sensée” être là
macroautophagy
formation d’une nouvelle vésicule et membrane qui emprisonne les protéines ou les organelles, ensuite il y a une fusion et les choses à dégradées sont mises dans le lysosome.
c’est comme ça qu’on dégrade les ubiquitine
il faut construire une vésicule à double membrane, les LC3 collent les protéines/organelles cibles. Ensuite il y a la fusion entre la membrane externe et un lysosome. La membrane interne et le contenu de la vésicule est dégradé.
formation d’autophagosome
en fait c’est important de savoir que cette vésicule est destinée à la poubelle (lysosome), les protéines on le label avec quatre ubiquinine, les vésicules avec des LC3 II, ce sont des protéines
on fixe le marqueur sur un lipide
on peut vraiment faire un parallèle avec l’ubiquitination d’une protéine, il y a d’abord une enzyme comme E1 qui se fixe, ensuite la protéine marqueur remplie le complexe. Une enzyme comme E2 remplace la première finalement une enzyme agit comme ligase. Il faut former LC3 II car elle n’a qu’un précurseur au début
modificateurs de type ubiquitine (UBLs)
famille de protéines qui partagent une structure tridimensionnelle similaire à l'ubiquitine — ressemble à un poing. Ils jouent un rôle crucial dans la régulation de divers processus cellulaires, souvent en modifiant de manière covalente les protéines cibles
un exemple c’est les LC3 dont on a déjà parlé