Volumen, Dichte, Anteilsberechnung
1/30
There's no tags or description
Looks like no tags are added yet.
Name | Mastery | Learn | Test | Matching | Spaced | Call with Kai |
|---|
No analytics yet
Send a link to your students to track their progress
31 Terms
Justierung

Wartezeit

Gerätefehler

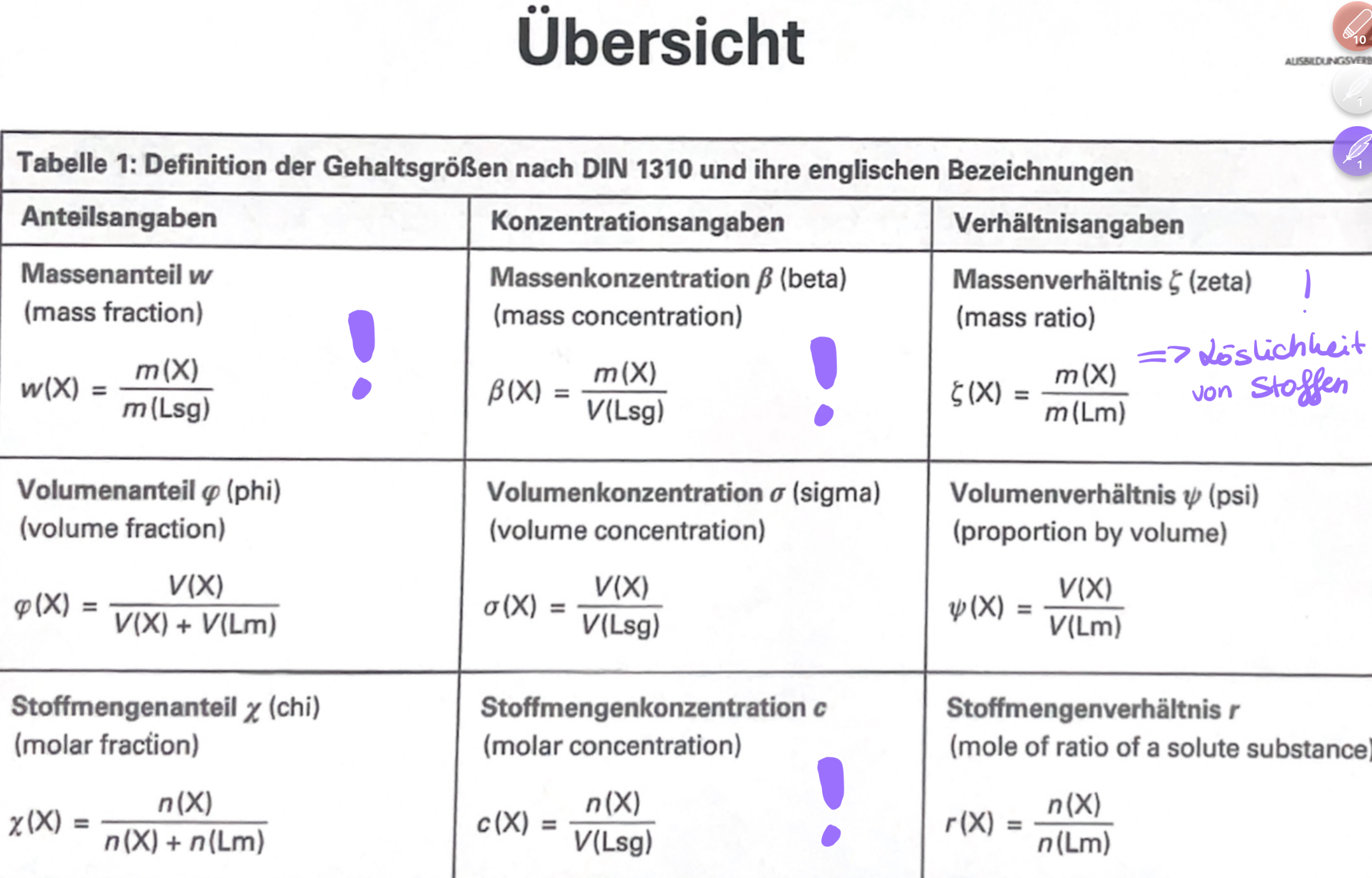
Massenanteil, Massenkonzentration & Stoffmengenkonzentration Formel
Fehlerquellen beim Volumenmessen

Piknometer Definition

Messungen mit Pyknometer

Volumenkontraktion Definition
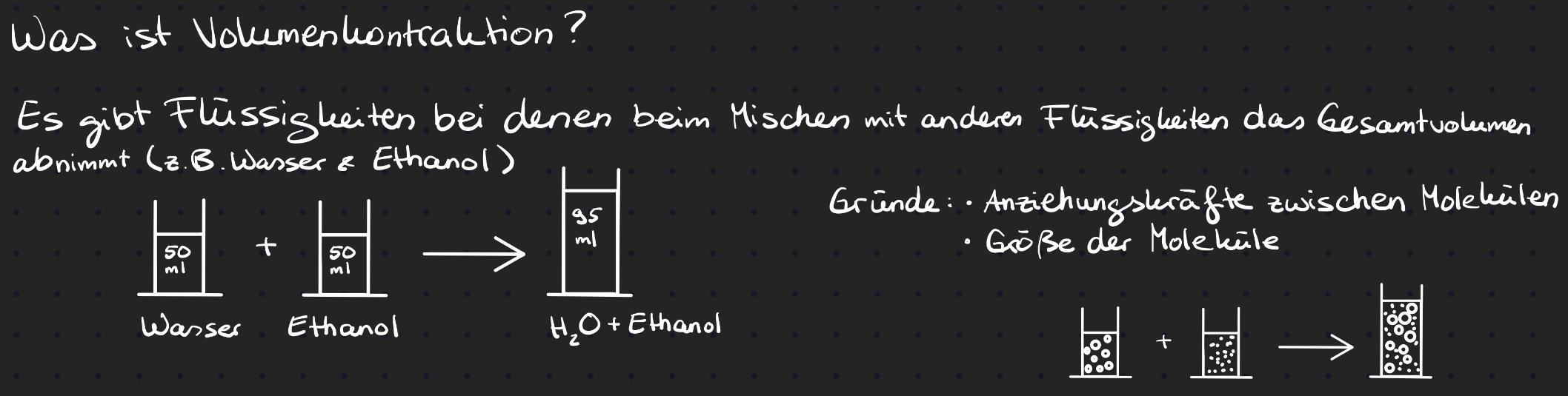
Gehaltsgrößen von Mischphasen

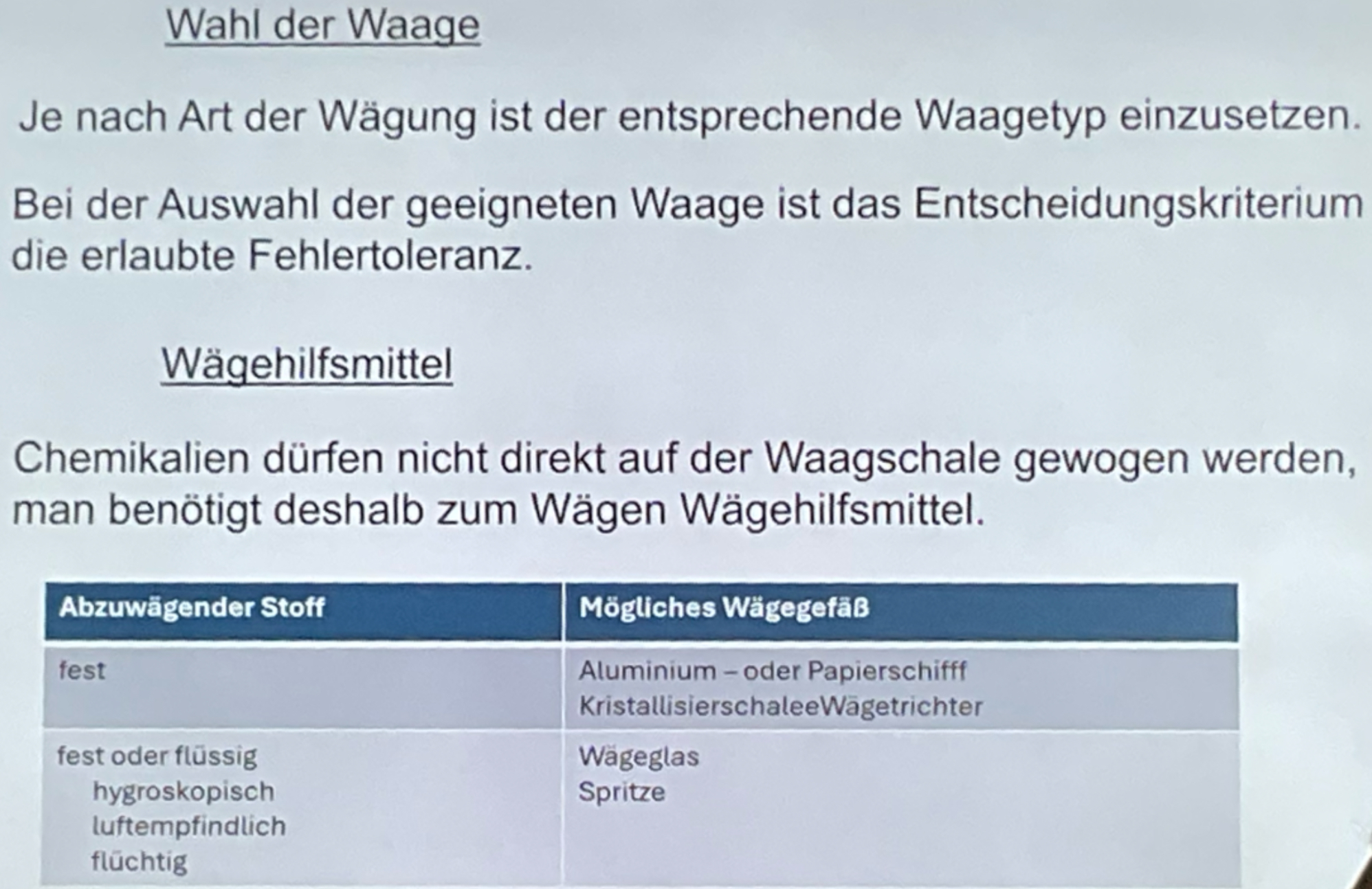
Wägehilfsmittel
Aräometer

richtiges Pipettieren mit vollpipette
Fehler beim Pipettieren
Volumenmessgeräte
Beschreibe kurz die Schritte, wie eine Bürette korrekt & auf Nullwert eingestellt wird
Bürettentrichter aufsetzen
Bürette mit Lösung vorspülen
Trichter entfernen
Lösung auf 0 ablassen
Was passiert bei exothermen Reaktion?
Es wird Energie frei
Beschreibe kurz, in Strichpunkten die Dichtebestimmung einer Flüssigkeit mit Pyknometer dessen Volumen bekannt ist.
Pyknometer leer wiegen → Tara
Flüssigkeit temperieren
Pyknometer (ca 0,5 Schliff)
Stopfen aufsetzen, Wasser abstreifen
Pyknometer abtrocknen & auswiegen
In 750g Wasser werden 75g Kochsalz gelöst. Wie groß ist der Salz-Anteil der Lösung in %?
w(Salz)= m : mges • 100%
w(Salz)= 75g : 825g • 100% = 9,09%
Was passiert bei einer endothermen Reaktion?
Energie wird aufgenommen
Beschreibe, wie du 100g einer Lösung mit Massenanteil w(Salz)=6% herstellen
Es werden 6g Salz eingewogen und diese in 94g Wasser (94ml) gelöst
Nenne 2 Kenndaten, die auf einem Messkolben stehen
Nennvolumen
Genauigkeitsklasse
Wieviel g Natriumsulfat und wieviel g Wasser benötigt man zum Herstellen von 1350g einer Natriumsulfatlösung, w(Natriumsulfat)=0,152?
Formeln: mSalz = w • mLösung
mWasser = mLösung - mSalz
mSalz = 0,152 • 1350g = 205,2g
mWasser = 1350g - 205,2g = 1.144,8 g
Ergebnis: Natriumsulfat: 205,2g
Wasser: 1144,8g
Welche Stoffmangenkonzentration c(NaCl) hat eine Natriumchlorid-Lösung, die durch Lösen von 15g NaCl und anschließendes Auffüllen im Messkolben auf 500ml erhalten wird?
Formeln: c=n:V mit n=m/M
molare Masse von NaCl: 58,44g/mol
Stoffmenge berechnen: n=15/58,44 =0,257 mol
Konzentration berechnen: c=0,257/0,5=0,514 mol/L
285l wässrige Ethanol-Lösung enthalten 16 mol Ethanol. Welche Stoffmengenkonzentration c(Ethanol) enthält die Mischphase?
Formeln: c=n/V=16/285=0,0561 mol/L
In 250ml wässrige Fructose-Lösung sind 135mg Fructose enthalten. Berechne die Massenkonzentration ß(Fructose).
ß=m/V=0,135g/0,25L=0,54 g/L
Berechne die Massenkonzentration ß(Cu) einer Lösung, die durch Lösen von 11,5g Kupfersulfat CuSO4 und anschließendes Auffüllen im Messkolben auf 2l erhalten wird.
Molmassen von Kupfer: w(Cu)=M(Cu)/M(CuSO4)=63,55/159,61=0,398
Masse von Cu: m(Cu)= 11,5 • 0,398 = 4,577g
Massenkonzentration ß(Cu): ß(Cu)=m(cu)/V=4,577/2=2,2885g/L
SI-Basiseinheiten Tabelle
Volumenmessgeräte die idR auf IN justiert sind
Messkolben
Pyknometer
Messzylinder
Nenn- und Teilvolumen
Nennvolumen: Volumen auf Gerät kalibriert ist
Teilvolumen: Volumenangaben, welche Teil vom Gesamtvolumen sind & auf Gerät markiert sind
DEF Ablaufzeit
Zeit in welcher die Flüssigkeit zb Pipette herausläuft
Umgang mit Vollpipette
Pipette auf Schäden & Verunreinigungen prüfen
Überprüfen Temperatur Lösung
Lösungen aufziehen
Pipette senkrecht halten
Aufziehen Flüssigkeit über ringmarke
Nicht in pipettierhilfe saugen
Pipette mit Papier abwischen
Flüssigkeitsspiegel auf ringmarke absenken → flüssig in Abfallglas
Tropfen abstreifen (Glaswand)
Flüssigkeit in entsprechende Gefäß ablassen
immer senkrecht Pipette mit Kontakt zur Gefäßwand halten
Letzten Tropfen abstreifen
Wartezeit bei AS-Pipetten abwarten & wieder letzten Tropfen abstreifen