thermodynamique chimique
0.0(0)
Card Sorting
1/75
Earn XP
Description and Tags
Study Analytics
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
76 Terms
1
New cards
thermodynamique ?
échanges d’énergies et permet de quantifier les échanges de chaleur enregistrer lors d’une réaction chimique
2
New cards
réaction
constitué de réactifs + des flèches + des produits
φA A + φB B ⇌ φC C + φD D où φ= coefficient stœchiométrique
φA A + φB B ⇌ φC C + φD D où φ= coefficient stœchiométrique
3
New cards
réaction totale
avec -→ il n’y a plus de réactifs, pas de cste d’équilibre
4
New cards
réaction d’équilibre
avec ⇌; on peut déterminer une cste d’équilibre
rq : ts les réactions de combustion ont une cste d’équilibre
rq : ts les réactions de combustion ont une cste d’équilibre
5
New cards
état initial
mélange des constituants avant la réaction
6
New cards
état final
mélange des constituants après la réaction
7
New cards
réaction chimique
= transformation de la matière
8
New cards
au cours d’une réaction chimique, il y a conversation de la matière cad….
* conservation des atomes
* conservation de la charge
* conservation de la masse
* conservation de la charge
* conservation de la masse
9
New cards
tableau d’avancement
on définit ξ = x comme l’avancement de réaction.

10
New cards
système chimique def:
la partie de l’Univers où se produit la réaction étudiée

11
New cards
échange de matière dans un système ouvert ?
oui
12
New cards
échange d’énergie dans un sys ouvert ?
oui
13
New cards
échange de matière dans un sys fermé
non
14
New cards
échange d’énergie dans un sys fermé
oui
15
New cards
échange de matière dans un sys isolé
non
16
New cards
échange d’énergie dans un sys fermé
non
17
New cards
récap
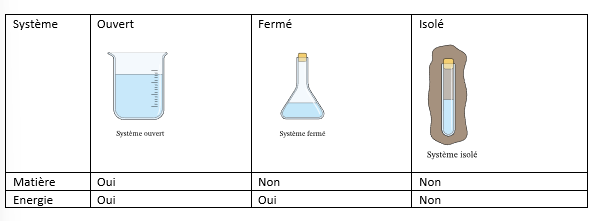
18
New cards
signe d’un système qui reçoit
positif +
19
New cards
signe d’un système donne
négatif -
20
New cards
grandeurs extensifs
proportionnels à la tailles du système (masse, volume,n,…)
21
New cards
grandeurs intensifs
indépendants de la taille du systèmes comme T°, pression, la masse volumique, la concentration …
22
New cards
remarque entre 2 grandeurs extensifs
donne une grandeur intensive
23
New cards
savoir M(C), M(O), et M(H) respectivement
12 g/mol; 16 g/mol et 1 g/mol
24
New cards
au cours d’une dilution formule
n(mère)= n(fille) => Cm × Vm = Cf × Vf
25
New cards
facteur de dilution
F = Vf/ Vm = Cm /Cf
26
New cards
fonction d’état
fonction d’état toute grandeur dont la variation au cours d’une transformation ne dépend de l’état initial et de l’état final du système considéré. Cad qu’il ne dépend pas du chemin parcourue.
27
New cards
équation d’état
exemple loi des gaz parfaits PV = nRT attention aux unités
28
New cards
volume molaire
Vn = 24,5 L/mol
29
New cards
transformations à volume cste
isochore
30
New cards
transformations à T° cste
isotherme
31
New cards
transformation à P° cste
isobare
32
New cards
système adiabatique
pas d’échange d’énergie avec l’extérieur
33
New cards
états d’équilibre conditions :
* Pour chaque phase qui le constitue, les variables d’états n’évoluent pas du cours du temps
* Et si les grandeurs intensifs ont la même valeur en tt point du système
Etat d’équilibre = état final
* Et si les grandeurs intensifs ont la même valeur en tt point du système
Etat d’équilibre = état final
34
New cards
énergie cinétique et énergie potentiel csq si le système est immobile
elles sont nulles.
35
New cards
énergie interne U
regroupe l’énergie thermique + l’énergie chimique + le travail mécanique des forces de pression
36
New cards
énergie thermique
est notée Q en J
37
New cards
transformation avec variation de T° ss chgt d’état
Q = C × ∆T où Q en J et T = variation de T° (en K)
38
New cards
C capacité calorifique du sys en J/K
Elle correspond à la quantité de chaleur nécessaire pour faire varier la T° du sys de 1°C.
grandeur extensive
grandeur extensive
39
New cards
capacités calorifiques en J/K/mol (1)
Q = n × C × ∆T
40
New cards
capacité calorifique en J/K/g (2)
Q= m × C × ∆T
41
New cards
dans les conditions (1) et (2)
C est une grandeur intensive
42
New cards
notation capacité calorifique à P° cste
cp
43
New cards
notation capacité calorifique à V cste
cv
44
New cards
si les phases sont condensés = solides ou liquide
cp = CV
45
New cards
si les phases sont gazeuses
cp - cv = nR
46
New cards
Transformation sans variation de T° avec un changement d’état
Q = m × L (kJ/g) ou n × L (kJ/mol) avec L la chaleur latente de changement d’état
47
New cards
L chaleur latente
correspond à la Q° de chaleur nécessaire pour passer d’un état à un autre.
48
New cards
1er principe de la thermodynamique
Le 1er principe de la thermodynamique affirme le caractère indestructible de l’énergie, cad qu’in va avoir conservation de l’énergie interne.
49
New cards
formule du 1er principe
Système isolé ∆U = Uef – Uei = 0
Système fermé : ∆U = W + Q avec W = -P∆V
à V° cste ; W=0 donc ∆U= Qv
à P° cste ; ∆U = W + Q
Système fermé : ∆U = W + Q avec W = -P∆V
à V° cste ; W=0 donc ∆U= Qv
à P° cste ; ∆U = W + Q
50
New cards
enthalpie H
H = U +PV
H est une fonction d’état
H est une fonction d’état
51
New cards
convention de signe sur H si le système dégage de l’énergie
∆ H < 0 : exothermique
52
New cards
convention de signe sur H si le système reçoit de l’énergie
∆ H > 0 : endothermique
53
New cards
si le système est à l’équilibre alors ∆ H est
= 0
54
New cards
loi de HESS
Si une réaction est une combinaison linéaire de n autres réaction alors son enthalpie de réaction sera égale à la combinaison linéaire des enthalpies de n réactions impliqués.
55
New cards
réaction de formation d’un composé à partir de
O2; C ;N2; H2
56
New cards
variation d’enthalpie standards de formation notée
ΔH°f
57
New cards
réaction de combustion d’un composé à partir et donne ?
combustible + O2 -→ CO2 + H20
58
New cards
variation d’enthalpie standard de combustion notée
ΔH°c
59
New cards
calculer ΔH°r à partir ΔH°f
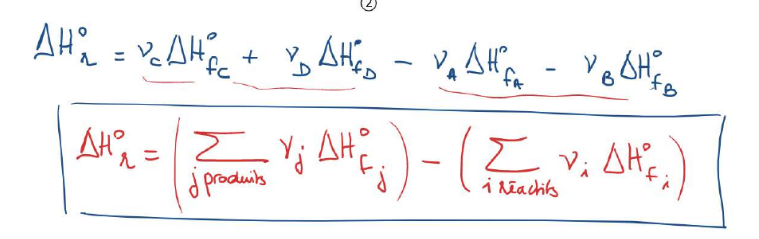
60
New cards
calculer ΔH°r à partir ΔH°c
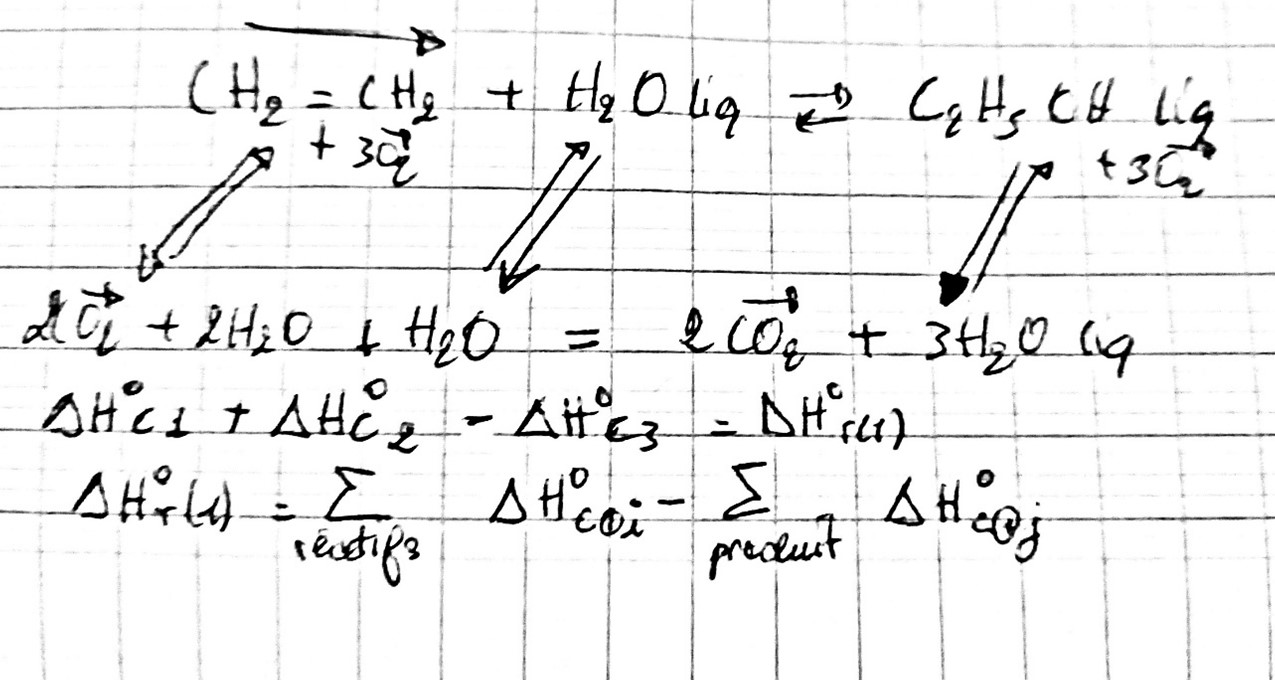
61
New cards
enthalpie standard de changement d’état
* solide à liquide → réaction endothermique ΔH° fusion> 0
* liquide à gazeux → réaction endothermique ΔH°vapo>0
* solide à gazeux → réaction endothermique ΔH°sublimation>0
* liquide à gazeux → réaction endothermique ΔH°vapo>0
* solide à gazeux → réaction endothermique ΔH°sublimation>0
62
New cards
d’après la loi de Hess, ΔH°sublimation =
ΔH°fusion + ΔH°vapo
63
New cards
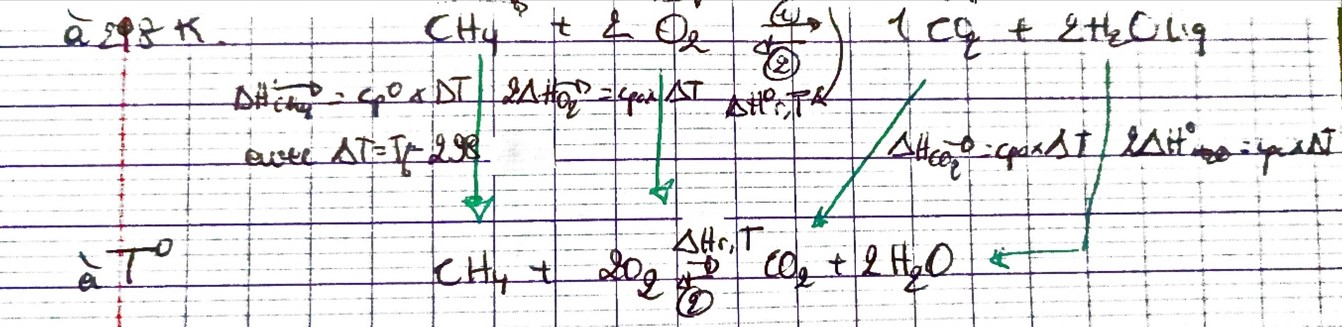
loi de Kirchoff

64
New cards
soit la fonction entropie
* notée S
* notion de désordre
* ΔS > 0 → augmentation du désordre
* notion de désordre
* ΔS > 0 → augmentation du désordre
65
New cards
à t = cste, ΔS =
Q / T où Q en J et T en K
66
New cards
enthalpie absolue standards molaire
* S fonction d’état, grandeur extensive, absolue
* S° d’un composé dans un tableau
* unité : J/K/mol
* S° d’un composé dans un tableau
* unité : J/K/mol
67
New cards
variation d’entropie standards de réaction
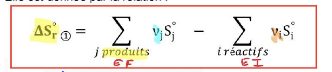
68
New cards
signe de ΔS°r
ΔS°r
69
New cards
soit d’enthalpie libre
* notée G
70
New cards
relation de G en fonction de H et S
G = H -TS => ΔG = ΔH - TΔS
71
New cards
à quoi sert l’enthalpie libre ?
* Elle permet de dire si une réaction est spontanée ou non.
* De dire quel est l’effet de la T° sur cette spontanéité
* De déterminer la composition d’un mélange réactionnel à l’équilibre.
* De dire quel est l’effet de la T° sur cette spontanéité
* De déterminer la composition d’un mélange réactionnel à l’équilibre.
72
New cards
si ΔG > 0 alors
sans indirect favorisé
73
New cards
si Δ G < 0 alors
sens direct favorisé
74
New cards
déterminer ΔG°r

75
New cards
formule de ΔG° en fonction K
ΔG°r = ΔH°r - T ΔS°r = -RT ln(K)
76
New cards