klinisch onderzoek
1/22
Earn XP
Description and Tags
Name | Mastery | Learn | Test | Matching | Spaced |
|---|
No study sessions yet.
23 Terms
softenonsschandaal
geneesmiddel softenon met actief bestannddeel thalidomide werd gebruikt voor behandeling: angst, slapeloosheid en ochtendmislijkheid.
Maar dit was jeel schademijk voor ongeboren babies door een teratogeen effect (schadelijk effect op een ongeboren kind) waardoor je bv verkote armen en benen kan krijgen.
Dit komt omdat het lichaam Thalidomide (r) enantiomeer (niet toxisch) omzet in het Thalidomide (s) enantiomeer.
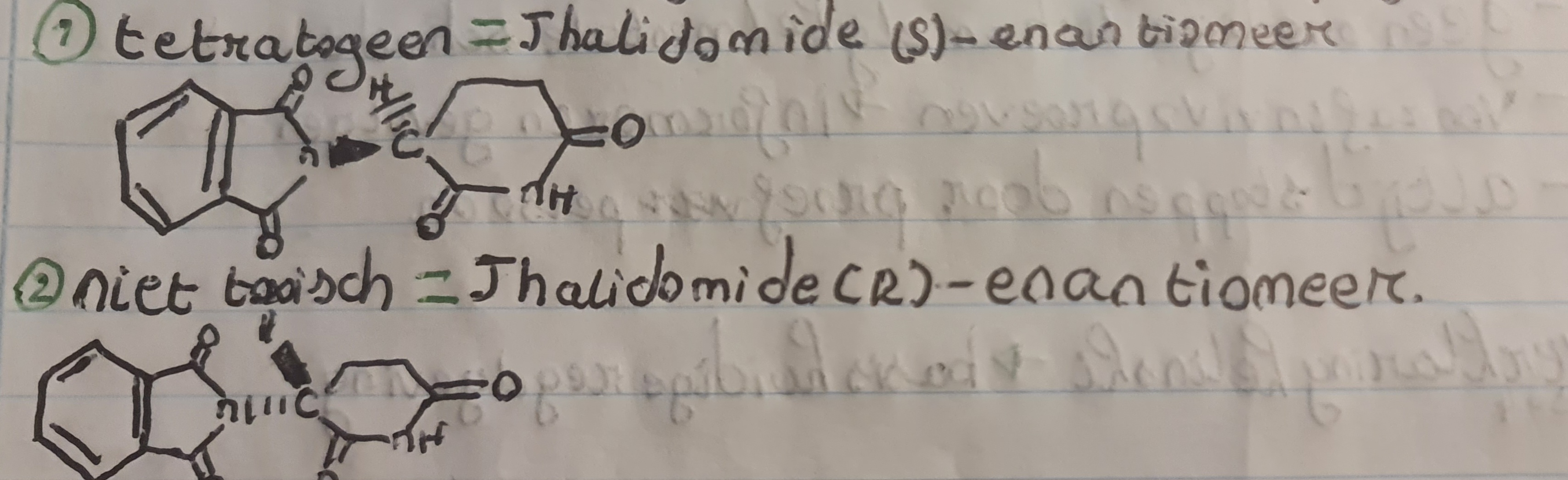
hoe worden strenge procesufdes opgevolgd om
european medicenes agency en amerikaanse food and drug administration kijken nouwlettend als geneesmiddelen werkzaam en veilig zijn.
belangrijk voor kandidaatgeneesmiddelen: stoffen die mogleijk als medicijn gerbuikt kan worden, word gekeen met releatief gezonde patiënten als ze veilig en effectief zijn
er worden meer neveneffecten toegalten voor geneesmiddelen met ersnstige ziektes
waarom overgang van preklinisch naar klinisch
experimenten in mensen want meest voorkomnde bijwerkingen niet vastelbaar dieren → streng om deelnemers te beschermen en etissche aspecten.
eed van hippocartes
princiepe: primum no nonecere = ten eerste geen kwaad doen, in ieder geval geen kwaad doen.
→ veiligheid gaat altijd voor, handelen is alleen maar als het waarscheinlijk helpt en geen schade veroorzaakt. soms is het beter om af te wachten.
artsen proces:
1947= oordeel tegen 23 nazi-artsen die experimenten met gevangenen uitvoerde.
code van neurenberg
1949: legale experimenten.
vrijwillig + schriftelijke verklaring
maatschapelijk nut
geen onodige lichamelijke / mentale schade
vooraf in vivorpoven → informeren gevolgen
altijd stoppen door proefpersoon
eed van neurenberg + verklaring helinski (1964)
basis huidige regelgeving
inzake experimenten op mensen
geld voor:Geneesmiddel experimenten en experimenten algemeen: vooraf geïnformeerd + toestemming → specefieke regelingen voor onbewkame meerderjarigen, minderjarigen en waarvan je geen toestemming kan krijgen door hoodringendheid.
gunstig advies moet hoe snel en door wie gegeven worden
door etische comissie + bevoegde overheid binnen 60 dagen maar belgië is dat 15 dagen voor fase 1 en voor ander e28 dagen.
er zijn ook regels voor ______________ en ____________ van onderzoeken
er zijn ook regels voor wijzigingen en eindigen van onderzoeken
documenten worden minstens ___ jaar na voltooing bewaard
documenten worden minstens 20 jaar na voltooing bewaard
koningklijk besluit
4 april 2014: invulling nationale als europeese wetgeving
europeese verandering klinische proeven
geld in belgië.
harmoniseert en reguleert klinische proeven met geneesmiddelen in de EU door de goedkeuringsproces te standaardiseren.
Bevorderd transparantie en veiligheid proefpersonene garandeerd.
Good CLinical Practice richtlijnene
internationale etische en wetenschappelijke normen voor klinische proeven.
belgië= klinische proeven met geneesmiddelen voldoen aan richtlijnene
veiligheid + welzijn waarborgen en kwaliteit resultaten garanderen
privacy
peroonlijke gevolige gegevens beschermen
wet: persoonlijke levensfeer (privacywet) en algemene verodering gegevnsbeschering
belgië: AVG + nationale wetgeving inzake gegevensbescherming.
federaal agentschap voor geneesmiddelen en gezondheidsproducnten (in belgië)
verantwoordleijk evalueren van wetenschappelijke en etische aspecten van klinische studies entoezicht naleving wettelijke voorschriften
vergoeding
onderzoek = belastend (verschillende bezoeken, langdurig verblijf en/of uitgebrijd onderzoek)
=> redelijke perken in verhouding met insapnning en niet gelopen risco
→word gecontroleerd door onafhankelijke etische commisie
iec= indepentend ethics commitee → europa + andere
irb: instituional revieuw board → vs
fase 1
beperkte schaal: farmacokintiek + tolerantie
=> eenmalige dossi, dosisecalatie, korte termijn herhlaadelijke doseringstudies.
fase 2
therapeutische verkenning= beperkte schaal teneinde preliminaire doeltreffendheid (preliminaire doeltreffendheid) en enveneffectne proefiel evalueren.
fase 3
therapeutische bevesteging = grote schaal voor veiligheid en doeltreffendheid mbv double blind Randomised Controlled Trials → noch patient en onderzoeker weet wie product krijgt tot na aflsuiten.
de firma moet noes for guidence / points to consider van Commitee for Human Medical Products door ema s tikt op te volgen of goedonderbouwde rede waarom niet.
soorten fase 3 onderzoeken
vs placebo
vs beter (superiority)
vs niet slechter (non-inferiotiy)
vs nieuw + alternatief (addon)
placebo
gerbuikt: als voor vergleijking geen alternatief farmacologisch product is
product word als geneesmiddel voorgeschreven zonder werkzame bestanddelen.
placeboeffect: positisch psychisch effect door vertrouwen geneeskrachitge werking →vdoet niets.
etisch bezwaar: deel geen werkzame behandeling (word vermuid door addon)
earlyescape: onvoldoende verbeterd / verlechtert onverschakelen actieve handeling
helenski en ich-gcp normen: alleen als geen effectieve ebahandeling is / noodzakelijk en veiligheid proefpersoon niet in gevaar.ei
einde
sponsor / firma dient doossier van kwaliteit klinsich en preklinisch luik bij registratie authoritiet indiendne voor een MAA